HCV核心蛋白对肝癌细胞系SMMC-7721增殖作用的研究
2016-08-10王勇,刘斌
王 勇,刘 斌
(1. 徐州医学院,江苏 徐州 221042;2. 徐州医学院附属连云港市东方医院,江苏 连云港 222042;3. 徐州医学院附属医院,江苏 徐州 221042)
HCV核心蛋白对肝癌细胞系SMMC-7721增殖作用的研究
王勇1,2,刘斌3
(1. 徐州医学院,江苏 徐州 221042;2. 徐州医学院附属连云港市东方医院,江苏 连云港 222042;3. 徐州医学院附属医院,江苏 徐州 221042)
[摘要]目的探讨HCV核心蛋白对肝癌细胞系SMMC-7721的增殖作用。方法将空载质粒(对照组)和HCV核心蛋白重组质粒(实验组)分别转染肝癌细胞系SMMC-7721,提取转染后细胞RNA、蛋白质,比较2组细胞HCV核心蛋白mRNA、蛋白表达水平,收集转染细胞上清液,ELLSA检测2组细胞上清液HCV核心蛋白表达差异,采用MTT检测2组细胞增殖率,并采用transwell检测2组细胞侵袭和迁移情况。结果实验组细胞HCV核心蛋白mRNA、蛋白表达水平均明显高于对照组(P均<0.05),同时实验组细胞上清液HCV核心蛋白表达水平明显高于对照组(P<0.05);实验组细胞增殖率明显高于对照组(P<0.05);实验组细胞侵袭细、迁移细胞数均明显高于对照组(P均<0.05)。结论HCV核心蛋白能够显著提高肝癌细胞系SMMC-7721增殖、侵袭及迁移。
[关键词]HCV核心蛋白;肝癌细胞;增殖;侵袭;迁移
丙型肝炎病毒(Hepatitis C Virus,HCV)核心蛋白是由HCV RNA核心区编码的多功能蛋白,该病毒有包膜,是单股正链RNA病毒。HCV病毒的编码区有且仅有一个开放阅读框,能够编码3010—3030氨基酸序列蛋白前体。HCV核心蛋白共含有191个氨基酸,其既是病毒的核壳成分,又可调节病毒的启动子活性[1-2]。在慢性丙型肝炎、肝硬化及肝癌的致病过程中HCV核心蛋白具有重要致病作用,其可通过影响线粒体功能、细胞间的信号转导及与宿主细胞蛋白的直接作用参与细胞增殖和凋亡,导致细胞周期异常[3-5],但是HCV核心蛋白导致肝癌发生的机制仍不清楚。为了进一步研究HCV核心蛋白在肝癌发病中的机制,本研究使用HCV核心蛋白的重组质粒及空载质粒分别转染人源肝癌细胞系SMMC-7721,检测2组细胞及细胞上清HCV核心蛋白的表达量,同时检测2组细胞的增殖能力,分析比较2组细胞的增殖能力差异,探究HCV核心蛋白对肝癌细胞增殖的影响。
1实验资料
1.1实验材料SMMC-7721细胞系:购自上海生命科学研究所,在DMEM培养基(Invitrogen)+胎牛血清10%(美国Gibco公司),37 ℃,2.5% CO2孵箱中培养;质粒:重组质粒pcDNA3.0-C-EGFP及空载质粒pcDNA3.0(-)购于上海生命科学研究所;HCV核心蛋白ELLSA检测试剂盒、MTT细胞增殖检测试剂盒、Transwell小室购于南京建成生物公司。
1.2实验方法
1.2.1细胞转染于转染前24 h将SMMC-7721细胞(2×105mL-1)接种在6孔板采用Lipofectamine 2000将重组质粒和空载质粒转入细胞,转染48 h后提取细胞RNA,转染72 h后提取细胞蛋白。
1.2.2HCV核心蛋白mRNA表达的检测转染48 h后采用Trizol提取2组细胞总RNA,采用逆转录试剂盒按1 μg 将RNA逆转录成cDNA,RT-PCR检测HCV核心蛋白mRNA表达水平,HCV核心蛋白引物:上游5’-CGCGGATCCATGAGCACAAATCC-3’,下游5’-CCGGAATTCGCAACCGGGC-3’; GAPDH:上游5’-ATGGGGAAGGTGAAGGTCG-3’,下游5’-GGGTCATTGATGGCAACAATATC-3’;反应体系(20 μL):SYBR染料10 μL,ddH2O 8.6 μL,上游0.6 μL,下游0.6 μL,cDNA 0.2 μL。
1.2.3HCV核心蛋白表达的检测采用Western blot检测HCV核心蛋白表达水平,于转染72 h后提取2组细胞蛋白,每孔蛋白上样量40 μg,电泳、转膜、封闭(BSA),1∶1 000稀释HCV核心蛋白一抗,4 ℃孵育过夜,TBS-T洗涤3遍,每遍15 min,加入二抗(兔抗)常温孵育2 h,显影液显色,以β-actin为内参。
1.2.4培养液上清HCV核心蛋白的检测于转染72 h收集细胞培养液上清(100 μL),于96孔板中4 ℃孵育过夜,硝酸盐缓冲液洗涤3次,37 ℃封闭1 h,TBS-T洗涤3次,HCV核心蛋白一抗(10 μL/孔),37 ℃孵育1 h,将96孔板内液体吸干,TBS-T洗涤3次,采用ELISA试剂盒检测表达量。
1.2.5细胞增殖率的检测将转染72 h的细胞种于96孔板,采用MTT方法检测2组细胞增殖情况,于570 nm波长下检测吸光度值,每组细胞设置6个复孔,且平行进行3次试验。增殖率=(实验组-对照组)/对照组×100%。
1.2.6细胞侵袭和迁移的检测将100 μL Matrigel加置于transwell上室,37 ℃,2 h。加入转染72 h的细胞(1×105mL-1)悬液,于下室加完全培养基,置于孵箱内培养48 h,去除上室Matrigel及未侵袭的细胞。采用多聚甲醛固定细胞10 min,Giemsa染色15 min,于显微镜下(200×)记录侵袭细胞数,每孔取8个视野的平均值。
1.3统计学方法采用统计学软件SPSS 13.0对实验数据进行统计分析,计量资料比较采用t检验。P<0.05为差异有统计学意义。
2结果
2.12组HCV核心蛋白mRNA及蛋白表达水平比较实验组细胞HCV核心蛋白mRNA及蛋白水平均显著高于对照组(P均<0.05)。见表1。
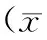
表1 2组HCV核心蛋白mRNA和蛋白
注:①与对照组相比,P<0.05。
2.22组细胞培养上清液HCV核心蛋白表达水平比较实验组细胞上清液HCV核心蛋白表达水平为(4.61±1.09)μg/mL,对照组为(14.78±2.33)μg/mL,2组比较差异有统计学意义(P<0.05)。
2.32组细胞增殖率比较实验组细胞增殖率为(49.6±6.7)%,对照组为(19.8±2.5)%,2组比较差异有统计学意义(P<0.05)。
2.42组细胞侵袭、转移情况比较实验组侵袭细胞数、迁移细胞数均明显高于对照组(P均<0.05)。见表2。
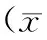
表2 2组细胞侵袭、转移情况比较±s,104个)
注:①与对照组相比,P<0.05。
3讨论
HCV核心蛋白与其他HCV蛋白相比,氨基酸序列高度保守,是组成病毒核衣壳的重要结构蛋白[6]。HCV核心蛋白除形成核衣壳外,还可与病毒本身或宿主细胞内的蛋白质结合,形成二聚体或多聚体,调节病毒自身及宿主某些蛋白质的转录及翻译过程[7-8]。HCV核心蛋白结合重要调节蛋白,能够直接影响宿主细胞信号转导、细胞凋亡、脂质代谢等过程,因此HCV核心蛋白与肝脏疾病的发生发展关系密切[9]。有研究表明在HepG2细胞系中HCV核心蛋白可通过抑制Jak-STAT通路的活化,下调ISGF-3水平,从而降低IFN-α的产生和应答,这与IFN-α在HCV感染治疗中临床应答率低息息相关[10]。HCV核心蛋白参与调节细胞凋亡信号通路,并诱导、抑制凋亡,如死亡受体Fas家族、Bcl-家族等;HCV-core是HCV蛋白的核心,其各种亚型均高度保守[11-12]。HCV核心蛋白参与了细胞的信号转导、脂质代谢,同时影响着细胞的死亡、凋亡以及增值。细胞维持正常生长发育的重要条件就是细胞周期,多种蛋白参与调控细胞生长周期,包括p53、p21、pRb、E2f、c-Myc、cyclin D等,十分复杂[13]。相关研究表明,HCV核心蛋白能够影响细胞生长周期,但是实验条件不同或使用的细胞品系不同,所得到的结果也不尽相同。此外,HCV核心蛋白能显著激活Wnt/β信号通路,从而促进肝癌细胞系SMMC-7721的增长[14]。
肝脏疾病发生发展的主要过程是慢性肝炎、肝硬化、肝癌,HCV的慢性持续感染能够引起慢性肝炎、肝硬化,但是HCV是如何诱发肝脏疾病呢?相关研究表明,HCV核心蛋白能够破坏细胞的生长周期,导致细胞在分裂时滞留在G1期,无法进入S期,从而使得HCV能够潜伏在G0/G1期的细胞内,G0期的细胞能够维持长期不增殖的状态,导致细胞长期处于HCV病毒感染的状态,这样宿主细胞会不断地被损伤,甚至发生基因突变[15]。但是当宿主细胞被某些生长因子或其他增殖信号激活,又能够进入S期进行增殖,导致大量HCV病毒被不断地复制,最终诱发慢性肝炎、肝硬化,甚至肝癌[16-17]。
本研究重点集中在HCV核心蛋白对人肝癌细胞系SMMC-7721增殖的作用,将HCV核心蛋白重组质粒及空载对照质粒分别转入细胞,检测细胞HCV核心蛋白表达情况,观察转入HCV核心蛋白后SMMC-7721的增殖、侵袭及迁移能力的变化。本研究提取转入HCV核心蛋白质粒组细胞和空转质粒组细胞的蛋白和RNA,Western Blot 及RT-PCR结果显示,HCV核心蛋白mRNA、蛋白表达水平均明显高于空载组细胞。此外本研究采用ELLSA试剂盒检测2组细胞上清HCV核心蛋白含量,结果显示实验组细胞上清HCV核心蛋白也明显高于对照组,且差异有显著统计学意义。以上实验结果在蛋白水平和RNA水平上证实本研究采用的HCV核心蛋白质粒能够稳定表达HCV核心蛋白。本研究采用MTT检测2组细胞的增殖能力,结果显示,实验组细胞增殖率明显高于对照组;Transwell结果显示,实验组细胞侵袭细胞数、迁移细胞数均明显高于对照组,表明当SMMC-7721细胞表达HCV核心蛋白后,其增殖及迁移能力均较对照组大大增强。
综上所述,HCV核心蛋白能显著促进SMMC-7721细胞增殖、侵袭及迁移能力,因此可推断,HCV核心蛋白感染与肝癌发生发展关系密切。将研究目光聚焦在HCV核心蛋白表达量上或许能为将来临床治疗慢性肝炎、肝硬化或肝癌提供新的治疗靶点。然而肝癌患者的临床治疗预后较差,手术和化疗以及生物治疗均是治疗肝癌患者的重要治疗方式,因此肝癌的治疗是一个综合治疗的过程,不断改进和完善这个综合治疗的每个环节是提高肝癌患者临床疗效并进一步改善患者预后的基础,而目前手术和化疗方面的治疗手段已经相对成熟,较难取得突破,微观生物治疗是目前研究的热点,需要临床同仁进一步探索,一方面对于了解和掌握肝癌的发病和病情进展机制具有重要意义,另一方面可以为临床评估肝癌患者的病情及指导临床治疗方案提供帮助和参考。
[参考文献]
[1]李志勤,孙长宇,余祖江,等. HCV核心蛋白对人肝癌细胞系SMMC-7721增殖的影响[J]. 郑州大学学报:医学版,2013,48(3):310-313
[2]蒋孝华,谢玉桃,张冬翠,等. HCV核心蛋白与NS4B对HepG2细胞增殖的影响[J]. 中华实验和临床病毒学杂志,2014,28(1):1-3
[3]谢艳,黄世峰,曹炬,等. HCV核心蛋白对HepG2细胞增殖的影响[J]. 第三军医大学学报,2013,35(6):482-486
[4]廖巧芳,李志花,陈汝福. 丙型肝炎病毒核心蛋白对胆管癌细胞NFAT1基因表达的影响[J]. 南方医科大学学报,2012,32(6):789-793
[5]朱季香,何长龙,郭艳,等. HCV核心蛋白氨基酸替换与干扰素应答的关系[J]. 第三军医大学学报,2013,35(9):880-885
[6]张丹,冯国和. 丙型肝炎病毒核心蛋白对双链RNA依赖蛋白激酶活性的影响[J]. 中华肝脏病杂志,2014,22(8):590-593
[7]孙丽杰,赵勇华,李树臣,等. 丙型肝炎病毒核心蛋白下调AMP激活蛋白激酶导致肝细胞糖代谢紊乱[J]. 肝脏,2013,18(6):374-377;397
[8]龚旭阳,马其欢,杜茜,等. 丙型肝炎病毒核心蛋白通过自诱导方式可溶性表达及其生物学功能鉴定[J]. 中华肝脏病杂志,2013,21(8):565-569
[9]权会琴,聂丹,周帆,等. HCV核心蛋白抑制SFRP1基因启动子活性[J]. 基础医学与临床,2013,33(4):406-411
[10] 曹统,王义国. 丙型肝炎病毒核心蛋白对人源性肝细胞凋亡的影响[J]. 山东大学学报:医学版,2014,52(3):37-39;44
[11] 孙丽杰,李树臣,赵勇华,等. 丙型肝炎病毒核心蛋白下调AMP激活蛋白激酶对肝细胞脂类代谢的影响[J]. 肝脏,2013,18(3):150-154
[12] 王巧侠,李文凡,成军,等. 丙型肝炎病毒核心蛋白上调基质金属蛋白酶组织抑制因子-1的表达[J]. 胃肠病学和肝病学杂志,2013,22(8):789-792
[13] 唐晶,周嘉嘉,邓小耿,等. 丙型肝炎病毒核心蛋白对肝癌细胞stat3通路及细胞周期蛋白cyclin D1的调控作用[J]. 中山大学学报:医学科学版,2013,34(4):498-504
[14] 李威,宁会彬,康谊,等. 核心蛋白和非结构蛋白5B 直接测序法对丙型肝炎病毒基因分型的影响[J]. 中华传染病杂志,2015,33(6):343-345
[15] 于建武,孙丽杰,刘伟,等. 丙型肝炎病毒核心蛋白下调沉默信息调节因子2相关酶1-AMP激活蛋白激酶信号通路活性致肝细胞能量代谢紊乱[J]. 中华传染病杂志,2013,31(2):71-76
[16] 杨春,陈文,王忠琼,等. 丙型肝炎病毒非结构蛋白4B对肝癌细胞c-myc和p53蛋白表达的影响[J]. 中国医师杂志,2013,15(8):1063-1065
[17] 乔卿华,吕欣,雷迎峰,等. 表达丙型肝炎病毒核心蛋白的人肝癌稳定转染细胞株的建立与鉴定[J]. 细胞与分子免疫学杂志,2014,30(11):1137-1141
doi:10.3969/j.issn.1008-8849.2016.21.020
[中图分类号]R735.7
[文献标识码]B
[文章编号]1008-8849(2016)21-2337-03
[收稿日期]2015-12-10
