黑曲霉发酵白术对小鼠胸腺指数、脾指数及脾T淋巴细胞增殖的影响
2016-08-09孙向婉刘晓晔
孙向婉,王 芸,王 鑫,刘晓晔,穆 祥*,董 虹*
(1.北京农学院 兽医学(中医药)北京市重点实验室,北京 102206;2.中国农业大学 动物医学院,北京 100193)
黑曲霉发酵白术对小鼠胸腺指数、脾指数及脾T淋巴细胞增殖的影响
孙向婉1,王芸1,王鑫1,刘晓晔2,穆祥1*,董虹1*
(1.北京农学院 兽医学(中医药)北京市重点实验室,北京 102206;2.中国农业大学 动物医学院,北京 100193)
摘要:旨在研究黑曲霉发酵白术对小鼠免疫功能的影响。利用环磷酰胺建立小鼠免疫抑制模型,检测黑曲霉发酵白术对小鼠胸腺指数、脾指数和脾T淋巴细胞增殖的影响。通过高效液相色谱技术(HPLC)检测白术发酵前后的有效成分变化。并通过正交试验筛选了提高白术有效成分含量的最佳发酵条件。试验结果表明:(1)黑曲霉发酵后的白术能有效提高小鼠免疫功能,其中发酵白术低、中、高剂量(0.5、1、2 g·kg-1)均能显著提高胸腺指数(P<0.05);而中剂量发酵白术能显著提高脾指数及小鼠脾T淋巴细胞增殖(P<0.05);(2)HPLC检测黑曲霉菌发酵白术后白术内酯Ⅰ的含量升高;(3)确立提高有效成分白术内酯Ⅰ含量的最佳发酵条件为接菌量8%,含水量40%,发酵时间96 h,此条件下白术内酯Ⅰ含量是原来的1.4倍。试验进一步揭示黑曲霉发酵白术可通过发酵后白术内酯Ⅰ含量的升高来增强小鼠免疫功能。
关键词:黑曲霉;发酵白术;免疫功能;白术内酯I
白术为菊科植物白术(AtractylodesmacrocephalaKoidz)的干燥根茎,是临床常用的重要中药之一,其性甘、苦、温,具有健脾益气、燥湿利水等功效[1]。白术的药理作用有抗肿瘤、抗菌、消炎和调节免疫功能等[2],其有效成分为挥发油、内酯类成分、苷类等。内酯类为白术主要有效成分[3],其中白术内酯Ⅰ具有健脾[4]、抗炎[5]、抗肿瘤[6]等广泛的药理作用,而不同的炮制方式对白术内酯Ⅰ含量也有一定影响[7]。黑曲霉(Aspergillusniger)作为被允许添加到饲料中的微生物之一,能够合成和分泌多种酶类,如水解酶、果胶酶、蛋白酶、淀粉酶、脂酶,纤维素酶和丹宁酸酶[8],而其中的果胶酶、纤维素酶类都可用来降解植物细胞壁,从而利于植物细胞中有效成分的析出。
中药发酵作为中药的一种炮制方式,正是借助于微生物及其代谢产物酶的分解转化作用,在一定的环境条件下(如温度、湿度、空气、水分等),通过微生物的发酵,改变其原有性能,增强或产生新的功效,扩大用药品种,以适应临床用药的需要[9-11]。随着发酵中药技术的发展,高效利用中药成为中药制品研发的新准则,其中利用中药发酵作为饲料添加剂的使用不仅可以节省成本,也可提高动物的生长性能和免疫功能[12-14]。本试验目的在于探究黑曲霉发酵白术对小鼠部分免疫指标的影响,可初步为发酵白术对免疫力方面的影响提供依据;分析白术发酵前后其有效成分白术内酯Ⅰ的变化,可进一步从白术发酵后其成分变化的角度揭示药效提高的内在机制;最后利用正交试验筛选提高白术内酯Ⅰ含量的最优发酵条件,从而优化白术的发酵工艺,得到高效安全的产物,同时也提供了一种提高其有效成分白术内酯Ⅰ含量的新思路,具有一定的临床参考意义。
1材料与方法
1.1试验动物
昆明小鼠,清洁级,雌性,18~22 g,购于北京市兴隆动物养殖场。
1.2主要仪器与试剂
多功能酶标仪(BIOTEK,型号SYNERGY4),超净工作台(哈尔滨东联电子技术开发有限公司,型号:DL-CF-ⅠND),全温振荡培养箱(上海上登实验设备有限公司,型号:HZQ160),CO2培养箱(SANYO,型号:MC0217AC),高压液相色谱仪(型号:Waters e2695),恒温干燥箱(上海一恒科技有限公司,型号:DK-8D)。白术内酯Ⅰ购于中国食品药品检定研究院(纯度>99.99%,批号:111975-201501),白术药材购于北京同仁堂。甲醇、乙腈为色谱纯,购于上海赛默飞世尔科技有限公司,其余试剂均为分析纯。黑曲霉(ATCC16404)购于上海复祥生物有限公司。RPMI-1640购于Gibco公司。3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide(噻唑蓝,MTT)购于Sigma公司。刀豆蛋白(ConA)购于Stanta Cruz。环磷酰胺(cyclophosphamide,Cy)购于Sigma 公司。
1.3发酵白术的制备及其对小鼠免疫功能的影响
1.3.1发酵菌种制备将黑曲霉标准菌种接种在马铃薯固体培养基[15],于28 ℃ 培养3 d,然后将活化后的黑曲霉用适量无菌蒸馏水溶解菌落,制成孢子悬液,取4 mL(浓度为1×108个·mL-1)转接于100 mL液体培养基中,于28 ℃,140 r·min-1振荡培养48 h,即可用于接种发酵。
1.3.2发酵白术制备称取两份粉碎处理的白术药材20 g于500 mL锥形瓶,121 ℃ 高压灭菌20 min。一份作为对照,另一份作为发酵培养基。在发酵培养基中加入灭菌蒸馏水10 mL,取活化好的黑曲霉菌液2 mL于无菌条件下接入发酵培养基中,置于电热恒温振荡培养箱中28 ℃,140 r·min-1振荡培养96 h,然后于50 ℃烘干储存。
1.3.3动物分组处理与给药将60只18~22 g雌性昆明小鼠随机分为6组,每组10只:A空白对照组、B模型组、C未发酵白术组,D、E、F分别为发酵白术低剂量、中剂量、高剂量组。适应性喂养3 d,饲养于温室内,饲养温度(20±1) ℃,湿度45%~55%,光照12 h,基础颗粒饲料饲喂,自由取食,饮水。药物以蒸馏水溶解,每只各灌胃0.4 mL。按照表1进行分组喂养连续灌胃相应药物7 d,第8天除空白对照组外,每组小鼠均釆用腹腔注射的方法,注入环磷酰胺(Cy)50 mg·kg-1(0.4 mL·只-1·d-1),连续注射3 d,制造免疫抑制模型[16]。第11 天进行免疫功能相关指标检测。
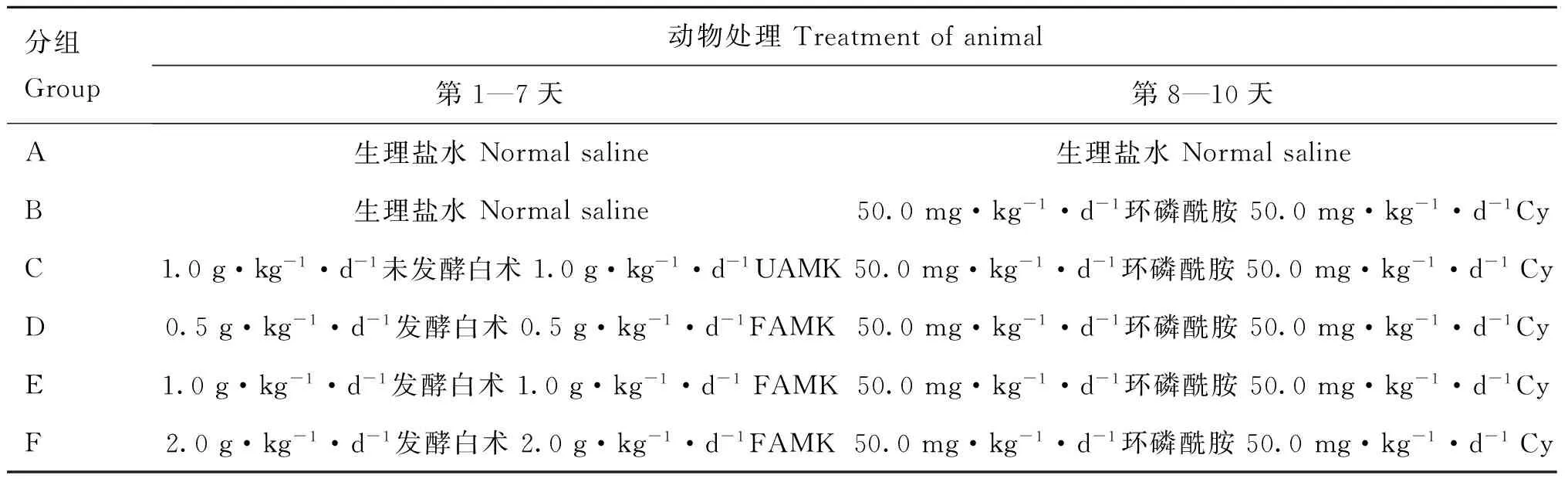
表1 小鼠免疫功能检测试验分组及处理
UAMK.Un-fermentedAtractylodesmacrocephalaKoidz;FAMK.FermentedAtractylodesmacrocephalaKoidz;Cy.Cyclophosphamide
1.3.4免疫器官指数测定取小鼠脾和胸腺称重,按照以下公式计算:
脏器指数= 脏器质量(mg)/动物质量(g)1.3.5小鼠脾细胞悬液的制备及脾T淋巴细胞增殖测定采用MTT 法,将上述分组小鼠无菌取脾,经过研磨,200目细胞筛网过滤,PBS重悬,1 500 r·min-1离心10 min,弃上清,沉淀加入适量红细胞裂解液,1 500 r·min-1离心10 min,PBS洗涤2次,制得单细胞悬液,最后用含10%小牛血清RPMI-1640调细胞浓度5×106·mL-1,并用台盼蓝染色检测细胞活力大于95%。将细胞接种于96孔板(100 μL·孔-1),并于每孔加入10 μL ConA刺激(终浓度为5 μg·mL-1),置于5% CO2,37 ℃培养箱培养48 h后,每孔加MTT 10 μL,继续培养4 h后,每孔加入DMSO 150 μL,振荡5 min,紫色结晶完全溶解后于酶标仪570 nm测定OD值。
1.4HPLC对比分析白术发酵前后有效成分白术内酯Ⅰ变化
选择Waters e2695色谱柱 250×4.6 mm,5 μm;流动相水(A)-乙腈(B)梯度洗(0~16 min,60%~76%A),流速1.0 mL·min-1;柱温25 ℃;检测波长250 nm;进样量20 μL。
1.4.1对照品溶液制备精密称取白术内酯Ⅰ 1 mg,加甲醇制成含白术内酯Ⅰ 0.05 mg·mL-1的对照品溶液。
1.4.2供试品溶液制备精密称量黑曲霉发酵样品1 g,置于磨口锥形瓶中,加甲醇5 mL,超声提取45 min,离心(3 000 r·min-1)10 min,取上清液,用0.22 μm 微孔滤膜过滤除菌,得供试品溶液备用。未发酵的样品同法制备。
1.4.3色谱条件的方法学考察利用HPLC对上述色谱条件进行线性关系、精密度、稳定性、重现性、加样回收率试验考察。具体方法如下:精确吸取对照品溶液5、10、20、30、40 μL分别注入高效液相色谱仪,按上述色谱条件进样,测定峰面积,以白术内酯Ⅰ为横坐标,峰面积为纵坐标作标准曲线,得线性回归方程。 对同一对照品白术内酯Ⅰ溶液,浓度为0.05 mg·mL-1,连续6次进样,计算指标成分峰面积的RSD,考察精密度。同一样品溶液,分别在0、3、6、9、12 h进样,计算指标成分峰面积的RSD,考察稳定性。取同一白术样品粉末,精密称取5份约0.5 g,按照“供试品溶液制备”项下的规定操作,计算指标成分峰面积的RSD,考察重复性。精密称取已知含量的白术粉末0.5 g,共6份,按“供试品溶液的制备”项下进行处理,每份各取1.1 mL分别加入浓度为0.5 mg·mL-1的标准品白术内酯Ⅰ 10 μL,计算回收率 。
1.5发酵条件的筛选
选取时间、含水量和接菌量3个条件进行三因素三水平的正交试验,以此来筛选提高白术主要有效成分白术内酯Ⅰ含量的发酵条件。称取60 ℃条件下烘干的白术药材粉末1 g (粉碎后过40目筛),分别放入50 mL的三角锥形瓶中,121 ℃ 高压灭菌20 min。采用L9(33)正交设计表,按表2所示的条件下,接入活化好的黑曲霉菌进行发酵。同时,设置一个未发酵白术的处理作为比较。利用HPLC测定不同条件处理下白术中白术内酯Ⅰ含量。

表2 影响白术内酯Ⅰ含量的发酵因素水平表
1.6数据处理与分析
2结果
2.1发酵白术对小鼠免疫功能的影响
2.1.1发酵白术对小鼠免疫器官指数的影响由图1可知,模型组小鼠脾指数、胸腺指数均极显著低于空白对照组(P<0.01),表明免疫抑制模型制备成功。与模型组相比,中剂量发酵白术可以显著提高脾指数(P<0.05),而未发酵白术与其他剂量的发酵白术组、模型组相比差异不显著(P>0.05)(A);发酵中药三个低、中、高剂量均可以显著提高胸腺指数(P<0.05或P<0.01),而未发酵白术与其相比没有差异(P>0.05)(B)。此结果说明发酵白术可以提高免疫抑制小鼠免疫器官指数,有助于提高免疫抑制小鼠的免疫功能。
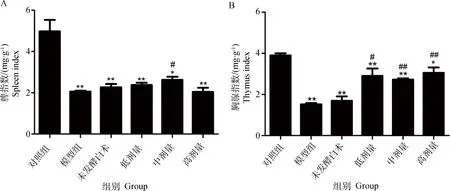
A.脾指数;B.胸腺指数;与对照组相比,*.P<0.05,**.P<0.01;与模型组相比,#.P<0.05,##.P<0.01A.Spleen index;B.Thymus index;Compared with control,*.P<0.05,**.P<0.01;Compared with model,#.P<0.05,##.P<0.01图1 发酵白术对免疫抑制小鼠免疫器官指数的影响Fig.1 Effect of fermented Atractylodes macrocephala Koidz on spleen and thymus index of immunosuppressive mice
2.1.2发酵白术对小鼠脾T淋巴细胞增殖的影响由图2可知,免疫抑制模型组小鼠T淋巴细胞增殖显著低于空白组(P<0.05),表明免疫抑制模型制备成功。与模型组相比,中剂量发酵白术和未发酵白术可明显提高T淋巴细胞增殖(P<0.05),且与空白组相比差异不显著。说明中剂量发酵白术可以提高免疫抑制小鼠脾T淋巴细胞增殖,从而提高其免疫功能。
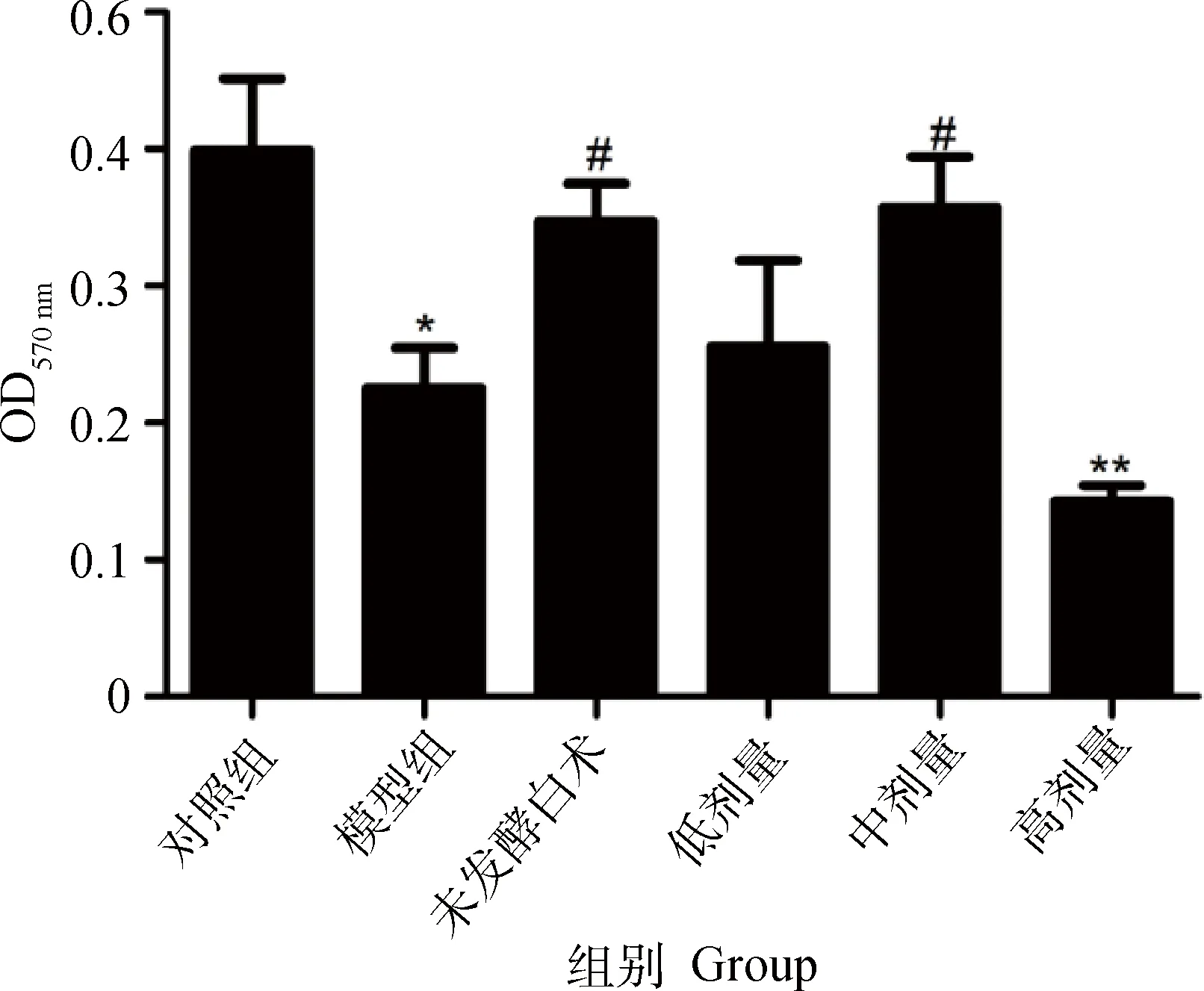
与对照组相比,*.P<0.05,**.P<0.01;与模型组相比,#.P<0.05,##.P<0.01Compared with control,*.P<0.05,**.P<0.01;Compared with model,#.P<0.05,##.P<0.01图2 发酵白术对免疫抑制小鼠T淋巴细胞增殖能力的影响Fig.2 Effect of fermented Atractylodes macrocephala Koidz on the T lymphocyte transformation rate of immunosuppressive mice
2.2白术发酵前后有效成分变化
2.2.1HPLC图谱采用HPLC初步考察了黑曲霉发酵白术前后有效成分的变化,试验中对未发酵白术(图3B)和发酵白术(图3C)保留时间一致的峰进行监测分析,通过标准品对照(图3A),结果发现白术内酯Ⅰ含量有所增加。
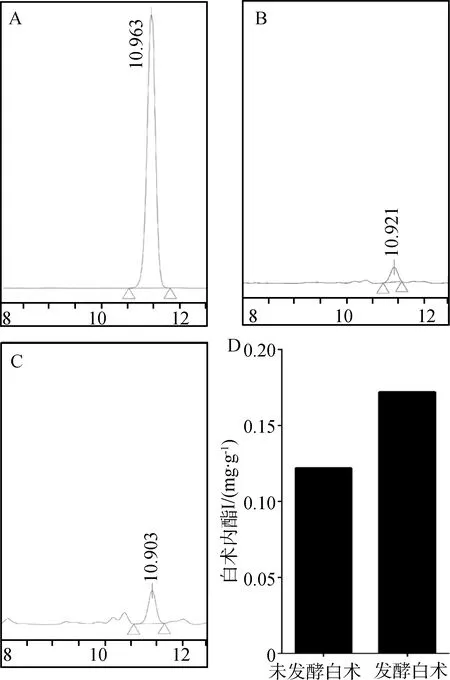
A.白术内酯Ⅰ标准品;B.未发酵白术;C.发酵白术;D.发酵白术和未发酵白术含量比较A.HPLC chromatogram of atractylenolide Ⅰ;B.HPLC chromatogram of Atractylodes macrocephala Koidz;C.HPLC chromatogram of fermented Atractylodes macrocephala Koidz;D.The atractylenolide Iof raw Atractylodes macrocephala Koidz and fermented Atractylodes macrocephala Koidz图3 黑曲霉发酵白术与未发酵白术中白术内酯Ⅰ图谱Fig.3 HPLC chromatogram of atractylenolide Ⅰ in Atractylodes macrocephala Koidz fermented with Aspergillus niger and without fermentation
2.2.2色谱条件的方法学考察结果按“1.4.3”中所描述的方法,得线性回归方程:y=2 421 038x-20 208,R2=0.999 9,结果表明白术内酯Ⅰ线性范围在0.25~2 μg;精密度 RSD为0.11%,表明精密度良好;稳定性RSD 为1.02%,结果表明样品在12 h内稳定;重复性 RSD 为2.5%,表明重现性良好。加样回收率试验得白术内酯Ⅰ平均回收率为99.46%,RSD 为0.56%(表3)。

表3 白术内酯Ⅰ加样回收率测定结果
2.3提高白术内酯Ⅰ含量的发酵条件筛选
为了获得提高白术中白术内酯Ⅰ含量的发酵条件,采用正交试验法研究各因素及其水平组合对其白术内酯Ⅰ含量的影响。按照白术发酵条件,以表2对应的因素水平进行发酵,并利用“2.2”中HPLC确立的色谱条件及方法测定白术内酯Ⅰ含量。由表4正交结果表明,最终确定提高白术内酯Ⅰ含量的最优发酵条件为A2B1C2,即接菌量8%,含水量40%,时间96 h,此条件下白术内酯Ⅰ含量最高。经极差分析,RB=0.07>RC=0.027>RA=0.025,影响因素大小顺序为B>C>A。同时测得的未经发酵处理白术的白术内酯Ⅰ含量为0.122 mg·g-1,由最佳发酵条件处理的发酵白术的白术内酯Ⅰ含量为0.172 mg·g-1,即白术在该条件发酵后,白术内酯Ⅰ含量是原来的1.4倍。
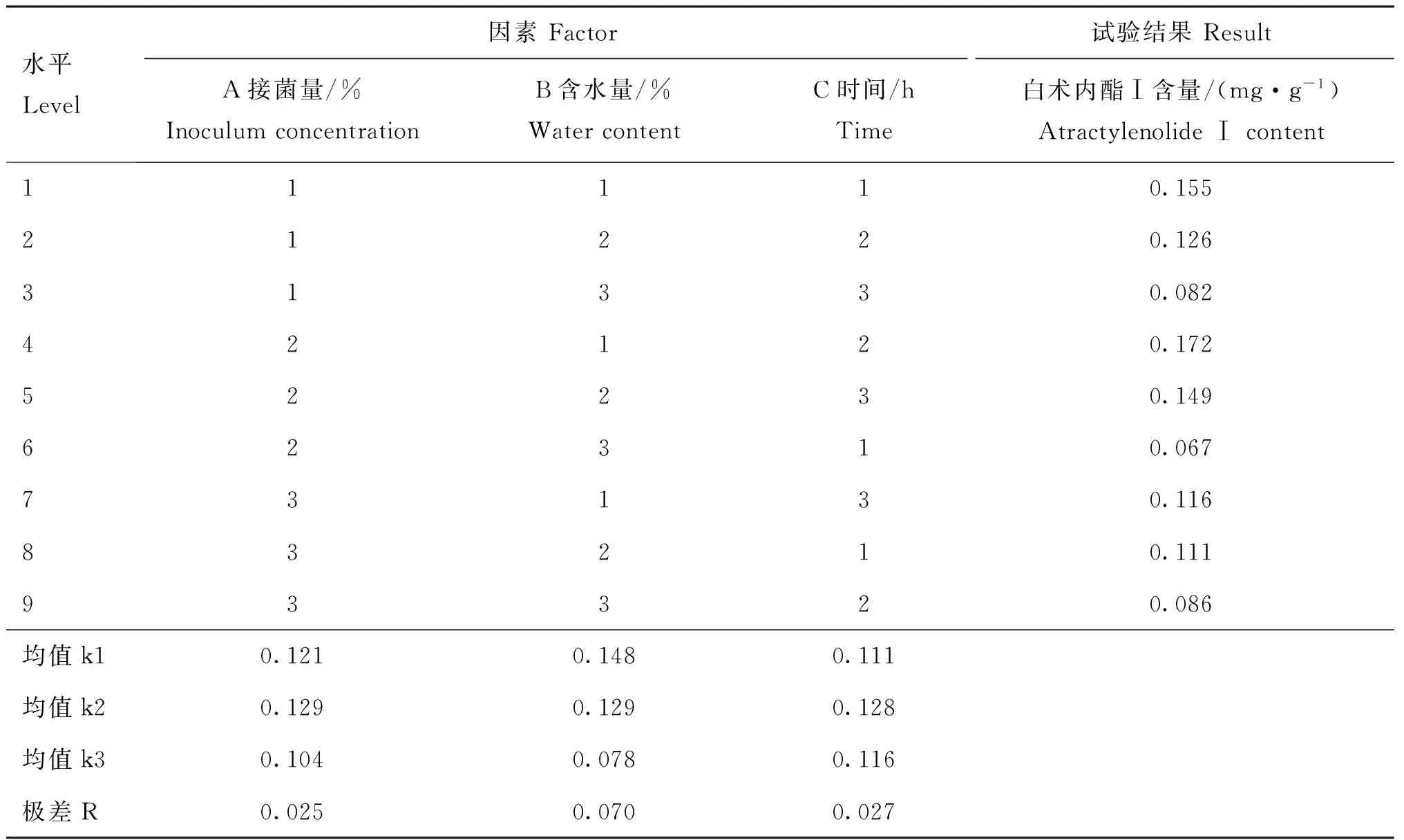
表4 正交试验白术内酯Ⅰ含量直观分析表
3讨论
3.1黑曲霉发酵白术对小鼠免疫器官指数及脾T淋巴细胞增殖的影响
白术是临床常用健脾益气的药物之一[17]。大量研究表明,白术水煎剂[18-19]、白术多糖[20]、白术复方[21]可提高动物的免疫功能。本研究考察了黑曲霉菌发酵白术对环磷酰胺造成的免疫抑制小鼠免疫器官指数和脾T淋巴细胞增殖的影响,结果表明与模型组相比,发酵白术低、中、高剂量(0.5,1,2 g·kg-1)均能显著提高胸腺指数(P<0.05);中剂量发酵白术能显著提高脾指数及小鼠脾T淋巴细胞增殖(P<0.05);而未发酵白术(1 g·kg-1)与模型组相比,免疫器官指数没有差异(P>0.05),可提高小鼠脾T淋巴细胞增殖(P<0.05)。环磷酰胺造成的免疫抑制模型通常会造成免疫器官指数降低,胸腺指数、脾指数可用来评价小鼠的免疫状况[22],通过中枢的胸腺指数和脾指数的增长,说明发酵白术能促进中枢免疫器官的发育,从而影响小鼠的免疫功能。淋巴细胞是机体主要免疫细胞,T淋巴细胞作为重要免疫细胞之一,参与免疫调节反应[23]。本试验发现未发酵白术对T淋巴细胞增殖也有一定促进作用,但对免疫器官指数无影响,而中剂量发酵白术对免疫器官指数提高和T淋巴细胞增值均有促进作用,这充分说明发酵白术对小鼠免疫功能的影响优于未发酵白术。有文献报道在免疫调节方面,六味地黄发酵液的功效明显优于六味地黄煎剂[24],玉屏风散发酵液的功效明显优于玉屏风散煎剂[25]。
3.2黑曲霉发酵白术对其有效成分白术内酯Ⅰ含量的影响
本试验另一结果发现白术经黑曲霉发酵后,经HPLC分析发现白术有效成分白术内酯Ⅰ含量有所增加。黑曲霉菌能够合成和分泌纤维素酶、半纤维素酶、果胶酶等酶[26]此特点,使得黑曲霉在发酵白术过程中所产生的酶破坏其细胞壁,进而促使白术活性成分白术内酯Ⅰ的溶出。陶蕾等[27]同样利用黑曲霉菌的发酵产生酶类的特点,使用黑曲霉菌发酵中药材黄柏,发现经黑曲霉菌液发酵过的黄柏中游离态小檗碱含量与未发酵相比有所提高。众多研究阐释中药发酵后药效增强的主要机制之一很大可能在于微生物发酵中药可通过微生物的降解作用,最大限度提取药物的有效成分和活性物质,并生成新的药物成分[28-29]。研究表明白术内酯Ⅰ为白术健脾益气[30]的主要成分,白术内酯Ⅰ可拮抗肿瘤患者体内的免疫抑制作用,提高T淋巴细胞的增殖活性,降低免疫抑制因子的表达,从而激活机体对肿瘤的免疫应答[31-32]。因此发酵白术可拮抗免疫抑制小鼠免疫功能低下这一现象,原因很大可能在于白术经黑曲霉一定条件发酵之后其有效成分白术内酯Ⅰ含量升高。本试验今后会对发酵过程中白术其他有效成分进行研究分析,更为全面地阐释发酵白术提高免疫功能的作用机制。
3.3提高白术内酯Ⅰ含量的发酵条件筛选
本研究最后通过正交试验探究了提高白术有效成分白术内酯Ⅰ含量的最佳发酵条件,发现不同发酵条件对白术内酯Ⅰ含量影响不同。说明研究发酵条件对提高中药有效成分含量具有重要意义。本试验最终确定白术发酵条件为A2B1C2,即黑曲霉接种量8%,含水量40%,时间为96 h,此条件下白术内酯Ⅰ含量最高。经极差分析,RB=0.07>RC=0.027>RA=0.025,影响因素大小顺序为B>C>A,同时测得的未经发酵处理的白术其白术内酯Ⅰ含量为0.122 mg·g-1,由最佳发酵条件处理的发酵白术其白术内酯Ⅰ含量为0.172 mg·g-1,可见白术在该条件发酵后,白术内酯Ⅰ含量是原来的1.4倍。刘双等[33]在中药神曲发酵工艺研究中谈到优化工艺利于得到安全有效的神曲,更利于建立质量标准。陈富文等[34]从发酵菌种、发酵时间、发酵温度、接种量等因素考察,以高效液相色谱法(HPLC)测定发酵后醇提液的总峰面积来代表发酵后总有效化学成分含量,对复方中药制剂质量评价有一定的参考意义。可见,优化发酵工艺利于得到安全有效的产物,对中药在质量方面的评价具有重要意义。
总之,本研究发现黑曲霉发酵白术可提高免疫抑制小鼠免疫器官指数及脾T淋巴细胞增殖,优于未发酵组;且白术发酵后其有效成分白术内酯Ⅰ含量增加,初步阐释了发酵白术药效增加的作用机制可能在于提高了其有效成分的含量;通过正交试验确定了提高白术内酯Ⅰ的最佳发酵条件,有利于质量可控,从而有助于发酵白术临床药效的发挥,为其在临床上使用提供一定参考依据。
参考文献(References):
[1]国家药典委员会.中华人民共和国药典2010年(一部)[M].北京:中国医药科技出版社,2010:95.
Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia 2010(the first part)[M].Beijing:China Medical Science Press,2010:95.(in Chinese)
[2]黄海英.白术活性成分的提取、纯化及功能性研究[D].南昌:南昌大学,2006.
HUANG H Y.Studies on extraction、purification and function of the active components inAtractylodesmacrocephalaKoidz[D].Nanchang:Nanchang University,2006.(in Chinese)
[3]彭腾,李鸿翔,邓赟,等.白术内酯类成分及其药理作用研究进展[J].中国药房,2012,23(39):3732-3734.
PENG T,LI H X,DENG Y,et al.Atractylenolide and pharmacological effects studies of Atractylodes Macrocephala Koidz[J].ChinaPharmacy,2012,23(39):3732-3734.(in Chinese)
[4]李伟,文红梅,崔小兵,等.白术健脾有效成分研究[J].南京中医药大学学报(自然科学版),2006,22(6):366-367.
LI W,WEN H M,CUI X B,et al.Invigorating spleen active ingredient research onAtractylodesmacrocephalaKoidz[J].JournalofNanjingUniversityofTraditionalChineseMedicine(NaturalScience),2006,22(6):366-367.(in Chinese)
[5]WANG C,DUAN H,HE L.Inhibitory effect of atractylenolide I on angiogenesis in chronic inflammationinvivoandinvitro[J].EurJPharmacol,2009,612(1-3):143-152.
[6]SHAN G S,ZHANG L X,ZHAO Q M,et al.Metabolomic study of raw and processed Atractylodes macrocephala Koidz by LC-MS[J].JPharmBiomedAnal,2014,98:74-84.
[7]潘利文,宋捷.白术内酯Ⅰ体内外的抗黑色素瘤研究[J].中国医院药学杂志,2015,35(8):682-685.
PAN L W,SONG J.Study on inhibiting effects of atractylenolide Ⅰ against melanomainvirtoandinvivo[J].ChineseJournalofHospitalPharmacy,2015,35(8):682-685.(in Chinese)
[8]PINTO G A S,LEITE S G F,TERZI S C,et al.Selection of tannase-producingAspergillusnigerstrains[J].BrazJMicrobiol,2001,32(1):24-26.
[9]ZHANG X H,CAO F L,SUN Z Y,et al.Effect of feedingAspergillusniger-fermented Ginkgo biloba-leaves on growth,small intestinal structure and function of broiler chicks[J].LivestSci,2012,147(1-3):170-180.
[10]王延年,董雪,乔延江,等.中药发酵研究进展[J].世界科学技术(中医药现代化),2010,12(3):437-441.
WANG Y N,DONG X,QIAO Y J,et al.Fermentation of traditional Chinese medicine[J].WorldScienceandTechnology(ModernizationofTraditionalChineseMedicineandMateriaMedica),2010,12(3):437-441.(in Chinese)
[11]MIYAKE Y,FUKUMOTO S,OKADA M,et al.Antioxidative catechol lignans converted from sesamin and sesaminol triglucoside by culturing with Aspergillus[J].JAgricFoodChem, 2005,53(1):22-27.
[12]刘观忠,安胜英,王凤霞.发酵中药对肉仔鸡生产性能和血液生化指标的影响[J].饲料工业,2011,32(23):47-49.
LIU G Z,AN S Y,WANG F X.Effects of fermented Traditional Chinese Medicines on perfeormance and blood biochemical indices of broilers[J].FeedIndustry,2011,32(23):47-49.(in Chinese)
[13]秦俊杰.发酵型黄芪党参饲料添加剂的评价研究[D].北京:中国农业科学院,2011.
QIN J J.Study on the evaluation of the fermented feed additive ofAstragalusmembranaceusandCodonopsispilosula[D].Beijing:Chinese Academy of Agricultural Sciences,2011.(in Chinese)
[14]张凯,杨志强,王学智,等.发酵型黄芪提取物对肉仔鸡生产性能及免疫球蛋白的作用研究[J].湖北农业科学,2011,50(6):1216-1218.
ZHANG K,YANG Z Q,WANG X Z,et al.Study on effects of fermentedradixAstragalusextraction on growth,immunoglobulin of broiler chicken[J].HubeiAgriculturalSciences,2011,50(6):1216-1218.(in Chinese)
[15]范秀蓉,李广武,沈萍.微生物学试验[M].北京:高等教育出版社,1999.
FAN X R,LI G W,SHEN P.Laboratory experiments in microbiology[M].Bejing:Higher Education Press,1999.(in Chinese)
[16]杨宪勇.应用环磷酰胺构建C57BL/6J小鼠免疫抑制模型[J].中国组织工程研究,2012,16(40):7486-7490.
YANG X Y.Establishing a C57BL/6J mouse immunosuppressive model induced by cyclophosphamide[J].ChineseJournalofTissueEngineeringResearch,2012,16(40):7486-7490.(in Chinese)
[17]陈文,何鸽飞,姜曼花,等.近10年白术的研究进展[J].时珍国医国药,2007,18(2):338-340.
CHEN W,HE G F,JIANG M H,et al.Progress onAtractylodesmacrocephalaKoidz in recent five years[J].ShizhenMedicineandMateriaMedicaResearch,2007,18(2):338-340.(in Chinese)
[18]黄利,李利民,唐丽燕.白术水煎剂对小鼠免疫功能的影响[J].中药药理与临床,2012,28(1):114-115.
HUANG L,LI L M,TANG L Y.Effect ofAtractylodesmacrocephalaKoidz Decoction on the immune function of mice[J].PharmacologyandClinicsofChineseMateriaMedica,2012,28(1):114-115.(in Chinese)
[19]LEE J C,LEE K Y,SON Y O,et al.Stimulating effects on mouse splenocytes of glycoproteins from the herbal medicineAtractylodesmacrocephalaKoidz[J].Phytomedicine,2007,14(6):390-395.
[20]孙文平,李发胜,陈晨,等.白术多糖对小鼠免疫功能调节的研究[J].中国微生态学杂志,2011,23(10):881-882,886.
SUN W P,LI F S,CHEN C,et al.Immunomodulation of Atractylodis polysaccharides in mice[J].ChineseJournalofMicroecology,2011,23(10):881-882,886.(in Chinese)
[21]黄争荣,王泳,王榕平,等.参苓白术散对荷瘤小鼠血清IL-2、IFN-γ、TNF-α 的影响[J].光明中医,2010,25(9):1584-1586.
HUANG Z R,WANG Y,WANG R P,et al.Effect of Shenlinbaizhu Powder on the level of IL-2、IFN-γ、TNF-α in Tumor-bearing Mice[J].GuangmingJournalofChineseMedicine,2010,25(9):1584-1586.(in Chinese)
[22]赵迎虎,张明军,刘进辉,等.中药制剂对小鼠耐力及免疫器官指数影响[J].中兽医医药杂志,2010(1):14-17.
ZHAO Y H,ZHANG M J,LIU J H,et al.Effects of traditional Chinese medicine preparation on the endurance and immune organ index in mice[J].JournalofTraditionalChineseVeterinaryMedicine,2010(1):14-17.(in Chinese)
[23]徐占云,秦睿玲,褚耀诚,等.枸杞多糖对雏鸡淋巴细胞体外增殖及分泌IL-2的影响[J].畜牧兽医学报,2013,44(2):322-328.
XU Z Y,QIN R L,CHU Y C,et al.Effects ofLyciumbarbarumpolysaccharide on cell proliferation of chicken lymphocytes and IL-2 excretioninvitro[J].ActaVeterinariaetZootechnicaSinica,2013,44(2):322-328.(in Chinese)
[24]郭芳,刘秀书,孟祥琴,等.六味地黄发酵液的免疫调节作用[J].河北医科大学学报,2001,22(2):72-74.
GUO F,LIU X S,MENG X Q,et al.Immunomodulating activity of fermented decotion of Liuweidihuang[J].JournalofHebeiMedicalUniverisity,2001,22(2):72-74.(in Chinese)
[25]徐启华,赵堃,曹军.玉屏风散发酵液对免疫抑制小鼠免疫功能的调节作用[J].齐齐哈尔医学院学报,2006,27(6):643-646.
XU Q H,ZHAO K,CAO J.The regulating effect of yupingfeng-ferment-product on the immune function of immunosuppressive mice[J].JournalofQiqiharMedicalCollege,2006,27(6):643-646.(in Chinese)
[26]刘金海.黑曲霉菌在生物发酵饲料上的应用及其产品对动物抗病力的影响[D].长春,吉林大学,2012.
LIU J H.Applications ofAspergillusNigermedia in biological fermentation feed and effects of its production on animal disease-resistant ability[D].Changchun:Jilin University,2012.(in Chinese)
[27]陶蕾,王宏伟,许冠英,等.黑曲霉发酵对黄柏中游离态小蘖碱含量的影响[J].中兽医医药杂志,2011 (2):41-43.
TAO L,WANG H W,XU G Y,et al.Effect ofAspergillusnigerfermentation on the contents of free berberine in Cortex phellodendri[J].JournalofTraditionalChineseVeterinaryMedicine,2011(2):41-43.(in Chinese)
[28]韩春杨,刘翠艳,牛钟相.中药制剂发酵前后成分的变化及对肉鸡部分免疫指标和生长的影响[J].畜牧兽医学报,2005,36(11):1223-1227.
HAN C Y,LIU C Y,NIU Z X.Component changes of Chinese herb before and after fermentation and the effect on some immune indices and growth performance of broiler chickens[J].ActaVeterinariaetZootechnicaSinica,2005,36(11):1223-1227.(in Chinese)
[29]安胜英,马学会,刘观忠.发酵中药添加剂对肉仔鸡免疫机能和抗氧化机能的影响[J].畜牧兽医学报,2015,46(5):863-867.
AN S Y,MA X H,LIU G Z.Effects of fermented Chinese herbs on immunty and antioxidants ability of broilers[J].ActaVeterinariaetZootechnicaSinica,2015,46(5):863-867.(in Chinese)
[30]郝延军,桑育黎,李宝林,等.白术内酯Ⅰ及白术内酯Ⅲ对唾液淀粉酶活性的影响[J].时珍国医国药,2006,17(9):1617-1618.
HAO Y J,SANG Y L,LI B L,et al.Effect of atractylode I、III on saliva amylase activity in rats of diarrhea and spleen deficiency[J].LishizhenMedicineandMateriaMedicaResearch,2006,17(9):1617-1618.(in Chinese)
[31]熊蕴珠.白术内酯Ⅰ对MyD88+人卵巢癌细胞分泌的免疫抑制因子TGF-β1、IL-17A、IL-10和IL-4的影响[D].成都:成都中医药大学,2014.
XIONG Y Z.The effect of atractylenolide I on immune inhibitory cytokines:TGF-B1、IL-17A、IL-10 and IL-4 secretion of MyD88+ human ovarian cancer cells[D].Chengdu:Chengdu University of TCM,2014.(in Chinese)
[32]王葱葱.白术内酯I对MyD88+人卵巢癌细胞的吲哚胺-2,3双加氧酶(indoleamine-2,3-dioxygenase IDO)的表达及外周血T淋巴细胞增殖活性的影响[D].成都:成都中医药大学,2014.
WANG C C.Atractylenolide I acting on MyD88+ human ovarian cancer cells have an effect on expression of indoleamine 2,3-dioxygenase(IDO)and T lymphocyte proliferation activity in peripheral blood[D].Chengdu:Chengdu University of TCM,2014.(in Chinese)
[33]刘双,杨静,江振作,等.中药“神曲”发酵工艺及质量标准研究进展[J].天津中医药,2015,32(5):318-320.
LIU S,YANG J,JIANG Z Z,et al.Research progress of fermentation technology and quality standard of Shenqu[J].TianjinJournalofTraditionalChineseMedicine,2015,32(5):318-320.(in Chinese)
[34]陈富文,史高峰,王国英,等.响应面法优化复方中药发酵工艺[J].中国中医药信息杂志,2014,21(4):73-77.
CHEN F W,SHI G F,WANG G Y,et al.Optimization of fermentation process of compound Chinese Medicine by response surface methodology[J].ChineseJournalofInformationonTraditionalChineseMedicine,2014,21(4):73-77.(in Chinese)
(编辑白永平)
doi:10.11843/j.issn.0366-6964.2016.07.026
收稿日期:2016-01-21
基金项目:国家自然科学基金(31572558;31272144);北京市科技新星(Z141105001814041);北京市农业科技项目(20150126)
作者简介:孙向婉(1991-),女,硕士生,主要从事中药提高动物免疫机制研究,E-mail:804501313@qq.com *通信作者:董虹,副教授,Tel:010-80799480,E-mail:donghong523@163.com;穆祥,教授,Tel:010-80789515,E-mail:muxiang1109@sina.com
中图分类号:S853.73
文献标志码:A
文章编号:0366-6964(2016)07-1502-09
Effect ofAspergillusniger-FermentedAtractylodesmacrocephalaKoidz on the Spleen Index,Thymus Index and T Lymphocyte Proliferation of Mice
SUN Xiang-wan1,WANG Yun1,WANG Xin1,LIU Xiao-ye2,MU Xiang1*,DONG Hong1*
(1.BeijingKeyLaboratoryofTraditionalChineseVeterinaryMedicine,BeijingUniversityofAgriculture,Beijing102206,China;2.CollegeofVeterinaryMedicine,ChinaAgriculturalUniversity,Beijing100193,China)
Abstract:This study aimed to study the effect of Aspergillus niger-fermented Atractylodes macrocephala Koidz on the immune function of mice.An immunosuppression mice model (cyclophosphamide) was utilize to study the effect of fermented Atractylodes macrocephala Koidz on spleen index,thymus index and T lymphocyte proliferation.High performance liquid chromatography (HPLC) was used to analyze the changes in the active omponents of Atractylodes macrocephala Koidz with or without fermentation by Aspergillus niger.Orthogonal experiment was conducted to select the best conditions.The results showed that:1)The low,middle and high dose groups (0.5,1,2 g·kg-1) of fermented Atractylodes macrocephala Koidz can effectively increase thymus index (P<0.05).In addition,middle dosage group of fermented Atractylodes macrocephala Koidz can effectively increase spleen index and T lymphocyte proliferation (P<0.05);2) The results of HPLC showed that the content of atractylenolide Ⅰ was effectively increased in the Atractylodes macrocephala Koidz processed by Aspergillus niger compared with unfermented Atractylodes macrocephala Koidz;3) The best fermentation conditions were as follows:inoculum concentration was 8%;water content was 40%;fermentation time was 96 h,under the optimized conditions,the content of atractylenolide Ⅰ was 1.4 times of those in raw Atractylodes macrocephala Koidz.These results indicated that fermented Atractylodes macrocephala Koidz could improve immune function of mice by increasing the content of atractylenolide Ⅰ.
Key words:Aspergillus niger;fermented Atractylodes macrocephala Koidz;immune function;atractylenolide Ⅰ
