基于倒毛鸡LSm14A分子序列分析的原核表达与免疫原性分析
2016-08-09伍昌华陈绍品温贵兰李天珍林汉卿管国丹王开功龚新勇
伍昌华,陈绍品,温贵兰,李 晨,李天珍,林汉卿,管国丹,王开功,文 明,龚新勇
(贵州大学动物科学学院 预防兽医学实验室,贵阳 550025)
基于倒毛鸡LSm14A分子序列分析的原核表达与免疫原性分析
伍昌华,陈绍品,温贵兰*,李晨,李天珍,林汉卿,管国丹,王开功,文明,龚新勇
(贵州大学动物科学学院 预防兽医学实验室,贵阳 550025)
摘要:旨在探明倒毛鸡LSm14A分子序列特征与免疫原性。通过提取倒毛鸡肝总RNA,经RT-PCR分别扩增倒毛鸡LSm14A全长CDS区与原核表达片段;采用分子生物学技术构建携带倒毛鸡LSm14分子的原核表达质粒;经IPTG诱导表达、His-tag镍柱纯化表达的重组蛋白质;纯化重组蛋白质rHis-cLSm14A分别免疫小鼠与兔制备相应的多克隆抗体;采用间接ELISA与Western blotting方法分析表达蛋白质的免疫原性。结果显示:倒毛鸡LSm14A全长CDS为1 386 bp,与原鸡源LSm14A相似性达100%,与鸭源的LSm14A相似性为95.1%;与鼠、爪蟾、猴、人、猪、鹅源的LSm14A相似性相对较低;鼠源、兔源抗cLSm14A多克隆抗体ELISA效价均高于1∶3 200;Western blotting结果显示,重组表达蛋白质分别被His抗体、鼠源与兔源抗cLSm14A多克隆抗体所识别,蛋白质条带大小约为19.6 ku。以上结果说明倒毛鸡源LSm14A分子具有较高的保守性与良好的免疫原性,研究结果为研究倒毛鸡的生物学特性与宿主的抗病毒天然免疫机制奠定了基础。
关键词:倒毛鸡;cLSm14A;免疫原性
Sm(Smith)蛋白家族最早在研究人类前体RNA的加工过程中被发现,参与前体RNA的加工[1]。从原核生物到真核生物的多种生物体内还发现多种含Sm基序的高度保守的同源蛋白质家族,称之为Sm样蛋白(Sm-Like,LSm)[2-3]。LSm蛋白是RNA结合蛋白,不同的LSm蛋白在生物中分布广泛,参与多种RNA代谢过程[4-5]。LSm14A也称为RAP55A/Tral/Scd6,属于Sm样蛋白家族,最先在伊比利亚肋突螈与非洲爪蟾中发现,主要结合在卵母细胞质处理小体上,在进化上具有保守性[6]。近期研究表明LSm14A是一种新型病毒核酸受体,参与宿主细胞的天然免疫反应[7]。倒毛鸡是贵州省重点保护与开发的品种之一,但其易患新城疫、传染性支气管炎、鸡痘等病毒性疾病,发病率为20%~30%,死亡率为70%~80%。为进一步探明倒毛鸡的品种特性、有效降低疫病对倒毛鸡养殖业的威胁,作者以倒毛鸡LSm14A作为研究对象,系统地对倒毛鸡LSm14A分子进行了核苷酸与氨基酸序列分析,同时构建了相应的原核表达载体、制备了相应的抗倒毛鸡LSm14A的兔源与鼠源多克隆抗体。
1材料与方法
1.1实验材料
1.1.1实验动物、质粒、菌株10周龄健康倒毛鸡5只,由贵州大学动物科学学院欧德渊教授惠赠;体重3 kg左右的健康雄性新西兰大白兔3只、4~6周的雄性小鼠购自贵州医科大学实验动物中心,饲养于本实验室;pColdⅠ质粒由上海兽医研究所马永志教授惠赠;BL21购自碧云天公司。
1.1.2试剂反转录试剂购自普洛麦格公司;PCR相关试剂购自宝生物公司;His-tag抗体、HRP标记山羊抗小鼠IgG(H+L)、HRP标记山羊抗兔IgG(H+L)、超敏ECL化学发光试剂盒等购自碧云天公司;Ni NTA琼脂糖凝胶购自北京韦氏博慧色谱科技有限公司。
1.2方法
1.2.1引物设计参照NCBI GallusLSm14A(基因登录号:NM_001012778.1)序列,用DNAStar软件分析LSm14A基因,采用Primer Premier5.0软件分别设计克隆cLSm14A基因和构建携带LSm14A原核表达载体用的特异性引物(表1)。
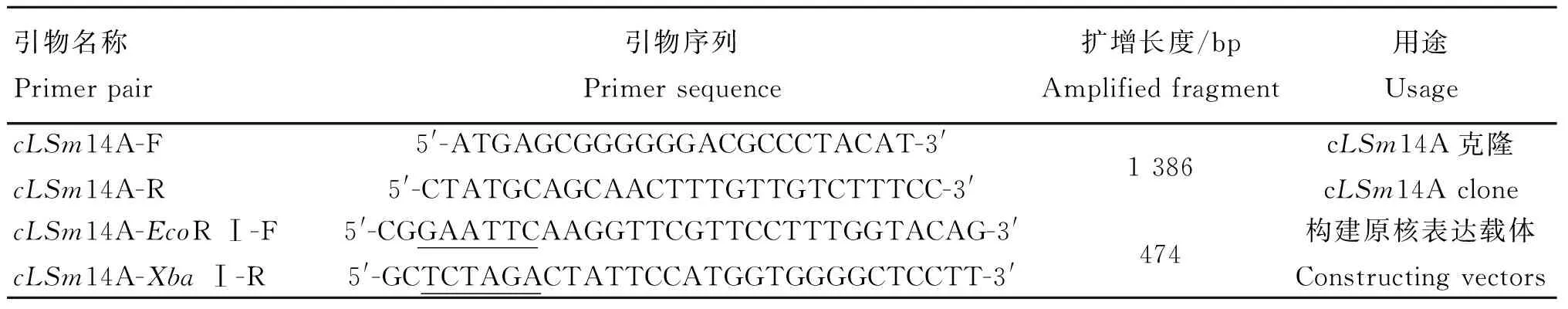
表1 cLSm14A克隆所需引物
下划线为酶切位点
The enzyme digestion sites are underlined
1.2.2组织RNA的提取与RT-PCR采用RNA提取试剂盒提取倒毛鸡肝总RNA作为模板、Oligo(dT)15为引物、M-MLV反转录酶反转录合成cDNA。用反转录生成的cDNA为模板、分别采用“1.2.1”的引物扩增倒毛鸡LSm14A全长编码区与原核表达截短区域。
1.2.3cLSm14A序列分析将倒毛鸡源cLSm14A核苷酸序列在NCBI网站进行比对分析,采用DNAStar软件MegAlign方法绘制倒毛鸡源cLSm14A进化树,比较倒毛鸡源与其他物种源LSm14A核苷酸序列相似性。利用在线网站(https://npsa-prabi.ibcp.fr/cgi-bin/secpred-sopma.pl)对LSm14A蛋白质的二级结构进行分析。1.2.4原核表达质粒的构建分别采用EcoRⅠ、XbaⅠ酶切PCR产物和pColdⅠ质粒、纯化酶切产物、于16 ℃反应条件下连接过夜、连接产物转入BL21感受态细胞中、菌液PCR鉴定、双酶切鉴定,初步鉴定阳性的重组质粒送广州立菲生物公司测序。测序正确后,阳性质粒命名为pCold Ⅰ-cLSm14A。1.2.5重组蛋白质的诱导表达、纯化与鉴定取含有阳性重组质粒pColdⅠ-cLSm14A的BL21表达宿主菌,按1∶100的比例接种于含氨苄青霉素抗性的LB培养液中、IPTG(终浓度为1.0 mmol·L-1)诱导4 h、8 mol·L-1脲素PBS重悬、超声破碎处理、Ni NTA琼脂糖(400 mmol·L-1咪唑洗脱)纯化表达蛋白质,蛋白质样品采用15% SDS-PAGE进行鉴定,纯化的重组蛋白质命名为rHis-cLSm14A。
1.2.6抗cLSm14A多克隆抗体的制备将纯化的重组蛋白质rHis-cLSm14A与弗氏完全佐剂等体积充分乳化后,分别颈部皮下多点注射新西兰大白兔(500 μg·只-1)、小鼠(50 μg·只-1),14 d后改用弗氏不完全佐剂乳化重组蛋白质,依次间隔14 d后,分别进行三、四次免疫。无菌心脏采血、分离血清、分装保存备用。
1.2.7抗cLSm14A多克隆抗体效价鉴定取“1.2.6”制备的抗cLSm14A兔源、鼠源多克隆抗体分别进行1∶200、1∶400、1∶800、1∶1 600、1∶3 200倍的稀释,采用纯化的重组蛋白质包被酶标板,按间接ELISA方法分别测定多克隆抗体的ELISA效价。
1.2.8Western blotting检测蛋白质样品采用15%SDS-PAGE进行电泳,采用湿转方法将样品蛋白质转移至PVDF膜,0.5%脱脂奶粉37 ℃封闭1 h,洗膜,分别加入His-tag抗体(1∶1 000)、抗cLSm14A兔源多克隆抗体(1∶1 000)、抗cLSm14A鼠源多克隆抗体(1∶500) 4 ℃孵育过夜,洗涤,分别加入HRP标记山羊抗小鼠IgG(1∶1 000)、HRP标记山羊抗兔IgG(1∶1 000) 37 ℃孵育1 h,洗膜,显色、压片、曝光、拍照,记录结果。
2结果
2.1cLSm14A序列分析
RT-PCR扩增结果显示,倒毛鸡源cLSm14A 编码区约为1 400 bp,测序结果显示扩增条带为1 386 bp,与预期长度一致(图1)。
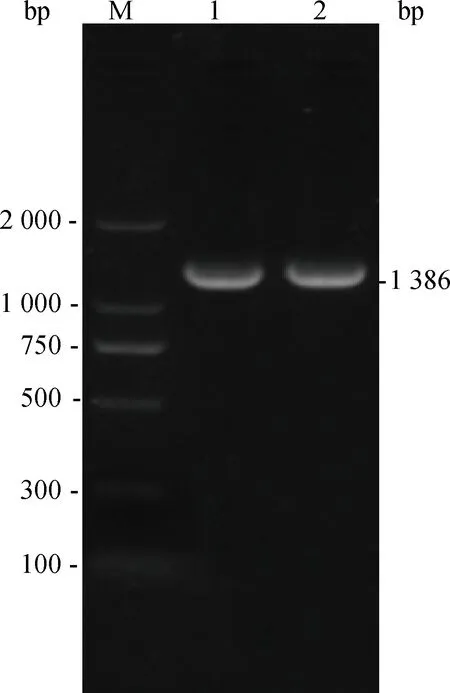
M.DL2000 DNA相对分子质量标准;1、2.cLSm14A基因PCR扩增产物M.DL2000 DNA marker;1,2.PCR product of cLSm14A gene图1 cLSm14A基因PCR扩增产物电泳图谱Fig.1 Amplification of cLSm14A gene
NCBI Blast分析发现,倒毛鸡cLSm14A与基因登录号为NM_001012778的原鸡源序列相似度达100%;系统进化树分析发现,倒毛鸡源cLSm14A与鸭源在同一分支,相似度为95.1%;与鼠、爪蟾、猴、人、猪、鹅的LSm14A较远,相似度分别为61.3%、46.2%、43.2%、43.0%、43.0%、26.7%(图2)。
通过DNAStar、NCBI网站提供的软件分析发现cLSm14A含有Sm2与FDF基序;cLSm14A基因编码的蛋白质中无规卷曲的含量最高(约占整个肽链的52.49%),其次是α-螺旋(占25.81%),延伸链占16.70%,β-转角占4.99%。
2.2原核表达质粒的构建与鉴定
阳性菌株质粒双酶切结果显示,酶切产物约为4 407与474 bp的两条特异性条带,与预期大小一致(图3)。测序结果表明,目的序列正确插入原核表达载体中,重组质粒命名为pColdⅠ-cLSm14A。
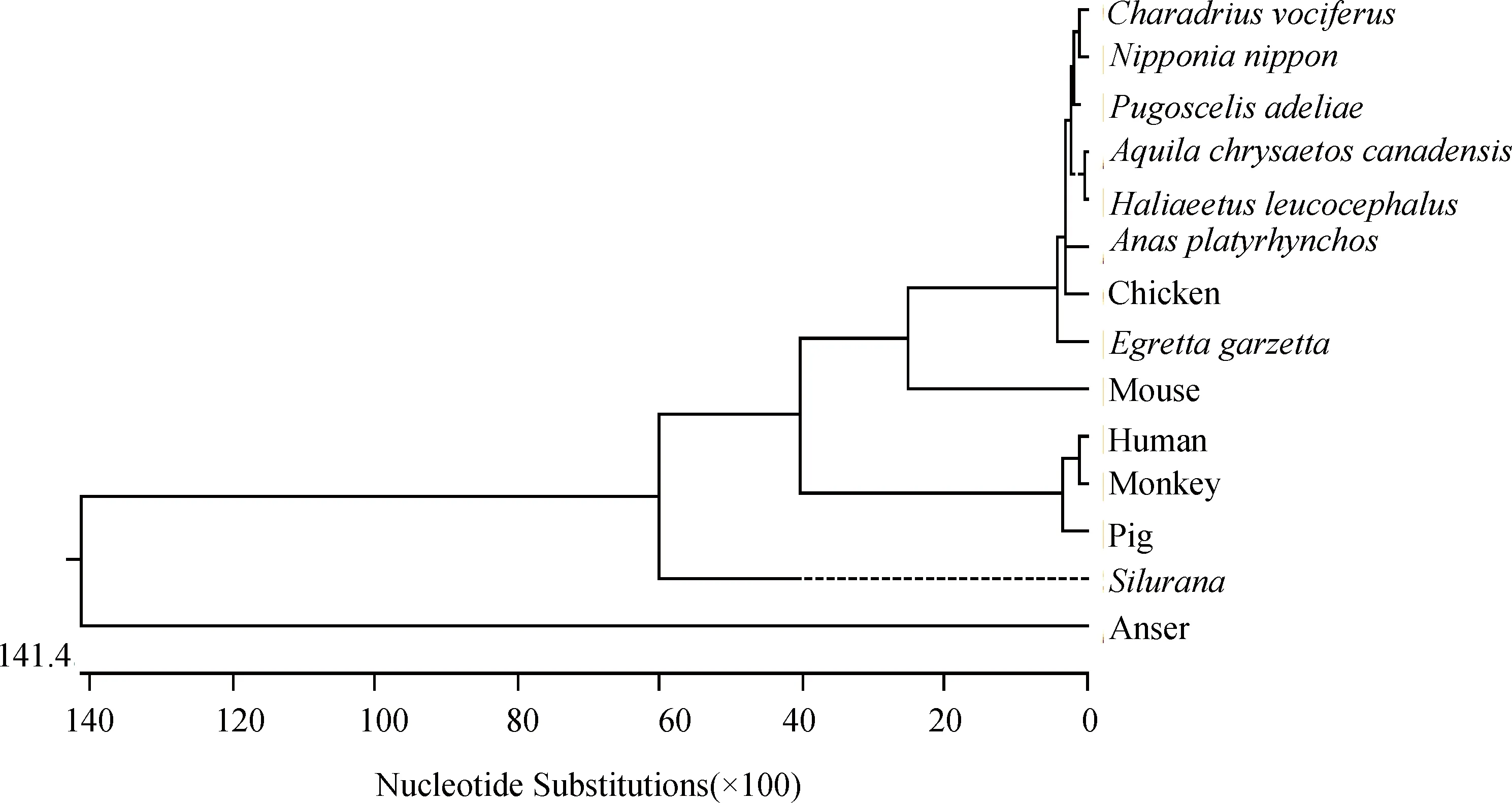
图2 cLSm14A与其他物种LSm14A分子系统进化树Fig.2 Phylogenetic analysis of LSm14A molecules from chicken and other species
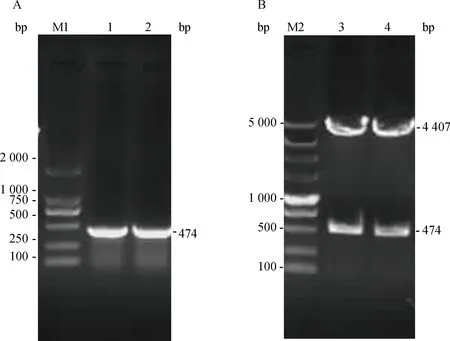
M1.DL2000 DNA相对分子质量标准;1、2.重组质粒pColdⅠ-cLSm14A PCR产物;M2.DL5000 DNA相对分子质量标准;3、4.重组质粒pColdⅠ-cLSm14A EcoRⅠ、XbaⅠ双酶切鉴定M1.DL2000 DNA marker;1,2.PCR product of recombinant plasmid pColdⅠ-cLSm14A;M2.DL5000 DNA marker;3,4.The product digested by EcoRⅠ and XbaⅠ from pColdⅠ-cLSm14A图3 原核表达质粒pColdⅠ-cLSm14A PCR(A)鉴定与酶切鉴定(B)Fig.3 Identification of the recombinant plasmid pColdⅠ-cLSm14A by PCR (A) and enzyme digestion (B)
2.3重组蛋白质表达、纯化与鉴定
15%的SDS-PAGE电泳鉴定结果显示,重组表达蛋白质rHis-cLSm14A主要以包涵体形式存在,rHis-cLSm14A相对分子质量约为19.6 ku(图4),与预期相一致。
2.4抗cLSm14A多克隆抗体的制备
间接ELISA结果显示,本次制备的抗cLSm14A兔源、鼠源多克隆抗体效价均高于1∶3 200。
2.5Western blotting
Western blotting结果显示,经IPTG诱导的重组表达蛋白质能与His单抗、兔源多克隆抗体、鼠源多克隆抗体产生特异性反应,条带均为19.6 ku左右(图5)。

M.预染的蛋白质相对分子质量标准;1.pColdⅠ-cLSm14A转入BL21菌经IPTG诱导后超声菌液;2.pColdⅠ-cLSm14A转入BL21菌IPTG诱导未超声菌液;3.pColdⅠ-cLSm14A转入BL21菌未诱导菌液;4~7.杂蛋白质;8、9.纯化的rHis-cLSm14A蛋白M.Protein marker;1.Supernatant of BL21 (pColdI-cLSm14A) induced with IPTG after ultrasound;2.Solution of BL21 (pColdⅠ-cLSm14A) induced with IPTG before ultrasound;3.Solution of BL21 uninduced;4-7.Without rHis-cLSm14A recombinant protein;8,9.Purified rHis-cLSm14A recombinant protein图4 重组pColdⅠ-cLSm14A蛋白表达产物的鉴定Fig.4 Analysis of expression of recombinant protein pColdⅠ-cLSm14A

A.一抗为His单抗体;B.一抗为鼠源抗cLSm14A多克隆抗体;C.一抗为兔源cLSm14A多克隆抗体;M.预染的蛋白质相对分子质量标准;1.空载体pColdⅠ;2:诱导的pColdⅠ-cLSm14A重组菌A.First antibody is His monoclonal antibody;B.First antibody is ployclonal mouse-anti-cLSm14A antibody;C.First antibody is ployclonal rabbit-anti-cLSm14A antibody;M.Protein marker;1.Empty vector pColdⅠ;2.Purified pColdⅠ-cLSm14A recombinant protein图5 重组蛋白rHis-cLSm14A的Western blotting鉴定Fig.5 Identification of recombinant protein rHis-cLSm14A by Western blotting
3讨论
通过RT-PCR获得了倒毛鸡源cLSm14A全长CDS,大小为1 386 bp;进化树结果表明cLSm14A分子在本物种中是高度保守的;Western blotting结果显示cLSm14A具有良好的免疫原性。LSm14A作为新型的核酸受体,可直接识别并结合病毒核酸,有效激活宿主的天然免疫,介导Ⅰ型干扰素的表达,抑制水疱病毒、新城疫病毒、猪繁殖与呼吸障碍综合征病毒的复制[8-9],说明LSm14A蛋白是重要的天然抗病毒免疫分子,本研究为下一步更深层次地探索LSm14A在天然免疫中的作用奠定了基础。
LSm14A也称为hRAP55A,不同物种的LSm14A氨基酸比对结果显示LSm14A的N端高度保守,人源与猪源LSm14A的N端包含一个Sm样结构域,C端有一个FFD-TFG box结构域,还具有α螺旋形成多个亲水的环状结构FDF结构域[10];倒毛鸡源LSm14A序列分析显示cLSm14A也含有Sm2与FDF基序,蛋白质二级结构中无规卷曲的含量最高,约占整个肽链的52.49%。LSm蛋白家族含有十多个成员,参与各种与RNA代谢有关的信号通路,施一公课题组首次报道了LSm2~8蛋白质复合物自组装的晶体结构及其特异识别U6小核RNA 3′末端序列的分子机制[11]。倒毛鸡cLSm14A的Sm2与FDF基序、蛋白质二级结构在病毒感染中发挥何种作用,还有待于进一步探索研究。
参考文献(References):
[1]TOLLERVEY D.A yeast small nuclear RNA is required for normal processing of pre-ribosomal RNA[J].EMBOJ,1987,6(13):4169-4175.
[2]NIELSEN J S,BØGGILD A,ANDERSEN C B,et al.An Hfq-like protein in archaea:crystal structure and functional characterization of the Sm protein from Methanococcus jannaschii[J].RNA,2007,13(12):2213-2223.
[3]SITTKA A,LUCCHINI S,PAPENFORT K,et al.Deep sequencing analysis of small noncoding RNA and mRNA targets of the global post-transcriptional regulator,Hfq[J].PLoSGenet,2008,4(8):e1000163.
[4]BOUVERET E,RIGAUT G,SHEVCHENKO A,et al.A Sm-like protein complex that participates in mRNA degradation[J].EMBOJ,2000,19(7):1661-1671.
[5]THARUN S,HE W,MAYES A E,et al.Yeast Sm-like proteins function in mRNA decapping and decay[J].Nature,2000,404(6777):515-518.
[6]YANG W H,YU J H,GULICK T,et al.RNA-associated protein 55 (RAP55) localizes to mRNA processing bodies and stress granules[J].RNA,2006,12(4):547-554.
[7]LI Y,LI C,XUE P,et al.ISG56 is a negative-feedback regulator of virus-triggered signaling and cellular antiviral response[J].ProcNatlAcadSciUSA,2009,106(19):7945-7950.
[8]WEN G L,ZHANG Y,ZHANG X,et al.Functional characterization of porcine LSm14A in IFN-β induction[J].VetImmunolImmunopathol,2013,155(1-2):110-116.
[9]李振红.猪LSm14A基因抑制PRRSV复制及G4基因激活NF-κB的功能研究[D].武汉:华中农业大学,2014.
LI Z H.Functional analysis of inhibition of PRRSV replication by procine LSm14A gene and activation of NF-κB byG4 gene[D].Wuhan:Huazhong Agricultural University,2014.(in Chinese)
[10]MATSUMOTO K,NAKAYAMA H,YOSHIMURA M,et al.PRMT1 is required for RAP55 to localize to processing bodies[J].RNABiol,2012,9(5):610-623.
[11]ZHOU L,HANG J,ZHOU Y,et al.Crystal structures of the Lsm complex bound to the 3′ end sequence of U6 small nuclear RNA[J].Nature,2014,506(7486):116-120.
(编辑白永平)
doi:10.11843/j.issn.0366-6964.2016.07.027
收稿日期:2015-12-28
基金项目:贵州大学博士基金项目[贵大人基合字(2013)12];国家自然科学基金(31460668);贵州大学研究生创新基金项目(研农2015024);贵州大学“本科教学工程”项目(JKSP2013004);贵州省科技创新人才团队项目[黔科合人才团队(2015)4016]
作者简介:伍昌华(1989-),男,仡佬族,贵州石阡人,硕士生,主要从事兽医微生物与免疫学研究,E-mail:1006492290@qq.com *通信作者:温贵兰,E-mail:glwen@gzu.edu.cn
中图分类号:S852.4
文献标志码:A
文章编号:0366-6964(2016)07-1511-06
Prokaryotic Expression of theLSm14A Gene in the Frizzle Chicken Based on the Sequence and Immunogenicity Analyses of the Expressed LSm14A
WU Chang-hua,CHEN Shao-pin,WEN Gui-lan*,LI Chen,LI Tian-zhen,LIN Han-qing,GUAN Guo-dan,WANG Kai-gong,WEN Ming,GONG Xin-yong
(PreventiveVeterinaryLaboratory,CollegeofAnimalScienceGuizhouUniversity,Guiyang550025,China)
Abstract:The aim of this study was to explore the sequence and the immunogenicity of LSm14A gene of the Frizzle chicken.Total cellular RNA was isolated from the livers of frizzle chickens hepatic tissue,and full length CDS region and prokaryotic expression fragment of LSm14A gene were amplified by reverse transcription polymerase chain reaction RT-PCR.The recombinant plasimd was transfected into BL21 competent cells,then His-tag Ni-NTA spin columns were applied to purify the recombinant protein which were produced by IPTG induced BL21.To generate the corresponding hyperimmune serum,rabbits and mice were immunized with the purified recombinant protein rHis-cLSm14A.Sequence analysis revealed that the full length of LSm14A CDS region transcripts from the frizzle chicken was amplified by RT-PCR.The amplified LSm14A CDS region had 1 368 bp and was 100% identical at the base sequence level to the sequence in GenBank.It has a close similarity to the duck source which reaches to 95.1%,on the contrary,the similarity to LSm14A from the mouse source,Xenopus,monkey source,human source,pig source,anser source were distant.The titers of serum mouse-anti-cLSm14A and rabbit-anti-cLSm14A antibodies were both higher than 1∶3 200.Western blotting assay showed that the recombinant protein displayed an immune response with the His-antibody,mouse-anti-cLSm14A hyperimmune serum and rabbit-anti-cLSm14A hyperimmune serum,The band weighted about 19.6 kDa in the western blotting.All the results indicated that the LSm14A molecule of frizzle chicken had a high conservative property and good immunogenicity,which laid a solid foundation for the further study of biological characteristics of frizzle chickens and antiviral natural immune mechanism of poultry.
Key words:the frizzle chicken;cLSm14A;immunogenicity
