表达H1N1亚型猪流感病毒三聚体HA重组慢病毒的免疫原性研究①
2016-08-09邓颖琦李俊峰唐雨博孙艺学王伟利丛彦龙
邓颖琦 李俊峰 曲 辉 唐雨博 孙艺学 李 鑫 王伟利 丁 壮 丛彦龙
(吉林大学动物医学学院,长春130062)
表达H1N1亚型猪流感病毒三聚体HA重组慢病毒的免疫原性研究①
邓颖琦李俊峰②③曲辉②④唐雨博孙艺学⑤李鑫王伟利⑥丁壮丛彦龙
(吉林大学动物医学学院,长春130062)
[摘要]目的:探讨表达猪H1N1亚型流感病毒三聚体HA的重组慢病毒(rLV-HA-GCN4)对BALB/c小鼠的免疫保护效果。方法:将雌性BALB/c小鼠随机分为重组慢病毒rLV-HA-GCN4组、重组慢病毒rLV-HA组、慢病毒LV空载体对照组及PBS对照组,先后进行质粒和慢病毒2次免疫,间隔为2周,注射部位均为小鼠大腿内侧肌肉;于初次免疫后的第28天,各组小鼠鼻腔滴注50 μl 100TCID50的H1N1病毒,采用淋巴细胞转化实验、流式细胞术、间接ELISA和脾肺指数检测各免疫指标。结果:加强免疫后第14天,rLV-HA-GCN4组脾淋巴细胞转化率为0.3±0.11,与PBS组相比,差异有统计学意义(P<0.01),产生以Th1型CD4+ T细胞为主的细胞免疫反应;rLV-HA-GCN4组小鼠IgG抗体效价可达1∶8 000,攻毒后第14天约为1∶7 000;攻毒后,rLV-HA-GCN4组脾肺指数小于PBS组,小鼠体重在前3 d略有下降,随后逐渐上升,两个指标与PBS组相比,差异均有统计学意义(P<0.05)。结论:rLV-HA-GCN4能够诱导小鼠良好的细胞与体液免疫应答,从而有效地保护小鼠抵御猪H1N1流感病毒的感染。
[关键词]猪流感;H1N1亚型;三聚体HA;慢病毒载体;免疫原性
流行性感冒(Influenza)简称流感(flu),是由流感病毒(Influenza virus)引起的一种潜伏期短、传染性强、传播迅速的急性呼吸道传染病。根据核蛋白(NP)和基质蛋白(M)抗原性的不同,将流感病毒分为3个型,即甲(A)、乙(B)、丙(C)型,其中A型流感病毒宿主感染谱最为广泛,包括多种禽类和哺乳动物。A型流感病毒根据血凝素(HA)和神经氨酸酶(NA)抗原性的不同可分为多种不同的亚型。其中H1N1亚型流感病毒自1918年发现至今,不仅导致了养猪业严重的经济损失,而且作为引发人群季节性流感的主要致病亚型,也给人类健康带来了巨大威胁。此外,H1N1亚型病毒在猪群与人群中的跨种传播也受到了密切关注,因此防控该亚型流感具有重要的公共卫生学意义[1,2]。本研究对前期利用慢病毒载体系统包装的表达H1N1亚型猪流感病毒三聚体HA的重组慢病毒进行了免疫原性评价,为今后防控H1N1亚型猪流感病毒提供理论和实验依据。
1材料与方法
1.1材料
1.1.1病毒H1N1亚型猪流感病毒由吉林大学动物医学学院传染病实验室分离并保存;重组慢病毒rLV-HA-GCN4、重组慢病毒rLV-HA、慢病毒LV均由吉林大学动物医学学院传染病实验室构建包装[3]。
1.1.2实验动物60只6~8周龄SPF雌性BALB/c小鼠,体重15~18 g,购自北京华阜康生物科技股份有限公司,合格证号:SCXK(京)2012-0004。
1.1.3主要试剂红细胞裂解液、MTT购自碧云天生物有限公司;ConA、PMA、离子酶素购自Sigma公司;阻断剂BFA、穿膜剂购自eBioscience公司;APC anti-mouse CD3、FITC anti-mouse CD4、PE anti-mouse CD8、FITC anti-mouse TNF-α、PE anti-mouse IFN-γ、PE anti-mouse IL-12、PE anti-mouse IL-4、FITC anti-mouse IL-10均购自BD Biosciences公司;1640细胞培养液购自Gibco公司;兔抗鼠酶标二抗购自Southern Biotech公司。
1.2方法
1.2.1动物分组、免疫及攻毒将饲养于温度22℃、相对湿度50%~60%环境中的小鼠随机分为4组:重组慢病毒rLV-HA-GCN4组、重组慢病毒rLV-HA组、慢病毒LV空载体对照组及PBS对照组。初次免疫时,免疫组小鼠分别肌注各慢病毒质粒15 μg/100 μl,PBS组肌注PBS 100 μl;于初次免疫后的第14天,免疫组再分别以各106转导单位(TU)的慢病毒进行加强免疫。质粒与慢病毒免疫部位均为小鼠大腿内侧肌肉;于初次免疫后的第28天,小鼠鼻腔滴注50 μl 100TCID50的H1N1病毒,每日观察小鼠状态并称重。
1.2.2脾细胞的制备加强免疫后第14天每组取3只小鼠,脱颈处死后无菌剪取部分脾脏置于200目细胞筛网上,充分研磨后将细胞悬液转入5 ml离心管中,2 000 r/min×5 min,弃上清,加入红细胞裂解液,混匀后立即加入1 ml含有10%血清的1640培养液中,2 000 r/min×5 min;用1640培养液洗涤2次后,再以1 ml培养液重悬细胞并计数。
1.2.3淋巴细胞转化率的测定采用MTT法。将1×106ml-1的脾细胞悬液铺至96孔细胞培养板中,每孔200 μl,置37℃、5%CO2培养箱中培养。待细胞长至单层后,用终浓度为5 μg/ml ConA刺激,未加刺激剂的自然增殖孔以细胞培养液代替,培养72 h后,加入10 μl MTT(5 mg/ml),继续培养4 h后,离心弃上清,加入150 μl DMSO,室温避光孵育20 min后,在酶标仪490nm波长处测定吸光度值(A)。
1.2.4T细胞亚群的检测采用流式细胞术。将1×106ml-1的脾细胞悬液铺至96孔细胞培养板中,每孔200 μl,置37℃、5%CO2培养箱中培养。待细胞长至单层后,以100 μl FACS buffer重悬细胞,每100万个细胞分别加入1 μg的APC anti-mouse CD3、FITC anti-mouse CD4、PE anti-mouse CD8,同时设置同型对照。4℃避光孵育1 h后,2 000 r/min×5 min,用1640培养液洗涤2次,以100 μl FACS buffer重悬细胞,经尼龙膜滤至流式细胞管,上流式细胞仪进行检测。
1.2.5脾细胞胞内细胞因子的检测采用流式细胞术。将1×106ml-1的脾细胞悬液铺至96孔细胞培养板中,每孔200 μl,置37℃、5%CO2培养箱中培养。待细胞长至单层后,每孔加入PMA与离子酶素(终浓度为10 mg/ml),12 h后加入BFA(3 μg/ml),培养5 h后收集4个复孔细胞。2 000 r/min×5 min弃上清,用PBS重悬细胞;2 000 r/min×5 min,弃上清,每管加入100 μl 4%多聚甲醛,室温避光孵育20 min;每管加入1 ml穿膜剂,混匀,2 000 r/min×5 min,弃上清。重复上述操作步骤1次。每管加入400 μl PBS,混匀后分装至100 μl/管。分别加入各10 μl的FITC anti-mouse TNF-α、PE anti-mouse IFN-γ、PE anti-mouse IL-12、PE anti-mouse IL-4、FITC anti-mouse IL-10,4℃孵育1 h后,用FACS buffer洗涤2次,2 000 r/min×5 min,剩余200 μl上清,经尼龙膜滤至流式细胞管,上流式细胞仪进行检检测。
1.2.6抗体效价的检测采用间接ELISA方法。分别于初次免疫、加强免疫和攻毒后的第14天,经小鼠眼眶无菌采血。37℃水浴30 min,4℃ 1 500 r/min×10 min,分离血清。采用间接ELISA方法测定血清中IgG抗体效价:将100 μl病毒液加入96孔ELISA板,4℃包被过夜;每孔加入150 μl BSA,37℃封闭2 h;每孔加入100 μl不同稀释度的待检血清,37℃作用1 h;每孔加入100 μl HRP标记的兔抗鼠酶标二抗(1∶5 000稀释),37℃作用1 h。上述各步骤之间均用PBST洗涤3次,每次5 min。二抗孵育后每孔加入50 μl底物,避光显色;当阳性对照孔显色时,每孔加入50 μl终止液,在酶标仪450nm波长处测定A值,A≥0.2判为阳性。
1.2.7脾肺指数的测定于攻毒后第14天,将小鼠断颈,无菌取出小鼠脾脏和肺脏,用滤纸吸干表面水分后称重,并计算:脾指数=(脾重/体重)×100%;肺指数=(肺重/体重)×100%。
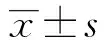
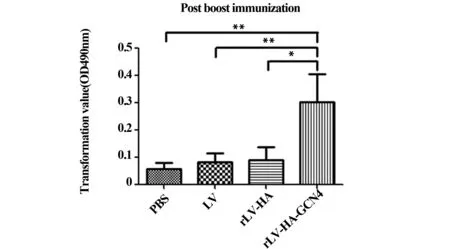
图1 淋巴细胞转化结果Fig.1 Result of lymphocyte transformationNote: *.P<0.05;**.P<0.01.
2结果
2.1细胞免疫水平
2.1.1淋巴细胞转化水平加强免疫后第14天,rLV-HA-GCN4组淋巴细胞转化率(TV)远大于其他组,TV=0.3±0.11,与其他3组比较,差异有统计学意义(P<0.05)。见图1。
2.1.2胞内细胞因子水平与对照组比较,初次免疫后第14天,rLV-HA-GCN4组各细胞因子含量均增加,其中IL-10、TNF-α分泌较多,分别达到26.13±2.51、18.67±1.17;加强免疫后第14天,各组细胞因子水平均有所下降,但重组慢病毒免疫组各细胞因子表达量均高于PBS组,以IFN-γ、TNF-α分泌较多。见图2。
2.1.3CD4+/CD8+T细胞亚群检测结果显示,初次免疫后第14天,与LV组和PBS组相比,rLV-HA-GCN4组与rLV-HA组两个亚群T细胞的百分含量均升高,且各组CD4+T细胞含量高于CD8+T细胞;与初次免疫相比,加强免疫后第14天,两个亚群T细胞的百分含量均有所增加,且以rLV-HA-GCN4组CD4+T细胞含量增加最为明显,为38.27±3.32,与PBS组相比,差异有统计学意义(P<0.01)。攻毒后第14天, rLV- HA- GCN4组

图2 胞内细胞因子水平Fig.2 Expression level of intracellular cytokinesNote: *.P<0.05;**.P<0.01;***.P<0.001.

图3 CD4+/CD8+ T细胞亚群分析Fig.3 Analysis of CD4+/CD8+ T cellsNote: *.P<0.05;**.P<0.01.
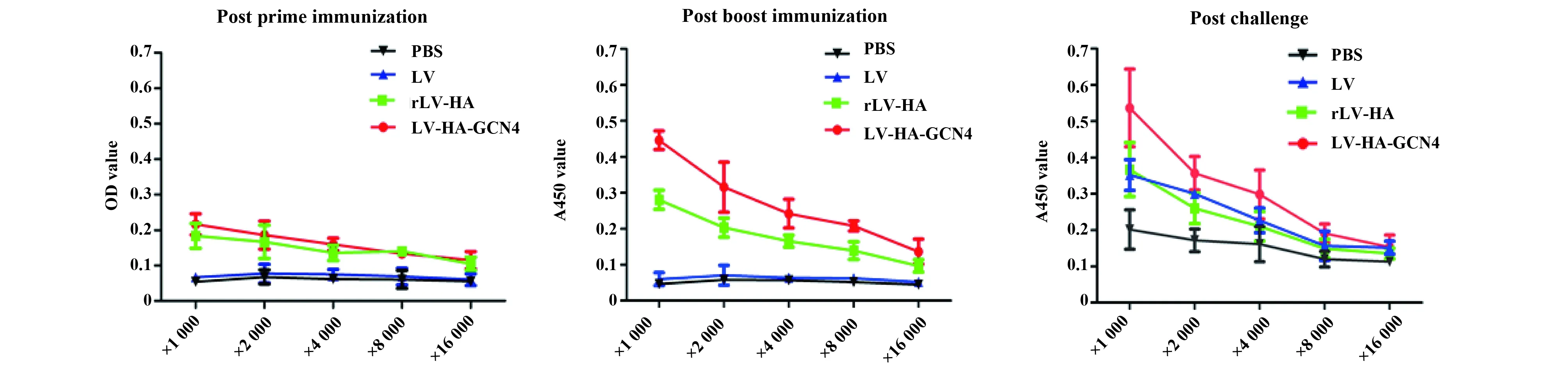
图4 IgG抗体滴度Fig.4 IgG titers
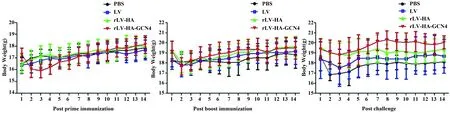
图5 免疫攻毒后小鼠体重变化Fig.5 Body weight change of mice after immunization and challenge

图6 攻毒后小鼠的脾肺指数Fig.6 Spleen and lung indexes in mice after challengeNote: *.P<0.05.
CD4+T细胞的百分含量下降,为33.93±4.8,而CD8+T细胞的百分含量增加至20.9±0.98,与PBS组相比,差异有统计学意义(P<0.05)。见图3。
2.2体液免疫水平ELISA检测结果显示,初次免疫后第14天,rLV-HA-GCN4组与rLV-HA组HA抗体效价约为1∶1 000;加强免疫后第14天,HA抗体效价明显升高,rLV-HA-GCN4组A=0.208时的稀释倍数为1∶8 000,rLV-HA组A=0.203时的稀释倍数为1∶2 000;攻毒后第14天,rLV-HA-GCN4组HA抗体效价略有降低,A=0.191时的稀释倍数为1∶8 000,1∶4 000 时A=0.235;rLV-HA组A=0.24时的稀释倍数为1∶2 000。见图4。
2.3免疫攻毒后小鼠的体重变化初次免疫后,rLV-HA-GCN4组小鼠体重变化较大,在免疫后第8天逐渐上升;加强免疫后,各组小鼠体重差异无统计学意义(P>0.05);攻毒后,rLV-HA-GCN4组小鼠体重在前3 d略有下降,随后显著上升,与LV组和PBS组相比,差异有统计学意义(P<0.05),表明rLV-HA-GCN4免疫后能有效保护小鼠抵御病毒的攻击。见图5。
2.4脾肺指数攻毒后第14天,LV-HA-GCN4组、rLV-HA组、LV组、PBS组小鼠脾指数分别为3.5±0.66、3.61±0.74、4.92±0.39、5.3±0.18。统计学分析显示,rLV-HA-GCN4组脾指数与PBS和LV组相比有统计学意义(P<0.05)。rLV-HA-GCN4组、rLV-HA组、LV组、PBS组肺指数分别为0.64±0.05、0.73±0.14、0.8±0.12、1.04±0.2,rLV-HA-GCN4组与PBS组相比,差异有统计学意义(P<0.05)。由此表明,免疫rLV-HA-GCN4对攻毒小鼠脾肺都具有保护作用。见图6。
3讨论
作为流感病毒表面的重要糖蛋白,HA不仅能结合细胞表面的唾液酸受体,而且是病毒最主要的保护性抗原。蛋白的功能取决于结构,所表达蛋白的结构越接近于天然构象,免疫原性越好。为了保持HA的天然三聚体结构,本研究组在前期工作中利用GS-linker将HA与GCN4偶联,形成HA-GCN4柔性链接,以此利于HA的自然折叠,并以慢病毒包装系统表达了HA-GCN4偶联蛋白,获得了主要以三聚体形式存在的HA[3]。本研究以细胞与体液免疫、脾肺指数、体重变化等指标评价了rLV-HA-GCN4的免疫原性及其免疫保护效果。
CD4+和CD8+T细胞是成熟T淋巴细胞的两个重要亚群。其中,CD4+T细胞通过产生细胞因子或细胞毒活性作用来清除病原,调节炎症反应,辅助CD8+T细胞活化。CD8+T细胞为细胞毒性细胞或抑制性细胞,能够发挥特异性的杀伤作用或抑制免疫反应。正常生理情况下,各亚群T淋巴细胞在数量和功能上保持稳定并相互协调,以维持机体的免疫稳态[4]。在本研究中,CD4+和CD8+分型结果显示,免疫或攻毒后,CD4+T细胞数量均明显多于CD8+T细胞。但是从免疫到攻毒,CD4+T细胞数量出现由低-高-低的走势,而CD8+T细胞数量表现为持续升高,表明免疫已经有效激活了T淋巴细胞,而当CD4+T细胞发挥抗病毒作用后,免疫系统可通过促进CD8+T细胞的活化、增殖来调节CD4+和CD8+T细胞的功能平衡,从而有利于免疫系统趋于稳态。
CD4+T细胞是不均一的细胞亚群,主要亚群是辅助性T细胞(helper T lymphocyte,Th)。根据CD4+Th细胞所分泌细胞因子的不同,可进一步将其分为若干亚群,其中Th1与Th2细胞是最早被认识的两个Th细胞亚型。Th1与Th2之间相互制约,通过遏制彼此的数量及功能而处于动态平衡,以保持机体正常的免疫功能。一旦发生平衡失调,即Th1/Th2漂移,就会导致免疫调节功能的紊乱。免疫功能的平衡主要由不同的T淋巴细胞亚群分泌的各种细胞因子进行调控。其中,Th1细胞以表达IFN-γ、TNF-α、IL-2、IL-12为主,Th2细胞主要分泌IL-4、IL-5、IL-6、IL-10、IL-13[5]。IFN-γ是主要的抗病毒因子,能激活CD8+T细胞、NK细胞及巨噬细胞,增强中性粒细胞的吞噬功能,促进炎性细胞因子(IL-1、IL-12等)的合成和分泌。IL-12是一种多功能中间物质,是介导Th0向Th1方向极化的最核心因子,可与IL-2共同诱导Th1细胞分泌更多的IFN-γ,是强化细胞免疫因子之一[6,7]。TNF-α是免疫与炎症反应中所分泌的具有抗病毒作用的细胞因子[8]。IL-4是Th2细胞分泌的特征性抗炎细胞因子,对B细胞、T细胞、巨噬细胞等都有免疫调节作用[9]。IL-10也是一种抗炎细胞因子,对恢复及维持体内的免疫平衡有重要作用。它能明显抑制Th1型细胞因子产生,并间接促进Th2细胞分化。此外,IL-10能够降低抗原的提呈,抑制巨噬细胞的活性,进而抑制促炎症因子和趋化因子的产生[10]。在本研究中,IFN-γ、TNF-α、IL-4、IL-10、IL-12五种细胞因子的检测结果显示,初次免疫后各组细胞因子含量高于加强免疫,这可能是由于初次免疫时机体首次受到抗原的刺激导致细胞因子在短期内大量释放,而处于免疫状态的机体受到同种抗原的再刺激时,不再表现出强烈的免疫反应。根据免疫后细胞因子的表达水平,本研究中收集的各免疫时间点的T淋巴细胞样本主要表达Th1型细胞因子。
体液免疫检测结果表明,rLV-HA-GCN4组小鼠在加强免疫后第14天,IgG抗体效价可达1∶8 000,攻毒后第14天约为1∶7 000;攻毒后,rLV-HA-GCN4组脾肺指数显著低于PBS组,小鼠体重在前3 d略有下降,随后逐渐上升。
4结论
由于酵母转录激活因子——GCN4能够促进与其偶联表达的蛋白分子保持天然的多聚体结构,从而有利于蛋白保留其生物学活性,因此利用慢病毒包装系统构建的rLV-HA-GCN4免疫小鼠后表现出了良好的免疫原性,能够有效诱导细胞与体液免疫应答,这比单纯表达HA的rLV-HA组效果要好。本研究对流感病毒免疫制剂的研制具有一定的借鉴意义。
参考文献:
[1]Watanabe T,Kawaoka Y.Pathogenesis of the 1918 Pandemic Influenza Virus[J].PLoS Pathogens,2011,7(1):e1001218.
[2]Leung GM,Nicoll A.Reflections on pandemic (H1N1) 2009 and the international response[J].PLoS Med,2010,7(10):e1000346.
[3]李鑫,宋战昀,朱利塞,等.表达猪H1N1亚型流感病毒三聚体HA的重组慢病毒包装[J].中国兽医学报,2012,32(12):1828-1845.
[4]Swain SL,McKinstry KK,Strutt TM.Expanding roles for CD4+T cells in immunity to viruses[J].Nat Rev Immunol,2012,12(2):136-148.
[5]Motomura Y,Kitamura H,Hijikata A,etal.The transcription factor E4BP4 regulates the production of IL-10 and IL-13 in CD4+T cells[J].Nat Immunol,2011,12(5):450-459.
[6]Nazari B,Amirzargar A,Nikbin B,etal.Comparison of the Th1,IFN-γ secreting cells and FoxP3 expression between patients with stable graft function and acute rejection post kidney transplantation[J].Iran J Allergy Asthma Immunol,2013,12(3):262-268.
[7]Méndez-Samperio P.Role of interleukin-12 family cytokines in the cellular response to mycobacterial disease[J].Int J Infect Dis,2010,14(5):e366-e371.
[8]Walsh KB,Teijaro JR,Rosen H,etal.Quelling the storm:utilization of sphingosine-1-phosphate receptor signaling to ameliorate influenza virus-induced cytokine storm[J].Immunol Res,2011,51(1):15-25.
[9]Luzina IG,Keegan AD,Heller NM,etal.Regulation of inflammation by interleukin-4:a review of "alternatives"[J].J Leukoc Biol,2012,92(4):753-764.
[10]Fujio K,Okamura T,Yamamoto K.The family of IL-10-secreting CD4+T cells[J].Adv Immunol,2010,105:99-130.
[收稿2016-01-13修回2016-01-27]
(编辑倪鹏)
doi:10.3969/j.issn.1000-484X.2016.07.011
作者简介:邓颖琦(1992年-),女,在读硕士,主要从事预防兽医方面研究,E-mail:dengyingqi92@126.com。
通讯作者及指导教师:丁壮(1960年-),男,教授,博士生导师,主要从事人兽共患病毒病诊断与防控研究。
中图分类号S855.3
文献标志码A
文章编号1000-484X(2016)07-0983-05
Study on immunogenicity of recombinant lentivirus expressing trimeric HA of swine H1N1 influenza virus
DENG Ying-Qi,LI Jun-Feng,QU Hui,TANG Yu-Bo,SUN Yi-Xue,LI Xin,WANG Wei-Li,DING Zhuang,CONG Yan-Long.
College of Veterinary Medicine,Jilin University,Changchun 130062,China
[Abstract]Objective:To evaluate the protective immunity by vaccination of BALB/c mice with rLV-HA-GCN4,a recombinant lentivirus expressing the trimeric HA of swine H1N1 influenza virus.Methods: The female mice were randomly divided into rLV-HA-GCN4,rLV-HA,LV and PBS groups.Mice were primed with plasmid and boosted with lentivirus by the administration of intramuscular thigh injections at an interval of two weeks.At day 28 post-prime immunization,mice were inoculated intranasally with 100TCID50of swine H1N1 influenza virus in a 50 μl volume.The immune levels were assessed by the T lymphocyte transformation test,flow cytometry,indirect ELISA and the indexes of spleen and lung.Results: The spleen lymphocyte transformation rate was 0.3±0.11 in the rLV-HA-GCN4 group at day 14 post-boost immunization,showing a statistical significance (P<0.01) compared to the PBS group.Meanwhile,rLV-HA-GCN4 could cause T lymphocyte response mainly based on the Th1-type CD4+ T cells.The IgG antibody titer reached to 1∶8 000 at day 14 post-boost immunization and approximately 1∶7 000 at day 14 post challenge.After challenge,the spleen and lung indexes of rLV-HA-GCN4 group were significantly lower than those of PBS group (P<0.05).The body weight of rLV-HA-GCN4 group demonstrated a slight decrease before 3 days post challenge and then a gradual increase compared to the LV and PBS groups (P<0.05).Conclusion: rLV-HA-GCN4 can effectively induce cellular and humoral immune response in BALB/c mice against swine H1N1 influenza virus.
[Key words]Swine influenza; H1N1 subtype; Trimeric HA; Lentiviral vector; Immunogenicity
①本文为国家质检总局科技计划项目(2014IK237)和吉林省科技厅重点科技攻关项目(20150204029NY)。
②共同第一作者。
③吉林农业大学校医院,长春130118。
④吉林省动植物检验检疫局,长春130062。
⑤吉林农业大学动物科学技术学院,长春130118。
⑥吉林省出入境检验检疫局,长春130000。
丛彦龙(1977年-),男,教授,硕士生导师,主要从事人兽共患病毒病诊断与防控研究。