微小RNA-146a上调cyclin D1表达诱导大鼠血管平滑肌细胞的增殖①
2016-08-09董少红李江华廖碧红庞新利罗林杰
熊 玮 骆 瑜 董少红 李江华 廖碧红 庞新利 罗林杰
(暨南大学第二临床医学院/深圳市人民医院心内科,深圳518020)
微小RNA-146a上调cyclin D1表达诱导大鼠血管平滑肌细胞的增殖①
熊玮骆瑜董少红李江华廖碧红庞新利罗林杰
(暨南大学第二临床医学院/深圳市人民医院心内科,深圳518020)
[摘要]目的:采用基因芯片技术研究小分子RNA-146a(miR-146a)促进血管平滑肌细胞增殖的作用靶点并进行验证。方法:原代培养大鼠血管平滑肌细胞,分成mimics组、inhibitor组、control组、sham组,分别体外转染miR-146a mimics(50 nmol/L)、miR-146a inhibitor(50 nmol/L)、miR-146a错义链(50 nmol/L)、PBS,Real time PCR测定转染后miR-146a水平,CCK8法检测转染后血管平滑肌细胞增殖情况。采用基因芯片检测inhibitor组和control组基因表达谱,通过生物信息学技术筛选出差异基因和调控的信号通路。对筛选出来的信号通路用Real time PCR和Western blot进行验证。结果:转染48 h后,inhibitor组血管平滑肌细胞的miR-146a水平明显低于control组和sham组(P<0.01),inhibitor组血管平滑肌细胞的OD值明显低于control组、sham组(P<0.05)。通过对基因表达谱分析发现,p53信号通路被miR-146a上调。用Real time PCR和Western blot进行检测发现,p53信号通路中关键分子p53、caspase3、PTEN的mRNA和蛋白水平无明显变化(P>0.05),而mimics组VSMC中cyclin D1的mRNA和蛋白水平增加(与sham相比,P<0.05),inhibitor组VSMC中cyclin D1的mRNA和蛋白水平下降(与sham相比,P<0.05)。 结论:miR-146a可能通过上调细胞周期蛋白cyclin D1的表达促进大鼠血管平滑肌细胞的增殖。
[关键词]血管平滑肌细胞;miR-146a;基因谱;P53;cyclin D1
小分子RNA-146a(microRNA-146a,miR-146a)是第一个被发现在免疫系统中具有调节作用的小RNA,主要与类风湿性关节炎、肿瘤、脓毒血症等疾病的发生相关[1]。近年来的研究发现,急性冠脉综合征患者外周血单个核细胞中miR-146a的水平显著升高,miR-146a能促进Th1细胞的分化,上调Th1细胞的功能,可能参与了对冠心病患者的免疫功能调节[2]。在颈动脉球囊损伤后颈动脉组织中miR-146a的表达水平显著上调,miR-146a可能参与了球囊损伤后再狭窄的病理[3]。最近的研究还发现,miR-146a参与了ApoE-/-小鼠动脉粥样硬化的发生[4]。这些研究都表明miR-146a与动脉粥样硬化、冠心病和再狭窄的发生具有相关性,但它在这些疾病中的具体作用并不清楚。
在前期研究中,我们发现在血管平滑肌细胞(Vascular smooth muscle cell,VSMC)增殖过程中,miR-146a水平显著上调,miR-146a可以促进VSMC的增殖和迁移,抑制其凋亡,但具体机制不清楚[5-7]。本文拟通过基因芯片技术和信息学分析,探寻miR-146a促进VSMC增殖的作用靶点和信号通路。
1材料与方法
1.1试剂与材料SPF级SD大鼠购自广东省实验动物中心,DMEM培养基、0.25%胰酶、FBS购自Gibco公司,Lipofectamine2000购自Invitrogen公司,RNeasy Mini Kit试剂盒购自Qiagen公司,All-in-one miRNA qRT-PCR detection kit购自genecopoeia公司,SYBR Premix Ex Taq试剂盒购自TaKaRa公司,CCK8试剂盒购自同仁化学研究所,大鼠alpha-actin抗体购自博士德公司,大鼠miR-146a mimics、抑制子及阴性对照由吉玛公司合成,miR-146a、p53、caspase3、PTEN、cyclin D1、U6引物由生工公司合成,p53、caspase3、PTEN、cyclin D1抗体购自Abcam公司。
1.2方法
1.2.1大鼠VSMC培养及miR-146a干扰按照本室建立的方法培养VSMC及进行miR-146a干扰[5-7]。实验分为4组,高表达组(mimics)、抑制组(inhibitor)、阴性对照组(control)及正常VSMC组(sham),其中miR-146a抑制子进行6-FAM荧光标记。分别转染miR-146a mimics(50 nmol/L)、miR-146a抑制子(50 nmol/L)、miR-146a错义链(50 nmol/L),sham组加入同等剂量PBS,5 h后换成完全培养基,荧光显微镜观察转染效率。
1.2.2荧光定量PCR转染48 h后按照试剂盒指南操作,提取RNA逆转录成cDNA,并进行PCR反应。引物序列为:miR-146a上游引物(5′-3′)TGAGAACTGAATTCCATGGGTT,miR-146a下游引物为通用引物,U6上游引物(5′-3′)CTCGCTTCGGCAGCACA,U6下游引物(5′-3′)ACGCTTCACGAATTTGCGT,miR-146a与U6相对表达量用公式2-ΔΔCT计算。
1.2.3VSMC增殖细胞处理后以每孔104个细胞接种至96孔板,每组设6个复孔,24 h后进行转染,5 h后换为100 μl完全培养基,培养48 h后加入10 μl WST试剂染色,在37℃、5%CO2培养2 h,在酶联免疫检测仪下测定450 nm(参考波长650 nm)的OD值。
1.2.4表达谱芯片检测实验分成miR-146a抑制组及对照组,每组3个样品,共6张芯片。具体检测方法为转染miR-146a inhibitor及control,48 h后吸出培养液,加入1~2 ml Trizol,-70℃保存送上海康成生物公司进行芯片检测:样品用Agilent ND1000检测RNA是否降解及RNA浓度,用Agilent Quick Amp Labeling对样品进行标记,Agilent Surehyb进行杂交,用Agilent DNA Microarray Scanner进行扫描,用Agilent Feature Extraction软件(v11.0.1.1)采集芯片信号,用Agilent GeneSpring GX 12.1对原始数据进行Quantile标准化和数据处理,两组样品间具有统计学意义的差异表达基因通过火山图筛选和Fold Change筛选,使用标准的富集计算方法进行GO分析和Pathway分析。
1.2.5实时PCR和Western 印迹分析将大鼠VSMC分成4组:sham、control、inhibitor及mimics,转染48 h提取RNA,逆转录成cDNA,按照试剂盒方法进行PCR反应,检测p53信号通路关键基因p53、caspase3、PTEN、cyclin D1的mRNA。
转染48 h后提取总蛋白质,每孔加入20 μl蛋白质溶液,在10%的SDS-PAGE中80 V、30 min及120 V、1 h进行电泳分离,半干转液38 mA、90 min转入PVDF膜,5%牛奶封闭2 h,加入兔抗大鼠p53一抗(1∶200)、caspase3一抗(1∶1 000)、PTEN一抗(1∶1 000)、cyclin D1一抗(1∶1 000)及GAPDH一抗(1∶1 000)4℃孵育过夜,1‰TBST洗10 min 3次,加入羊抗兔二抗(1∶6 000)孵育1 h,1‰TBST洗10 min 3次,加入ECL发光液100 μl在Image Quant RT ECL冷CCD成像系统进行显影,用Imagequant TL软件进行半定量分析。
2结果
2.1miR-146a促进VSMC增殖转染miR-146a 抑制子 5 h用荧光显微镜观察,在VSMC胞浆内可见大量颗粒状荧光,表明miR-146a inhibitor已进入VSMC内(见图1)。用实时PCR检测3组细胞之间的miR-146a水平,与sham组和对照组相比,抑制子组的miR-146a mRNA相对表达水平显著下降,差异具有显著性(P<0.01),sham组和control组相比miR-146a水平无明显差异(P>0.05),表明RNA干扰成功(见图2A)。采用CCK8检测干扰48 h时VSMC的增殖情况,sham组和control组OD值无明显差异(P>0.05),inhibitor组的OD值明显下降(P<0.05),表明miR-146a inhibitor抑制了VSMC的增殖(见图2B)。

图1 荧光显微镜检测血管平滑肌细胞内miR-146a抑制剂转染效率Fig.1 miR-146a inhibitors labeled by 6-FAM fluorescence in VSMCs were detected by fluorescence microscope
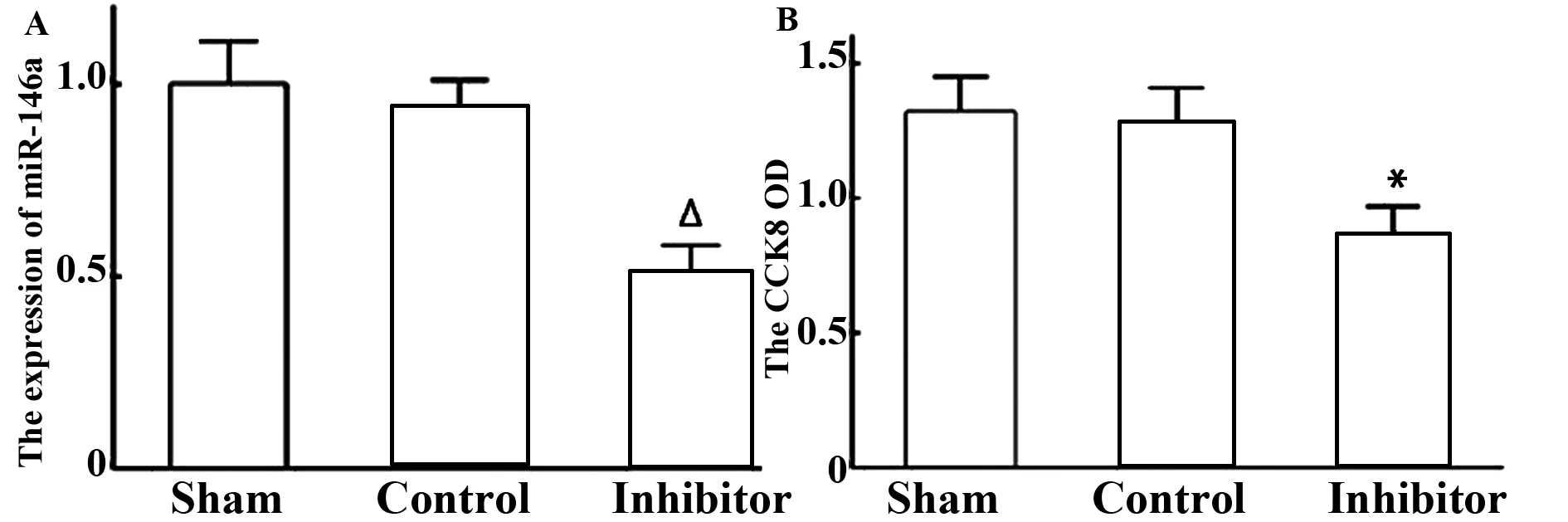
图2 miR-146a促进血管平滑肌细胞增殖Fig.2 miR-146a promoted proliferation of VSMCsNote: A.Relative expression of miR-146a(Real time PCR);B.VSMCs proliferation(CCK8).Contrast with Sham,Δ.P<0.01,*.P<0.05.
2.2p53信号通路是miR-146a的作用靶点用实时 PCR检测inhibitor和control组之间的miR-146a相对水平,inhibitor组显著低于control组(P<0.01)(见图3)。在总共16 802个基因中,8 547个基因表达上调,占50.8%,8 255个基因表达下降,占49.2%.以变化倍数>2.0为截断点,有806个基因上调,其中7个基因变化倍数>10.0(见表1);在下调基因中有1 026个基因变化倍数>2.0,有9个基因变化倍数>10.0(见表2)。KEGG通路分析显示P53信号通路被miR-146a上调。
2.3miR-146a上调cyclin D1表达Real time PCR结果显示,各组VSMC之间p53、caspase3、PTEN的mRNA水平无明显改变(P>0.05),而mimics组VSMC中的cyclin D1 mRNA上调(sham vs mimics,P<0.001),inhibitor组cyclin D1 mRNA水平下降(sham vs inhibitor,P<0.01),sham与control组VSMC的cyclin D1相比无明显差异(P>0.05)(见图4A)。
Western印迹结果显示,各组VSMC的p53、 caspase3、 PTEN蛋白的水平无明显变化, 而 mimics
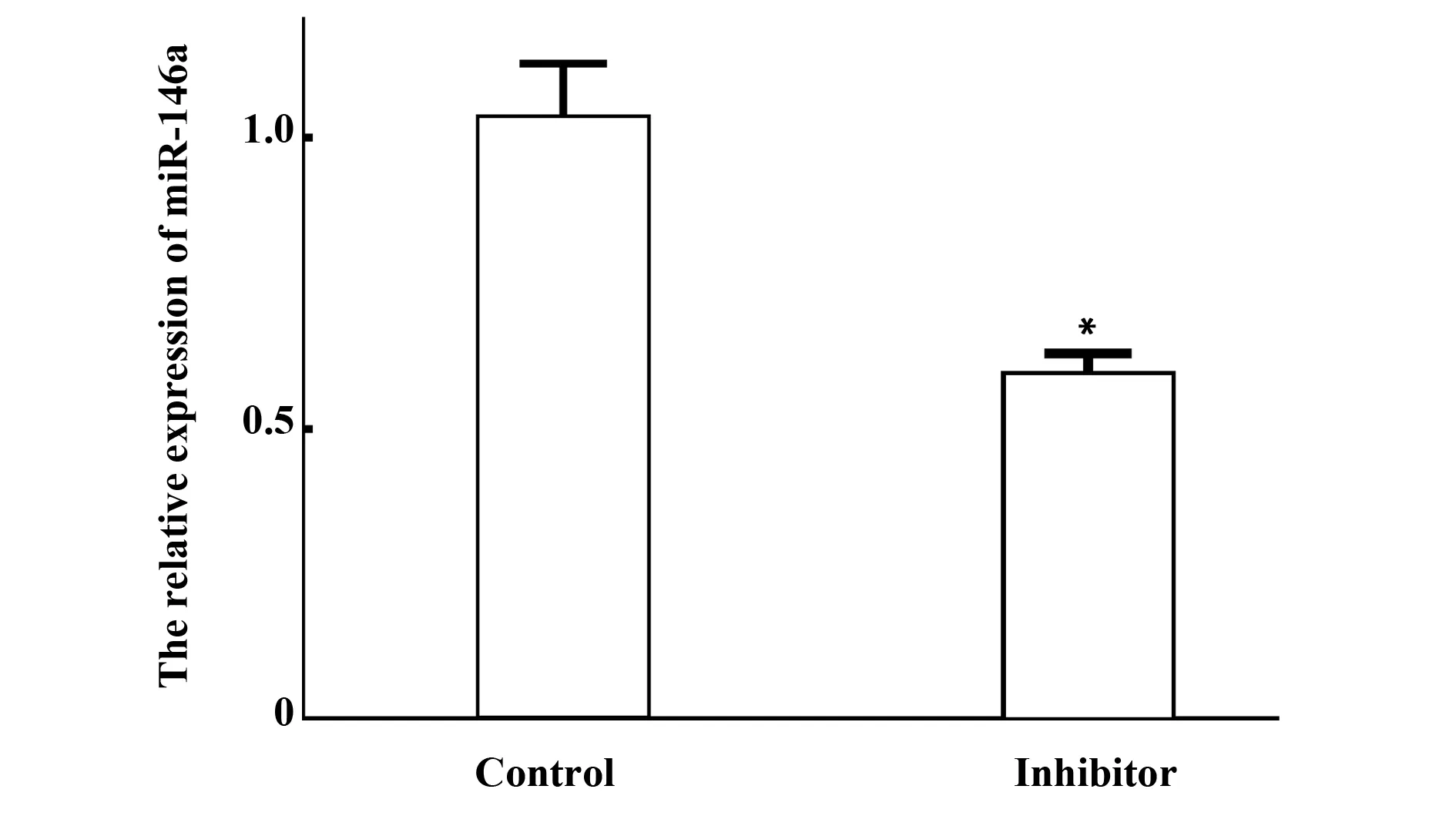
图3 荧光定量PCR检测miR-146a mRNA的相对水平Fig.3 Relative expression of miR-146a explored by real time PCRNote: Contrast with Control,*.P<0.01.
表1miR-146a上调且Fold change>10.0的基因
Tab.1Genes raised by miR-146a(Fold change>10.0)

GenesymbolGenbankaccessionFoldchangeP-valueFDRRegulationDdx60XM_00625306023.46518610.0006277180.007357081upNkx6-1NM_03173714.70960570.0191168130.051872179upBrinp3NM_17312113.07642470.0001254620.00347545upPlcd1NM_01703512.49469320.0004579920.006324951upPtpn5NM_01925312.36949960.0085046740.030104898upParp9NM_00110335111.18903980.0023357910.013887582upPrkg2NM_01301210.8583110.0014909770.010976278upDdx58NM_0011066459.17563010.0002059920.004289575up
表2miR-146a下调且Fold change>10.0的基因
Tab.2Genes decreased by miR-146a(Fold change>10.0)

GenesymbolGenbankaccessionFoldchangeP-valueFDRRegulationTbc1d31NM_00113484216.96458930.0013576080.010500376downCrabp1NM_00110571615.35712270.0006196420.007298685downSlfn3NM_05368713.31673960.0058545420.023927947downDchs1NM_00110754412.06812520.0002816760.004978058downLOC102555503XR_36076311.85774220.0314077960.073162969downSpdyaNM_13885511.52859130.0002543630.004785786downDlgap5NM_00113580210.63689990.0007633780.008067516downCse1lNM_00110860710.33489480.0008177590.008380534downTmem108XM_00622654310.2315780.0001090740.003233177down
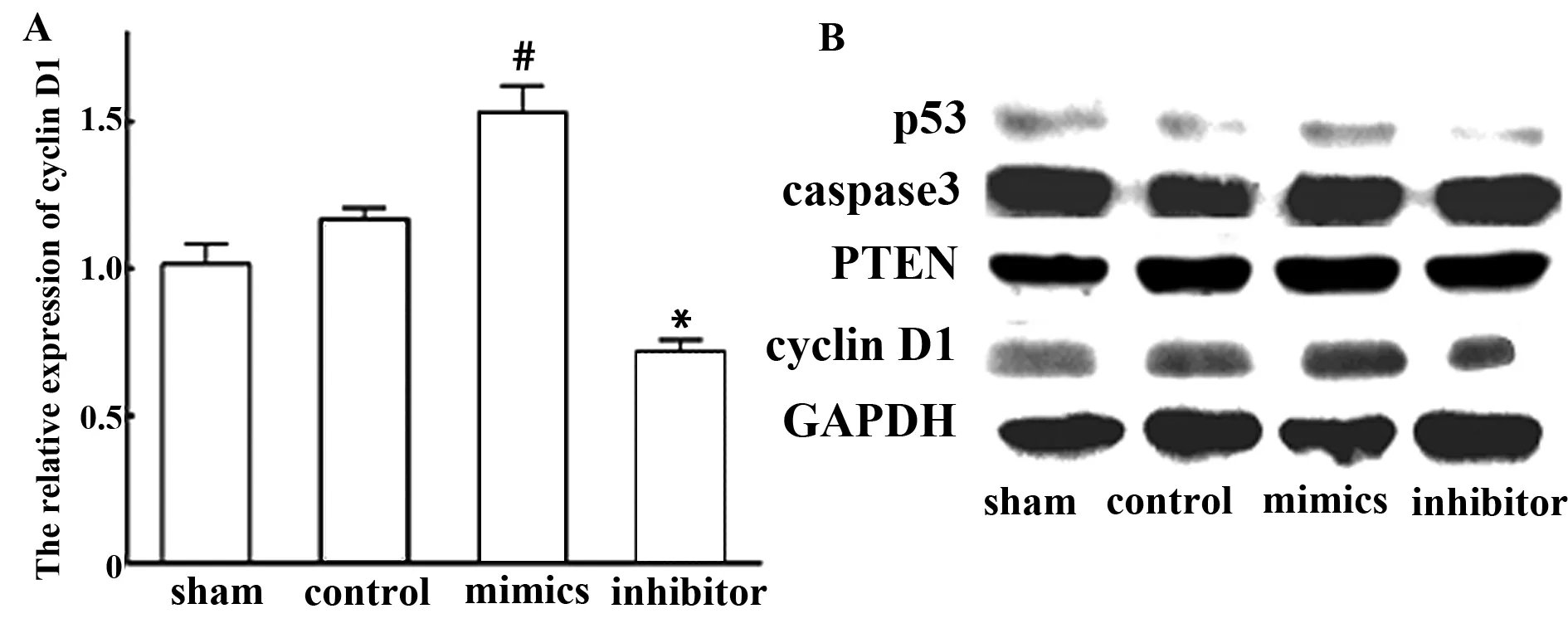
图4 miR-146a上调cyclin D1的表达水平Fig.4 miR-146a up-regulated the expression of cyclin D1Note: A.Relative expression of cyclin D1(Real time PCR),contrast with Sham,#.P<0.001,*.P<0.01;B.Protein expression of p53,caspase3,PTEN,cyclin D1(Western blot).
组VSMC中的cyclin D1表达上调(sham vs mimics,P<0.05),inhibitor组cyclin D1表达下降(sham vs inhibitor,P<0.05),sham与control组VSMC的cyclin D1相比无明显差异(P>0.05)(见图4B)。
3讨论
小分子RNA作为一个广泛分布的重要的基因调节子,在机体的正常生长、发育、分化、信号转导、疾病和死亡等生理和病理过程均发挥重要作用。近年来的研究表明,miRNA不仅可以作为疾病的生物学诊断标志用于疾病的诊断,还可以作为基因药物用于疾病的治疗[8,9]。
miR-146a被认为是调节免疫功能的主要miRNA之一[10]。研究发现,用脂多糖刺激单核细胞,可以诱导miR-146a表达增加,用肿瘤坏死因子-α(Tumor necrosis factor,TNF-α)和白细胞介素-1β(Interleukin-1,IL-1β)也能够通过核因子(Nuclear factor-κB,NF-κB)依赖的途径促进miR-146a的表达。miR-146a通过下调TNF受体相关因子6和白介素1受体相关激酶1的水平,负调控炎症和免疫反应,避免过度炎症反应的发生[11,12]。在类风湿性关节炎、肿瘤、脓毒血症等疾病的研究中也证实了miR-146a在疾病发生发展中的重要作用,可以作为某些疾病的生物学标志[13-15]。Guo等[2]发现急性冠脉综合征患者外周血单个核细胞中miR-146a的水平显著升高,并能上调Th1细胞的功能,给予miR-146a可以促进Th1细胞的分化和NF-κBp65的合成,表明miRNA-146a可能与冠心病患者的免疫功能调节有关。也有学者发现,在球囊损伤再狭窄的动物模型中miR-146a的表达水平显著上调[3],可能参与了动脉粥样硬化和球囊损伤后再狭窄的发生发展过程。载脂蛋白E(ApoE)是调节脂质代谢的重要蛋白,对动脉粥样硬化发挥负调控作用。最近的研究发现,在单核细胞和巨噬细胞中ApoE通过促进miR-146a表达,抑制NF-κB,抑制炎症和动脉粥样硬化的发生[4]。在急性ST抬高型心肌梗死的患者中循环miR-146a有助于预测心室重构的发生[16]。这些研究表明miR-146a与动脉粥样硬化、冠心病、再狭窄等疾病存在密切关联,但研究结果存在不一致。如Guo等[2]发现miR-146a促进Th1细胞合成NF-κB,而在巨噬细胞和单核细胞中miR-146a抑制NF-κB表达[4]。
我们在前期研究中发现,在血管平滑肌细胞增殖过程中miR-146a水平显著上调;用RNA干扰的方法抑制VSMC中miR-146a表达后,VSMC增殖和迁移明显减少,凋亡增加,但具体机制不清楚[5-7]。双荧光素酶报告基因检测是研究miRNA的目的基因的经典方法,但该方法对信号通路的研究缺乏系统性。在本文中,我们采用了基因表达谱芯片来筛选miR-146a发生作用所依赖的靶点和信号通路,检测结果和生物信息学分析显示p53信号通路被miR-146a inhibitor激活。进一步研究发现,p53信号通路中的关键分子cyclin D1的基因和蛋白水平均被miR-146a上调。
细胞周期蛋白(cyclin)和细胞周期蛋白依赖性激酶(CKD)的复合物(cyclin/CDKs)在细胞从G1期向S期转化的过程中发挥重要调控作用,其中最关键的调控蛋白为cyclin D1/CDK4[17]。多个研究都发现cyclin D1活化与血管平滑肌细胞的增殖和血管内膜的重构密切相关,是介导血管平滑肌细胞增殖的重要作用靶点[18-20]。在本文中,我们发现miR-146a可能是通过上调cyclin D1的表达促进了血管平滑肌细胞的增殖。
参考文献:
[1]Chan EK,Ceribelli A,Satoh M.MicroRNA-146a in autoimmunity and innate immune responses[J].Ann Rheum Dis,2013,72(Suppl 2):ii90-ii95.
[2]Guo M,Mao XB,Ji QW,etal.MiR-146a in PBMCs modulates Th1 function in patients with acute coronary syndrome[J].Immunol Cell Biol,2010,88(5):555-564.
[3]Ji R,Cheng Y,Yue J,etal.MicroRNA expression signature and antisense-mediated depletion reveal an essential role of microRNA in vascular neointimal lesion formation[J].Circ Res,2007,100(11):1579-1588.
[4]Li K,Ching D,Luk FS,etal.Apolipoprotein E enhances microRNA-146a in monocytes and macrophages to suppress nuclear factor-κB-driven inflammation and atherosclerosis[J].Circ Res, 2015,117(1):e1-e11.
[5]熊玮,董少红,袁建辉,等.MiRNA-146a通过NF-κB依赖的途径促进血管平滑肌细胞增殖[J].南方医科大学学报,2012,32 (2):270-273.
[6]熊玮,董少红,袁建辉,等.微小RNA-146a影响血管平滑肌细胞增殖和凋亡的机制[J].中国组织工程研究,2012,16 (20):3715-3719.
[7]Dong S,Xiong W,Yuan J,etal.MiRNA-146a regulates the maturation and differentiation of vascular smooth muscle cells by targeting NF-κB expression[J].Mol Med Rep,2013,8(2):407-412.
[8]Creemers EE,Tijsen AJ,Pinto YM.Circulating microRNAs:novel biomarkers and extracellular communicators in cardiovascular disease?[J].Circ Res,2012,110(3):483-495.
[9]van Rooij E,Olson EN.MicroRNA therapeutics for cardiovascular disease:opportunities and obstacles[J].Nat Rev Drug Discov,2012,11(11):860-872.
[10]Li L,Chen XP,Li YJ.MicroRNA-146a and human disease[J].Scand J Immunol,2010,71(4):227-231.
[11]Bhaumik D,Scott GK,Schokrpur S,etal.Expression of microRNA-146 suppresses NF-kappaB activity with reduction of metastatic potential in breast cancer cells[J].Oncogene,2008,27(42):5643-5647.
[12]Taganov KD,Boldin MP,Chang KJ,etal.NF-κB dependent induction of microRNA miR-146a,an inhibitor targeted to signaling proteins of innate immune responses[J].Proc Natl Acad Sci USA,2006,103 (33):12481-12486.
[13]Kaleb MP,Minoru S,Annie LC,etal.Upregulated miR-146a expression in peripheral blood mononuclear cells from rheumatoid arthritis patients[J].Arthritis Res Ther,2008,10(4):R101.
[14]Pacifico F,Crescenzi E,Mellone S,etal.Nuclear factor-kappaB contributes to anaplastic thyroid carcinomas through up-regulation of miR-146a[J].J Clin Endocrinol Metab,2010,95(3):1421-1430.
[15]Wang JF,Yu ML,Yu G,etal.Serum miR-146a and miR-223 as potential new biomarkers for sepsis[J].Biochem Biophys Res Commun,2010,394(1):184-188.
[16]Liu X,Dong Y,Chen S,etal.Circulating MicroRNA-146a and microRNA-21 predict left ventricular remodeling after ST-elevation myocardial infarction[J].Cardiology,2015,132(4):233-241.
[17]Pestell RG.New roles of cyclin D1[J].Am J Pathol,2013,183(1):3-9.
[18]Martin-Garrido A,Williams HC,Lee M,etal.Transforming growth factor β inhibits platelet derived growth factor-induced vascular smooth muscle cell proliferation via Akt-independent,Smad-mediated cyclin D1 downregulation[J].PLoS One,2013,8(11):e79657.
[19]Kim MH,Ham O,Lee SY,etal.MicroRNA-365 inhibits the proliferation of vascular smooth muscle cells by targeting cyclin D1[J].J Cell Biochem,2014,115(10):1752-1761.
[20]Wang K,Wen L,Peng W,etal.Vinpocetine attenuates neointimal hyperplasia in diabetic rat carotid arteries after balloon injury[J].PLoS One,2014,9(5):e96894.
[收稿2015-10-15修回2016-01-13]
(编辑许四平)
doi:10.3969/j.issn.1000-484X.2016.07.009
作者简介:熊玮(1975年-),男,博士,副主任医师,主要从事冠心病的基础研究,E-mail:xw0926@126.com。
中图分类号R544.1
文献标志码A
文章编号1000-484X(2016)07-0974-05
MicroRNA-146a promotes proliferation of rat vascular smooth muscle cells by up-regulating cyclin D1 expression
XIONG Wei,LUO Yu,DONG Shao-Hong,LI Jiang-Hua,LIAO Bi-Hong,PANG Xin-Li,LUO Lin-Jie.
Department of Cardiology,the Second Clinical Medical College of Ji′nan University,Shenzhen People′s Hospital,Shenzhen 518020,China
[Abstract]Objective:To detect and verifica the gene profile difference of microRNA-146a (miR-146a) and its role in the proliferation of vascular smooth muscle cells (VSMCs) by gene chip technology.Methods: Artificially synthesized miR-146a mimics(50 nmol/L),miR-146 inhibitor(50 nmol/L),scramble(50 nmol/L) and PBS were transfected into cultured primary rat VSMCs in vitro.After transfection,Real time PCR was used to measure the levels of miR-146a and the cell counting kit 8(CCK8) was employed to investigate the proliferation of VSMCs.The VSMCs interfered by miR-146a inhibitor or miR-146a control were examined by gene chips and the profile of gene were analyzed by bioinformatics technology to detect the different genes and signal transduction pathway.The changes in mRNAs and proteins were accessed separately by Real time PCR and Western blot.Results: Compared with sham and control VSMCs,miR-146a expression level was significantly decreased in treatment with miR-146a inhibitor(P<0.01),as well as optical density(OD) was also shown remarkably down regulated simultaneously(P<0.05).The investigation of gene profile revealed that the p53 signal pathway was up-regulated in VSMCs interfered by miR-146a.The mRNA and protein expression levels of p53,caspase3 and PTEN in p53 signal transduction pathway didn′t show significant differences(P>0.05),however,the mRNA and protein expression levels of cyclin D1 significantly increased in treatment with miR-146a mimics VSMCs group and decreased in miR-146a inhibitor VSMCs group(compared with sham VSMCs group,both P<0.05).Conclusion: Our data indicated that miR-146a may promote the proliferation of rat VSMCs by up-regulating cyclin D1 expression.
[Key words]Vascular smooth muscle cell;miRNA-146a;Gene profile; p53;cyclin D1
①本文为深圳市卫计委资助课题(No.201505001)。