PI-IBS小鼠肠黏膜γδT 细胞表型和功能变化的实验研究①
2016-08-09周旭春孙晓宁黄白丽邓桃枝何周桃韩向阳DemingSun
周旭春 孙晓宁 杨 波 黄白丽 邓桃枝 何周桃 韩向阳 Deming Sun 蓝 程
(海南省人民医院消化内科,海口570311)
PI-IBS小鼠肠黏膜γδT 细胞表型和功能变化的实验研究①
周旭春②孙晓宁杨波②黄白丽邓桃枝何周桃韩向阳Deming Sun③蓝程
(海南省人民医院消化内科,海口570311)
[摘要]目的:探讨PI-IBS小鼠γδT 细胞的表型和功能及其在PI-IBS发病中的作用。方法:旋毛虫感染小鼠,观察肠道炎症、腹壁撤退反射(内脏高敏感性)和结肠传输时间(肠道动力)。分别在感染后第2周和第8周处死动物,取末端回肠和近端结肠组织,免疫荧光组化,激光扫描共聚焦显微镜观察肠黏膜γδT 细胞的分布和数量变化。收集PI-IBS小鼠肠道淋巴结和脾脏的淋巴细胞,单克隆抗体免疫磁珠分选法分离和纯化 γδT 细胞,3HTdR法检测其增殖情况,FACS检测其表面分子CD69、CD62L,ELISA检测细胞培养上清液中IFN-γ及IL-17的表达。结果:感染后第2周,PI-IBS小鼠肠道炎症明显,肠黏膜γδT细胞数量明显增加,明显增殖和活化,产生IL-17明显增加(P<0.01)。感染后第8周,PI-IBS小鼠肠道炎症基本消退,动物的腹壁撤退反射和结肠传输试验明显异常。肠黏膜γδT细胞数量仍然明显高于对照组小鼠,仍然有明显增殖、活化和产生IL-17(P<0.01)。结论:肠道γδT细胞增殖、活化及分泌IL-17可能参与PI-IBS的发病。
[关键词]感染后肠易激综合征;γδT细胞;炎症;表型;功能
感染后肠易激综合征(Post-infectious irritable bowel syndrome,PI-IBS)的发病可能与感染和炎症诱导的肠道免疫紊乱有关,但其具体机制并不完全清楚[1-3]。γδT细胞是一类表型和功能独特的T淋巴细胞亚群,占全身T细胞总数的0.5%~5%。作为连接天然免疫和固有免疫的桥梁,γδT细胞决定机体特异性免疫应答的类型,对维持黏膜免疫稳态具有重要作用[4,5]。目前关于γδT细胞在PI-IBS中的作用报道不多,本研究拟探讨PI-IBS时γδT细胞的表型和功能变化,为深入研究PI-IBS的免疫学发病机制提供实验依据。
1材料与方法
1.1实验材料无病原环境出生的雌性C57BL/6(B6)小鼠(4~6周龄,体重13~15 g)购自中科院昆明动物所。旋毛虫购自兰州兽医研究所。重组小鼠 IL-2、IL-23购自美国R&D公司。旋毛虫ES抗原购自美国Sigma公司。所有抗体均来自美国BD Bioscience公司。抗小鼠TCR-δ单克隆抗体(GL3)由美国科罗拉多大学免疫系Willi Born博士惠赠。DU530分光光度计为美国Beckman公司产品,流式细胞仪(FACS)为美国BD Bioscience公司产品,磁性细胞分选仪(MACS)为德国Miltenyi Biotec公司产品。共聚焦激光扫描荧光显微镜为日本Nikon公司产品。小鼠细胞因子ELISA试剂盒为美国R&D公司产品。
1.2方法
1.2.1PI-IBS小鼠模型的建立
1.2.1.1旋毛虫感染采用旋毛虫感染法[6,7]制作PI-IBS小鼠模型。旋毛虫包囊感染60 d的Sprague-Dawley大鼠以胃蛋白酶人工消化法分离肌幼虫,悬于2%琼脂中。每只小鼠饲服0.2 ml含300个幼虫的琼脂。造模成功的标准:感染后第8周,小鼠肠道组织无明显炎症,但腹壁撤退反射(Abdominal withdrawal reflex,AWR)评分明显高于对照组,结肠传输功能实验(Colon transportation test,CTT)明显异常,表现为首次排便时间缩短,粪便Bristol评分增加。
1.2.1.2组织病理在旋毛虫感染后的第2周和第8周处死部分动物,取末端回肠组织,4%多聚甲醛固定,常规石蜡包埋切片,HE染色,显微镜下观察各段肠黏膜组织炎症情况。
1.2.1.3内脏高敏感性采用AWR评分观测小鼠内脏高敏感性。动物实验前24 h禁食不禁水,2%戊巴比妥钠腹腔注射麻醉,带气囊的导尿管经肛门插入,以容量0.35/0.5 ml×15 min扩张3次,每次间隔30 s。AWR评分标准为0、1、2、3、4分:结直肠扩张刺激时情绪基本稳定0分;刺激时不稳定,偶尔扭动头部1分;腹背部肌肉轻微收缩但腹部未抬离地面2分;腹背部肌肉较强烈收缩并把腹部抬离地面3分;腹部肌肉强烈收缩,腹部呈弓形并把腹部﹑会阴部抬离地面4分[8]。
1.2.1.4肠道动力采用CTT检测小鼠肠道动力改变。活性炭悬液推进试验:每只小鼠予0.4 ml活性炭悬液灌胃后开始记录首次排黑便时间,连续采集8 h,记录每只小鼠的粪便总粒数、总湿重并进行Bristol评分[9,10]。
1.2.2肠道黏膜γδT细胞观察第2周及第8周处死部分动物,取末端回肠组织,肠组织超薄冰冻切片,免疫荧光组化染色(直接法),抗体为异硫氰酸荧光素(FITC)标记的大鼠抗小鼠γδTCR抗体(GL3克隆)。激光扫描共聚焦显微镜观察肠黏膜γδT 细胞的分布和数量变化。
1.2.3总T细胞的制备和γδT细胞的分离纯化采用笔者先前报道的方法[11]。取小鼠脾脏和肠系膜淋巴结研磨后,过尼龙毛柱,去除混杂的B细胞,Ficoll不连续梯度离心获得总T细胞群,完全培养基及IL-2、IL-23继续培养72 h。总T细胞用FITC-抗δTCR单克隆抗体染色(每1×108细胞加100 μl抗体,4℃孵育30 min),加带有微小磁珠的抗FITC单克隆抗体孵育(每1×108细胞加100 μl抗体,4℃孵育30 min),MACS分选收集阳性细胞。
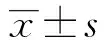
1.2.5γδT 细胞表面活化分子鉴定γδT 细胞分别加入IL-23和TLR-4配体10 pg/ml,37℃ 5%CO2孵育1 h,再以PE交联的抗CD62L及抗CD69抗体单染,每1×108细胞加100 μl抗体,4℃孵育30 min,流式细胞仪分析。
1.2.6细胞因子表达γδT 细胞培养上清液中的IL-17和IFN-γ浓度用相应的小鼠IL-17、IFN-γ ELISA试剂盒测定,按说明书操作。
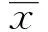
2结果
2.1成功建立PI-IBS模型
2.1.1肠道病理肠组织HE染色病理切片显示,见图1。与对照组相比,PI-IBS小鼠的末段结肠从第2周起出现明显的炎症,表现为大量炎症细胞浸润和间质充血水肿,炎症于第8周时基本消退(放大倍数×200)。
2.1.2内脏高敏感性感染后第8周时PI-IBS小鼠结肠充气扩张的AWR评分显示(图2),在扩张气量为0.35~0.5 ml时,PI-IBS小鼠的AWR评分明显高于对照组(P< 0.01)。
2.1.3肠道动力改变与对照组相比,感染后第8周时PI-IBS小鼠的结肠传输时间(首次排便时间)明显缩短,粪便Bristol评分则明显增加(P< 0.01),见表1。
2.2肠道黏膜γδT 细胞数量及分布末段回肠和结肠黏膜γδT细胞主要位于上皮内淋巴细胞中。与对照组比较,PI+IBS组第2周时γδT细胞明显增加,第8周时γδT细胞数量有所下降,但仍明显高于对照组(图3)。阴性对照组在免疫荧光染色时只加生理盐水而未加FITC标记的大鼠抗小鼠γδTCR抗体。
2.3γδT 细胞分离纯化经过两步法分离纯化的γδT细胞纯度可达99%以上。
2.4γδT 细胞活性
2.4.1γδT 细胞分泌细胞因子在IL-23和TLR4的刺激下,活化的PI-IBS小鼠肠道γδT 细胞主要分泌IL-17而不是IFN-γ(P<0.01)。第2周和第8周均明显高于对照组,第2周和第8周无明显差异(图5)。
2.4.2γδT 细胞活化感染后第2周分离纯化得到的PI-IBS小鼠肠道γδT细胞在IL-2+IL-23的刺激下,CD62L的表达明显降低而CD69的表达明显升高,而感染后第8周肠道γδT细胞仍然存在明显的活化,第2周和第8周无明显差异(图6)。
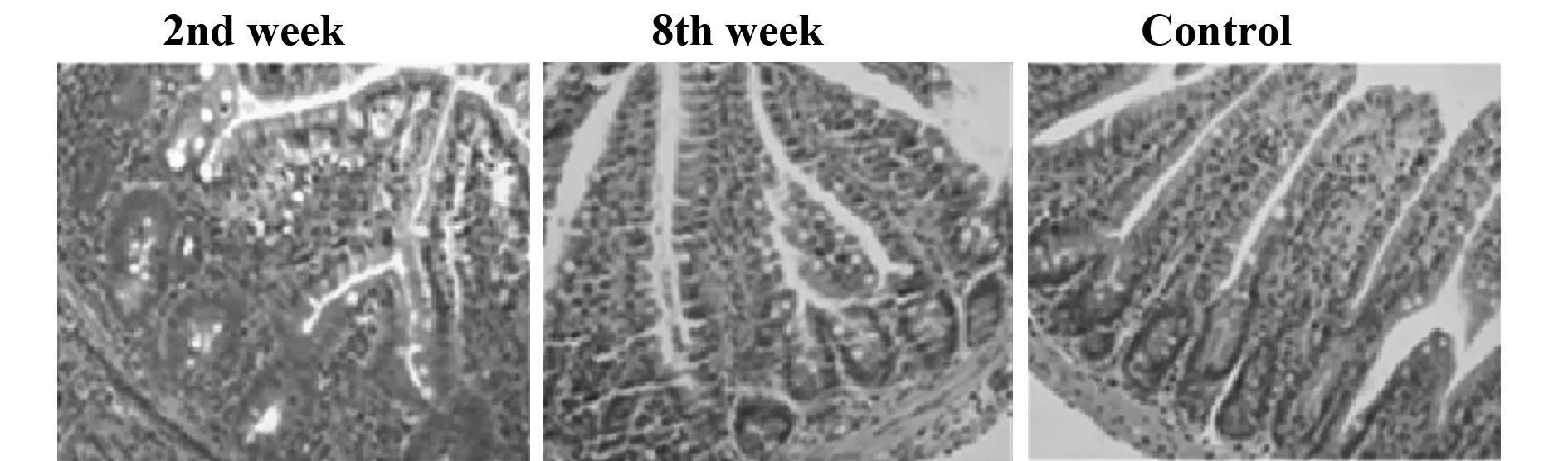
图1 PI-IBS小鼠肠道组织病理变化Fig.1 Pathological changes of intestine in PI-IBS mouseNote: In PI-IBS mouse,significant neutrophil granulocytes infiltration and interstitial edema were observed in the terminal ileum from 2nd week,abated from 8th week.
表1PI-IBS小鼠肠道动力变化
Tab.1Changes of intestine mobility in PI-IBS mouse
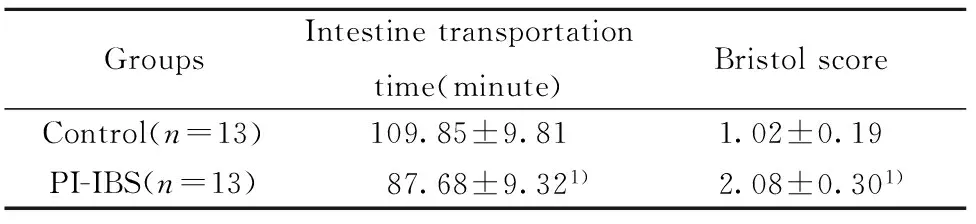
GroupsIntestinetransportationtime(minute)BristolscoreControl(n=13)109.85±9.811.02±0.19PI-IBS(n=13)87.68±9.321)2.08±0.301)
Note:Compared with the control group,1)P<0.01.
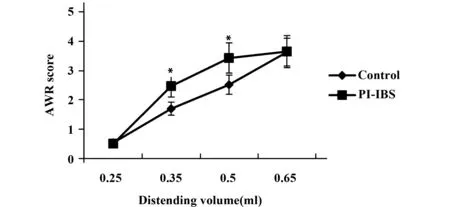
图2 PI-IBs小鼠内脏高敏感性变化Fig.2 Changes of visceral hypersensitivity in PI-IBs mouseNote: Compared with the control group,*.P<0.01.
2.4.3γδT 细胞增殖反应感染后第2周PI-IBS小鼠的肠道γδT细胞体外增殖反应的cpm值明显高于对照组,P< 0.01。感染后第8周,PI-IBS小鼠的肠道γδT细胞体外增殖反应仍明显高于对照组,第2周和第8周无明显差异。
图4 PI-IBS小鼠γδT细胞分离纯化结果Fig.4 Isolation and purification of γδT cell′s from PI-IBS mouseNote: The γδT cell′s purity was upto more than 99%.

图5 PI-IBS小鼠γδT细胞分泌细胞因子变化Fig.5 Production of cytokines by γδT cells from PI-IBS mouseNote: Compared with the control group,*.P<0.01;compared with the PI-IBS1 group,**.P>0.05.
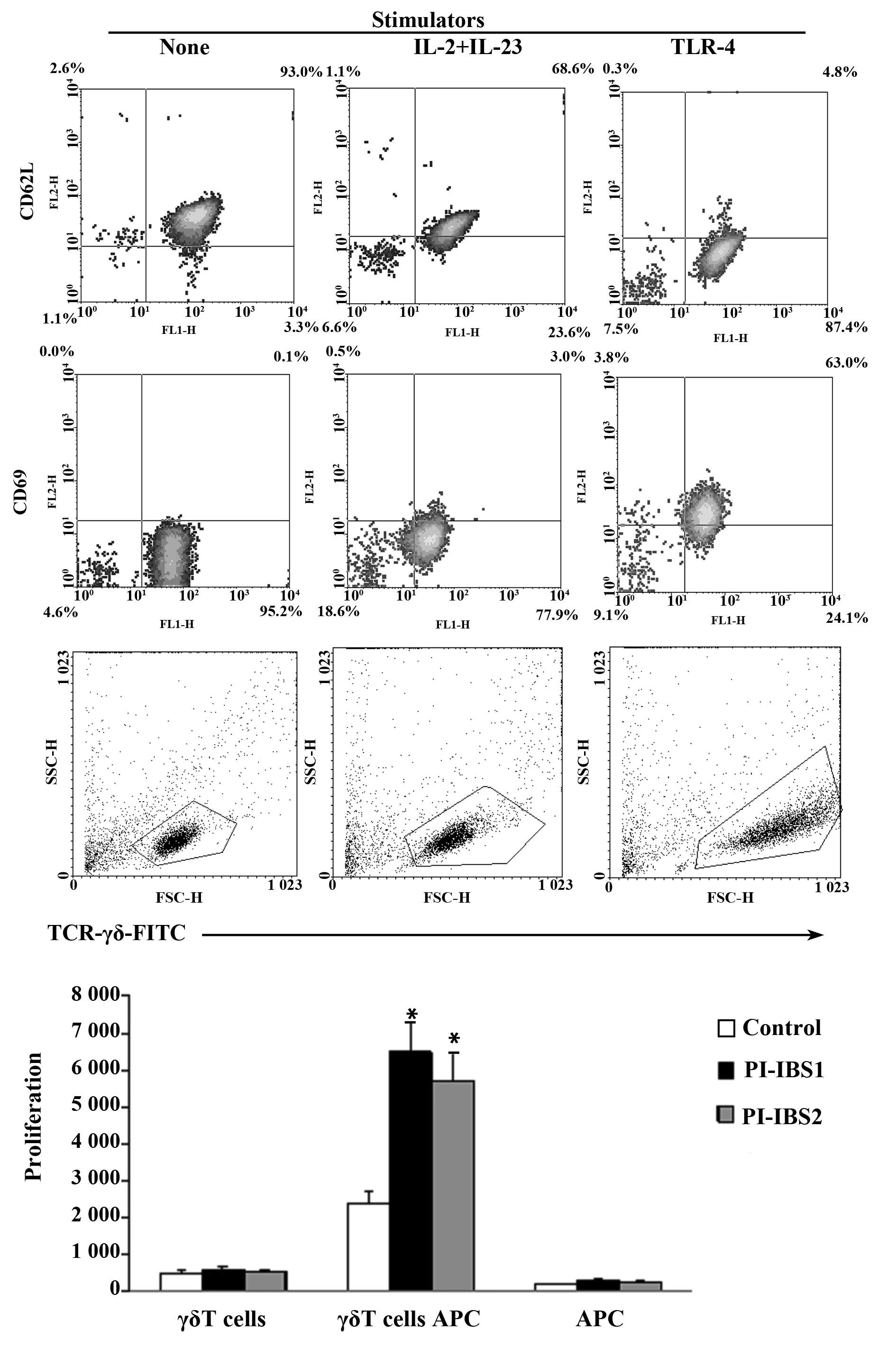
图6 PI-IBS小鼠γδT细胞增殖反应Fig.6 Proliferation of γδT cells from PI-IBS mouseNote: Compared with the control group,*.P<0.01.
3讨论
IBS是由胃肠动力异常、内脏敏感性增高、局部炎症免疫反应、心理社会因素等多种因素共同作用的结果。感染后肠道低度炎症和持续免疫激活机制可能是IBS的重要发病机制。γδT细胞在肠道可占全部T细胞的50%,提示其在肠道炎症和免疫的生理、病理过程中具有重要作用。关于γδT细胞在IBS中的作用的实验研究报道较少。Remes-Troche等[12]报道腹泻型IBS患者十二指肠黏膜上皮间γδT细胞数量不像乳糜泻和小肠细菌过生长患者那样明显增加,但未对其功能作进一步研究,这可能与γδT细胞分离纯化和培养困难有关。
旋毛虫抗原按照其来源部位的不同,即根据旋毛虫解剖部位,将其分为表面抗原(SA)、排泄分泌抗原(ES抗原)和虫体可溶性抗原(BSA)。目前研究较多的主要有虫体可溶性抗原和排泄分泌抗原。由于旋毛虫肌幼虫较成虫和新生幼虫容易获得,所以研究最多的是肌幼虫抗原。旋毛虫感染过程中肌幼虫ES抗原直接暴露于宿主的免疫系统,是诱导宿主产生免疫反应的主要靶抗原[13,14]。因此,在体外实验中,我们使用旋毛虫ES抗原来刺激γδT细胞的增殖。
未经旋毛虫感染的小鼠的肠系膜淋巴结和脾脏中的γδT细胞数量较少,其原因可能是γδT细胞需要炎症免疫刺激以增殖活化。旋毛虫感染后第2周,小鼠肠黏膜γδT细胞数量明显增加,同时肠道出现明显炎症。旋毛虫感染后第8周,小鼠肠道炎症基本消退,此时肠粘膜γδT细胞数量虽较第2周时有所减少,但仍明显高于未感染小鼠。PI-IBS时肠道γδT细胞数量增加这一现象是PI-IBS时肠道免疫紊乱的原因或结果还不清楚,可能二者互为因果,共同促进IBS的发生发展。
另一方面,细胞数量的增加并不一定意味着其功能的变化。笔者以前的研究建立了小鼠γδT细胞分离纯化和培养方法[15],通过分离和纯化,我们获得了纯度达到99%以上的γδT细胞,这有助于在体外进一步研究其功能。体外实验显示,PI-IBS小鼠的γδT细胞增殖能力明显增强,这可以解释其肠黏膜局部γδT细胞数量的增加。分离纯化的γδT细胞在IL-23、TLR配体的刺激下,CD62L下调而CD69上调,提示明显活化。细胞因子分泌实验显示,活化的γδT细胞产生IL-17的能力明显提高。IL-17是γδT细胞合成和分泌的主要细胞因子,在炎症和免疫反应中起重要的调控作用[16,17]。从时间关系上看,PI-IBS小鼠感染旋毛虫后第2周和第8周时,γδT细胞均处于功能活跃状态。这提示在感染初期,γδT细胞的表型和功能变化可能是促进炎症进展的因素,而在炎症消退期,其表型和功能变化可能并非肠道炎症的直接结果而是维持低度炎症以至内脏高敏感性和肠道动力异常的因素。
然而,关于γδT细胞在各种炎症和免疫性疾病中的作用仍存在争议,很可能γδT细胞在不同病理状态下扮演着不同的角色,或者同时扮演着双面角色,这体现了免疫调控网络的复杂性[18-21]。其次,γδT细胞是通过什么具体途径和机制在PI-IBS发生发展中起作用还不得而知,这些都有待进一步研究。
参考文献:
[1]Bokic T,Storr M,Schicho R.Potential causes and present pharmacotherapy of irritable bowel syndrome:an overview[J].Pharmacology,2015,96:76-85.
[2]Chey WD,Kurlander J,Eswaran S.Irritable bowel syndrome:a clinical review[J].JAMA ,2015,313:949-958.
[3]Sperber AD,Drossman DA,Quigley EM.The global perspective on irritable bowel syndrome:a Rome Foundation-World Gastroente-rology Organisation symposium[J].Am J Gastroenterol,2012,107:1602-1609.
[4]Born WK,Reardon CL,O′Brien RL.The function of gammadelta T cells in innate immunity[J] .Curr Opin Immunol,2006, 18:31-38.
[5]Odyniec A,Szczepanik M,Mycko MP,etal.Gammadelta T cells enhance the expression of experimental autoimmune encephalomyelitis by promoting antigen presentation and IL-12 production[J].J Immunol,2004, 173:682-694.
[6]Bercik P,Wang L,Verdu EF,etal.Visceral hyperalgesia and intestinal dysmotility in a mouse model of postinfective gut dysfunction[J].Gastroenterology,2004,127:179-187.
[7]Yang B,Zhou X,Lan C.Changes of cytokine levels in a mouse model of post-infectious irritable bowel syndrome[J].BMC Gastroenterol,2015,15:43.
[8]Yang CQ,Wei YY,Leng YX,etal.Vesicular glutamate transporter-3 contributes to visceral hyperalgesia induced by Trichinella spiralis infection in rats[J].Dig Dis Sci,2012,57:865-872.
[9]Caroff DA,Edelstein PH,Hamilton K,etal.The Bristol stool scale and its relationship to Clostridium difficile infection[J].J Clin Microbiol,2014,52:3437-3439.
[10]Pokkunuri V,Pimentel M,Morales W,etal.Role of cytolethal distending toxin in altered stool form and bowel phenotypes in a rat model of post-infectious irritable bowel syndrome[J].J Neurogastroenterol Motil,2012,18:434-442.
[11]蓝程,董丽伟,孙晓宁,等.小鼠γδT细胞抗原呈递功能的实验研究[J].中国免疫学杂志,2009,25(6):500-553.
[12]Remes-Troche JM,Adames K,Castillo-Rodal AI,etal.Intraepithelial gammadelta+ lymphocytes:a comparative study between celiac disease,small intestinal bacterial overgrowth,and irritable bowel syndrome[J].J Clin Gastroenterol,2007,41:671-676.
[13]Sofronic-Milosavljevic L,Ilic N,Pinelli E,etal.Secretory products of trichinella spiralis muscle larvae and immunomodulation:implication for autoimmune diseases,allergies,and malignancies[J].J Immunol Res,2015,2015:523875.
[14]Ilic N,Gruden-Movsesijan A,Sofronic-Milosavljevic L.Trichinella spiralis:shaping the immune response[J].Immunol Res,2012,52:111-119.
[15]Cheng L,Cui Y,Shao H,etal.Mouse gammadelta T cells are capable of expressing MHC class II molecules,and of functioning as antigen-presenting cells[J].J Neuroimmunol,2008,203:3-112.
[16]Shabgah AG,Fattahi E,Shahneh FZ.Interleukin-17 in human inflammatory diseases[J].Postepy Dermatol Alergol,2014,31:256-261.
[17]Isailovic N,Daigo K,Mantovani A,etal.Interleukin-17 and innate immunity in infections and chronic inflammation[J].J Autoimmun,2015,60:1-11
[18]Odyniec A,Szczepanik M,Mycko MP,etal.Gamma delta T cells enhance the expression of experimental autoimmune encephalomyelitis by promoting antigen presentation and IL- 12 production[J].J Immunol,2004,173:682- 694.
[19]Holoshitz J.Activation of gammadelta T cells by mycobacterial antigens in rheumatoid arthritis[J].Microbes Infect,1999,1:197-202.
[20]Kühl AA,Pawlowski NN,Grollich K,etal.Aggravation of intestinal inflammation by depletion/deficiency of gammadelta T cells in different types of IBD animal models[J].J Leukoc Biol,2007,81:168-175.
[21]Chun-Shiang Chung,Lara Watkins,Antonio Funches,etal.Deficiency of gammadelta T lymphocytes contributes to mortality and immunosuppression in sepsis[J].Am J Physiol Regul Integr Comp Physiol,2006,291:R1338-R1343.
[收稿2015-10-05修回2015-10-22]
(编辑倪鹏)
doi:10.3969/j.issn.1000-484X.2016.07.005
作者简介:周旭春(1967年-),女,博士,副教授,副主任医师,主要从事胰腺和胃肠免疫性疾病研究。
通讯作者及指导教师:蓝程(1971年-),男,博士,科副主任,教授,主任医师,主要从事胃肠道黏膜免疫方面研究。
中图分类号R392.12
文献标志码A
文章编号1000-484X(2016)07-0957-05
Study on phenotype and function of intestinal gamma delta T lymphocytes in mice with post-infectious irritable bowel syndrome
ZHOU Xu-Chun,SUN Xiao-Ning,YANG Bo,HUANG Bai-Li,DENG Tao-Zhi,HE Zhou-Tao,HAN Xiang-Yang,Deming Sun,LAN Cheng.
Department of Gastroenterology,Hainan Provincial General Hospital,Haikou 570311,China
[Abstract]Objective:To investigate the phenotype and function of the intestinal γδT lymphocytes in post-infectious irritable bowel syndrome mouse model.Methods: The mouse model for post-infectious irritable bowel syndrome was established by the infection with trichinella spiralis.The intestinal inflammation,abdominal withdrawal reflex(AWR) and colon transportation test were observed.2 and 8 weeks later,the animals were sacrificed and the lymphocytes in the intestinal lymph nodes and spleen were collected,from which the γδT lymphocytes were isolated and purified by monoclonal antibody-immuno-microbeads method.The functions of the purified γδT lymphocytes were evaluated,including proliferation by3HTdR;CD69,CD62L molecule staining by flow cytometry.Furthermore,the concentration of cytokine IL-17 and IFN-γ in the supernatant of the cultured γδT lymphocytes were detected by ELISA.Results: At 2nd weeks after infection,significant intestinal inflammation was observed,with increasing γδT lymphocytes,proliferating and activating with increasing production of IL-17.At 8th weeks after infection,the intestinal inflammation disappeared,whereas the number of γδT lymphocytes remained increasing,also with proliferating and activating with increasing production of IL-17.Meanwhile,the mice show higher AWR score and Bristol score.Conclusion: γδT lymphocytes could participate in the pathogenesis of PI-IBS via their proliferation,activation and production of IL-17.
[Key words]Post-infectious irritable bowel syndrome;γδT cells;Inflammation;Phenotype;Function
①本文为国家自然科学基金(No.81160057)和海南省国际科技合作专项基金(No.KJHZ2013-14)。
②重庆医科大学附属第一医院消化内科,重庆400016。
③Doheny Eye Institute,University of California,Los Angeles,CA90033,USA。