低剂量纳曲酮对小鼠巨噬细胞的免疫调节作用及机理研究①
2016-08-09郭胜男王晓楠单风平
郭胜男 李 岩 王晓楠 单风平
(中国医科大学免疫教研室,沈阳110001)
低剂量纳曲酮对小鼠巨噬细胞的免疫调节作用及机理研究①
郭胜男李岩王晓楠单风平
(中国医科大学免疫教研室,沈阳110001)
[摘要]目的:探讨纳曲酮(Naltrexone,NTX)对小鼠腹膜巨噬细胞表型,分泌细胞因子及吞噬功能的影响。 方法:本实验利用新型四唑化合物比色法测得NTX对RAW264.7细胞作用的最佳剂量;再将培养的腹膜巨噬细胞分为3组,RPMI1640空白对照组、脂多糖(LPS)阳性对照组和NTX处理组,采用流式细胞术检测CD206、CD64的阳性表达率及对葡聚糖的吞噬能力;ELISA法检测白介素10(IL-10)、白介素6(IL-6)、白介素1β(IL-1β)、肿瘤坏死因子-α(TNF-α)的分泌表达。结果:10-11mol/L剂量可显著促进RAW264.7细胞的增殖;NTX(10-11mol/L)处理可明显提高腹膜巨噬细胞表面CD64的阳性表达,减少CD206的表达;提高对葡聚糖的吞噬能力;TNF-α、IL-6、IL-1β的表达显著增加,IL-10的表达无明显差异。结论:低剂量纳曲酮可改变巨噬细胞表型及功能,起免疫调节作用。
[关键词]纳曲酮;巨噬细胞;表型;细胞因子;吞噬能力
纳曲酮(Naltrexone,NTX)是一种有效的非选择性阿片受体拮抗剂,特定剂量下能明显阻断μ、κ、δ阿片受体,其在结构和功能上都与阿片类拮抗剂纳洛酮相似[1]。NTX在临床中主要被用于戒断阿片等毒品所致的成瘾[2],低剂量纳曲酮(Low dose of naltrexone,LDN)指的每日剂量大约是阿片类药物成瘾剂量的1/10,现纳曲酮的每日剂量常为4.5 mg[3]。现有研究表明,LDN具有显著的抗炎和免疫调节作用[4]。课题组的研究已表明LDN可以促进树突细胞的成熟,提高其抗原递呈能力[5]。目前就LDN对巨噬细胞的免疫调节作用尚未见报道。本文通过LDN作用于小鼠腹腔巨噬细胞,以观察对巨噬细胞表型及功能的影响。
1材料与方法
1.1材料
1.1.1细胞与动物小鼠巨噬细胞系 RAW264.7购自中科院上海细胞库,所用培养基为含10%FBS的DMEM,于37℃、5%CO2孵箱中传代培养;雌雄各一半的BALB/c小鼠,重量19~23 g,周龄6~8周,购自中国医科大学实验动物中心。
1.1.2药物与试剂纳曲酮(C20H23NO4·HCl,分子量为377.86,由嘉事瑞康医药有限公司惠赠);MTS细胞增殖试剂盒购自Sigma公司;F4/80、CD206、CD64抗体购自Biolegend公司;IL-12、IL-10、IL-6、IL-1β、TNF-α ELISA试剂盒购自eBioscience公司。
1.2方法
1.2.1小鼠腹腔巨噬细胞的分离与培养实验前3 d,将10%可溶性淀粉肉汤注射到小鼠腹腔,剂量为1 ml/只,3 d后处死,在75%乙醇溶液中浸泡10~15 min后向小鼠腹腔注射含1%胎牛血清的PBS5 ml,轻揉腹部15~20 min,在腹壁剪一小口,将灌洗液吸出,1 000 r/min离心10 min。弃上清,PBS洗涤2次,含10%胎牛血清的RPMI1640培养基悬浮细胞,计数活细胞数并调整细胞浓度至1×106ml-1。将细胞分别接种于6孔板和96孔板中,置于CO2培养箱中培养,4 h后换液,去除未贴壁的细胞,贴壁细胞即巨噬细胞。
1.2.2以MTS细胞增殖试剂盒测定RAW264.7细胞增殖率,确定LDN的最佳作用浓度用消化液消化RAW264.7细胞,收集细胞悬浮液,经1 000 r/min,3 min离心后以10%FBS的DMEM培养基悬浮细胞,然后以细胞密度5×104/孔注入96孔板中,设实验组(即终浓度分别为10-3、10-4、10-5、10-6、10-7、10-8、10-9、10-10、10-11、10-12、10-13、10-14、10-15mol/L的NTX)、对照组(DMEM组),37℃培养24 h。于4 h前加入试剂液,继续培养,4 h后在酶标仪上测定490nm处吸光度。根据公式计算RAW264.7在药物刺激下的增殖作用。巨噬细胞增殖作用(%)=[(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)-1]×100%。
1.2.3药物处理以上述方法测得的LDN最佳剂量,加入分离后培养的小鼠腹腔巨噬细胞中,用RPMI1640培养作空白对照组,10 ng/ml的LPS刺激培养作为阳性对照,继续培养24 h。
1.2.4免疫荧光标记和流式细胞仪检测巨噬细胞经药物作用24 h后,用胰酶消化为细胞悬液,用FACS(含2%FCS的PBS)洗1次,1 500 r/min离心5 min,调整细胞浓度1×107个/ml,每管加入100 μl,细胞悬液,加入FITC标记的F4/80、Percp-Cy5.5标记的CD64、PE标记的CD206单克隆抗体。4℃避光温育30 min,用FACS缓冲液洗3遍,然后用300 μl FACS缓冲液重悬细胞置于流式细胞仪(FACScan B.D.)检测。
1.2.5吞噬作用检测巨噬细胞经24 h刺激后,消化收集细胞,加入FITC-dextran抗体,37℃避光温育1 h,用FACS缓冲液洗3遍,然后用300 μl FACS缓冲液重悬细胞置于流式细胞仪(FACScan BD)检测。
1.2.6细胞因子检测巨噬细胞经药物作用24 h后收集上清,应用双抗体夹心法酶联免疫吸附试验(ELISA)检测细胞培养上清中的IL-10、IL-6、IL-1β、TNF-α含量,试验按照试剂盒说明书中的步骤操作,制作标准曲线来确定所测细胞因子的浓度。
1.3统计学方法数据均采用GraphPad Prism 5软件进行处理分析,两组间比较采用t检验,多组间两两比较采用Scheffe法,P<0.05为差异有显著性。
2结果
2.1LDN最佳作用浓度的确定RAW264.7细胞经不同浓度的NTX处理后,继续培养24 h,MTS比色法检测其细胞生长情况,发现不同剂量对细胞增殖的影响有显著差异(P<0.05),10-3mol/L的NTX可抑制细胞的增殖,而10-4mol/L剂量以下浓度的NTX可促进细胞的增殖,根据公式计算细胞增殖率,发现在10-11mol/L剂量时细胞的增殖作用最强,见图1。
2.2LDN对CD206、CD64表达的影响小鼠腹腔巨噬细胞经药物刺激培养24 h后,流式细胞仪检测膜分子CD206、CD64的表达情况。与RPMI1640组相比较,LPS组和LDN组巨噬细胞表达CD64+CD206+降低,CD64+CD206-增多(P<0.05),见图2。
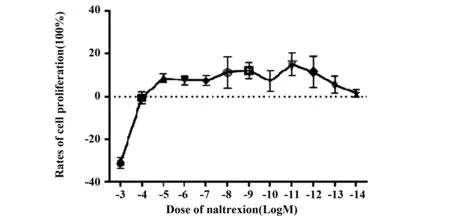
图1 纳曲酮对细胞增殖作用的影响(n=3,%)Fig.1 Effects of naltrexone on cell proliferation(n=3,%)

图2 巨噬细胞膜表面分子CD206和CD64的表达(n=3)Fig.2 Expression of CD206 and CD64 on macrophages (n=3)Note: A.Blank control;B.LPS treated group;C.NTX treated group.Compared with RPMI1640 group,*.P<0.01.
表1细胞因子的表达情况(n=3)
Tab.1Expression of cytokines on different groups(n=3)

GroupsTNF-α(pg/ml)IL-6(pg/ml)IL-1β(pg/ml)IL-10(pg/ml)Blankcontrol15.59±5.4394.697±4.53012.08±9.063191.1±228.6NTX70.08±6.59727.56±15.23125.40±35.21203.6±77.82LPS31.92±9.187190.6±12.9974.28±5.7051768±787.1
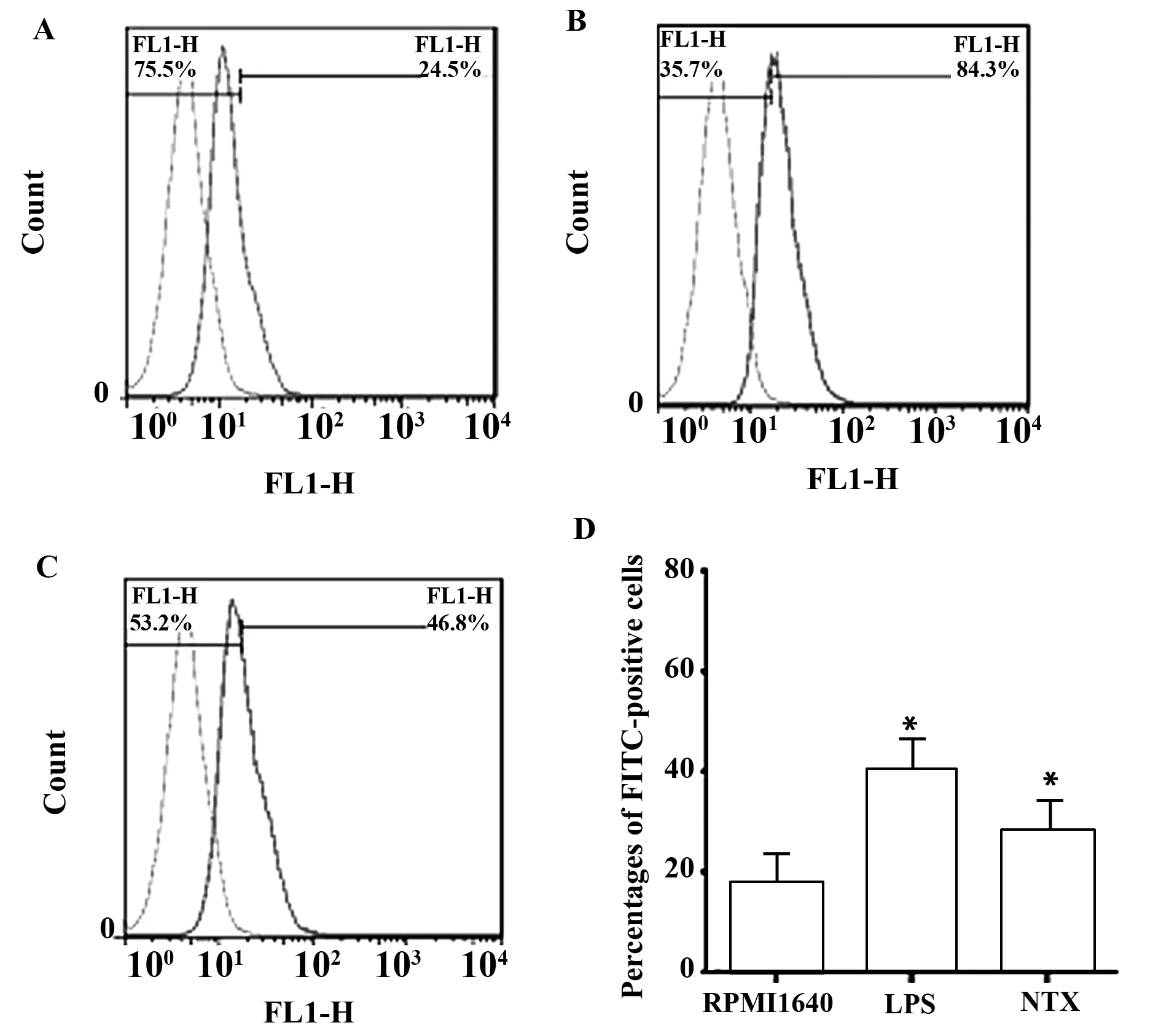
图3 不同处理组巨噬细胞吞噬能力的改变(n=3)Fig.3 Phagocytosis of macrophages on different groups(n=3)Note: A.Blank control;B.LPS treated group;C.NTX treated group.Compared with RPMI1640 group,*.P<0.05.
2.3LDN促进巨噬细胞对葡聚糖的吞噬能力巨噬细胞经药物刺激培养24h后,再加入FITC-dextran后37℃避光温育1 h,在流式细胞仪上检测阳性细胞的百分比,以此代表Mφ吞噬FITC-dextran的量,反映Mφ的吞噬能力。与空白对照组(即RPMI1640组)相比较,经10-11mol/L的NTX处理后巨噬细胞吞噬能力明显提高(P<0.05)。见图3。
2.4LDN对巨噬细胞Mδ分泌IL-6、IL-10、IL-1β、TNF-α的影响ELISA结果显示,与空白对照(即RPMI1640组)比较,LPS处理组分泌的TNF-α、IL-6、IL-1β、IL-10表达明显提高;10-11mol/L的NTX处理组分泌的TNF-α、IL-6、IL-1β表达也显著提高(P<0.01),分泌IL-10水平无统计学差异;与LPS处理组比较,10-11mol/L的NTX处理组能分泌高水平的TNF-α和IL-1β(P<0.01),详情见表1、图4。
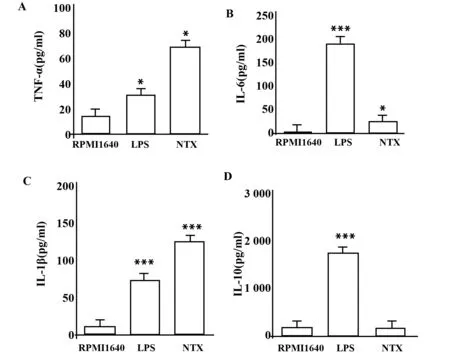
图4 细胞因子的表达情况(n=3)Fig.4 Expression of cytokines on different groups(n=3)Note: A.TNF-α;B.IL-6;C.IL-1β;D.IL-10.Compared with RPMI1640 group,*.P<0.05,**.P<0.01.
3讨论
巨噬细胞作为重要的固有免疫细胞,是机体抗感染的第一道防线,在维持机体内环境的稳定和免疫防御中扮演非常重要的角色。巨噬细胞是一类具有可塑性、异质性的细胞群体,在不同微环境条件下,可被诱导激活,发生极化现象。M1型巨噬细胞和M2型巨噬细胞是国际上多数学者所认可的一种分类方法,两型巨噬细胞表现出各自的功能及区分标志。M1型可由LPS、IFN-γ诱导产生,高表达iNOS、TNF-α、IL-6、IL-1β,表现出较强的促炎和抗肿瘤作用;M2型可由IL-4诱导产生,高表达TGF-β、Arg-1等,可增强巨噬细胞的吞噬活性和清理能力,同时促进组织修复[6]。
研究表明,不同极化状态的小胶质细胞在动物模型实验性多发性硬化症、自身免疫性脑脊髓膜炎、肌萎缩侧索硬化症及阿尔茨海默病的发病各个阶段存在明显差异[7]。巨噬细胞的极化与动脉粥样硬化形成的机制相关[8]。另外,肿瘤相关巨噬细胞(Tumor-associated macrophage,TAM)是肿瘤进展和肿瘤免疫抑制的重要参与者,大量动物实验和临床试验均证实了M2型TAM对肿瘤的生长、浸润和转移起着重要作用,而M1型则具有抑制肿瘤生长的作用[9,10]。巨噬细胞的极化可参与多种疾病的演化过程,进一步探索M1和M2型巨噬细胞间的关系,逆转M2型向M1型极化,为肿瘤治疗和其他免疫相关疾病提供了一个新的可能。
近年来,LDN作为一种新型抗炎制剂,其免疫活性的研究越来越多。已有研究表明其可通过小胶质细胞对中枢神经系统起作用,能减轻纤维肌痛症,克罗恩氏病,多发性硬化症等疾病症状[11-13]。Donahue研究发现LDN联合抗肿瘤药物在体外可显著抑制卵巢癌细胞SKOV-3的生长,体内则有效抑制小鼠肿瘤发生进程[14]。Abdel等[15,16]研究发现LDN可以增强AIDS病人对HIV感染的免疫应答。关于LDN调节机体免疫功能的具体机制尚在探索中,众多研究者普遍认为低剂量纳曲酮的免疫调节作用是与机体内源性阿片物质的免疫调节机制相关联的。Brown[17]认为LDN诱导产生一个小的、瞬态的阿片样物质封锁,从而促进人体上调内源性阿片类物质和阿片受体,这种反弹效应引起了免疫机能的改变。本文就LDN可逆转M2型向M1型极化的表型、分泌细胞因子和吞噬能力等方面做了初步研究,但具体的作用机制尚不清楚,有待进一步研究。
参考文献:
[1]Wang D,Sun X,Sadee W.Different effects of opioid antagonists on mu-delta-and kappa-opioid receptors with and without agonist pretreatment[J].J Pharmacol Exp Ther,2003,321(2):544-552.
[2]Gold MS,Dackis CA,Pottash AL,etal.Naltrexone,opiate addiction,and endorphins[J].Med Res Rev,2(3):211-246.
[3]Younger J,Noor N,McCue R,etal.Low dose naltrexone for the treatment of fibromyalgia:findings of a small,randomized,double-blind,place bo-controlled,counterbalanced,crossover trial assessing daily pain levels[J].Arthritis Rheum,2013,65(2):529-538.
[4]Bihari B,Bernard bihari.Low dose naltrexone for normalizing immune system function[J].Altern Ther Health Med,2013,19(2):56-65.
[5]Jingjuan M,Yiming M,Nicholas P,etal.Low dose naltrexong (LDN) enhances maturation of bone marrow dendritic cells(BMDCs)[J].Int Immunopharmacol,2013,17:1084-1089.
[6]Gordon S,Martinez FO.Alternative activation of macrophages:mechanism and functions[J].Immunity,2010,32(5):593-604.
[7]Fang Xue,Tan Wei-Xing,HE Cheng,etal.MicroRNAs in microglia polarization and CNS dseases:mechanism and functions[J].Acta Physiologica,2015,67(1):32-40.
[8]Stoger JL,Gijbels MJ,van der Velden S,etal.Distribution of macrophage polarization markers in human atherosclerosis[J].Atherosclersis,2012,225(2):461-468.
[9]Lewis CE,Pollard JW.Distinct role of macrophage in different tumor micoenvironments[J].Cancer Res 2006,66:605-612.
[10]Ginderachter JA,Movahedi K,Hassanzadeh K,etal.Classical and alternative activation of mononuclear phagocytes:picking the best of both worlds for tumor promotin[J].Immunobiology,2006,211:487-501.
[11]Smith JP,Bingaman SI,Ruggiero F,etal.Therapy with the opioid antagonist naltrexone promotes mucosal healing in active Crohn’s disease:a ran domized place bo-controlled trial[J].Dig Dis Sci,2011,56(7):2088-2097.
[12]Younger J,Parkitny L,McLain D.The use of low-dose naltrexone (LDN) as a novel anti-inflammatory treatment for chronic pain[J].Clin Rheumatol,2014,33:451-459.
[13]Cree BA,Kornyeyeva E,Goodin DS.Pilot trial of low-dose naltrexone and quality of life in multiple sclerosis[J].Ann Neurol,2010,68(2):145-150.
[14]Donahue RN,McLaughlin PJ,Zagon IS.Low-dose naltrexone suppresses ovarian cancer and exhibites enhanced inhibition in combination with cisplatin[J].Exp Biol Med,2011,236:883-895.
[15]Abdel K,Traore,Oumar Thiero,etal.Single cohort study of the effect of low dose naltrexone on the evolution of immunological,virological and clinical state of HIV+ adults in Mali[J].J AIDS HIV Res,2011,3(10):180-188.
[16]Abdel K,Traore,Oumar Thiero,etal.Impact of low dose naltrexone (LDN) on antiretroviral therapy (ART) treated HIV+ adults in Mali:A single blind randomized clinical trial[J].J AIDS HIV Res,2011,3(10):189-198.
[17]Brown N,Panksepp J.Low dose naltrexone for disease prevention and quality of life[J].Med Hypotheses,2009,72(3):333-337.
[收稿2015-09-22修回2016-02-23]
(编辑张晓舟)
doi:10.3969/j.issn.1000-484X.2016.07.008
作者简介:郭胜男(1990年-), 女,在读硕士,主要从事肿瘤免疫调节方面的研究,E-mail:drguoshengnan@163.com。 通讯作者及指导教师:单风平(1959-),男,博士,教授,博士生导师,主要从事肿瘤免疫调节研究,E-mail:fpshan@mail.cmu.edu.cn。
中图分类号R392.12R392.5
文献标志码A
文章编号1000-484X(2016)07-0970-04
Immuno-regulatory effects on murine macrophages by low dose naltrexone(LDW)
GUO Sheng-Nan,LI Yan,WANG Xiao-Nan,SHAN Feng-Ping.
Department of Immunology,China Medical University,Shenyang 110001,China
[Abstract]Objective:The effect of naltrexone on function of murine peritoneal macrophage in vitro was studied in order to illuminate its immune activity futher.Methods: Peritoneal macrophages were divided in three groups:RPMI1640 blank control group,LPS positive control group and NTX treated group.Various phenotypic and functional indices were tested by MTS,flow cytometry technology,phagocytosis experiment and ELISA.Results: Compared with RPMI1640 group,at a LDN exhibits paradoxical properties;the expression of CD64 on surface increased while the expression of CD206 decreased in NTX group; the expression of tumour necrosis factor-α(TNF-α),interleukin-6(IL-6),interleukin-1β(IL-1β)were increased.Conclusion: The results of experiment had proved that LDN could influence macrophage polarzation,regulate the inflamatory mediators production and affect the phagocytosis function of peritoneal macrophage.
[Key words]Naltrexone; Macrophage; Phenotype; Cytokine; Phagocytosis
①本文为辽宁省科技厅基金项目(No.2012-225014)。
