溶藻弧菌Ⅲ型分泌系统C-环组分VscQ的原核表达及免疫原性
2020-10-26曾福源伍艳清邱明生武沛文周诗慧王俊霖简纪常谢妙庞欢瑛
曾福源 伍艳清 邱明生 武沛文 周诗慧 王俊霖 简纪常 谢妙 庞欢瑛

摘 要:为探究溶藻弧菌(Vibrio alginolyticus)HY9901菌株III型分泌系统(Type III secretion system,T3SS)胞质环(C-环)组分VscQ作为疫苗候选抗原的可能性,根据GeneBank上登陆的溶藻弧菌vscQ序列(NO.MN862753),设计1对带酶切位点的特异性引物,PCR扩增vscQ基因,进行序列分析。结果显示,该基因全长969bp,预计分子量35.61kDa。将vscQ基因定向插入原核表达载体pGEX-4T-1中,构建重组表达质粒pGEX-vscQ。用异丙基-β-D-硫代半乳糖苷(IPTG)诱导后,能在大肠杆菌(Escherichia coli)BL21(DE3)中表达分子质量约为61.6kDa的VscQ融合蛋白。VscQ蛋白表达的最优条件为:0.4mmol/L IPTG,15℃条件下诱导12h。用纯化后的VscQ融合蛋白免疫白兔,获得高效多克隆抗体,抗体效价为1∶121500。兔抗VscQ血清能与重组VscQ蛋白发生特异性反应,表明T3SS C-环组分VscQ可能是溶藻弧菌的重要保护性抗原之一。
关键词:溶藻弧菌;VscQ;Ⅲ型分泌系统;原核表达;免疫原性
中图分类号 S941.42;Q786文献标识码 A文章编号 1007-7731(2020)18-0101-05
Prokaryotic Expression and Immunogenicity of the Type III Secretion System C-ring Component Protein VscQ from Vibrio alginolyticus
ZENG Fuyuan et al.
(1Shenzhen Institute of Guangdong Ocean University,Shenzhen 510000,China;2 Fisheries College of Guangdong Ocean University,Zhanjiang 524088,China;3 Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Key Laboratory of Diseases Controlling for Aquatic Economic Animals of Guangdong Higher Education Institutions,Zhanjiang 524088,China)
Abstract:To investigate the prokaryotic expression and the possibilities as a vaccine candidate antigen of VscQ from V.alginolyticus HY9901,primers ware designed according to the publicated vscQ gene sequence(NO.MN862753).Followed by digestion,connection,prokaryotic expression,vector pGEX-vscQ was constructed through directional inserting into pGEX-4T-1,and the Gst-VscQ fusion protein with 61.6kDa was successfully expressed in Escherichia coli BL21(DE3).The recombinant protein was highly expressed under induction conditions of exposure with 0.4mmol/L IPTG at 15℃ for 12 hours.The purified fusion protein was injected into rabbit to produce anti-VscQ serum.Western blot analysis revealed that the prepared antiserum specifically reacted to the VscQ fusion protein,which indicated that the VscQ may be one of the important protective antigens of V.alginolyticus.
Key words:Vibrio alginolyticus;VscQ;Type III secretion system(T3SS);Prokaryotic expression;Immunogenicity
弧菌病(Vibriosis)暴发迅速,流行面积广,是鱼虾贝养殖中最为严重的病害之一,严重制约了养殖业的发展[1-3]。溶藻弧菌(Vibrio alginolyticus)是一种嗜盐嗜温型的革兰氏阴性细菌,可产生黏附因子、脂多糖、Ⅲ型分泌系统、外膜蛋白等毒力因子[4],能引起文蛤和菲律宾蛤仔外套膜萎缩、闭壳肌松弛无力、软体部颜色淡红等病变[5,6]。近年来,抗生素在弧菌病防治方面虽有成效,但长期使用抗生素所导致的耐药性及药物残留问题也日益严重[7-9]。相比之下,疫苗是更优的防控方法,其通过激发机体自身的免疫防御系统,可有效提高机体对病原的抵抗能力[10]。
Ⅲ型分泌系统(Type III secretion system,T3SS)是细菌保守存在的“针状样”注射装置(injectisome),其核心结构由嵌入在细菌膜中的多环基底、周质内杆、位于内膜的跨膜输出器和包括ATP酶复合体与C-环的胞质组分组成[11],是细菌特有的将分泌蛋白注入宿主细胞并致其死亡的装置[12]。C-环位于内膜环和输出装置的下方,与ATP酶复合体共同起着底物装载、分泌枢纽和分选平台的作用[13]。在耶尔森氏菌(Yersinia pestis)中,C-环由22个YscQ亚单位组成,可以在装置与细胞质之间完成转换,YscQ的交换与效应分子的分泌和ATP酶(VscN)的功能有關[14]。
有研究表明:T3SS相关蛋白具有较高的免疫保护作用,如将注射装置蛋白VscP免疫多鳞鱚(Sillago sihama Forskál),28d后用溶藻弧菌、哈维氏弧菌(Vibrio harveyi)分别攻毒,发现多鳞鱚的免疫保护率分别为67.7%和86.6%,而用VscO蛋白免疫斜带石斑鱼(Epinephelus coioides)后,对溶藻弧菌的免疫保护率达80.0%[15-18],但目前对于C-环组分蛋白的免疫保护性尚未知晓。笔者对溶藻弧菌T3SS C-环组分VscQ蛋白进行原核表达、诱导条件优化和免疫原性研究,为探讨其作为基因工程亚单位疫苗的研发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 溶藻弧菌强毒株HY9901、大肠杆菌DH5α、BL21(DE3)和质粒pGEX-4T-1均由本实验室保存。
1.1.2 主要试剂及材料 Ex Taq DNA聚合酶、T4 DNA连接酶、BamH I和Sal I限制性核酸内切酶购自Takara公司;细菌基因组抽提试剂盒、核酸切胶回收试剂盒购自北京全式金生物技术有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自上海生物工程技术服务有限公司;克隆载体pMD18-T购自宝生物工程(大连)有限公司;预染蛋白Marker购自Fermentas公司;鼠抗IgG和DAB显色试剂盒购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 溶藻弧菌基因组DNA的提取 将活化培养9h的溶藻弧菌HY9901按体积比1∶100的比例接种于TSB(20mg/mL NaCl,pH7.0)培养基,于28℃条件下振荡培养10h。取2mL菌液,8000r/min离心1min收集菌体,按照细菌基因组DNA提取试剂盒说明书提取溶藻弧菌基因组DNA,于-20℃条件下保存备用。
1.2.2 克隆载体构建 根据GenBank上登陆的溶藻弧菌VscQ基因序列(NO.MN862753),用Primer 5设计1对带酶切位点的特异性引物(由上海生物工程技术服务有限公司合成),上游引物V1:GGCGGATCCATGACGCCGTTAATAATCCCCA(下划线为BamH I位点),下游引物V2:GGCGTCGACTCATGCTGGCTCCTGCGTGC(下划线为Sal I位点),以1.2.1所述基因组DNA为模板,进行PCR反应。反应条件:94℃预变性4min,94℃变性30s,41℃退火30s,72℃延伸30s,共35个循环,最后72℃延伸10min。0.8%(质量分数)琼脂糖凝胶电泳检测VscQ片段,回收片段,克隆至pMD18-T载体,命名为pMD-vscQ。
1.2.3 原核表达载体构建及大肠杆菌诱导表达 提取测序正确的pMD-vscQ菌株质粒,经双酶切后,按T4DNA连接酶说明书操作步骤,与经同样双酶切的pGEX-4T-1质粒连接,构建重组质粒pGEX-vscQ。将其转化入大肠杆菌菌株BL21(DE3)感受态细胞,涂布LB平板(含Amp 100?g/mL),挑取单菌落,接种于800?L LB(含Amp 100?g/mL)培养基中,于37℃条件下振荡培养9h。菌落PCR、测序鉴定正确后,按体积比1∶100的比例接种于30mL LB(含Amp 100?g/mL)培养液中,于37℃条件下220r/min振荡培养至OD600为0.4~0.6时,取1mL培养物,10000g室温离心2min,弃上清,用100μL 1×上样缓冲液重悬菌体沉淀。在剩余的培养物中加入IPTG至终浓度为0.1mmol/L,于15℃条件下220r/min振荡培养12h,取1mL培养物,12000g室温离心2min,弃上清,用100μL 1×上样缓冲液重悬菌体沉淀,12% SDS-PAGE电泳分析蛋白表达情况。
1.2.4 原核表达条件的优化 IPTG设0.1、0.4、0.7和1.0mmol/L共4个浓度进行诱导,在15℃条件下诱导12h;时间设1、2、4、6、8、10、12h共7个时间点,分别于15℃、0.4mmol/L IPTG条件下诱导;温度设15℃和37℃,在0.4mmol/L IPTG条件下诱导12h。SDS-PAGE分析不同诱导条件下VscQ蛋白诱导表达情况。
1.2.5 表达产物的纯化 在最佳诱导条件诱导后,取30mL菌液,1000r/min离心,收集菌体,用PBS(pH7.4)重悬,超声破碎,程序为:300W超声6s,间隔8s,直至菌液澄清。在4℃条件下经Washing Buffer和Rashing Buffer洗涤,离心收集沉淀并称重,按30mg/mL的浓度比加入PBS,加入8mol/L的尿素3mL,于4℃条件下裂解9h。用GST琼脂糖凝胶装柱(柱床体积5mL)纯化,PBS(pH7.4)平衡,流速为1mL/min,将诱导上清上样,让GST FUSION融合蛋白挂柱。用PBS(pH7.4)洗脱杂蛋白,然后用洗脱液(0.1mmol/L Tris溶液50mL,0.514g还原型谷胱甘肽GSH,pH8.0)洗脱目的蛋白,收集洗脱峰液体,12% SDS-PAGE分析纯化结果。最佳洗脱液洗脱下的目的蛋白,经过小体积透析袋透析,再用K4000 Brandford试剂盒测定蛋白浓度,于-20℃下保存备用。
1.2.6 抗血清的制备与抗体效价的测定 将纯化的VscQ蛋白与佐剂混合,直至完全乳化。免疫开始前,抽取兔血作为空白对照,离心,分离血清,于-80℃条件下保存备用。皮下注射免疫新西兰白兔(2~2.5kg),每只白兔免疫400?g VscQ蛋白,对照组注射等量磷酸缓冲液(PBS),14~21d免疫1次,共免疫4次。首次注射的抗原为蛋白或PBS与弗氏完全佐剂混匀制备,后3次注射的抗原均采用蛋白或PBS与不完全佐剂混匀制备。免疫结束后,取血、离心分离血清,提前准备包被板,用PBS(pH7.4)包被缓冲液将VscQ抗原稀释到5?g/mL,混匀后加入板条中,每孔100?L,于4℃冰箱过夜。弃去包被液,洗涤3次,每孔加入200?L封闭液,于37℃恒温箱封闭1h。取出酶标板,弃去内液,洗涤1次。加入VscQ兔抗血清(1/500),3倍稀释,每孔100?L,于37℃恒温箱反应1h。取出酶标板,弃去内液,洗涤3次,向每孔中加入100?L HRP-标记的羊抗兔IgG(1/5000稀释),于37℃恒温箱反应1h。取出酶标板,弃去内液,洗板4次,每孔加入100?L TMB显色液,显色完成后每孔加入100?L 1mol/L HCL溶液,终止反应。在酶标仪上(450nm)读数,将≥阴性对照OD值2.1倍的孔所對应的稀释度,定为该样品的效价。
1.2.7 免疫原性分析 Western-blot分析VscQ的免疫原性。取VscQ蛋白,加入Loadind Buffer煮沸、冷却,取20?L进行SDS-PAGE电泳,电泳条件:5%浓缩胶,90V,30min;10%分离胶,120V,20min。使用转印仪将VscQ蛋白转印至PVDF膜,条件为100V,60min。结束后用5%脱脂奶粉TBST溶液进行封闭,于37℃摇床中封闭2h,PBS漂洗5min。一抗用兔抗VscQ血清,于4℃条件下反应过夜,TBST漂洗3次,每次5min。二抗用HRP-标记的羊抗兔IgG(1∶1500稀释),于37℃下反应1h,TBST漂洗4次,每次5min。加入二氨基联苯胺(Diaminobenzidine,DAB)显色液,待有明显蛋白条带出现后用双蒸水终止反应,膜自然干燥后拍照,避光长期保存。
2 结果与分析
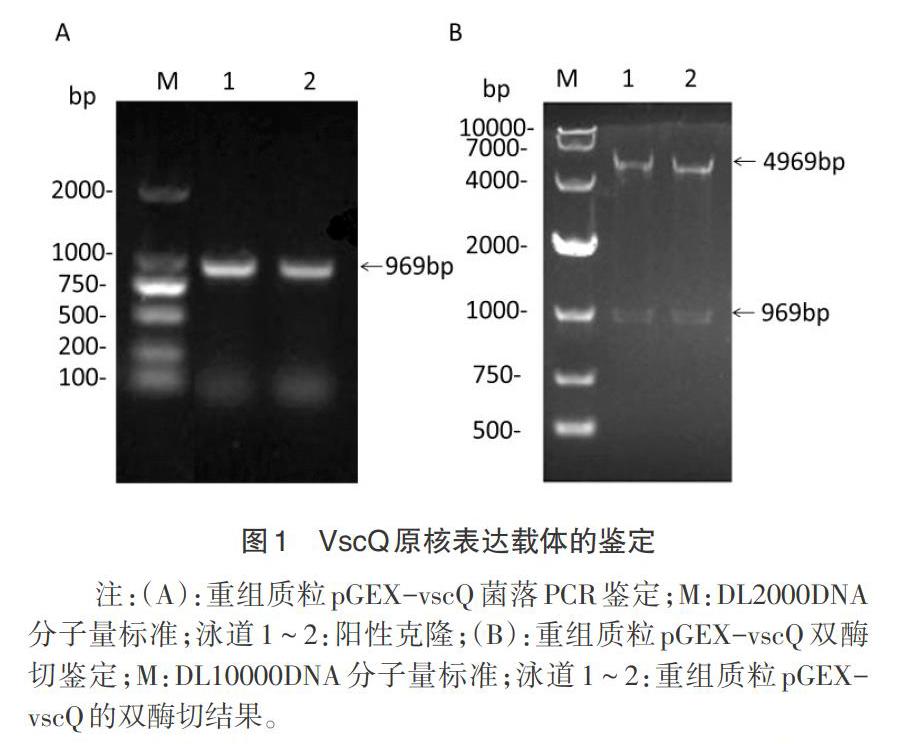
2.1 原核表達载体的构建 将vscQ基因片段连接到pGEX-4T-1质粒后,转化大肠杆菌BL21(DE3),挑取单克隆进行菌落PCR鉴定,结果获得969bp的特异性条带,与预期结果一致(图1A)。提取的质粒经内切酶BamH I和Sal I酶切后,得到大小约5kp和1kp的2个片段(图1B),双向测序未发现vscQ有错配或突变,证明原核表达载体pGEX-vscQ构建成功。
2.2 大肠杆菌的诱导表达 将pGEX-vscQ质粒转化大肠杆菌BL21(DE3)中,经IPTG诱导可表达相对分子质量约61.6kDa的VscQ蛋白(图2泳道2),其中VscQ的预计分子量35.6kDa,pGEX-4T-1表达的融合标签为26kDa。对照组均未表达VscQ蛋白。
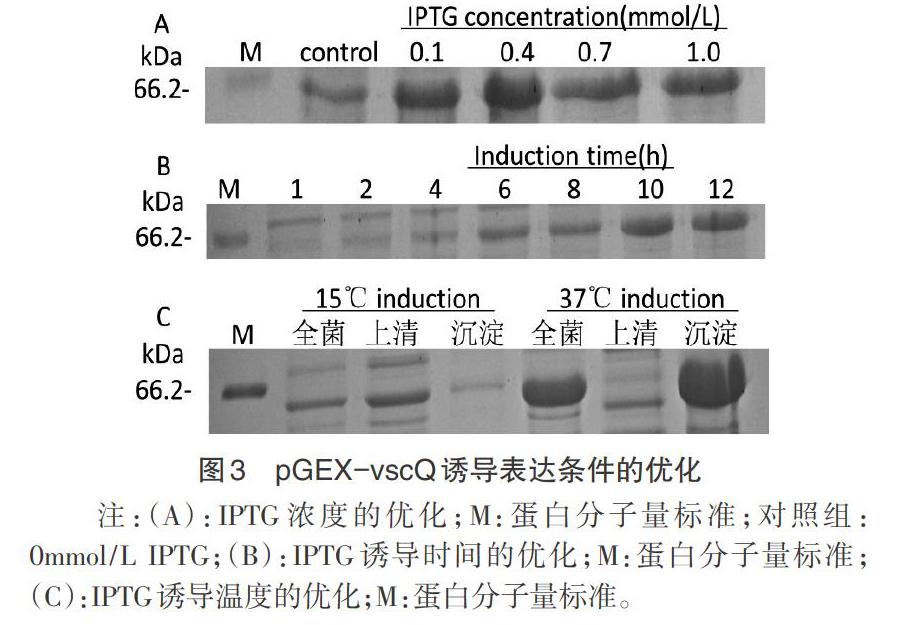
2.3 诱导表达的条件优化 IPTG诱导浓度0.4mmol/L时VscQ表达量最大(图3A);诱导时间为12h时表达量最佳(图3B);诱导温度为37℃时全菌、沉淀中蛋白表达量较15℃时高,上清中几乎不表达(图3C),而诱导温度为15℃时上清中VscQ蛋白表达量较大(图4)。通过对IPTG浓度、诱导时间、诱导温度的优化,确定VscQ的最佳诱导表达条件为:0.4mmol/L IPTG,15℃条件下诱导12h。
2.4 VscQ蛋白纯化 选取IPTG诱导浓度为0.4mmol/L,于15℃条件下诱导12h后的上清进行GST柱亲和纯化,经GSH洗脱,从上清液中获得VscQ蛋白,纯度在90%以上。经SDS-PAGE分析,成功获得目的蛋白(图5泳道3)。
2.5 兔抗VscQ血清效价测定 VscQ免疫新西兰白兔后,ELISA检测兔抗血清效价高达1∶121500(表1)。
2.6 VscQ的免疫原性分析 Western-blot分析表明,VscQ抗血清能与重组表达的61.6kDa VscQ蛋白发生反应(图6泳道1),而对照血清不能与重组VscQ蛋白反应(图6泳道2)。
3 结论与讨论
3.1 结论 本研究成功表达了溶藻弧菌T3SS C-环组分VscQ蛋白,并对其表达条件了进行优化。结果表明,最佳诱导表达条件为15℃,0.4mmol/L IPTG诱导12h。用纯化的重组VscQ蛋白免疫白兔获得了高效价的抗血清,抗体效价为1∶121500。Western blot结果显示,抗血清能与VscQ重组蛋白发生特异性反应,提示溶藻弧菌T3SS C-环组分蛋白VscQ具有免疫原性,未来可通过免疫保护试验探讨其作为疫苗候选蛋白的可能性。
3.2 讨论 长期以来,化学药物在水产养殖动物病害防治中被广泛使用,由此产生的药物残留、污染环境等问题不利于该行业的可持续发展。疫苗不仅能提高动物免疫水平,还能增强机体抗应激能力,且符合绿色、安全等要求,是目前水产动物疾病防治界研究与开发的主流产品[19]。Ⅲ型分泌系统是细菌为了适应环境演变出的一套有利于自身发展的装置,在致病过程中扮演重要角色[20]。该毒力装置负责将其编码的效应蛋白直接注入宿主细胞内部,导致细胞骨架重排或干扰细胞信号通路,进而使宿主细胞死亡[21,22]。有研究表明,弧菌的部分外膜蛋白(Omp)、T3SS装置蛋白等具有较好的免疫原性[23-25]。C-环作为溶藻弧菌T3SS的重要组成部分,其免疫原性尚未可知。
本研究通过构建VscQ的原核表达载体,并对其表达条件进行优化,当IPTG浓度为0.4mmol/L时VscQ表达量最大,IPTG浓度过高或过低都会抑制VscQ的表达。VscQ表达量受诱导时间影响较小,诱导12h为最佳。在本研究中,VscQ在37℃条件下诱导的全菌、沉淀中蛋白表达量均较高,其原因可能是E.coli在37℃时体内酶的活性最大。值得注意的是,当诱导温度为15℃时,上清中VscQ蛋白表达量明显高于沉淀,而诱导温度为37℃时则相反。为制备亚单位疫苗,需让目的蛋白在上清中表达,故在15℃条件下诱导效果更好。
以纯化后具有免疫原性的抗原为原材料制成的亚单位疫苗,其免疫保护力远远高于灭活全菌疫苗[26]。本研究中,纯化的融合VscQ蛋白能刺激白兔产生强烈的免疫反应,兔抗VscQ血清能与重组表达的61.6kDa VscQ蛋白发生免疫反应,但其是否为保护性抗原,还需进一步通过免疫保护性试验加以验证。
参考文献
[1]杨少丽,王印庚,董树刚.海水养殖鱼类弧菌病的研究进展[J].海洋水产研究,2005(4):75-83.
[2]吕莉,朱志东,邓剑壕,等.对虾弧菌病的研究进展[J].水产学杂志,2018,31(4):53-58.
[3]张颖雪,苏洁,樊景凤,等.海水养殖贝类弧菌病流行暴发及其环境影响因素研究进展[J].海洋环境科学,2020,39(3):480-487.
[4]程海燕,庞欢瑛,鲁义善,等.溶藻弧菌acfA基因克隆与生物信息学分析[J].广东海洋大学学报,2014,34(1):9-14.
[5]刘连生,闫茂仓,赵海泉,等.文蛤疾病学研究进展[J].水产科学,2009,28(4):234-237.
[6]李启蒙,朱贝贝,方皓,等.一起菲律宾蛤仔出血病病原的鉴定[J].山东畜牧兽医,2017,38(10):7-8.
[7]徐晓津,李秀华,马一帆,等.复方中草药及其与抗生素联用对斜带石斑鱼溶藻弧菌病的治疗效果[J].水产学报,2019,43(5):1338-1346.
[8]陈会.中草药提取物与抗生素联用抑制副溶血弧菌机制研究[D].镇江:江苏大学,2018.
[9]张颖雪,苏洁,叶仕根.养殖贝类病原弧菌的耐药性及防治方法研究进展[J].江西水产科技,2019(5):53-56.
[10]PULENDRAN B,AHMED R.Immunological mechanisms of vaccination[J].Nature Immunology,2011,12(6):509-517.
[11]GAYT?N M O,MART?NEZ-SANTOS V I,SOTO E,et al.Type Three Secretion System in Attaching and Effacing Pathogens[J].Front Cell Infect Microbiol,2016,6:129.
[12]ENNINGA J,ROSENSHINE I.Imaging the assembly,structure and activity of type III secretion systems[J].Cell Microbiol,2009,11(10):1462-1470.
[13]DENG W Y,MARSHALL N C,ROWLAND J L,et al.Assembly,structure,function and regulation of type III secretion systems[published correction appears in Nat Rev Microbiol,2017 May 12;15(6):379][J].Nat Rev Microbiol,2017,15(6):323-337.
[14]DIEPOLD A,KUDRYASHEV M,DELALEZ N J,et al.Composition,formation,and regulation of the cytosolic c-ring,a dynamic component of the type III secretion injectisome[J].PLoS Biol,2015,13(1):e1002039.
[15]李靜,庞欢瑛,简纪常,等.溶藻弧菌Ⅲ型分泌系统vscP基因的克隆与生物信息学分析[J].广东海洋大学学报,2016,36(4):30-36.
[16]李静.溶藻弧菌Ⅲ型分泌系统“针状样”毒力装置相关基因功能的研究[D].湛江:广东海洋大学,2016.
[17]周泽军.溶藻弧菌Ⅲ型分泌系统分子伴侣护航蛋白VscO的功能研究[D].湛江:广东海洋大学,2013.
[18]庞欢瑛,周泽军,丁燏,等.溶藻弧菌Ⅲ型分泌系统注射装置蛋白VscO的原核表达及免疫原性[J].广东海洋大学学报,2014,34(3):41-46.
[19]王玉堂.疫苗及其在水生动物疾病预防中的应用(一)[J].中国水产,2018(7):82-86.
[20]GAL?N J E,WOLF-WATZ H.Protein delivery into eukaryotic cells by type III secretion machines[J].Nature,2006,444(7119):567-573.
[21]POPA C M,TABUCHI M,VALLS M.Modification of Bacterial Effector Proteins Inside Eukaryotic Host Cells[J].Front Cell Infect Microbiol,2016,6:73.
[22]VANDER BROEK C W,STEVENS J M.Type III Secretion in the Melioidosis Pathogen Burkholderia pseudomallei[J].Front Cell Infect Microbiol,2017,7:255.
[23]段丽华.迟钝爱德华氏菌与创伤弧菌外膜蛋白基因原核表达及其免疫原性研究[D].厦门:集美大学,2016.
[24]钱荣华.溶藻弧菌主要毒力相关基因的克隆、表达及其免疫原性研究[D].杭州:浙江大学,2007.
[25]BABIUK S,ASPER D J,ROGAN D,et al.Subcutaneous and intranasal immunization with type III secreted proteins can prevent colonization and shedding of Escherichia coli O157:H7 in mice[J].Microb Pathog,2008,45(1):7-11.
[26]BJ?RNSD?TTIR B,GUDMUNDSD?TTIR S,BAMBIR S H,et al.Experimental infection of turbot,Scophthalmus maximus(L.),by Aeromonas salmonicida subsp.achromogenes and evaluation of cross protection induced by a furunculosis vaccine[J].J Fish Dis,2005,28(3):181-188.
(责编:徐世红)
