地塞米松对小鼠甲状腺滤泡细胞增殖和凋亡的影响及其相关机制
2016-08-09徐亚沛秦贵军王守俊孙良阁
任 蕾 徐亚沛 秦贵军 刘 聪 王守俊 孙良阁
(郑州大学第一附属医院内分泌科,郑州450002)
地塞米松对小鼠甲状腺滤泡细胞增殖和凋亡的影响及其相关机制
任蕾徐亚沛①秦贵军刘聪②王守俊孙良阁
(郑州大学第一附属医院内分泌科,郑州450002)
[摘要]目的:探讨地塞米松对小鼠甲状腺滤泡细胞的增殖及凋亡的影响。方法:取BALB/c小鼠甲状腺组织,以胰酶+Ⅱ胶原酶联合消化组织获得甲状腺滤泡细胞,并以甲状腺球蛋白表达与否判断是否为目的细胞。随后采用不同浓度地塞米松刺激目的细胞,并采用MTT、流式细胞术检测细胞增殖抑制率、凋亡率并对相关凋亡基因表达情况进行分析。结果:胰酶联合Ⅱ型胶原酶处理甲状腺组织可获得稳定传代的甲状腺滤泡上皮细胞,且细胞稳定表达甲状腺球蛋白。同时,不同浓度地塞米松对细胞增殖抑制差异具有统计学意义(F=8.544,P<0.05),且抑制情况与药物作用时间具有交互作用(F=4.532,P<0.05);此外,不同的地塞米松浓度10-6、10-5、10-4mol/L下,细胞凋亡率分别为13.39%±0.79%、17.43%±1.38%、26.42%±1.74%,均与0 mol/L地塞米松细胞凋亡率4.51%±0.06%差异均具有统计学意义(P<0.05,P<0.01),而该差异趋势在凋亡基因表达中仍表现出剂量依赖性。结论:地塞米松可有效抑制小鼠甲状腺滤泡细胞增殖,并通过多种凋亡途径促进细胞凋亡。
[关键词]地塞米松;甲状腺滤泡细胞;增殖;凋亡
地塞米松(Dexamethasone,DEX)是临床上应用较为广泛的一种糖皮质激素药物;且因其具有较强的免疫抑制及抗炎、抗过敏作用,从而在甲状腺相关疾病以及其他自身免疫性疾病的治疗中占有一席之地[1]。与此同时,近年来研究还发现,对桥本甲状腺功能减退症患者采取局部注射DEX治疗时,调节性T淋巴细胞数量将会受DEX给药浓度变化而产生变化,而该细胞凋亡或增殖,又可在一定程度上影响局部免疫功能及最终治疗效果[2]。此外,DEX在促细胞凋亡方面的报道也屡见不鲜,如促进胰腺腺泡细胞及骨髓间充质干细胞的凋亡[3,4],但是DEX在治疗甲状腺相关疾病中主要通过促进目的细胞凋亡还是通过调节其他免疫细胞发挥生理作用仍不得而知。而本研究旨在以小鼠甲状腺滤泡上皮细胞(Thyroid follicular epithelium cells,TFECs)为研究对象,通过比较不同DEX浓度下TFECs增殖及凋亡情况,从而为DEX在甲状腺相关疾病中的应用提供参考依据。
1材料与方法
1.1材料
1.1.1动物BALB/c小鼠,22~25 g,20只,雌雄各10只,购自广东省医学实验动物中心,许可证号:SCXK(粤)2013-009。
1.1.2主要试剂DEME(高糖)培养基、胎牛血清均购自GE公司,胰酶、地塞米松、Ⅱ型胶原酶购自Sigma公司、小鼠抗甲状腺球蛋白(thyrogloulin)I抗、HRP-标记羊抗鼠Ⅱ抗购自Abcam公司,实时荧光定量反转录聚合酶链式反应(Recerse transcription-polymerase chain reaction,Real-time PCR)试剂盒购自TaKaRa公司,MTT试剂盒购自南京凯基生物技术发展有限公司。
1.2方法
1.2.1小鼠甲状腺滤泡原代细胞培养小鼠脊柱脱臼处死后,浸泡酒精10 s,并在无菌条件下分离小鼠甲状腺组织。将分离组织剪成10~15小块,约1 mm/块,放入无菌的1.5 ml EP管中,用Dank′s液吹洗2~3次加入消化液(含0.25%胰酶,250 U/ml Ⅱ型胶原酶),按频率250次/min,37℃水浴振荡90 min,离心1 000 r/min,3 min,弃上清,加入1 ml含10%FBS的DEME完全培养基重悬沉淀,将细胞悬液过200目筛后加入6孔细胞培养板内,培养条件37℃ 5%CO2,次日观察细胞生长情况,其中贴壁细胞为甲状腺滤泡细胞,随后根据细胞生长情况,进行换液及传代。待细胞处于对数生长期时进行后续实验。
1.2.2Western blot检测收集培养48 h时以上且呈单层生长的TFECs,采用RIPA裂解液提取细胞内蛋白,并以β-actin为内参,依据如下步骤进行Western blot检测甲状腺球蛋白:获得目的蛋白并定量,进行PAGE-SDS电泳,转膜,封闭加入一抗(thyrogloulin)及二抗、显影。
1.2.3抗增殖实验将培养的单层TFECs消化后,用DMEM完全培养基(含10%FBS)稀释至细胞浓度约5×103个/ml,并按100 μl/孔接种于4块96孔板中,每块96孔板均1~2排添加50 μl/孔DEME完全培养基,3~4排、5~6排、7~8排分别加入10-6、10-5、10-4mol/L地塞米松50 μl/孔,放入37℃ 5%CO2培养箱中培养,并于培养后12、24、48、72 h分别取一块96孔板弃上清,每孔加入50 μl MTT,37℃条件下培养4 h,弃上清,加入DMSO(150 μl/孔),振荡5~10 min,酶标仪读取待测物在波长490nm下吸光度值。
1.2.4地塞米松促凋亡实验将培养的单层TFECs消化后,用DMEM完全培养基(含10%FBS)稀释至细胞浓度约2×106个/ml,1 ml/孔接种于6孔板中,并按0、10-6、10-5、10-4mol/L浓度添加地塞米松,每个样品设置三个复孔,放于 37℃ 5% CO2培养48 h后,胰酶消化制成单细胞悬液。采用流式细胞仪测定各组细胞中所处细胞周期比例及凋亡情况。凋亡指数(%)=凋亡细胞数/细胞总数×100%。
1.2.5凋亡相关基因检测采用Real-time PCR法,步骤如下:胰酶消化获得目的细胞,Trizol抽提获得细胞总RNA,加入反转录酶获得cDNA。检测Bax、Bcl2、p53、Fas、caspase3及caspase9 mRNA转录情况。具体引物及内参设计见表1。
表1引物及内参设计
Tab.1Primer sequences and internal reference sequence

Sensechain(5'-3')Antisensechain(5'-3')BaxTCCACCAAGAAGCTGAGCGAGGTCCAGCCCATGATGGTTCTBcl2GGATTGTGGCCTTCTTTGAGCCAAACTGAGCAGAGTCTTCp53ATGAATTCGTTGGCTCGACTGTACCACCTGGAGTCTTCCAGTGTGATFasGATATGCTGTGGATCATGGCAACTTTTCGTTCACCAGcaspase3ACATGGCGTGTCATAAAATACCCACAAAGCGACTGGATGAACcaspase9ATGCTGTCCCATACCAGGCAGGAACCCCTTCTTGTGAPDHCGGAGTCAACGGATTTGGTCGTATAGCCTTCTCCATGGTGGTGAAGAC
2结果
2.1目的细胞获取甲状腺组织经胰酶联合 Ⅱ 型胶原酶法处理后,预第三日即可获得大量TFECs,且细胞形态均一,均为贴壁生长、呈上皮样或多角形,经多次传代处理后细胞形态无明显变化。见图1。
2.2Western blot检测取TFECs原代细胞(P0)以及培养10代(P10)、培养20代细胞(P20),并取三组细胞甲状腺球蛋白表达量进行Western blot,且结果显示三组蛋白表达量上无明显差异。见图2。
2.3MTT抗增殖结果由重复资料方差分析可知,不同的地塞米松浓度下,对TFECs增殖抑制程度具有一定差异,且组间比较存在统计学意义(F=8.544,P<0.05), 且不同浓度与不同培养时间存在交互作用(F=4.532,P<0.05),见图3。
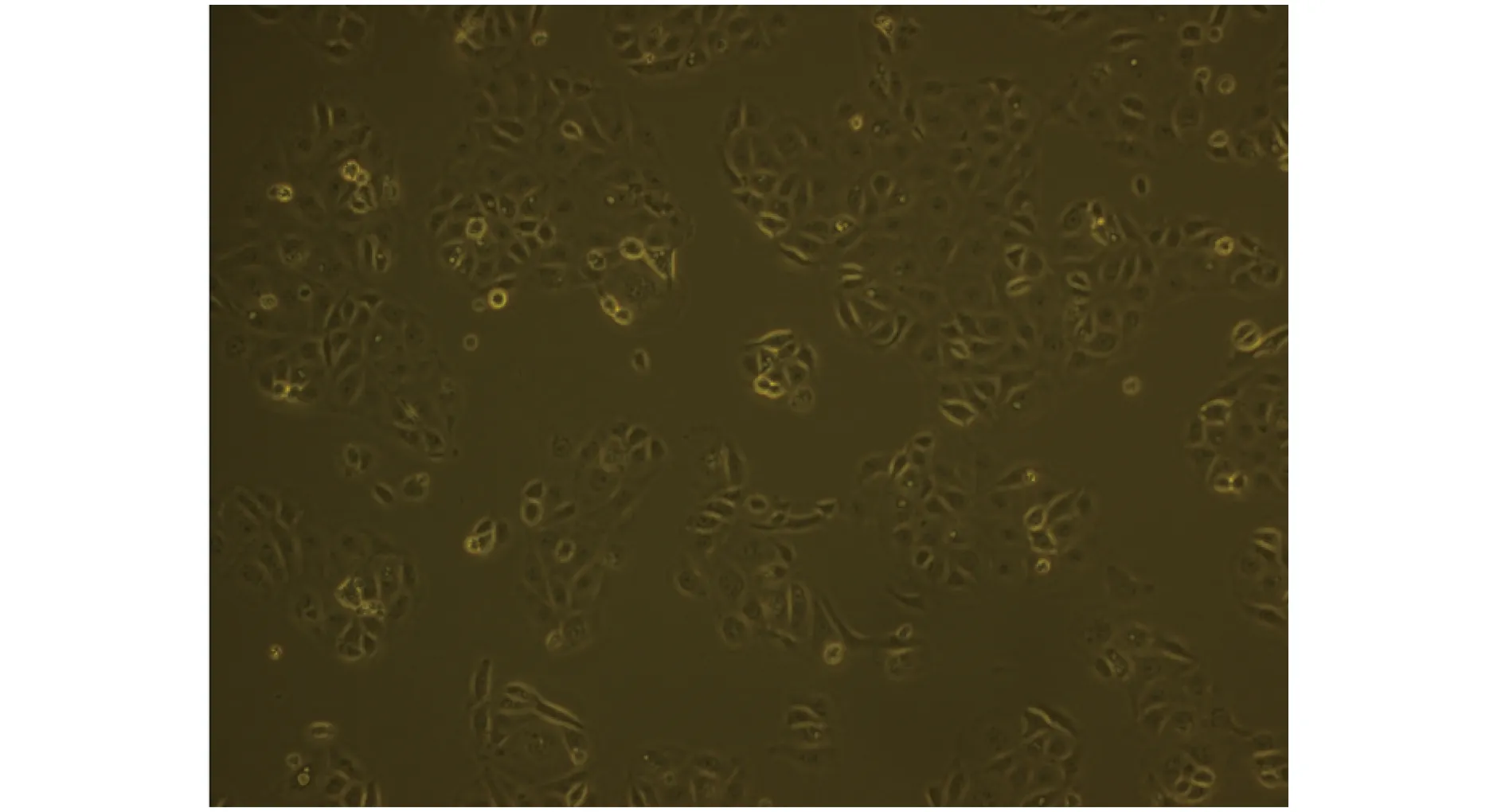
图1 小鼠甲状腺滤泡上皮细胞Fig.1 Thyroid follicular epithelium cells
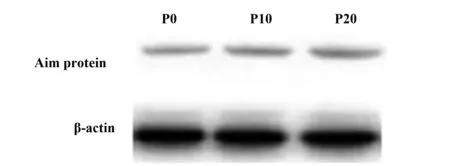
图2 细胞甲状腺球蛋白表达情况Fig.2 Expression of cell thyroglobulin
2.4流式细胞术检测凋亡结果不同浓度地塞米松组细胞其细胞凋亡率与未添加地塞米松组细胞凋亡率差异具有统计学意义(P<0.01,P<0.05),且细胞凋亡率与地塞米松剂量增加成正相关,见表2。
2.5相关凋亡指标检测如下表所示,所检测的相关凋亡指标mRNA表达量变化趋势均与DEX浓度具有剂量依赖性,除了Bcl2 mRNA量随着DEX浓度增加而减少外,其余各指标mRNA均随着DEX增加而增加,且均与未添加DEX(0 mol/L)组具有统计学差异(P<0.05)。此外,Western blot结果进一步验证以上结论。
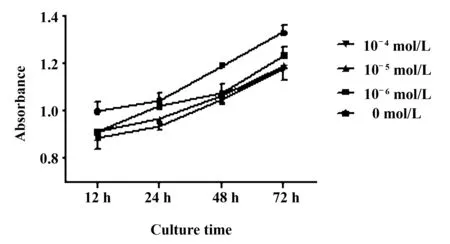
图3 不同浓度地塞米松对细胞增殖的影响Fig.3 Different concentrations of dexamethasone on cell proliferation

图4 凋亡蛋白表达情况Fig.4 Apoptotic protein expression
表2TFECs流式细胞式结果
Tab.3TFECs flow type results
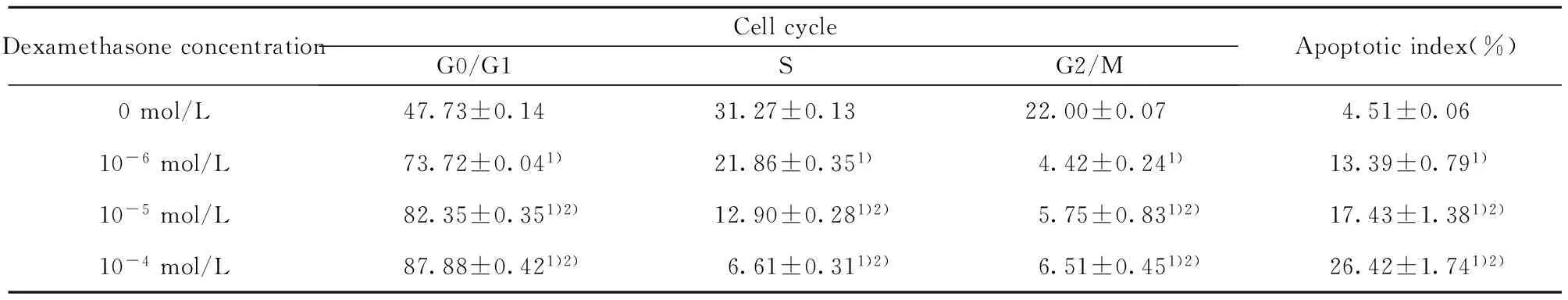
DexamethasoneconcentrationCellcycleG0/G1SG2/MApoptoticindex(%)0mol/L47.73±0.1431.27±0.1322.00±0.074.51±0.0610-6mol/L73.72±0.041)21.86±0.351)4.42±0.241)13.39±0.791)10-5mol/L82.35±0.351)2)12.90±0.281)2)5.75±0.831)2)17.43±1.381)2)10-4mol/L87.88±0.421)2)6.61±0.311)2)6.51±0.451)2)26.42±1.741)2)
Note:Compared with 0 mol/L,1)P<0.05;2)P<0.01.
表3各凋亡指标mRNA表达情况
Tab.3Each mRNA expression of apoptotic index

Groups0mol/L10-6mol/L10-5mol/L10-4mol/LBax1.001.22±0.231)1.34±0.241)1.48±0.351)Bcl21.000.87±0.191)0.63±0.281)0.34±0.121)p531.001.89±0.291)2.67±0.311)3.28±0.391)Fas1.001.28±0.211)2.23±0.241)3.29±0.251)caspase31.001.63±0.391)1.78±0.351)1.94±0.261)caspase91.001.68±0.171)2.26±0.241)3.25±0.291)
Note:Compared with 0 mol/L,1)P<0.05.
3讨论
研究表明,细胞凋亡异常是桥本式甲状腺炎等甲状腺自身免疫性相关疾病发生的主要因素之一[5]。而DEX因具有明显的促凋亡及抑制细胞增殖作用,已被作为常用细胞凋亡诱导剂用于各种肿瘤治疗中[6]。因此,近年来对于DEX在甲状腺相关疾病中的应用效果报道屡见不鲜。如其在甲状腺滤泡癌及桥本甲状腺功能减退症中均具有较好疗效[2]。然而,由于目前对甲状腺自身免疫性相关疾病的发病机理尚不清楚,同时DEX具有较强的免疫抑制及抗炎、抗过敏等功效,因此探讨DEX具体的作用机制对于疾病治疗及发病机制研究具有一定临床意义。然而,以往的研究多侧重于DEX对疾病转归的影响,缺乏细胞水平的探讨,此外,即使如何珂等[7]从细胞水平对药物治疗效果进行分析,但由于其并未对细胞进行必要的鉴定及是否具有传代稳定性进行研究,因此,对其所获得结论的可靠性仍需进一步探讨。
本研究采用双酶联合方法成功从甲状腺组织中获得甲状腺滤泡上皮细胞,并采用显微观察及Western blot技术对多次传代TFECs形态及其表达的甲状腺球蛋白进行分析可知,20代次内的TFECs仍保持较好在体状态,且细胞蛋白表达无明显差异,从而为保证体外结果与体内结果的一致性提供可参考依据。而通过不同浓度梯度DEX药物刺激TFECs可知,药物在浓度为0~10-4mol/L之间时,其对细胞增殖的抑制作用具有明显的剂量依赖性,且随着药物作用时间增加,其抑制作用更加明显,而细胞凋亡情况可从另一方面解释该现象。我们知道细胞周期G1/S期、G2/S期的转换是细胞增殖周期的重要时刻,其中G1/S期主要是DNA合成,G2/S期主要为有丝分裂。而本研究中,随着DEX浓度增加其细胞处于G0/G1期数量明显增加,而处于S期的细胞比例则显著降低,而该现象并不存在于G2/M期。由此我们推断,G0/G1期是DEX抑制细胞增殖主要作用时相。而细胞增殖周期的不完全进行,往往可诱发细胞凋亡的发生。研究证实,细胞长时间处于某一时相时且DNA受损或未完全复制并最终导致无法修复时,细胞将启动凋亡机制从而促进细胞凋亡[8]。因此,DEX浓度最高组10-4mol/L,其细胞凋亡率也最高26.42±1.74。
而为进一步研究DEX通过高表达哪些基因促发细胞凋亡,我们对Bax、Bcl2、p53、Fas、caspase3及caspase9 mRNA进行反转录,以便我们深入细胞凋亡发生具体原因。以往研究证实,Bax是促线粒体凋亡的重要基因,其可增加线粒体膜通透性,从而增加细胞色素C释放量,并作用于凋亡效应因子从而诱导细胞凋亡[9]。而Bcl2基因具有抗凋亡作用,但给予不同浓度DEX后,细胞中Bcl2 mRNA表达量下降,同时,Bax mRNA表达量上升,而后者高表达往往是细胞凋亡的另一促发因素[10]。此外,Fas作为研究较多的死亡基因,其通过与FasL结合,促发多种效应途径诱导细胞凋亡[11]。另外,caspase9是细胞凋亡通路中的起始基因,而caspase3是细胞凋亡的执行基因[12],两者在本研究中均出现剂量依赖性高表达,由此可见,DEX可作用于多个凋亡基因,从而确保细胞凋亡的顺利进行。因此,更加确信了其在诱导细胞凋亡及抗增殖中的作用。
综上所述,地塞米松浓度在0~10-4mol/L范围时,其对于甲状腺滤泡上皮细胞的增殖抑制作用及诱导凋亡的能力与药物浓度具有剂量依赖性。然而,鉴于目前对于自身免疫性甲状腺疾病发生机制尚不清楚,而细胞凋亡是否为疾病发展的主要因素仍需进一步研究。因此,后续有必要就甲状腺滤泡上皮细胞相关性疾病或以细胞凋亡有关疾病深入研究,从而为更好的解释疾病发生及药物应用提供实验依据。
参考文献:
[1]何珂,胡蕴,毛晓明.甲状腺局部注射地塞米松治疗Graves病中调节性T细胞变化的研究[J].免疫学杂志,2013,29(9):787-791.
[2] 张良岩,李传红,陆诗清,等. 地塞米松局部治疗对桥本甲状腺功能减退症患者甲状腺的影响[J]. 中华内分泌外科杂志,2011,5(4): 250-252.
[3]张桂信,陈海龙,纪军,等.地塞米松对重症急性胰腺炎大鼠胰腺腺泡细胞凋亡的影响[J].现代诊断与治疗,2012,23(5):385-387.
[4]张文信,刘美芬,叶青合,等.地塞米松对兔骨髓间充质干细胞凋亡及细胞周期的影响[J].广东医学,2012,33(2):170-172.
[5]Grosse J,Warnke E,Wehland M,etal.Mechanisms of apoptosis in irradiated and sunitinib-treated follicular thyroid cancer cells[J].Apoptosis,2014,19(3):480-490.
[6]余宗艳,齐宇红,梁军.地塞米松联合顺铂对肺腺癌A549细胞增殖和凋亡的影响[J].现代肿瘤医学,2014,22(4):762-766.
[7]何珂,胡蕴,郭慕红,等.地塞米松促进人甲状腺滤泡上皮原代细胞凋亡[J].基础医学与临床,2014,34(7):950-954.
[8]Wojtas B,Ferraz C,Stokowy T,etal.Differential miRNA expression defines migration and reduced apoptosis in follicular thyroid carcinomas[J].Mol Cell Endocrinol,2014,388(1/2):1-9.
[9]刘泽兵,王丽,叶宣光,等.环境内分泌干扰物双酚A对小鼠甲状腺滤泡上皮细胞增殖和凋亡的影响[J].中国病理生理杂志,2013,29(6):1076-1080.
[10]Champa D,Ghossein R,Cristofano AD.Aggressive thyroid carcinomas are intrinsically resistant to apoptosis but can be effectively targeted by a Bcl2 family inhibitor[J].Cancer Res,2014,74(19 Suppl):2755-2755.
[11]涂意辉,薛华明,夏志道,等.不同浓度地塞米松对人骨关节炎软骨细胞凋亡及Fas/FasL基因表达的影响[J].中国修复重建外科杂志,2012,26(5):536-541.
[12]何珂,胡蕴,毛晓明.淋巴细胞对人原代甲状腺滤泡上皮细胞凋亡的影响[J].免疫学杂志,2014(11):966-969,974.
[收稿2015-10-29]
(编辑张晓舟)
doi:10.3969/j.issn.1000-484X.2016.07.007
作者简介:任蕾(1983年-),女,硕士,主要从事甲状腺相关研究。
中图分类号Q95.33
文献标志码A
文章编号1000-484X(2016)07-0965-05
Dexamethasone thyroid follicular cell proliferation and apoptosis in mice and its mechanisms
REN Lei,XU Ya-Pei,QIN Gui-Jun,LIU Cong,WANG Shou-Jun,SUN Liang-Ge.
Department of Endocrinology,the First Affiliated Hospital of Zhengzhou University,Zhengzhou 450002,China
[Abstract]Objective:To discuss dexamethasone on proliferation of mouse thyroid follicular cells and apoptosis.Methods: Taken BALB/c mice thyroid tissue to trypsin+Ⅱ collagenase digestion organizations get thyroid follicular cells,and expression of thyroglobulin determined whether or not the target cell.Then different concentrations of dexamethasone to stimulate target cells,and the use of MTT,flow cytometry cell proliferation rate,apoptosis rate and the apoptosis-related gene expression analysis.Results: Trypsin joint type Ⅱ collagenase treatment of thyroid tissue to obtain a stable passage of thyroid follicular epithelial cells,and cells stably expressing thyroglobulin.At the same time,different concentrations of dexamethasone on cell proliferation difference was statistically significant (F=8.544,P<0.05),and the suppression of drug action have interaction (F =4.532,P<0.05);in addition,differently dexamethasone concentration 10-6mol/L,10-5mol/L,10-4mol/L,the apoptosis rates were 13.39%±0.79%,17.43%±1.38%,26.42%±1.74%,both with 0 mol/L to plug betamethasone 4.51%±0.06% apoptosis rate differences were statistically significant(P<0.05,P<0.01),while the difference in the expression of apoptotic genes trend still showed a dose-dependent manner.Conclusion: Dexamethasone can effectively inhibit thyroid follicular cell proliferation and induce apoptosis through a variety of apoptotic pathways.
[Key words]Dexamethasone;Thyroid follicular cells;Proliferation;Apoptosis
①郑州市第三人民医院,郑州450000。
②中国医科大学附属盛京医院,沈阳110000。
