ITP病人外周血中T细胞免疫抑制性受体Tim-3、LAG-3和BTLA的表达特点①
2016-08-09陈少华卢育洪杨力建李扬秋
钟 隽 陈少华 张 涛 郁 志 卢育洪 杨力建 赖 菁 李扬秋
(暨南大学附属一院血液科,广州510632)
ITP病人外周血中T细胞免疫抑制性受体Tim-3、LAG-3和BTLA的表达特点①
钟隽陈少华②张涛郁志卢育洪杨力建②赖菁李扬秋②
(暨南大学附属一院血液科,广州510632)
免疫性血小板减少症(Immune thrombocyt-openia,ITP)是一种自身免疫性出血性疾病,T细胞免疫调控在ITP的发生发展中起重要作用。我们前期研究发现了ITP中存在异常的TCR亚家族克隆增殖和TCR信号通路[1,2]。近几年系列研究发现ITP的T细胞免疫异常与一些介导免疫耐受的分子表达异常相关[3-5]。T细胞免疫抑制受体在T细胞活化与增殖的负调控中扮演着重要的角色,这些受体主要包含了PD-1(程序性死亡分子-1)、CTLA-4(细胞毒性淋巴细胞相关抗原 4)、Tim-3(T细胞免疫球蛋白黏蛋白分子3),LAG-3(淋巴细胞活化基因-3)和BTLA(B和T淋巴细胞弱化子)等[6]。近期已有研究报道显示ITP病人血清可溶性PD-1和PD-L1表达水平明显降低,提示该信号通路与疾病的相关性,同样,CTLA-4突变,多态性和表达水平的改变也提示与ITP相关[5,7-9]。而未有研究显示Tim-3、LAG和BTLA等新近报道的免疫抑制分子在ITP中的变化特点。本研究首先分析这些基因在ITP病人外周血中的表达特点。
1材料与方法
1.1样本资料本研究收集了18例初诊ITP病人(男6例,女12例,年龄24~68岁)外周血,病人按照常规方案资料,其中4例病人为难治ITP。20例健康人(男9例,女11例,年龄:20~50岁)外周血作为对照组。收集各样本经肝素抗凝血后,按常规方法分离外周血单个核细胞。
1.2方法
1.2.1RNA提取和cDNA合成RNA 提取应用 TRIzol 试剂盒,并应用随机引物和反转录酶试剂盒Superscript Ⅲ反转录合成 cDNA 第一链。
1.2.2实时定量PCR应用Real Master Mix试剂盒,利用SYBR GreenⅠ染料进行各基因的实时荧光定量PCR检测。分别利用Tim-3,LAG-3和BTLA基因的引物检测其表达水平,利用β2微球蛋白(β2M)作为内参,所采用引物见表1,其中BTLA基因的引物由Origene(Accession No.NM_001085357,NM_181780)提供( http://www.origene.com/qPCR/primer_pair/HP226238.aspx)[10]。随机选取每个基因的实时定量PCR产物经琼脂糖凝胶电泳确定产物片段大小。
1.3统计学分析采用SPSS13.0进行数据处理,结果以中位数表示;采用两样本秩和检验进行数据分析;相关性分析采用Spearman等级相关性分析;P<0.05有统计学意义。
2结果
2.1ITP中Tim-3、LAG-3和BTLA表达特点所检测的ITP和健康人样本中,均表达Tim-3、LAG-3和BTLA基因,实时定量PCR的产物经琼脂糖凝胶电泳确定产物片段大小与预期结果相符合(结果未显示)。由于3种基因的表达水平在不同样本中差异较大,故采用中位数表示结果并结合秩和检验比较结果的统计学意义。在18例ITP中Tim-3基因(中位数:0.135 2)、LAG-3(中位数:0.072 3)和BTLA(中位数:0.140 3)的表达水平均比健康人对照组高,尤其是BTLA基因的表达水平更为明显。在健康人中,各基因表达水平分别为Tim-3(中位数:0.075 1)(P=0.007)(图1A);LAG-3(中位数:0.015 5)(P< 0.001)(图1B)和BTLA(中位数:0.031 5)(P< 0.001)(图1C)。此外,4例难治病人与其他14例病人(常规组)样本之间各基因的表达水平存在一定的差异,但是结果没有统计学意义(表2)。
表1荧光定量RT-PCR引物序列
Tab.1Sequences of primers used in real-time RT-PCR
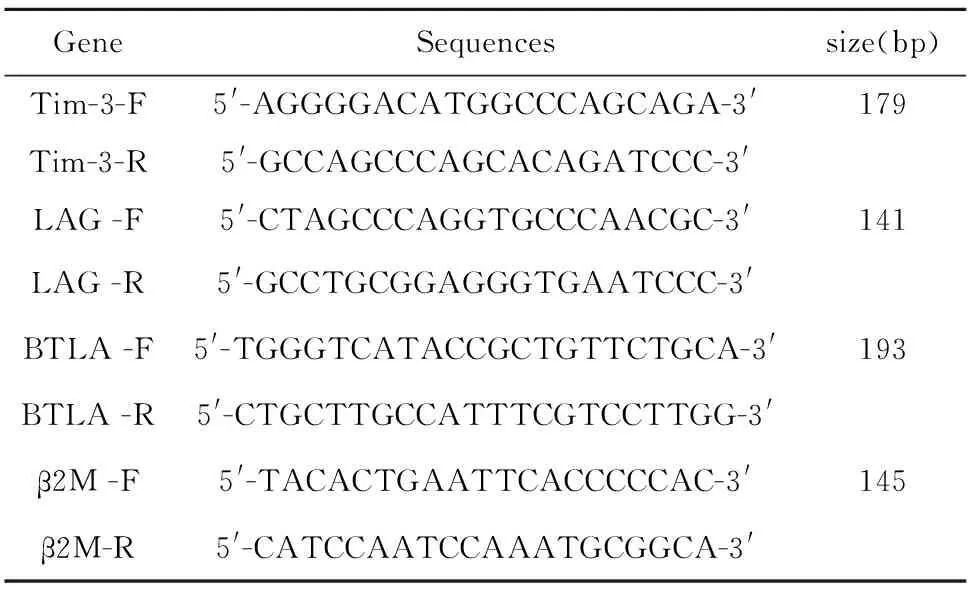
GeneSequencessize(bp)Tim-3-F5'-AGGGGACATGGCCCAGCAGA-3'179Tim-3-R5'-GCCAGCCCAGCACAGATCCC-3'LAG-F5'-CTAGCCCAGGTGCCCAACGC-3'141LAG-R5'-GCCTGCGGAGGGTGAATCCC-3'BTLA-F5'-TGGGTCATACCGCTGTTCTGCA-3'193BTLA-R5'-CTGCTTGCCATTTCGTCCTTGG-3'β2M-F5'-TACACTGAATTCACCCCCAC-3'145β2M-R5'-CATCCAATCCAAATGCGGCA-3'
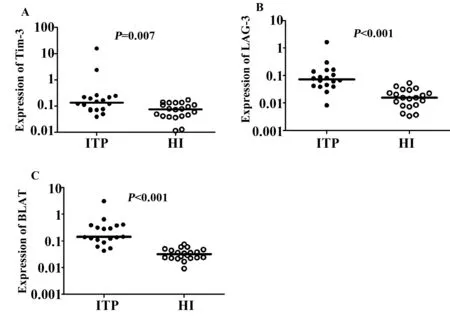
图1 Tim-3、LAG-3和BTLA在ITP和健康人中的表达水平Fig.1 Expression levels of Tim-3,LAG-3 and BTLA gene in patients with ITP and healthy individuals(HI)Note: ITP Immune thrombocytopenic purpura;HI.healthy individuals
表2不同疗效ITP样本中各基因表达水平比较
Tab.2Comparison of gene expression level in ITP with different response group

GeneExpressionlevel(median)Standardgroup(n=14)Refractorygroup(n=4)PvalueTim-30.1350.1830.671LAG-30.0790.0530.524BTLA0.1390.2160.832
2.2ITP中Tim-3、LAG-3和BTLA表达相关性我们进一步各基因表达水平之间的相关性,结果显示,Tim-3、LAG-3和BTLA基因表达水平之间在ITP样本中的相关性无统计学意义(图2A-C),而在健康人对照组中,Tim-3和LAG-3基因的表达水平呈正相关(rs =0.496,P=0.026)(图2D),而Tim-3与BTLA和LAG-3与BTLA基因表达水平之间的相关性无统计学意义(图2E-F)。
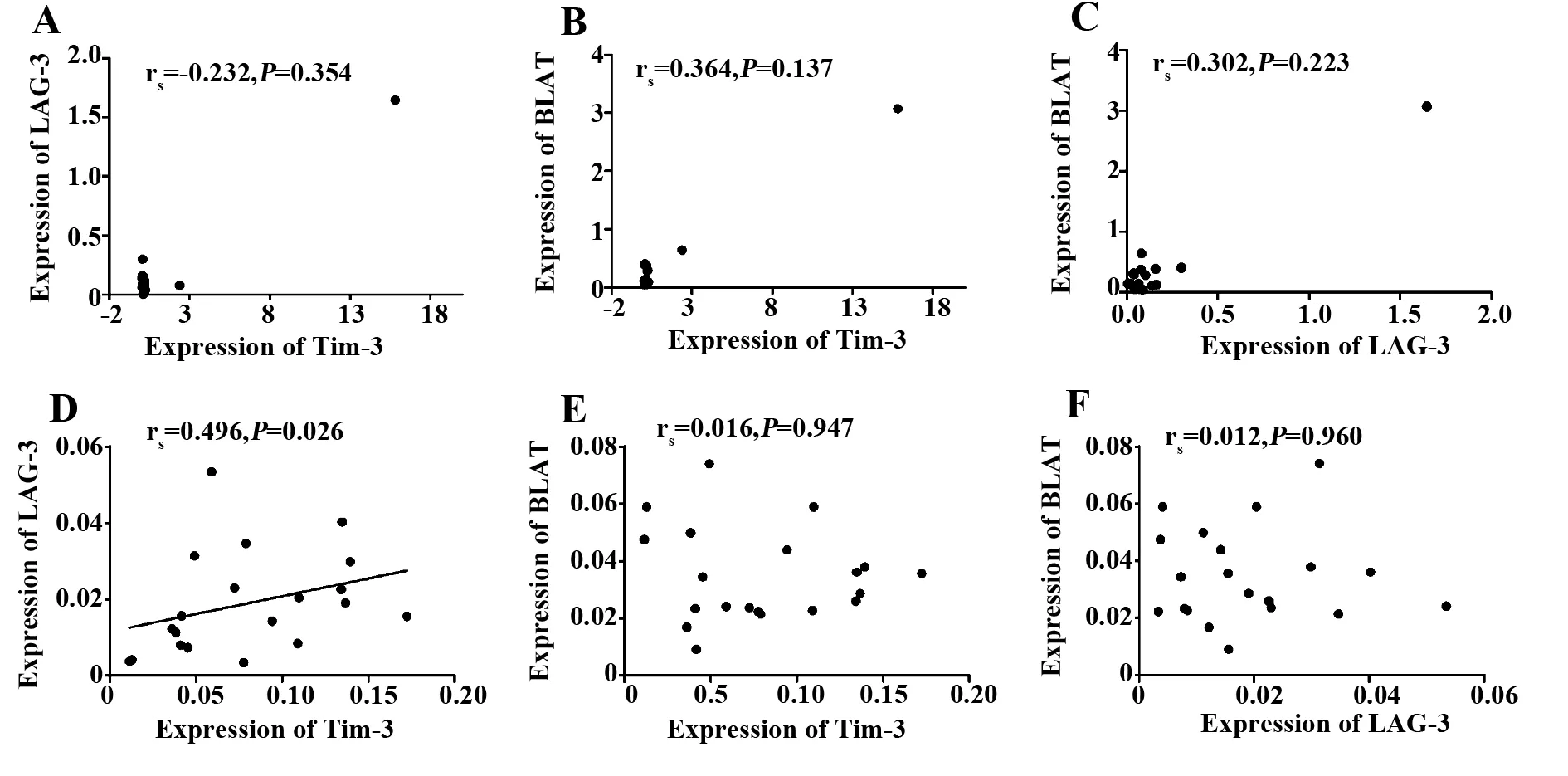
图2 ITP和HI中Tim-3、LAG-3和BTLA基因表达水平的相关性分析Fig.2 Correlation analysis between relative expression level of Tim-3,LAG-3 and BTLA gene in ITP and HINote: A-C.Correlation analysis among Tim-3,LAG-3 and BTLA genes from ITP ; D-F.Correlation analysis between relative expression level of Tim-3,LAG-3 and BTLA genes from HI.
3讨论
越来越多研究显示ITP发病机制涉及多层面的T细胞介导的免疫异常,包括了T细胞亚群失衡,调节性T细胞比例降低、异常T细胞克隆增殖、异常细胞因子分泌、以及一系列涉及T细胞增殖分化调控基因的异常表达。随着T细胞免疫耐受研究的进展,近几年研究发现,T细胞免疫抑制受体包括PD-1、PD-L1、CTLA-4、Tim-3、LAG-3和BTLA等在T细胞活化与增殖的负调控中起重要作用[6,11]。因此,近期开始有研究分析这些T细胞免疫抑制受体在ITP中的作用。已有发现ITP病人外周血中PD-1和PD-L1表达显著降低,这可能是从另一个侧面反映导致病人的免疫耐受程度降低而诱发自身免疫性病变的新原因之一。而在CTLA-4中的改变特点,主要发现其出现基因突变和多态性,某些遗传学的改变与ITP存在关联性,且不同课题组的研究结果也有所不同[7,9]。而不同病人中这些分子的变化存在差异性,是否存在更多的免疫抑制分子参与ITP的发病机制,正对这一问题,不断有新的研究成果,如近期报道了Tim-3、LAG-3和BTLA等系列的T细胞免疫抑制分子,他们在肿瘤免疫抑制中有着不同的作用。然而, Tim-3、LAG-3和BTLA等在ITP中的变化特点如何,则未见有相关的研究报道。
我们前期研究分析了ITP病人外周血T细胞中存在异常的TCR亚家族克隆增殖和TCR信号通路[1,2]。为此,本研究首先分析了其他T细胞抑制性受体包括Tim-3、LAG-3和BTLA在ITP中的表达特点。Tim-3是TIM家族成员[12],主要参与Th细胞的分化及免疫调节作用,与自身免疫性疾病的发生发展以及诱导免疫耐受有关。TIM-3高表达于Th1和细胞毒性T细胞(Tc1)上,通过与其天然配体半乳糖凝集素-9(Galectin-9,Gal-9)结合介导表达Tim-3的抑制性T效应细胞的免疫抑制作用[13]。LAG-3(CD223)属于免疫球蛋白超家族成员的一种跨膜蛋白,是近年来发现的另一种免疫抑制受体[11],其配体为MHC-II分子。LAG-3分子主要表达于活化的T细胞和NK细胞表面,与MHC-II高亲和力结合,抑制Th1细胞增殖和IFN-γ、IL-2和TNF-α等细胞因子的分泌。LAG-3也同样抑制CD8+T细胞活性,抑制LAG-3分子可增加CD8+T细胞的增殖,促进IFN-γ的分泌和增强细胞毒性作用。而BTLA(CD272)是近年发现的又一种新的免疫抑制受体,是CD28家族新成员[14]。BTLA与其配体HVEM(疱疹病毒入侵介质),结合启动免疫抑制效应,负调节淋巴细胞的活化增殖,并可以抑制抗原刺激下的T细胞活化,通过抑制IL-2、IFN-γ、IL-4和IL-10等细胞因子的分泌,下调免疫应答。这些分子都在不同方面负性调控T细胞功能。而与ITP中所发现的PD-1和PD-L1表达结果不一致,我们发现这三种基因的表达水平在ITP病人外周血单个核细胞中均有不同程度的升高,这提示了这些因子似乎发挥了正反馈的作用,在这些病人中,我们也发现PD-1和PD-L1的表达水平明显减低(结果另文报道),因此,这可能提示不同的免疫抑制因子在ITP中的作用不尽相同,综合分析多种免疫抑制性分子的变化特点,可能更好地综合评价病人的免疫改变模式,但这些需要通过更多的样本分析,同时更全面地从蛋白水平尤其是在可能的情况下,通过分析T细胞表面所表达的各种分子的情况,而获得更全面的结果,才能更有效的采取相应的免疫治疗和靶向治疗手段。有报道,PD-1基因表达水平高低与肿瘤病人预后相关,主要是因为其影响了肿瘤病人的免疫状态[15],我们也尝试分析比较难治ITP与常规治疗有效病人样本之间基因表达的差异性,尽管可能看到各基因表达水平有一定差异,但是无统计学意义,这可能是与样本数较少有关,也可能是这种差异性的确与疾病难治无关,仍需扩大样本进一步观察和随访。
总之,本研究首先初步分析和报道了Tim-3、LAG-3和BTLA三种T细胞免疫抑制性受体基因在ITP中的表达紊乱情况,提供更为全面的ITP中免疫抑制受体的表达变化谱,也为进一步开展相应的免疫靶向治疗和诱导免疫耐受提供新的资料,但本研究样本量较少,仍有待进一步扩大研究而获得更有代表性结果。
参考文献:
[1]Zhang XL,Li YQ,Chen SH,etal.The feature of clonal expansion of TCR Vβ repertoire,thymic recent output function and TCR chain expression in patients with immune thrombocytopenic purpura[J].Int J Lab Hematol,2009,31(6):639-648.
[2]Zhang X,Chen S,Yang L,etal.The feature of TRGV and TRDV repertoire distribution and clonality in patients with immune thrombocytopenic purpura[J].Hematology,2009,14(4):237-244.
[3]冀学斌,侯明.诱导原发性免疫性血小板减少症T细胞免疫耐受新途径[J].中华血液学杂志,2014,35(9):862-865.
[4]Xu SQ,Wang CY,Zhu XJ,etal.Decreased indoleamine 2,3-dioxygenase expression in dendritic cells and role of indoleamine 2,3-dioxygenase-expressing dendritic cells in immune thrombocytopenia[J].Ann Hematol,2012,91(10):1623-1631.
[5]Atesoglu EB,Tarkun P,Demirsoy ET,etal.Soluble programmed death 1 (PD-1) is decreased in patients with immune thrombocytopenia (ITP):potential involvement of PD-1 pathway in ITP immunopathogenesis[J].Clin Appl Thromb Hemost,2014 Dec 14.pii:1076029614562952.[Epub ahead of print]
[6]Shin DS,Ribas A.The evolution of checkpoint blockade as a cancer therapy:what′s here,what′s next?[J].Curr Opin Immunol,2015,33:23-35.
[7]Schubert D,Bode C,Kenefeck R,etal.Autosomal dominant immune dysregulation syndrome in humans with CTLA4 mutations[J].Nat Med,2014,20(12):1410-1416.
[8]Arandi N,Mirshafiey A,Jeddi-Tehrani M,etal.Alteration in frequency and function of CD4+CD25+FOXP3+regulatory T cells in patients with immune thrombocytopenic purpura[J].Iran J Allergy Asthma Immunol,2014,13(2):85-92.
[9]Li H,Ge J,Zhao H,etal.Association of cytotoxic T-lymphocyte antigen 4 gene polymorphisms with idiopathic thrombocytopenic purpura in a Chinese population[J].Platelets,2011,22(1):39-44.
[10]Shankar EM,Che KF,Messmer D,etal.Expression of a broad array of negative costimulatory molecules and Blimp-1 in T cells following priming by HIV-1 pulsed dendritic cells[J].Mol Med,2011,17(3-4):229-240.
[11]Nguyen LT,Ohashi PS.Clinical blockade of PD1 and LAG-3 potential mechanisms of action[J].Nat Rev Immunol,2015,15(1):45-56.
[12]卿吉琳,赵林,赵仁峰,等.TIM基因家族在疾病中作用的研究进展[J].中国免疫学杂志,2015,31(4):573-577.
[13]Wiener Z,Kohalmi B,Pocza P,etal.TIM-3 is expressed in melanoma cells and is upregulated in TGF- beta stimulated mast cells[J].J Invest Dermatol,2007,127(4):906-913.
[14]Sakoda Y,Park JJ,Zhao Y,etal.Dichotomous regulation of GVHD through bidirectional functions of the BTLA-HVEM pathway[J].Blood,2011,117(8):2506-2514.
[15]Rossille D,Gressier M,Damotte D,etal.High level of soluble programmed cell death ligand 1 in blood impacts overall survival in aggressive diffuse large B-Cell lymphoma:results from a French multicenter clinical trial[J].Leukemia,2014,28(12):2367-2375.
[收稿2015-09-10修回2015-09-28]
(编辑许四平)
doi:10.3969/j.issn.1000-484X.2016.07.021
作者简介:钟隽(1963年-),女,主治医生,主要从事血液病临床诊治研究工作。
通讯作者及指导教师:李扬秋(1962年-),女,博士,研究员,博士生导师,主要从事血液肿瘤分子发病的机制和免疫治疗的基础研究。
中图分类号R558.2R392.11
文献标志码A
文章编号1000-484X(2016)07-1028-03
①本文受国家自然科学基金(No.81570143)资助。
②暨南大学医学院血液病研究所,广州510632。
