抗PD-L1单抗的研制及其对乙型肝炎病毒的抑制效果初步研究①
2016-08-09张天英宋浏伟夏宁邵
吴 勇 张天英 宋浏伟 夏宁邵 袁 权
(厦门大学分子疫苗学与分子诊断学国家重点实验室,国家传染病诊断试剂与疫苗工程技术研究中心,公共卫生学院,厦门361102)
抗PD-L1单抗的研制及其对乙型肝炎病毒的抑制效果初步研究①
吴勇张天英②宋浏伟③夏宁邵袁权
(厦门大学分子疫苗学与分子诊断学国家重点实验室,国家传染病诊断试剂与疫苗工程技术研究中心,公共卫生学院,厦门361102)
[摘要]目的:获得具有阻断PD-1/PD-L1结合活性的Anti-PD-L1单克隆抗体,并在体内和体外模型中初步探索其应用于慢性HBV感染治疗的潜力。方法:利用大肠杆菌原核表达系统和离子交换柱层析纯化手段,表达纯化获得具有体外结合活性的人源和鼠源的PD-1/PD-L1蛋白,采用纯化后的人PD-L1蛋白作为免疫原免疫BALB/c小鼠,制备小鼠抗人PD-L1的单克隆抗体杂交瘤细胞株,基于间接化学发光免疫法评估了这些抗体与人源和鼠源重组蛋白的结合活性,并定量评估它们对PD-L1体外相互作用的阻断活性。利用慢乙肝病人PBMC体外刺激方法评估其对T细胞功能的促进作用,在HBV转基因小鼠中评估其抑制HBV的效果。结果:本研究获得了8株稳定分泌Anti-PD-L1的单克隆抗体杂交瘤细胞株,其中Anti-PD-L1 Ab5和Ab6两株单抗与人和小鼠的PD-L1具有较强的交叉反应性,且均可阻断人和小鼠的PD-1/PD-L1结合活性。在慢乙肝病人PBMC刺激培养实验中,Ab5和Ab6可促进γ干扰素水平升高;在HBV转基因小鼠中单剂注射Ab6,48 h后血清HBV DNA水平降低20倍,血清HBsAg水平降低至基线水平的30%。结论:获得了2株具有阻断人和小鼠PD-1/PD-L1结合活性的单克隆抗体,其在PBMC体外刺激培养系统中可促进慢乙肝病人的T细胞功能,在HBV转基因小鼠中具有显著的抗病毒效果,具备一定的治疗应用潜力。
[关键词]程序性细胞死亡蛋白配体1;治疗性单克隆抗体;乙型肝炎病毒;免疫治疗
乙型肝炎病毒(Hepatitis B virus,HBV)感染会导致急性或慢性的肝脏炎症,其中慢性肝炎可能会进一步进展为肝硬化或肝癌,目前全球仍有超过2.4亿慢性HBV感染者[1]。在慢性感染期间,病毒复制与宿主免疫应答的动态平衡关系对于疾病的进展至关重要。多数学者认为获得性免疫应答,尤其是细胞免疫应答介导了HBV的清除[2,3]。然而,慢乙肝病人体内的HBV特异性T细胞的功能是有缺陷的,表现为抗病毒细胞因子分泌水平较低,细胞毒性T细胞(CTL)活性较弱以及持续的病毒血症[4]。但是目前对于慢乙肝感染后T细胞功能缺陷的机制并不清楚。
程序性细胞死亡受体-1 (Programed cell death l,PD-1),最初是在凋亡的T细胞杂交瘤中利用削减杂交的方法得到的,由于其和细胞凋亡相关而得名,其N 端酪氨酸残基参与构成一个免疫受体酪氨酸抑制基序[5]。PD-1/PD-L1通路已被广泛报道在T细胞激活和增殖以及细胞因子分泌过程中起负向调节作用[6,7]。已有证据表明PD-1信号通路在抑制慢性病毒性感染病人体内的病毒特异CD8+T细胞过程中起重要作用,包括HIV感染、HCV感染和HBV感染[8-10]。最近的研究通过诱导T细胞失活、在外周T淋巴细胞上高表达PD-1分子、阻断PD-1介导的通路表明PD-1/PD-L1负调控信号是导致T细胞耗竭的重要因素[11-13]。
目前用于HBV治疗的药物包括干扰素类(IFN)和核苷类似物类(NAs),治疗策略相对有限,治疗效果不理想[14,15],针对慢性HBV感染者发展创新的、能促进逆转免疫耐受的创新治疗药物和方法是迫切且必要的。近期研究表明慢性HBV感染与PD-1/PD-L1信号通路密切相关,通过抗体阻断该通路可以刺激特异的T细胞增殖,从而促进病毒的清除[16,17]。因此,筛选具有阻断活性的Anti-PD-L1单克隆抗体有望为慢性乙型肝炎病毒感染等免疫耐受性疾病的治疗提供新策略。
1材料与方法
1.1材料
1.1.1菌株E.coli DH5α由本中心保存;E.coli ER2566购自New England Biolabs公司。
1.1.2载体和质粒pMD18-T购自TaKaRa公司;pTO-T7载体由本实验室自行构建。
1.1.3细胞小鼠骨髓瘤细胞Sp2/0细胞由厦门万泰公司馈赠,培养于含10% 胎牛血清、50 μg/ml青霉素/链霉素的1640HT培养基(pH7.2)中,5%CO2培养箱中37℃培养。
1.1.4实验动物BALB/c品系小鼠购自上海斯莱克实验动物有限公司,HBV转基因小鼠由台湾大学陈培哲教授惠赠,饲养于分子疫苗学与分子诊断学国家重点实验室SPF级动物房内,本实验遵循《实验动物保护条例》。
1.1.5主要试剂生化药品为进口或国产分析纯;质粒小量提取试剂盒、微量胶回收试剂盒均购自Tiangen公司;HBsAg检测试剂盒、HBV DNA荧光定量PCR试剂盒、人干扰素定量检测试剂盒均购自北京万泰生物公司;DNA Marker DL2000购自TaKaRa公司;考马斯亮蓝染色试剂(SDS-PAGE)购自HyClone公司;SYBR Green DNA荧光染料购自Clare Chemical公司;弗氏完全佐剂、弗氏不完全佐剂购自美国Sigma公司;RPMI1640培养基购自美国Gibco公司;胎牛血清(FBS)购自美国Hyclone公司。
1.2方法
1.2.1质粒构建从Genbank获得人和小鼠的PD-1/PD-L1基因全长序列,本研究设计表达了人PD-1/PD-L1和小鼠PD-1/PD-L1的膜外区域,分别为:Human PD-1-aa21-aa170、Human PD-L1-aa20-aa238、Mouse PD-1-aa1-a167、Mouse PD-L1-aa20-aa240(以下简称hPD-1、hPD-L1、mPD-1、mPD-L1),引物设计如表1所示;以人PD-1和人PD-L1的cDNA为模板扩增出hPD-1、hPD-L1目的片段,提取C57BL/6小鼠的脾脏细胞的mRNA作为模板,反转录后扩增出mPD-1、mPD-L1目的片段。
将扩增获得的DNA片段分别与pMD18-T载体连接,得到以下四种质粒:T-hPD-1、T-hPD-L1、T-mPD-1、T-mPD-L1经测序鉴定正确后用BglⅡ和EcoRⅠ进行双酶切后与pTO-T7载体连接并转入E.coli菌株ER2566挑克隆,经BglⅡ/EcoRⅠ双酶切及DNA测序鉴定获得重组表达质粒pT-hPD-1、pT-hPD-L1、pT-mPD-1、pT-mPD-L1。
表1人和小鼠PD-L1 PCR扩增正反向引物序列
Tab.1Upper and lower primers of human and mouse PD-L1

PrimernamePrimersequenceHumanPD-1(21-170)FTTTAGATCTATGCCAGGATGGTTCTTAGACTCCHumanPD-1(21-170)RTTTGAATTCTCACCAGGGTTTGGAACTGGCCHumanPD-L1(20-238)FTTTAGATCTATGACTGTCACGGTTCCCAAGGACCTHumanPD-L1(20-238)RTTTGAATTCTTACCTTTCATTTGGAGGATGTGCCAMousePD1(1-167)FTTTAGATCTA6TGTGGGTCCGGCAGGTACCCTGGTCAMousePD1(1-167)RTTTGAATTCTTATTGAAACCGGCCTTCTGGTTTGGGCGAMousePD-L1(20-240)FTTTAGATCTATGACTATCACGGCTCCAAAGGACMousePD-L1(20-240)RTTTGAATTCTTACCAGTGAGTCCTGTTCTGTGGAGGAT
1.2.2蛋白表达纯化将鉴定正确的单克隆表达菌株于37℃大量培养至菌液OD600=0.5左右,加入IPTG至终浓度1 mmol/L, 37℃诱导表达5 h,经鉴定,4种蛋白均表达在包涵体。hPD-1和mPD-1纯化步骤一致,以hPD-1为例详述纯化步骤,超声破碎表达菌体后高速离心后弃上清,以含有2% Triton X-100的PBS缓冲液洗涤两次,每次在室温条件下搅拌洗涤1 h,完成洗涤后以20 mmol/L PBS洗一次,不溶解的沉淀部分以适量的2 mol/L Urea+10 mmol/L DTT的20 mmol/L Tris-HCl缓冲液(pH=8.0),4 mol/L Urea+10 mmol/L DTT的20 mmol/L Tris-HCl缓冲液(pH=8.0)及8 mol/L Urea+10 mmol/L DTT的20 mmol/L Tris-HCl缓冲液(pH=8.0)逐级溶解;经过包涵体洗涤后溶解于4 mol/L Urea+10 mmol/L DTT的20 mmol/L Tris-HCl缓冲液的蛋白进一步进行阴离子交换层析(GE公司DEAE-FF-Sepharose、Q-FF-Sepharose层析柱)纯化。纯化后将蛋白透析至20 mmol/L MES缓冲液pH5.5中,于-20℃保存。hPD-L1和mPD-L1的纯化步骤一致,其蛋白包涵体洗涤、溶解、柱层析纯化过程与hPD-1基本相同,差别之处在于其复性过程相对简单,DEAE柱层析纯化后的hPD-L1蛋白处于4 mol/L Urea+10 mmol/L DTT的20 mmol/L Tris-HCl(pH8.0)缓冲液中,采用Sephadex G25脱盐柱将缓冲液置换为20 mmol/L TB8.0(pH8.0)缓冲液中,于-20℃保存。
1.2.3Anti-PD-L1单抗制备初次免疫选取6周龄BABL/c雌性小鼠皮下多点注射弗氏完全佐剂乳化后的免疫原hPD-L1,剂量为100 μg/只,同时经眼球采集空白阴性血。2周后以相同途径、相同剂量的抗原与弗氏不完全佐剂乳化后皮下加强免疫,加强2次后小鼠血清抗体滴度达到平台期,脾脏冲击免疫20 μg,进行融合实验。每次免疫前眼底采血,放置于37℃恒温培养箱30 min,12 000 r/min高速离心 10 min后,取血清-80 ℃保存,利用间接法 ELISA检测血清Anti-PD-L1抗体滴度。
融合前三天进行脾脏免疫加强,无菌条件下取小鼠脾脏制备脾细胞悬液,使用PEG 1500促进脾细胞与骨髓瘤细胞融合;用hPD-L1蛋白包板,通过常规间接ELISA差异筛选特异性阳性融合株,有限稀释法进行克隆化,获得的稳定细胞株扩增、腹腔注射BALB/c小鼠,1周后收集腹水,硫酸铵沉淀法、Protein A柱纯化得到单克隆抗体。抗体进行12%的SDS-PAGE分析,观察样品纯度。
1.2.4单抗阻断hPD-1/hPD-L1、mPD-1/mPD-L1结合活性检测实验分别将mPD-1和hPD-1蛋白包被于聚苯乙烯微孔板中作为固相受体,100 ng/孔,再将生物素标记的PD-L1蛋白和Anti-PD-L1单抗混合样品于微孔板中孵育,待其充分反应之后将样品中未结合的游离蛋白洗去,然后加入辣根过氧化物酶标记的亲和素进行反应,将未结合的酶标记亲和素洗去,最终加入化学发光显色底物,通过酶标仪读取数值判断反应强弱,进而分析待检测的Anti-PD-L1单抗的阻断活性。
1.2.5单抗功能评价体外刺激T细胞功能实验:分离慢乙肝患者的外周血单核细胞(PBMC)进行体外刺激培养,方法参考文献[18]。在培养基中加入去类毒素的HBV核心蛋白(10 μg/ml)刺激HBV-core 特异的T细胞活性,分别加入不同剂量的待测抗体或对照抗体(0、1、5、20 μg/ml),刺激培养48 h后检测其分泌的γ干扰素水平以反应其T细胞应答的水平。
体内抗病毒效果评估实验:以20 mg/kg的剂量单剂尾静脉注射的方式注入HBV转基因小鼠体内,每组4只HBV转基因小鼠。通过眼眶后静脉丛取血的方式监测小鼠血清中的HBsAg水平和HBV DNA水平的变化。HBsAg化学发光检测及HBV DNA定量检测按照试剂盒说明书操作。
2结果
2.1PD-1与PD-L1蛋白的表达、纯化与鉴定
2.1.1PD-1与PD-L1蛋白的表达、纯化本研究成功构建了hPD-1、hPD-L1、mPD-1和mPD-L1四种原核重组表达质粒,通过大肠杆菌系统表达并纯化了这四种蛋白。纯化最终得到蛋白纯度均在85%以上,如图1A所示。
2.1.2PD-1与PD-L1蛋白的生物活性鉴定利用化学发光免疫法分析本研究制备的PD-1和PD-L1之间的相互作用活性,人和小鼠的PD-1/PD-L1进行同种属及种属间的相互配对检测,结果如图1B所示,hPD-1与mPD-L1的结合力最强,hPD-1与hPD-L1、mPD-1与mPD-L1两者结合力都较强且强度相当,mPD-1与hPD-L1的结合力最弱。此结果表明,重组表达的4种蛋白具备很好的生物活性,可作为免疫原用于制备特异的Anti-PD-L1小鼠抗体,并为后续的抗体性质评估提供基础。
2.2Anti-PD-L1单克隆抗体性质鉴定
2.2.1Anti-PD-L1单抗与重组抗原反应性鉴定本研究共计制备了8株稳定分泌鼠Anti-PD-L1的单克隆抗体杂交瘤细胞株(Ab1-Ab8),分别将重组蛋白hPD-L1和mPD-L1包被于96孔化学发光板,将抗体浓度稀释至0.1 μg/ml,利用间接法CLEIA鉴定这8株单抗的反应性,结果如图2A所示,与无关对照单抗相比,8株单抗均具有特异的反应活性,其中Ab5和Ab6两株单抗与人和小鼠的PD-L1具有较强的交叉反应活性。
2.2.2Anti-PD-L1单抗阻断hPD-1/hPD-L1、mPD-1/mPD-L1结合的活性鉴定基于1.2.4所述方法,通过摸索生物素标记的PD-L1-biotin的浓度,使其在未加入阻断抗体时最终读值为log10(RLU)=6.3,该读值处于仪器设备线性读值范围的中间区域;经过条件优化,最终确定反应条件如下:hPD-1或mPD-1稀释于50 mmol/L 碳酸盐缓冲液至2 μg/ml,100 μl/孔,于4℃过夜包被至96孔化学发光板中; hPD-L1-biotin或mPD-L1-biotin使用20%牛血清稀释至终浓度为2 μg/ml作为工作液,抗PD-1或抗PD-L1单抗初始浓度为20 μg/ml,3倍梯度稀释,检测稀释的抗体对人和小鼠的PD-1/PD-L1的阻断效果。
对8株Anti-PD-L1单抗的阻断活性进行评估,结果如图2B所示,5株抗体人和小鼠PD-1/PD-L1均显示出不同程度的阻断效果,其中Ab5与Ab6株单抗对人和小鼠PD-1/PD-L1的相互作用均显示出较为显著的阻断效果。
2.3Anti-PD-L1抗体的体内外功能初步研究挑选对人和小鼠PD-1/PD-L1阻断活性较强的Ab5与Ab6两株抗体进行体内外功能评估。本实验基于慢乙肝患者的PBMC体外刺激培养系统,评估Ab5和Ab6对其γ干扰素分泌的影响,该刺激系统中同时在培养基中加入去类毒素的HBV核心蛋白可刺激HBV-core 特异的T细胞活性,检测其分泌的γ干扰素水平以反映其T细胞应答的水平。每组中的单抗剂量分别为0、1、5、20 μg/ml,以无关单抗作为对照,结果如图3A所示,在刺激培养体系中加入Ab5或Ab6可以刺激慢乙肝患者外周血细胞的γ干扰素分泌,且呈现出一定的剂量依赖性,γ干扰素分泌水平随抗体剂量的升高而上升,提示Ab5和Ab6可增强HBV特异的T细胞的活性,对于逆转慢乙肝患者的HBV免疫耐受状态具有一定的潜力。
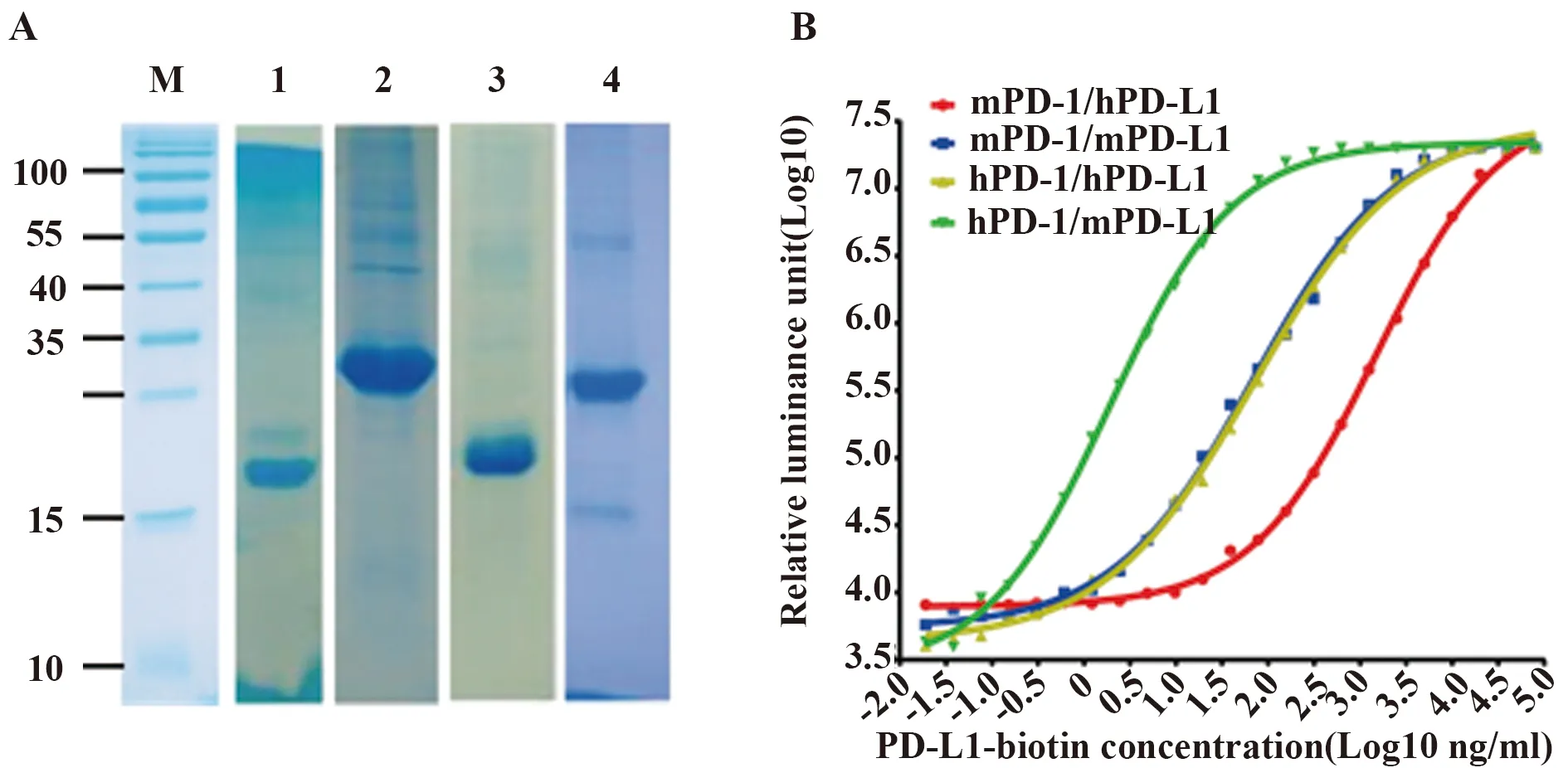
图1 人和小鼠PD-1/PD-L1蛋白纯度与结合活性鉴定Fig.1 Purity and interaction activity of human and mouse PD-1/PD-L1 Note: A.SDS-PAGE analysis of human and mouse recombinant PD-1/PD-L1;M.Protein ladder;1.hPD-1;2.hPD-L1;3.mPD-1;4.mPD-L1;B.The cross interaction between PD-1/PD-L1.
由于Ab5和Ab6可阻断mPD-1/mPD-L1结合,因此可以利用HBV携带小鼠评估其体内的抗病毒活性。本实验所用的模型是基于C57BL/6的HBV转基因小鼠,Anti-PD-L1单抗Ab5和Ab6通过尾静脉,以20 mg/kg的剂量给药后,HBV转基因小鼠血清中的HBsAg和HBV DNA水平均显著下降,其中Ab5治疗效果较优,抗体治疗后48 h,小鼠血清中HBsAg平均水平从7 000 U/ml降至2 000 U/ml,HBV DNA水平从106.60 U/ml降至105.30 U/ml(见图3)。结果显示该抗体在HBV转基因小鼠中具有显著的抗病毒效果,具备一定的治疗应用潜力。
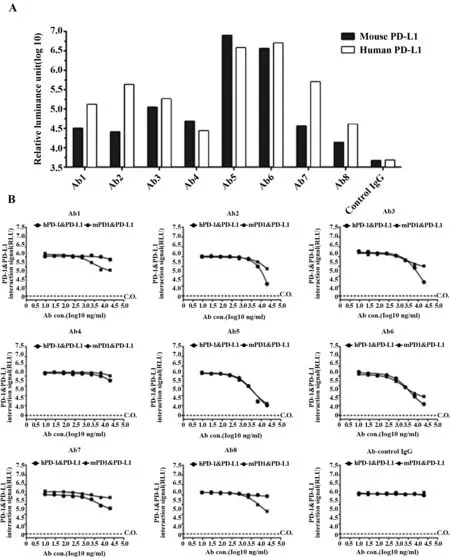
图2 Anti-PD-L1单抗性质鉴定Fig.2 Properties of Anti-PD-L1 mAbNote: A.Analysis of Anti-PD-1 mAb reactivity;B.Blockade efficiency of Anti-PD-L1 mAbs against human and mouse PD1/PD-L1.

图3 Anti-PD-L1单抗治疗后HBV转基因小鼠体内γ干扰素水平和HBsAg水平变化Fig.3 Change of interferon-gamma level and HBV level post Anti-PD-L1 mAbs treatment in HBV transgenic miceNote: A.Change of interferon-gamma level;B.Change of HBsAg level.
3讨论
在持续性病毒感染动物模型中的研究显示,长期暴露于高浓度的抗原会造成不同程度的抗病毒T细胞功能的缺陷,甚至是功能性缺失。慢性HBV感染的病人血清中存在大量的病毒抗原,有研究显示HBV特异的T细胞功能与病毒学水平呈负相关,T细胞耗竭的机制可能在慢乙肝疾病进展中扮演重要角色[8,19,20]。因此,通过抗体阻断PD-1/PD-L1共抑制信号通路,从而增强抗病毒特异的T细胞功能,促进免疫耐受的逆转,可能为慢性乙型肝炎的治疗提供新途径。
本研究采用大肠杆菌表达的人PD-L1蛋白作为免疫原免疫BALB/c小鼠,获得8株稳定分泌Anti-PD-L1的单克隆抗体杂交瘤细胞株,部分抗体与小鼠PD-L1也具有较强的反应活性,其中交叉结合活性最强的两株抗体是Ab5和Ab6,且均可阻断人和小鼠的PD-1/PD-L1结合活性,提示这部分单抗所识别的表位可能在PD-L1蛋白中是种属间保守的,这些交叉反应性抗体的存在,为进一步利用小鼠动物模型评估Anti-PD-L1单抗的治疗作用奠定基础。
Ab5和Ab6在PBMC体外刺激培养系统中可促进慢乙肝病人的T细胞功能,在HBV转基因小鼠中具有显著的抗病毒效果,具备一定的治疗应用潜力。目前的慢性HBV感染治疗药物,如干扰素和核苷类似物,能对HBV相关疾病的发展起一定的控制作用,但它们并不能完全清除病毒感染。抗PD-1/PD-L1类免疫调节单抗的治疗原理,与上述两类药物完全不同,并可能存在互补性,本研究获得的Ab5和Ab6可能为慢乙肝药物的研发提供新的候选分子。
参考文献:
[1]Schweitzer A,Horn J,Mikolajczyk RT,etal.Estimations of worldwide prevalence of chronic hepatitis B virus infection:a systematic review of data published between 1965 and 2013[J].Lancet,2015,386(10003):1546-1555.
[2]Chisari FV,Ferrari C.Hepatitis B virus immunopathogenesis[J].Annu Rev Immunol,1995,13:29-60.
[3]Jung MC,Pape GR.Immunology of hepatitis B infection[J].Lancet Infect Dis,2002,2(1):43-50.
[4]Iwai Y,Terawaki S,Ikegama M,etal.PD-1 inhibits antiviral immunity at the effector phase in the liver[J].J Exp Med,2003,198(1):39-50.
[5]Ishida Y,Agata Y,Shibahara K,etal.Induced expression of PD-1,a novel member of the immunoglobulin gene superfamily,upon programmed cell death[J].EMBO J,1992,11(11):3887-3895.
[6]Chen L.Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity[J].Nat Rev Immunol,2004,4(5):336-347.
[7]Nurieva R,Thomas S,Nguyen T,etal.T-cell tolerance or function is determined by combinatorial costimulatory signals[J].EMBO J,2006,25(11):2623-2633.
[8]Boni C,Boni C,Fisicaro P,etal.Characterization of hepatitis B virus (HBV)-specific T-cell dysfunction in chronic HBV infection[J].J Virol,2007,81(8):4215-4225.
[9]Day CL,Kaufmann DE,Kiepiela P,etal.PD-1 expression on HIV-specific T cells is associated with T-cell exhaustion and disease progression[J].Nature,2006,443(7109):350-354.
[10]Golden-Mason L,Palmer B,Klarquist J,etal.Upregulation of PD-1 expression on circulating and intrahepatic hepatitis C virus-specific CD8+T cells associated with reversible immune dysfunction[J].J Virol,2007,81(17):9249-9258.
[11]Barber DL,Wherry EJ,Masopust D,etal.Restoring function in exhausted CD8 T cells during chronic viral infection[J].Nature,2006,439(7077):682-687.
[12]Maier H,Isogawa M,Freeman GJ,etal.PD-1:PD-L1 interactions contribute to the functional suppression of virus-specific CD8+T lymphocytes in the liver[J].J Immunol,2007,178(5):2714-2720.
[13]Velu V,Titanji K,Zhu B,etal.Enhancing SIV-specific immunity in vivo by PD-1 blockade[J].Nature,2009,458(7235):206-210.
[14]European Association for the Study of the Liver.EASL clinical practice guidelines:Management of chronic hepatitis B virus infection[J].J Hepatol,2012,57(1):167-185.
[15]Niederau C.Chronic hepatitis B in 2014:great therapeutic progress,large diagnostic deficit[J].World J Gastroenterol,2014,20(33):11595-11617.
[16]Tzeng HT,Tsai HF,Liao HJ,etal.PD-1 blockage reverses immune dysfunction and hepatitis B viral persistence in a mouse animal model[J].PLoS One,2012,7(6):e39179.
[17]Bengsch B,Martin B,Thimme R.Restoration of HBV-specific CD8+T cell function by PD-1 blockade in inactive carrier patients is linked to T cell differentiation[J].J Hepatol,2014,61(6):1212-1219.
[18]do Livramento A,Sampaio J,Schultz J,etal.In vitro lymphocyte stimulation by recombinant hepatitis B surface antigen:a tool to detect the persistence of cellular immunity after vaccination[J].J Virol Methods,2013,193(2):572-578.
[19]Crawford A,Angelosanto JM,Kao C,etal.Molecular and transcriptional basis of CD4(+) T cell dysfunction during chronic infection[J].Immunity,2014,40(2):289-302.
[20]Maini MK,Boni C,Lee CK,etal.The role of virus-specific CD8(+) cells in liver damage and viral control during persistent hepatitis B virus infection[J].J Exp Med,2000,191(8):1269-1280.
[收稿2016-03-07]
(编辑倪鹏)
doi:10.3969/j.issn.1000-484X.2016.07.016
作者简介:吴勇(1989年-),男,在读硕士,主要从事乙肝基因型方面研究,E-mail:uncleyong@163.com。 通讯作者及指导教师:袁权(1982年-),男,博士,副教授,主要从事乙型肝炎病毒感染机制方面研究,E-mail:yuanquan@xmu.edu.cn。
中图分类号R392
文献标志码A
文章编号1000-484X(2016)07-1004-06
Development of monoclonal antibodies against PD-L1 and preliminary investigation on potential application in treatment of chronic hepatitis B virus infection
WU Yong,ZHANG Tian-Ying,SONG Liu-Wei,XIA Ning-Shao,YUAN Quan.
State Key Laboratory of Molecular Vaccinology and Molecular Diagnostics,School of Public Health,National Institute of Diagnostics and Vaccine Development of Infectious Diseases,Xiamen University,Xiamen 361102,China
[Abstract]Objective:To get specific monoclonal antibodies (mAbs) against PD-L1 which can block PD-1/PD-L1 binding,and explore the feasibility of its application on the treatment of chronic HBV infection preliminarily by in vitro and in vivo model.Methods: E.coli expression and series chromatography purification system were employed to get human and mouse PD-1/PD-L1 that had binding activity in vitro.By immunizing BALB/c mouse with purified recombination proteins of PD-L1,mAb hybridoma cell lines against PD-L1 were obtained.The reactivity with human/mice PD-L1 of individual antibody and the interaction blocking activity of the mAbs to PD-1/PD-L1 in vitro were examined by indirect chemiluminescence immune assay.Results: 8 cell lines against PD-L1 were obtained and 2 Anti-PDL1 mAbs (Ab5 & Ab6) performed strong immune activity to human/mice PD-L1 and blocking activity to PD-1/PD-L1.In the PBMC stimulation experiment of chronic HBV patient,Ab5 and Ab6 could promote the γ-IFN levels.With HBV infecting mice model,intravenous injections of these mAbs induced dramatically decrease of HBV DNA copies about 20 times,HBsAg levels in serum reduced to 30% of the baseline level.Conclusion: We obtained 2 PD-L1 mAbs with the reactivity to human/mice PD-L1 and blocking activity to PD-1/PD-L1.The 2 mAbs can promote T cell function in PBMC stimulation culture of chronic HBV patient,have significant antiviral effect in HBV transgenic mice and can be candidates for immunotherapy applications.
[Key words]PD-L1;Therapeutic monoclonal antibodies;HBV;Immunotherapy
·免疫学技术与方法·
①本文为国家级科技重大专项(No.2013ZX10002002-001)。
②厦门大学生命科学学院,厦门361102。
③厦门万泰凯瑞生物技术有限公司,厦门361000。
