上海地区幽门螺杆菌的检出率及耐药性分析
2016-08-08胡玢婕赵付菊柴子岚保志军杨长青王一飞张艳梅
胡玢婕, 赵付菊, 柴子岚, 保志军, 项 平, 杨长青, 王一飞, 方 毅, 张艳梅,赵 虎
上海地区幽门螺杆菌的检出率及耐药性分析
胡玢婕1, 赵付菊1, 柴子岚1, 保志军*, 项平*, 杨长青2, 王一飞2, 方毅1, 张艳梅1,赵虎1
摘要:目的 了解幽门螺杆菌的阳性检出率及其影响因素,分析上海2所医院幽门螺杆菌临床分离菌株对一线治疗幽门螺杆菌抗菌药物的耐药性,为临床幽门螺杆菌根治提供用药依据。方法 收集上海2所医院2013年9月—2015年1月临床胃组织活检样本,进行幽门螺杆菌分离培养和鉴定;采用E试验法对131株幽门螺杆菌临床菌株分别进行4种治疗幽门螺杆菌的一线抗菌药物克拉霉素、甲硝唑、阿莫西林和四环素的体外药敏试验。结果 共收集955例胃组织活检样本,分离出幽门螺杆菌248株,检出率为26.0%。幽门螺杆菌对克拉霉素、甲硝唑、四环素和阿莫西林的耐药率分别为14.5%、64.1%、0和0.8%,对上述药物中的2种同时耐药占10.7%(14/131),其中92.8%(13/14)为克拉霉素和甲硝唑同时耐药。结论 幽门螺杆菌阳性检出率较以前报道的阳性携带率低,且与性别、年龄与疾病类型等因素相关,而耐药率则与之无明显相关性。幽门螺杆菌的临床治疗应根据体外药敏结果进行个体化用药。
关键词:幽门螺杆菌; 阳性检出率; 耐药性; 药敏试验
幽门螺杆菌(Helicobacter pylori)是胃部感染最常见的病原体[1],其在人类胃表面黏膜上皮细胞和黏液层的长期定植是慢性活动性胃炎和消化性溃疡的主要发病原因,也是导致胃部恶性肿瘤以及黏膜相关性淋巴样组织淋巴瘤的重要危险因子[2]。目前根除幽门螺杆菌的一线治疗方案首选含质子泵抑制剂(proton pump inhibitor, PPI)和2种抗菌药物(克拉霉素+阿莫西林/甲硝唑)的三联疗法[3]。然而,随着近年来抗菌药物的广泛使用以及治疗的不规范,幽门螺杆菌的临床根除率不断下降[4]。幽门螺杆菌对不同抗菌药物的耐药率逐渐增长的同时,也在世界范围内呈现出明显的地域差异。克拉霉素作为临床治疗幽门螺杆菌感染最常用的抗菌药物之一,在美洲地区显示出较高的耐药率(29.3%),在部分亚洲地区则具有较低的耐药水平(2.1%)[5];而在全国范围内,广东、广西两省临床菌株的耐药率(26%)[6-7]亦显著高于北方省市(4%~9%)[8-9]。
因此,对某一地区幽门螺杆菌的耐药性进行检测与分析,根据不同抗菌药物的耐药率指导本地区幽门螺杆菌的根除方案,具有重要的临床价值。本研究采用E试验法,选取克拉霉素、甲硝唑、阿莫西林和四环素4种一线抗菌药物,对2所医院临床分离的幽门螺杆菌菌株进行体外药敏试验,并对其培养影响因素和耐药特点进行分析,以更好地了解幽门螺杆菌的耐药情况,避免反复治疗和继发性多重耐药,为合理用药提供临床依据。
1 材料与方法
1.1材料
1.1.1 病例来源 选取2013年9月—2014年7月复旦大学附属华东医院和2014年8月—2015 年1月同济大学附属同济医院接受胃镜检查患者955例,年龄19~88岁,平均(53.9±13.0)岁;其中男性444例(46.5%),年龄19~88岁,平均(54.0±14.3)岁;女性511例(53.5%),年龄19~87岁,平均(54.0±13.7)岁。
1.1.2 纳入标准[10-11]①年龄不限,性别不限;②有消化道症状,如腹痛、腹胀、反酸、嗳气、恶心等;③无消化道急症,如胃穿孔、消化性溃疡大出血、呕血、急性胰腺炎等;④未接受胃大部切除术,胃黏膜组织完整;⑤近1个月内未使用对幽门螺杆菌有杀灭作用的抗菌药物、铋剂、H2受体拮抗剂及PPI;⑥无同时服用非甾体抗炎药(NSAID)或酗酒;⑦患者同意取胃黏膜组织标本进行幽门螺杆菌培养及药敏试验;⑧能够获取患者的一般情况资料,并记录年龄、性别、主诉和临床诊断结果等。
1.1.3 质控菌株 幽门螺杆菌标准菌株ATCC43504,NCTC11637(上海北诺生物科技有限公司)。
1.1.4 主要试剂 CM0331哥伦比亚琼脂干粉、CM1135脑心浸液琼脂干粉(OXOID LTD, UK);新鲜无菌脱纤维绵羊血(上海诸翟路耀英羊血供应站);5%羊血+MH琼脂培养基(上海科玛嘉微生物技术有限公司);万古霉素、甲氧苄啶、多黏菌素B和两性霉素B(Sigma-Aldrich LTD,America);微需氧产气袋及密封培养盒(Mitisubishi三菱化学株式会社);克拉霉素、甲硝唑、阿莫西林和四环素的E试验药敏纸条(BioMérieux LTD,France)。
1.2方法
1.2.1 幽门螺杆菌的分离培养与鉴定 在获得患者同意后,由内镜医师在内镜直视下用灭菌活检钳取距幽门前2~3 cm大弯或小弯处约0.5 cm×0.5 cm胃黏膜组织1块,进行快速尿素酶试验后置入0.9% NaCl溶液的离心管中,于4 h内转送至实验室。胃黏膜组织经全自动研磨仪充分研磨,制成组织匀浆后,用无菌滴管将混悬液接种于幽门螺杆菌选择性培养基(8%无菌脱纤维羊血,0.5%选择性抗菌药物混合液),置于35℃,湿度>95%的微需氧环境下(5% O2、10% CO2、85% N2),培养3~7 d。
培养72 h后观察培养基上菌落形态,挑取疑似幽门螺杆菌菌落(透明细砂样或水滴样,针尖大小,直径0.1~1 mm)进行革兰染色、镜检,显微镜下呈革兰阴性句号状、螺旋状、海鸥状或弯曲短杆状菌,氧化酶、脲酶、触酶均为阳性,即鉴定为幽门螺杆菌[12-14],并分纯进行传代增殖。
1.2.2 幽门螺杆菌的体外药敏试验 用无菌棉签刮取传代纯培养72 h后、无污染、菌落形态良好、镜下形态典型的幽门螺杆菌适量菌落于0.45% NaCl灭菌溶液中,调节菌悬液浓度为2.0麦氏单位(6×108CFU/mL),吸取100 μL菌悬液均匀涂布于MH血琼脂培养基上,分别贴上克拉霉素、甲硝唑、阿莫西林和四环素的E试验条,置于35 ℃,湿度>95%微需氧环境下培养72 h,读取抑菌圈与E试验纸条相交处的数值即为待检幽门螺杆菌对该药物的最低抑菌浓度(MIC)。
根据美国临床和实验室标准化协会(CLSI)2013年版[15]及相关文献[16-17]的判断标准:克拉霉素≥1 mg/L;甲硝唑≥8 mg/L;阿莫西林≥0.5 mg/L;四环素≥1 mg/L,判定为耐药。
2.1幽门螺杆菌阳性检出率及其影响因素
2.1.1 幽门螺杆菌培养检出率 对收集的955份胃活检组织进行微需氧环境下分离培养,共获得幽门螺杆菌248株,培养检出率为26.0%。在幽门螺杆菌临床菌株来源中,男性患者130例(52.4%),女性患者118例(47.6%),患者年龄19~87岁,平均(51.5±13.6)岁。
2.1.2 幽门螺杆菌培养检出率与疾病类型的相关性 幽门螺杆菌在男性患者中的培养检出率略高于女性患者,差异有统计学意义(χ2=4.731,P=0.030);且在不同年龄组之间亦存在差异(χ2=10.232,P=0.017);另外,不同疾病类型的幽门螺杆菌培养检出率之间有显著差异(χ2=49.005,P=0.000);其中,消化性溃疡患者的幽门螺杆菌培养检出率显著高于慢性胃炎患者(χ2=37.888,P=0.000),而不同溃疡类型之间的幽门螺杆菌培养检出率略有差异,但差异无统计学意义(χ2=5.198,P=0.074)。幽门螺杆菌培养的检出率与患者性别、疾病类型的关系见表1、图1。 1.2.3 统计分析 应用Stata 12.0统计软件进行数据统计学分析,选用χ2检验,以P<0.05表示差异有统计学意义。
2 结果

表1 幽门螺杆菌培养检出率与性别、年龄、疾病诊断类型Table 1 Positive rate of H. pylori in gastric mucosa and characteristics of patients
2.2 体外药敏试验结果
2.2.1 幽门螺杆菌对不同抗菌药物的耐药率 对分离出的248株幽门螺杆菌临床菌株复苏、传代,对其中的131株采用E试验法进行体外药敏试验(117株未测定菌株在保存期间死亡,无法成功复苏),菌落形成的抑菌圈均清晰可读,见图2。
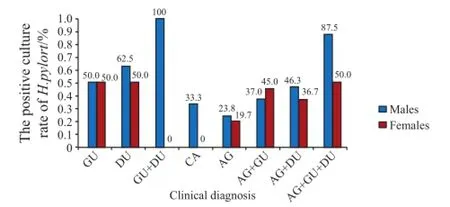
图1 幽门螺杆菌阳性检出率与不同疾病类型的关系Figure 1 Association between prevalence of H. pylori and clinical diagnosis GU: gastric ulcer; DU: duodenal ulcer; GA: gastric cancer; AG:chronic atrophic gastritis.
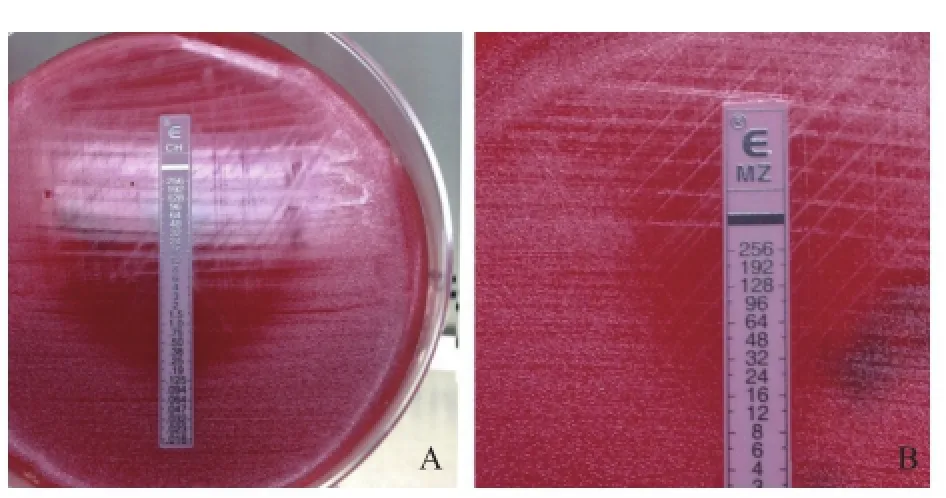
图2 克拉霉素、甲硝唑E试验纸条对待检菌株的抑菌结果Figure 2 E-test results showing the inhibition zone formed by clarithromycin and metronidazole(A)Susceptibility of H.pylori to clarithromycin determind by the E-test; (B)Susceptibility of H.pylori to metronidazole determined by the E-test. The MIC is read from the intersection of the inhibition ellipse with the strip.
在131株菌株中,幽门螺杆菌对临床常用的4种抗菌药物产生不同程度的耐药,其中对克拉霉素、甲硝唑的耐药率分别为14.5%和64.1%,仅1株幽门螺杆菌对四环素耐药(MIC=8 mg/L),而未发现对阿莫西林耐药菌株。幽门螺杆菌对克拉霉素和甲硝唑的耐药率差异有统计学意义(χ2=67.592,P=0.001),见表2。
2.2.2 幽门螺杆菌耐药率与性别的关系比较 不同性别之间幽门螺杆菌对克拉霉素和甲硝唑的耐药率结果显示,不同性别患者体内分离的幽门螺杆菌菌株对2种抗菌药物的耐药率差异均无统计学意义(克拉霉素:χ2=1.147,P=0.284;甲硝唑:χ2=0.002,P=0.967),结果见表3。

表2 E试验法检测幽门螺杆菌对4种抗菌药物的耐药情况(n=131)Table 2 Susceptibility of 131 strains of H. pylori to four antibiotics determined by E-test

表3 不同性别患者幽门螺杆菌对抗菌药物的耐药情况Table 3 Susceptibility of H. pylori strains to 4 antibiotics by patient sex
2.2.3 幽门螺杆菌对抗菌药物的耐药率与疾病类型的关系 消化性溃疡患者中幽门螺杆菌对甲硝唑与克拉霉素的耐药率均略高于慢性胃炎患者(包括慢性萎缩性胃炎和浅表性胃炎),但差异无统计学意义(P>0.05),因胃癌患者例数较少,未进行统计分析,见表4。
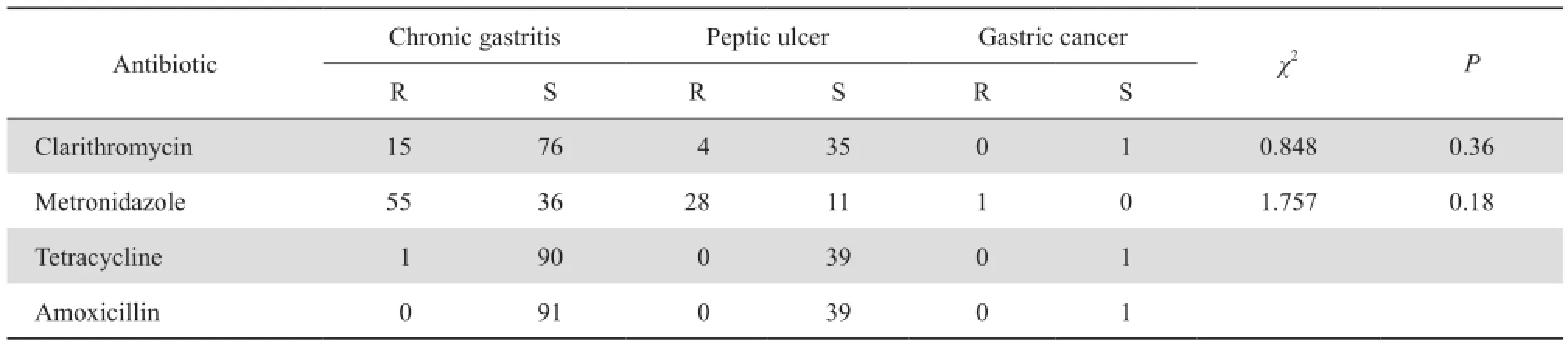
表4 不同疾病类型幽门螺杆菌对抗菌药物的耐药情况Table 4 Susceptibility of H.pylori strains to 4 antibiotics by disease type

表5 不同年龄组幽门螺杆菌对抗菌药物的耐药率Table 5 Susceptibility of H. pylori strains to 4 antibiotics by age group

表6 幽门螺杆菌多重耐药患者基本情况Table 6 Basic information of the patients with a H. pylori strain resistant to at least two antibiotics
3 讨论
自1985年幽门螺杆菌首次被成功分离培养以来,其在自然人群中的高感染率及在消化道疾患中的重要致病作用引起了日益广泛的关注。世界范围内一半以上的人口(在部分发展中国家高达80%)携带此菌[18],而我国幽门螺杆菌的平均感染率亦达到58.07%[10]。另外,诸多研究证实幽门螺杆菌感染是胃肠道疾病发生的重要危险因素,1994年,国际癌症研究机构(International Agency for Research on Cancer, IARC)将幽门螺杆菌列为胃癌的Ⅰ类致癌因子[19],幽门螺杆菌感染已经发展为严重危害人们健康的公共卫生问题。由于阳性检出率低、培养周期长、样本对转送时间要求严格、培养条件和培养环境相对特殊,幽门螺杆菌的分离培养和体外药敏试验在临床上并不作为常规检测;而经验性地制定治疗方案及使用抗菌药物导致了幽门螺杆菌的耐药率呈逐年上升趋势[20],幽门螺杆菌感染的有效控制在临床上仍是巨大挑战。因此,分析幽门螺杆菌的阳性检出率与影响因素,以及特定地区、特定疾病类型的幽门螺杆菌耐药率,有助于进行个体化治疗,提高幽门螺杆菌根除率。
本研究显示,幽门螺杆菌的培养检出率为26.0%,与国内外文献报道基本一致[21-22],但远低于以前报道的幽门螺杆菌携带率[10]。主要原因可能与样本取材的部位、样本运输的条件与方法、培养的条件与方法,以及胃部感染部位幽门螺杆菌的含菌量有关。下一步研究,我们会采集不同部位的胃黏膜样本,并改进样本运输与培养的条件,提高阳性检出率。
本研究中,男性的幽门螺杆菌培养阳性率高于女性,同时中青年人群的幽门螺杆菌培养阳性率略高于老年人群。多数研究认为,幽门螺杆菌的感染与年龄存在正相关性,而幽门螺杆菌的培养阳性率则在一定程度上受样本取材部位的影响,幽门腺组织具有适宜幽门螺杆菌定植的pH条件,并且其主要构成细胞黏液分泌细胞高表达幽门螺杆菌黏附素相关受体及信号转导分子;与中青年相比,老年人群幽门腺在胃体部出现率增加的幅度较胃窦胃角处更为明显,即幽门腺随年龄的增长向胃近端迁移,进而导致幽门螺杆菌感染部位在不同年龄人群中亦存在差异[23]。另外,消化性溃疡的幽门螺杆菌培养阳性率显著高于慢性胃炎,表明上消化道疾病与幽门螺杆菌感染有着密切的关系,其中胃黏膜病变与幽门螺杆菌在胃表面黏膜上皮细胞和黏液层的长期定植具有较高的相关性[24]。幽门螺杆菌分泌的尿素酶水解尿素时产生的NH4+能够直接损伤胃黏膜上皮细胞,并降低黏膜上的电位差,从而影响胃黏膜的离子转运,导致H+反渗,从而加重了胃黏膜组织损伤。另外,幽门螺杆菌还能够诱导各种炎性介质及氧自由基的释放,从而诱导细胞凋亡,形成消化性溃疡[25]。本研究收取的恶性肿瘤患者胃黏膜组织标本较少,幽门螺杆菌感染与恶性肿瘤发生之间的相关性有待进一步研究。
在以往的幽门螺杆菌的根除方案中,克拉霉素、甲硝唑、阿莫西林与四环素常作为一线药物。但一项关于上海地区10年内幽门螺杆菌耐药率变化的最新调查表明,克拉霉素的耐药率由2000年的8.6%上升至2009年的20.7%;甲硝唑的耐药率有小幅下降但仍高达42%[20]。本研究发现,2013—2014年,上海地区幽门螺杆菌对克拉霉素耐药率为14.5%,较2009年有所下降,仍可作为治疗首选药物。然而,克拉霉素在呼吸系统疾病治疗中的大量使用,可能加速了大环内酯类耐药菌株的出现,GAO等[26]研究认为,克拉霉素的继发耐药率在10年间升高趋势明显,因此使用克拉霉素治疗失败的患者在没有体外药敏试验的情况下反复治疗,也容易导致幽门螺杆菌的难治性感染。 幽门螺杆菌对甲硝唑的耐药率为64.1%,仍处于较高的耐药水平。根据MaastrichtⅣ共识,甲硝唑耐药率高于40%的地区,三联疗法的有效性显著降低,但含甲硝唑的疗法可以通过增加剂量、延长时间、联合阿莫西林和使用铋剂等方式改进[20, 27]。本研究提示幽门螺杆菌对四环素的耐药率较低,对阿莫西林无耐药菌株。由于四环素存在较多临床不良反应,在无药敏结果之前,阿莫西林可作为经验用药。
国内外报道的不同性别、年龄、疾病类型幽门螺杆菌分离株对甲硝唑和克拉霉素的耐药率各异。DE FRANCESCO等[5]研究发现女性患者对甲硝唑及克拉霉素的耐药率明显高于男性,且克拉霉素的耐药率在无溃疡消化不良的患者中较高,甲硝唑耐药率在消化性溃疡患者中较高;而浙江义乌的一项研究认为,随着年龄的增长,克拉霉素的耐药率逐渐增加[28]。本研究中,分别比较幽门螺杆菌对各抗菌药物的耐药率与性别、年龄、疾病类型之间的关系,各项差异均无统计学意义。这可能与所获取的菌株总量、疾病来源及地区差异有关。
本研究总结的幽门螺杆菌双重耐药情况显示,双重耐药率为10.7%,多为对克拉霉素和甲硝唑耐药,未发现对2种以上抗菌药物耐药的临床菌株。克拉霉素和甲硝唑作为幽门螺杆菌临床一线抗菌药物外,克拉霉素常用于上呼吸道感染的治疗,而甲硝唑广泛用于妇产科疾病、牙科疾病以及寄生虫感染,可能是幽门螺杆菌对两种抗菌药物耐药的原因之一[26, 29],同时这也可以解释幽门螺杆菌对克拉霉素和甲硝唑的耐药率与性别、年龄之间存在的相关性。
本研究采用E试验法进行体外药敏试验,CLSI推荐的幽门螺杆菌体外药敏试验为琼脂稀释法,但其方法学繁琐,不适合临床常规开展。而E试验条抗菌药物浓度梯度稳定,预孵育、预扩散的时间及接种菌液量的变异对结果影响较小,操作简便,可直接得出定量结果,且在实验室间具有很高的重复性,其测定的MIC与琼脂稀释法所得的MIC相关性高,能够很好地在临床检测中大量开展。
另外,有研究认为幽门螺杆菌对左氧氟沙星的耐药形势同样十分严峻,2009年上海地区该菌对左氧氟沙星耐药率达到32.5%[30],本研究未进行包括左氧氟沙星、莫西沙星、呋喃唑酮等其他常用的幽门螺杆菌根除药物的MIC检测,这一结论需要更多的实验进行验证和评价。
随着幽门螺杆菌耐药率的逐年变化,对比多种药敏试验方法的MIC结果进行耐药监测,同时发展分子生物学检测,使得临床制定幽门螺杆菌个体化用药时能有所依据,对更有效地防治幽门螺杆菌耐药,提高治愈率具有非常重要的意义。
参考文献:
[1]PERETZ A, PARITSKY M, NASSER O, et al. Resistance of Helicobacter pylori to tetracycline, amoxicillin, clarithromycin and metronidazole in Israeli children and adults[J]. J Antibiot (Tokyo), 2014, 67(8):555-557.
[2]YONEZAWA H, OSAKI T, KURATA S, et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in bioflm formation[J]. BMC Microbiol, 2009, 9:197.
[3]MALFERTHEINER P, MEGRAUD F, O'MORAIN C, et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report[J]. Gut, 2007,56(6):772-781.
[4]HOJO M, MIWA H, NAGAHARA A, et al. Pooled analysis on the efficacy of the second-line treatment regimens for Helicobacter pylori infection[J]. Scand J Gastroenterol, 2001,36(7):690-700.
[5]DE FRANCESCO V, GIORGIO F, HASSAN C, et al. Worldwide Helicobacter pylori antibiotic resistance: a systematic review[J]. Gastrointestin Liver Dis, 2010,19(4):409-419.
[6]张晓光,胡品津,李瑜元,等. 广东城乡病人中分离的幽门螺杆菌对常用3种抗菌药物耐药的调查[J]. 新医学,2002,33(5):275-277.
[7]李晓华,黄赞松,黄衍强,等. 桂西地区幽门螺杆菌多重耐药现状和治疗方案分析[J]. 重庆医学,2013,42(14):1578-1580.
[8]张学英,焦健,李岩,等. 48例消化性溃疡患者幽门螺杆菌的耐药性调查[J]. 微生物学杂志,2003,23(2):35-37.
[9]乔文,胡家露,彭道荣,等. 西安地区幽门螺杆菌临床分离株耐药性研究[J]. 中国现代医学杂志,2002,6(3):48-49.
[10]项利娟,朱新建,黄德富,等. 幽门螺杆菌感染调查与耐药性分析[J]. 中华医院感染学杂志,2015,25(8):1710-1712.
[11]成虹,胡伏莲,谢勇,等. 中国幽门螺杆菌耐药状况以及耐药对治疗的影响—全国多中心临床研究[J]. 胃肠病学,2007,12(9):525-530.
[12]SMITH SM, O'MORAIN C, MCNAMARA D. Antimicrobial susceptibility testing for Helicobacter pylori in times of increasing antibiotic resistance[J]. World J Gastroenterol, 2014,20(29):9912-9921.
[13]LLANES R, FELICIANO O, GUZMAN D, et al. Use of a single biopsy specimen for diagnosing Helicobacter pylori infection by culture and two different PCR methods: report from Cuba[J]. Trop Gastroenterol, 2010, 31(2):111-112.
[14]KHADEMI F, FAGHRI J, POURSINA F, et al. Resistance pattern of Helicobacter pylori strains to clarithromycin,metronidazole, and amoxicillin in Isfahan, Iran[J]. J Res Med Sci, 2013, 18(12):1056-1060.
[15]Clinical and laboratory standards institute. Performance standards for antimocrobial susceptibility testing: twenty-third informational supplement[S]. 2013, M100-S23.
[16]MEGRAUD F, LEHN N, LIND T, et al. Antimicrobial susceptibility testing of Helicobacter pylori in a large multicenter trial: the MACH 2 study[J]. Antimicrob Agents Chemother, 1999,43(11):2747-2752.
[17] MEGRAUD F, LEHOURS P.Helicobacter pylori detection and antimicrobial susceptibility testing[J]. Clin Microbiol Rev, 2007,20(2):280-322.
[18]CAMMAROTA G, SANGUINETTI M, GALLO A, et al. Review article: bioflm formation by Helicobacter pylori as a target for eradication of resistant infection[J]. Aliment Pharmacol Ther, 2012, 36(3):222-230.
[19] WONG BC, LAM SK, WONG WM, et al.Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial[J]. JAMA, 2004,291(2):187-194.
[20]SUN QJ, LIANG X, ZHENG Q, et al. Resistance ofHelicobacter pylori to antibiotics from 2000 to 2009 in Shanghai[J]. World Gastroenterol, 2010, 16(40):5118-5121.
[21]TANIH NF, NDIP LM, NDIP RN. Characterisation of the genes encoding resistance to metronidazole (rdxA and frxA) and clarithromycin (the 23S-RNA genes) in South African isolates of Helicobacter pylori [J]. Ann Trop Med Parasitol, 2011,105(3):251-259.
[22]张万岱,胡伏莲,萧树东,等. 中国自然人群幽门螺杆菌感染的流行病学调查[J]. 现代消化及介入诊疗,2010,15(5):265-270.
[23]蔺蓉,熊汉华,钱伟,等. 不同年龄人群幽门腺、幽门螺杆菌胃内分布特点及其关系[J]. 中华消化杂志,2005,25(11):680-681.
[24] SUERBAUM S, MICHETTI P.Helicobacter pylori infection[J]. N Engl J Med, 2002, 347(15):1175-1186.
[25]刘健波,张锦坤. 有关消化性溃疡流行病学问题的近况与发展[J]. 临床消化病杂志,1992,4(2):55-59.
[26]GAO W, CHENG H, HU F, et al. The evolution ofHelicobacter pylori antibiotics resistance over 10 years in Beijing, China[J]. Helicobacter, 2010, 15(5):460-466.
[27]ZHENG Q, CHEN W J, LU H, et al. Comparison of the effcacy of triple versus quadruple therapy on the eradication of Helicobacter pylori and antibiotic resistance[J]. J Dig Dis, 2010,11(5):313-318.
[28]冀子中,金夏,韩丰,等. 不同年龄段临床分离的幽门螺杆菌2311株多重耐药性分析[G]. 2013第六届浙江省消化病学术大会论文汇编:172.
[29]BIERNAT MM, PONIEWIERKA E, BLASZCZUK J, et al. Antimicrobial susceptibility of Helicobacter pylori isolates from Lower Silesia, Poland[J]. Arch Med Sci, 2014, 10(3):505-509.
[30]YU C, LI L, CHEN W, et al. Levofoxacin susceptibility testing for Helicobacter pylori in China: comparison of E-test and disk diffusion method[J]. Helicobacter, 2011, 16(2):119-123.
2.同济大学附属同济医院消化内科。
中图分类号:R378
文献标识码:A
文章编号:1009-7708(2016)03-0346-07
DOI:10.16718/j.1009-7708.2016.03.017
收稿日期:2015-06-15 修回日期:2015-07-08
基金项目:上海市卫生局重点课题基金(20134008);上海申康医院发展中心新兴前沿技术联合攻关项目基金(SHDC12013123);上海市科委自然科学基金(14ZR1413100);上海市科委引导项目基金(14411962800)。
作者单位:1. 复旦大学附属华东医院检验科,上海 200040;*消化内科;
作者简介:胡玢婕(1990—),女,硕士研究生,主要从事细菌耐药机制研究。
通信作者:赵虎,E-mail:hubertzhao@163.com。
Prevalence and antibiotic resistance profle of Helicobacter pylori in Shanghai
HU Binjie, ZHAO Fuju, CHAI Zilan, BAO Zhijun, XIANG Ping, YANG Changqing, WANG Yifei, FANG Yi,ZHANG Yanmei, ZHAO Hu. (Department of Laboratory Medicine, Huadong Hospital of Fudan University,Shanghai 200040, China)
Abstract:Objective To examine the prevalence of Helicobacter pylori in Shanghai and relevant risk factors, evaluate the resistance profle of H. pylori isolates to antibiotics used in frst-line therapy in two hospitals in Shanghai. Methods H. pylori were isolated from the biopsy samples of gastric mucosa collected from September 2013 to January 2015. Antimicrobial susceptibility test was performed by E-test method for 131 H. pylori strains to 4 antibiotics, clarithromycin, metronidazole, amoxicillin and tetracycline. Results A total of 955 patients receiving gastroscopy were enrolled. And 248 (26.0%) H. pylori strains were isolated from the biopsy samples of gastric mucosa. Overall, 14.5%, 64.1%, 0 and 0.8% of the strains were resistant to clarithromycin, metronidazole,amoxicillin and tetracycline, respectively. Resistance to two drugs was found in 10.7%(14/131) of the strains, and majority (92.8%,13/14) of which were resistant to clarithromycin and metronidazole. Conclusions The prevalence of H. pylori in gastric mucosa is rather lower compared with the data reported previously. It is associated with the sex, age and clinical outcome of patients, however, antibiotic resistance profile is not related to these factors. H. pylori eradication therapy should be individualized according to the results of susceptibility test in Shanghai.
Key words:Helicobacter pylori; prevalence; antibiotic resistance; antimicrobial susceptibility test
