2005
—2014年CHINET克雷伯菌属细菌耐药性监测
2016-08-08苏丹虹胡付品朱德妹蒋晓飞徐英春张小江孙自镛陈中举倪语星孙景勇胡志东张朝霞王传清王爱敏徐元宏0沈继录0魏莲花胡云建艾效曼俞云松黄文祥禇云卓田素飞韩艳秋郭素芳
徐 安, 卓 超, 苏丹虹, 胡付品, 朱德妹, 汪 复, 蒋晓飞, 徐英春, 张小江,孙自镛, 陈中举, 倪语星, 孙景勇, 胡志东, 李 金, 张朝霞, 季 萍, 王传清,王爱敏, 杨 青, 徐元宏0, 沈继录0, 单 斌, 杜 艳, 张 泓, 孔 菁, 魏莲花,吴 玲, 谢 轶, 康 梅, 胡云建, 艾效曼, 俞云松, 林 洁, 黄文祥, 贾 蓓,禇云卓, 田素飞, 韩艳秋, 郭素芳
2005
—2014年CHINET克雷伯菌属细菌耐药性监测
徐安1, 卓超1, 苏丹虹1, 胡付品2, 朱德妹2, 汪复2, 蒋晓飞2, 徐英春3, 张小江3,孙自镛4, 陈中举4, 倪语星5, 孙景勇5, 胡志东6, 李金6, 张朝霞7, 季 萍7, 王传清8,王爱敏8, 杨青9, 徐元宏10, 沈继录10, 单斌11, 杜艳11, 张泓12, 孔菁12, 魏莲花13,吴 玲13, 谢轶14, 康梅14, 胡云建15, 艾效曼15, 俞云松16, 林洁16, 黄文祥17, 贾蓓17,禇云卓18, 田素飞18, 韩艳秋19, 郭素芳19
摘要:目的 了解2005—2014年CHINET细菌耐药性监测网所属19所医院临床分离克雷伯菌属细菌的分布及耐药性变迁情况。方法 采用纸片扩散法或自动化仪器法对临床分离株作药物敏感性试验,并按CLSI 2014年版标准判断药敏试验结果。结果 2005—2014年共收集19所医院临床分离的肺炎克雷伯菌56 281株、产酸克雷伯菌4 779株、肺炎克雷伯菌臭鼻亚种300株及其他克雷伯菌属细菌46株。其中89.0%菌株(54 664/61 406)分离自住院患者。60.0%菌株(36 835/ 61 406)分离自呼吸道。成人来源的克雷伯菌属占83.3%(51 158/61 406),儿童(0~17岁)占16.7%(10 248/61 406)。10年间,克雷伯菌属细菌的检出率呈逐年上升趋势:2005年为10.1%,2014年为14.3%。药敏试验结果显示,10年里克雷伯菌属对碳青霉烯类药物耐药率呈上升趋势,对亚胺培南和美罗培南耐药率分别从2.9%上升到10.5%和2.8%上升到13.4%。产ESBL肺炎克雷伯菌和产酸克雷伯菌检出率从39.0%下降到30.1%。细菌对阿米卡星、环丙沙星、头孢他啶、哌拉西林-他唑巴坦和头孢哌酮-舒巴坦耐药率呈下降趋势,对头孢噻肟耐药率波动幅度较小,维持在49.5%左右。共检出碳青霉烯类耐药菌5 796株,其中肺炎克雷伯菌5 492株,产酸克雷伯菌280株。分离出广泛耐药菌共4 740株,其中肺炎克雷伯菌4 520株,产酸克雷伯菌202株。碳青霉烯类耐药株对绝大多数其他测试的抗菌药物耐药率均在60%以上,对替加环素、阿米卡星、甲氧苄啶-磺胺甲�唑耐药率分别为16.8%、54.4%、55.1%。结论 临床分离克雷伯菌属细菌对碳青霉烯类抗生素的耐药率10年间呈较大幅度增加,对其他常用抗菌药物耐药率较为平稳。
关键词:克雷伯菌属; 耐药性; 监测
CHINET细菌耐药性监测网自2005年起建立,对我国多个地区临床分离菌的耐药情况进行连续监测,目前已有11个省市、自治区19所教学医院加入该监测网。现将2005—2014年CHINET收集的克雷伯菌属细菌对临床常用抗菌药物的耐药性和敏感性结果总结如下。
1 材料与方法
1.1材料
1.1.1 细菌 2005—2014年CHINET细菌耐药性监测网所属19所医院连续收集的非重复临床分离株。
1.1.2 培养基和抗菌药物纸片 药敏试验用MH琼脂、抗菌药物纸片为美国BBL或英国OXOID公司产品。部分按照各医院自动化仪器测定。
1.2方法
1.2.1 药敏试验 参照CLSI推荐的药敏试验方法,采用纸片扩散法(K-B法)或自动化仪器法。质控菌株为大肠埃希菌ATCC 25922和肺炎克雷伯菌ATCC 700603。结果参照CLSI药敏试验判断标准M100-S24[1]。替加环素药敏折点参照2013年美国FDA标准中肠杆菌科细菌的MIC折点(抑菌圈直径≤2 mg/L为敏感,≥8 mg/L为耐药),K-B法折点(抑菌圈直径≤14 mm为敏感,≥19 mm为耐药)[2]。
1.2.2 ESBL确定试验 按CLSI推荐的纸片法筛选和酶抑制剂增强确证试验检测克雷伯菌属中产ESBL菌株。
1.2.3 统计分析 药敏结果采用WHONET 5.6软件统计分析。
1.2.4 相关定义 广泛耐药(XDR):除1~2类抗菌药物外,几乎对所有类别抗菌药物不敏感(在推荐进行药敏测定的每类抗菌药物中至少1种不敏感,即认为此类抗菌药物耐药)。碳青霉烯类耐药肠杆菌科细菌(CRE)的定义:对亚胺培南、美罗培南或厄他培南任一种药物不敏感者[3]。
2 结果
2.1细菌分布
CHINET自2005年创立以来,由8所监测网点医院增加至2014年19所医院,期间共收集克雷伯菌属非重复株61 406株,其中肺炎克雷伯菌56 281株、产酸克雷伯菌4 779株、肺炎克雷伯菌臭鼻亚种300株及其他克雷伯菌属细菌46株。89.0%菌株(54 664/61 406)分离自住院患者,儿童(0~17岁)来源的克雷伯菌属占16.7%(10 248/61 406),成人来源的克雷伯菌属占83.3%(51 158/61 406)。10年间,克雷伯菌属细菌的检出率呈逐年上升趋势:2005年为10.1%,2014年为14.3%,见表1。10年间收集菌株主要来源于呼吸道标本(60.0%,36 835/ 61 406),其次为尿液(14.9%,9 165/61 406),血液(8.3%,5 102/61 406),伤口、脓液和分泌物(6.4%,3 931/61 406)。其中血标本来源菌株由2005年5.2%逐年上升至2013年11.3%,2011年之后上升幅度较明显,2014年回落至10.3%。
2.2药敏试验
2.2.1 克雷伯菌属细菌 10年间克雷伯菌属对亚胺培南、美罗培南和厄他培南最敏感,耐药率分别为7.9%、8.8%和11.0%,其次为阿米卡星13.1%、头孢哌酮-舒巴坦14.6%和哌拉西林-他唑巴坦15.5%。对环丙沙星类耐药率约为26.3%。对青霉素类,第一代、二代、三代头孢菌素(头孢他啶除外)的耐药率,均维持在50%以上。
动态观察,2005—2014年克雷伯菌对碳青霉烯类药物耐药率呈上升趋势,尤以2009年后上升幅度大。其中,亚胺培南耐药率从2005年2.9%上升至2014年10.5%。美罗培南耐药率从2005年2.8%上升至2014年13.4%。相反,哌拉西林-他唑巴坦和头孢哌酮-舒巴坦耐药率分别从27.6%和22.5%下降到13.9%和16.1%。对阿米卡星、环丙沙星和头孢他啶耐药率分别从27.8%、40.5%和 33.1%下降到9.0%、22.4%和29.1%。对头孢噻肟耐药率波动幅度小,维持在49.5%左右。对庆大霉素、头孢吡肟、头孢西丁耐药率波动幅度分别为15.9%、11.4%、9.6%。2012年开始对替加环素的MIC进行监测,克雷伯菌属细菌对替加环素保持90%以上敏感率,耐药率由起始3.9%上升至2014年5.4%。见表2。

表1 克雷伯菌属细菌在所有临床分离株中的检出率Table 1 Prevalence of Klebsiella spp. among all clinical isolates

表2 克雷伯菌属细菌对常见抗菌药物敏感率和耐药率Table 2 Susceptibility of Klebsiella species to antimicrobial agents during the period from 2005 through 2014
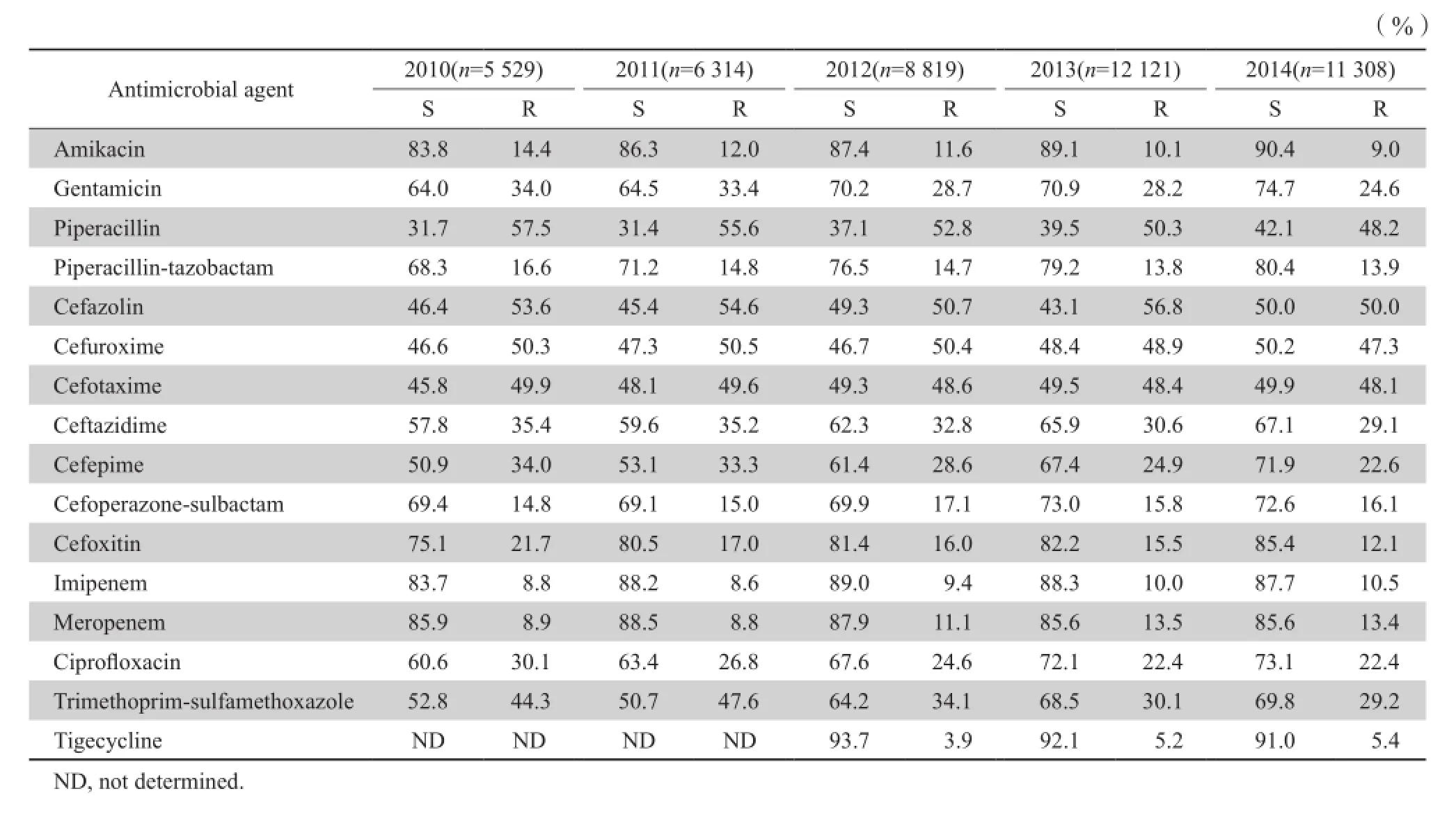
表2 (续)Table 2 (continued)
2.2.2 产和非产ESBL株 61 406株克雷伯属细菌中有 53 121株进行了ESBL检测,其中18 814株肺炎克雷伯菌和1 009产酸克雷伯菌产ESBL,产酶检出率分别为38.7%和25.0%。各年产ESBL肺炎克雷伯菌和产酸克雷伯菌检出率分别为:2005 为39.0%,2006年从45.2%逐年下降到2011年37.6%,2012年从39.9%下降到2014年30.1%,总体呈下降趋势。各年药敏结果均显示产ESBL株对抗菌药物耐药率大多高于非产ESBL株,对碳青霉烯类敏感率在85%以上,其次为阿米卡星、头孢哌酮-舒巴坦和哌拉西林-他唑巴坦及头孢西丁,其中替加环素对1 213株产ESBL株MIC结果显示,敏感率为83.5%,耐药率10.4%。见表3。
2.2.3 儿童分离株 本次对10 248株分离自儿童克雷伯菌属细菌进行监测,结果显示儿童株碳青霉烯类药物耐药率明显上升。亚胺培南和美罗培南耐药率分别从2005年的1.3%和0上升至2014年的14.6%和15.2%。对头孢噻肟耐药率从59.7%上升至64.0%。其他药物耐药率波动幅度也较大,见表4。
2.2.4 碳青霉烯类耐药克雷伯菌属细菌 本次监测共检出碳青霉烯类耐药5 796株,其中肺炎克雷伯菌5 492株,产酸克雷伯菌280株。分离出广泛耐药菌共4 740株,其中肺炎克雷伯菌4 520株,产酸克雷伯菌202株。本次监测显示我国碳青霉烯类耐药克雷伯属细菌流行存在地域性差异,全国碳青霉烯类耐药克雷伯属菌分离率为9.4%,其中,华东和西南地区碳青霉烯类耐药株分离率较高,分别为15.7%和10.5%;华南、华北、西北分别为4.3%、4.0%、4.2%;东北地区最低,为1.7%。儿童碳青霉烯类耐药株检出率高于成人,平均为9.7%( 998/10 248)对9.4%(4 798/51 158)。90.4%( 5 239/5 796)碳青霉烯类耐药株来源于住院患者,住院患者碳青霉烯类耐药株检出率为9.6%( 5 239/54 664),非住院患者检出率为8.3%( 557/6 742)。38.0% (2 205/5 796)碳青霉烯耐药株来源于ICU包括中心ICU、脑外科ICU、急诊ICU。ICU碳青霉烯耐药株检出率为23.7%( 2 205/9 317),非ICU碳青霉烯耐药株检出率为6.9%( 3 591/52 089)。碳青霉烯耐药株中50.3%( 2 916/5 796)来源于痰液标本,其次为尿液16.3%( 947/5 796),血液13.3%( 769/5 796)。碳青霉烯类耐药克雷伯菌属痰标本检出率为7.9%(2 916/ 36 835),尿液检出率为10.3%(947/9 165),血液检出率15.1% (769/5 102)。药敏结果显示,碳青霉烯类耐药株对绝大多数抗菌药物耐药率均在60%以上,仅替加环素、阿米卡星、甲氧苄啶-磺胺甲唑敏感率在30%以上,广泛耐药株耐药情况相似,见表5。

表3 产ESBL和非产ESBL克雷伯属细菌对常见抗菌药物敏感率和耐药率Table 3 Susceptibility of ESBL(+) and ESBL(-) Klebsiella strains to the commonly used antimicrobial agents

表4 儿童克雷伯菌属细菌分离株对常见抗菌药物敏感率和耐药率Table 4 Susceptibility of the Klebsiella strains from children to antimicrobial agents during the period from 2005 through 2014 (%)

表4 (续)Table 4 (continued)

表5 碳青霉烯类耐药和广泛耐药克雷伯菌属细菌分离株对常见抗菌药物敏感率和耐药率Table 5 Susceptibility of the carbapenem-resistant and extensively-drug resistant Klebsiella strains to antimicrobial agents (%)
肺炎克雷伯菌是引起医院感染最常见的病原菌之一,同时也是革兰阴性杆菌血流感染第二大常见病原菌。近年来高致病性肺炎克雷伯菌引起致命性的社区获得性感染也备受关注,健康人群发病率较高,包括肺炎克雷伯菌肝脓肿、肺炎、脑膜炎、眼内炎等[4-5]。
2005—2014年CHINET细菌耐药性监测结果显示克雷伯菌属细菌主要来源于呼吸道标本,约占60%,各年分离率波动幅度小。血标本来源菌株占比由5.2%上升至10.3%,可能与医院血培养送检率增高有关。
药敏结果显示,产ESBL肺炎克雷伯菌和产酸克雷伯菌检出率从39.0%下降到30.1%,可能与其产生如KPC 、OXA以及IPM等碳青霉烯酶、ESBL、AmpC酶或合并外膜孔蛋白的丢失及外排泵高表达等耐药机制有关;这些机制可导致用CLSI推荐的ESBL筛选试验和确定试验无法正确检测ESBL[6-7]。产ESBL菌株对青霉素类、头孢菌素类、氨基糖苷类、喹诺酮类和甲氧苄啶-磺胺甲唑等抗菌药物的耐药率显著高于非产ESBL菌株,主要由于产ESBL菌株存在由质粒介导的CTX耐药基因,并同时携带AmpC酶、氨基糖苷类钝化酶和喹诺酮类耐药基因导致细菌呈多重耐药[8-9]。
近10年肠杆菌科细菌对碳青霉烯类药物耐药率呈稳定上升趋势,其中克雷伯菌属细菌占最大比例[10-11],本研究结果与之一致。克雷伯菌属细菌对碳青霉烯类抗生素耐药主要由产碳青霉烯酶(如产A类KPC酶和B类MBL酶)导致,菌株可同时具有或不具有ESBL、AmpC β内酰胺酶、外排泵、膜孔道蛋白突变等耐药机制,多呈现广泛耐药现象[11-12]。我国肠杆菌科细菌产碳青霉烯酶的常见类型为A类KPC酶(KPC-2),尚有金属酶IMP及VIM,NDM-1偶见[13]。本次研究发现,我国碳青霉烯类耐药克雷伯菌属细菌流行存在地域性差异,华东地区碳青霉烯类耐药株分离率最高,为15.7%;其次为西南和华中,分别为10.5%和6.3%;东北地区最低,为1.7%。既往研究表明,产碳青霉烯酶类药物水解酶(KPC-2)及ST11(ST258变异体)克隆株流行是导致华东地区克雷伯菌属对碳青霉烯类耐药的重要原因[13-14]。本研究发现,分离自ICU患者碳青霉烯耐药株检
3 讨论
出率23.7%,明显高于非ICU患者6.9%;儿童碳青霉烯类耐药株检出率高于成人,分别为9.7%、9.4%;儿童克雷伯菌属分离株对碳青霉烯类药物耐药率呈明显上升趋势。既往研究表明,碳青霉烯类耐药肠杆菌科细菌感染主要与患者的一般情况差、以往抗菌药物的使用、入住ICU、实质脏器或血液移植、外科手术、导管和引流管留置及老年等因素有关[12]。尽管有关儿童克雷伯菌属对碳青霉烯类耐药相关报道很少,但少部分研究资料表明儿童CRE产生可能与医院感染、肺部疾病、早产儿、极低体重儿、血液肿瘤等有关[15]。本次研究中发现,碳青霉烯类耐药株对绝大多数抗菌药物耐药率均在60%以上,仅对替加环素、阿米卡星、甲氧苄啶-磺胺甲唑等敏感,与有关报道相一致[16-17]。碳青霉烯类耐药株的出现给公共卫生带来重大威胁,给临床抗菌药物合理经验治疗带来巨大挑战[11-12]。因此,加强抗生素临床应用管理,提高细菌耐药监测水平,提高感染防控措施等至关重要[18]。
2012年开始对克雷伯菌属细菌进行替加环素药物敏感性监测,采用2013美国FDA标准结果进行分析。替加环素对5 351株克雷伯菌属细菌MIC结果显示,替加环素耐药率从2012年3.9%上升至2014年5.4%,总体水平为4.6%,其中124株碳青霉烯类耐药克雷伯菌对替加环素耐药率约为16.8%。TEST全球替加环素药敏监测系统数据资料显示,2004—2013年全球肺炎克雷伯菌和产酸克雷伯菌对替加环素耐药率为0.8%和0.2%,碳青霉烯类耐药肺炎克雷伯菌为2.1%[16],2007—2012年来自中东和非洲国家124株碳青霉烯类耐药肺炎克雷伯菌对替加环素耐药率为0.8%[19]。本研究中共12所医院进行了替加环素药敏检测,其中5所医院采用仪器检测,7所医院采用纸片法进行检测。获得的耐药率为0~40%,其中采用自动化仪器测MIC法获得耐药率为3.6%~8.3%,与相关文献报道存在差异[16-19]。肉汤稀释法、琼脂稀释法、E试验法、自动化仪器法和纸片法对替加环素药敏结果存在差异,与培养基的类型、配制时间、检测方法等因素有关,会造成结果判读的误差,导致替加环素的敏感率被低估[20]。建议各实验室规范药敏试验操作,统一检测方法,保证结果的有效和准确[20]。
参考文献
[1]Clinical and Laboratory Standards Institute. PerformanceStandards for Antimicrobial Susceptibility Testing [S]. Twenty-Fourth Informational Supplement, 2014, M100-S24.
[2]Pifzer Inc.TygacilProduct Insert.Philadelphia, PA, 2013[Z/OL]. [2015-04-20]. http://www.pfzerpro.com/hcp/tygacil.
[3]MAGIORAKOS AP, SRINIVASAN A, CAREY RB, et al . Multidrug-resistant, extensively drug-resistant and pandrugresistant bacteria: an international expert proposal for interim standard definitions for acquired resistance [J]. Clin Microbiol Infect, 2012, 18(3):268-281.
[4]SHON AS, BAJWA RP, RUSSA TA, et al. Hypervirulent (hypermucoviscous) Klebsiella pneumoniae: a new and dangerous breed[J]. Virulence, 2013, 4(2):107-118.
[5]LIU YM, LI BB, ZHANG YY, et al. Clinical and molecular characteristics of emerging hypervirulent Klebsiella pneumoniae bloodstream infections in mainland China[J]. Antimicrob Agents Chemother, 2014, 58(9):5379-5385.
[6]卓超,苏丹虹,倪语星,等. 2010年中国CHINET克雷伯菌属细菌耐药性监测[J].中国感染与化疗杂志,2012,12(3):174-179.
[7]TSAKRIS A, POULOU A, THEMELI-DIGALAKI K, et al. Use of boronic acid disk tests to detect extended- spectrum betalactamases in clinical isolates of KPC carbapenemase-possessing Enterobacteriaceae[J]. J Clin Microbiol, 2009, 47(11):3420-3426.
[8]CHONG Y, ITO Y, KAMIMURA T. Genetic evolution and clinical impact in extended-spectrum β-lactamase-producing Escherichia coli and Klebsiella pneumoniae[J]. Infect Genet Evol, 2011, 11(7):1499-1504.
[9]CURELLO J, MACDOUGALL C, et al. Beyond susceptible and resistant, part Ⅱ: treatment of infections due to gram-negative organisms producing extended-spectrum β-lactamases[J]. J Pediatr Pharmacol Ther, 2014, 19(3):156-164.
[10]XU Y, GU B, HUANG M, et al. Epidemiology of carbapenem resistant Enterobacteriaceae (CRE) during 2000-2012 in Asia [J]. J Thorac Dis, 2015,7(3):376-385.
[11]PETROSILLO N, GIANNELLA M, LEWIS R, et al. Treatment of carbapenem-resistant Klebsiella pneumoniae: the state of the art[J]. Expert Rev Anti Infect Ther, 2013, 11(2):159-177.
[12]TEMKIN E, ADLER A, LEMER A, et al. Carbapenem-resistant Enterobacteriaceae: biology, epidemiology, and management [J]. Ann N Y Acad Sci, 2014, 1323:22-42.
[13]MUNOZ-PRICE LS, POIREL L, BONOMO RA, et al. Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases [J]. Lancet Infect Dis, 2013, 13(9):785-796.
[14]QI Y, WEI Z, JI S, et al. ST11, the dominant clone of KPC-producing Klebsiella pneumoniae in China[J]. J Antimicrob Chemother, 2011, 66(2):307-312.
[15]PANNARAJ PS, BARD JD, CERINI C, et al. Pediatric carbapenem-resistant Enterobacteriaceae in Los Angeles,California, a high-prevalence region in the United States[J]. Pediatr Infect Dis, 2015, 34(1):11-16.
[16]HOBAN DJ, REINERT RR, BOUCHILLON SK, et al . Global in vitro activity of tigecycline and comparator agents: Tigecycline Evaluation and Surveillance Trial 2004-2013[J]. Ann Clin Microbiol Antimicrob, 2015, 14:27.
[17]ZAVASCKI AP, BULITTA JB, LANDERSDORFER CB. Combination therapy for carbapenem-resistant Gram-negative bacteria[J]. Expert Rev Anti Infect Ther, 2013, 11(12):1333-1353.
[18]KHABBAZ RF, MOSELEY RR, STEINER RJ, et al. Challenges of infectious diseases in the USA[J]. Lancet, 2014, 384(9937):53-63.
[19]RENTERIA MI, BIEDENBACH DJ, BOUCHILLON SK,et al. In vitro activity of tigecycline against isolates collected from complicated skin and skin structure infections and intraabdominal infections in Africa and Middle East countries: TEST 2007-2012[J]. Diagn Microbiol Infect Dis, 2014, 79(1):54-59.
[20]王辉,俞云松,王明贵,等. 替加环素体外药敏试验操作规程专家共识[J].中华检验医院杂志,2013,36(7):584-587.
验室,广州 510120;
2. 复旦大学附属华山医院;
3. 北京协和医院;
4. 华中科技大学同济医学院附属同济医院;
5. 上海交通大学医学院附属瑞金医院;
6. 天津医科大学总医院;
7. 新疆医科大学第一附属医院;
8. 复旦大学附属儿科医院;
9. 浙江大学附属第一医院;
10. 安徽医科大学第一附属医院;
11. 昆明医科大学第一附属医院;
12. 上海交通大学附属儿童医院;
13. 甘肃省人民医院;
14. 四川大学华西医院;
15. 北京医院;
16. 浙江大学医学院附属邵逸夫医院;
17. 重庆医科大学附属第一医院;
18. 中国医科大学附属第一医院;
19. 内蒙古医科大学附属医院 。
中图分类号:R378.2
文献标识码:A
文章编号:1009-7708(2016)03-0267-08
DOI:10.16718/j.1009-7708.2016.03.006
收稿日期:2015-06-12 修回日期:2015-08-06
作者单位:1. 广州医科大学附属第一医院,呼吸疾病国家重点实
作者简介:徐安(1987—),女,硕士研究生,主要从事细菌耐药性监测和抗生素临床应用研究。
通信作者:卓超,E-mail:chao_sheep@263.net。
Changing susceptibility of Klebsiella strains in hospitals across China: data from the CHINET Antimicrobial Resistance Surveillance Program,2005-2014
XU An, ZHUO Chao, SU Danhong, HU Fupin, ZHU Demei, WANG Fu, JIANG Xiaofei, XU Yingchun,ZHANG Xiaojiang, SUN Ziyong, CHEN Zhongju, NI Yuxing, SUN Jingyong, HU Zhidong, LI Jin, ZHANG Zhaoxia, JI Ping, WANG Chuanqing, WANG Aimin,YANG Qing, XU Yuanhong, SHEN Jilu, SHAN Bin,DU Yan, ZHANG Hong, KONG Jing, WEI Lianhua,
WU Ling, XIE Yi, KANG Mei, HU Yunjian, AI Xiaoman, YU Yunsong, LIN Jie, HUANG Wenxiang, JIA Bei, CHU Yunzhuo, TIAN Sufei, HAN Yanqiu, GUO Sufang. (State Key Laboratory of Respiratory Diseases, the First Affliated Hospital of Guangzhou Medical University, Guangzhou 510120, China)
Abstract:Objective To evaluate the changing pattern of antibiotic resistance in Klebsiella strains isolated from the patients in 19 hospitals across China based on the data from CHINET Antimicrobial Resistance Surveillance Program during the period from 2005 through 2014. Methods Kirby-Bauer disk diffusion and automated susceptibility testing methods were used to test the susceptibility of Klebsiella isolates to the commonly used antibiotics. The results were interpreted according to the criteria of the Clinical and Laboratory Standards Institute (CLSI) Performance Standards for Antimicrobial Susceptibility Testing (CLSI-2014). Results A total of 61 406 Klebsiella strains were identified between 2005 and 2014, including K. pneumoniae (56 281 strains),K. oxytoca (4 779), Klebsiella pneumoniae subsp. Ozaenae (300) and other Klebsiella species (46). Most (89.0%, 54 664/61 406)of the Klebsiella strains were isolated from inpatients, and 60.0% (36 835/61 406) were from respiratory tract speciems. About 16.7% (10 248/61 406) of the strains were isolated from pediatric patients aged 0-17 years and 83.3% (51 158/61 406) from adult patients. The prevalence of Klebsiella spp. increased with time from 10.1% in 2005 to 14.3% in 2014. Based on the surveillance data during the 10-year period, we found a marked increase of resistance to imipenem (2.9% to 10.5%) and meropenem (2.8% to 13.4%)in Klebsiella spp. The prevalence of ESBLs-producing isolates in K. pneumoniae and K. oxytoca decreased from 39.0% in 2005 to 30.1% in 2014. The resistance to amikacin, ceftazidime, ciprofoxacin, pipracillin-tazobactam and cefoperazone-sulbactam was on decline. The resistance rate to cefotaxime remained high about 49.5%. Carbapenem resistantance was identifed in 5 796 (9.4%) of the isolates, including 5 492 strains of K. pneumoniae and 280 strains of K. oxytoca. Overall, 4 740 (7.8%) strains were identifed as extensively-drug resistant (XDR), including 4 520 strains of K. pneumoniae and 202 strains of K. oxytoca. The carbapenem-resistant strains showed high (>60%) resistance rate to majority of the antimicrobial agents tested, but relatively low resistance to tigecycline (16.8%), amikacin (54.4%), and trimethoprim-sulfamethoxazole (55.5%). Conclusions During the 10-year period from 2005 through 2014, carbapenem resistance among Klebsiella isolates has increased dramatically in the hospitals across China. The level of resistance to other antibiotics remains stable.
Key words:Klebsiella spp.; antibiotic resistance; surveillance
