154例肝硬化失代偿期患者并发血流感染的临床分析
2016-08-08梁丽芬周召刚
梁丽芬, 周召刚, 雷 宇, 钟 珊, 凌 宁, 周 智, 任 红
154例肝硬化失代偿期患者并发血流感染的临床分析
梁丽芬, 周召刚, 雷宇, 钟珊, 凌宁, 周智, 任红
摘要:目的 探讨肝硬化患者并发血流感染(BSI)的临床特点,分析其临床特征、病原菌的分布及耐药特征与患者预后情况,为临床有效诊治并改善临床预后提供依据。方法 收集2012年1月至2014年12月住院诊断为肝硬化失代偿期合并BSI患者的临床资料,分析其诱发因素、临床诊断和治疗特点、病原菌分布及临床预后等情况。结果 同期收治肝硬化失代偿并行血培养患者1 071例,其中血培养阳性患者154例,并发BSI率14.4%。共分离出155株病原菌,分别为革兰阴性菌115株,主要包括大肠埃希菌、肺炎克雷伯菌和气单胞菌属;革兰阳性菌40株主要为金黄色葡萄球菌、缓症链球菌、表皮葡萄球菌。血培养阳性患者中白细胞计数大于10×109/L仅48例(31.2%),中性粒细胞分类大于0.75者133例(86.4%);降钙素原检测大于0.5 ng/mL 74例(68.5%);患者治愈好转率为68.8%,死亡及自动出院率为31.2%。并发BSI患者肝功能均为Child-Pugh C级,部分患者合并其他系统疾病或反复多次住院。结论 肝硬化失代偿期患者并发BSI的比例高,预后差,病原菌以革兰阴性菌为主。早期诊断并及时予以经验性抗菌治疗,待药敏报告后,根据临床治疗反应,必要时调整抗菌治疗方案,可望改善预后。
关键词:失代偿性肝硬化; 血流感染; 病原菌
肝硬化患者肝功能严重障碍、机体免疫功能低下、机体防御机制紊乱,易发生各种感染,感染率高达20%~60%[1],其中血流感染(BSI)的发生率为3.5%~8.8%[2]。而一旦发生BSI,患者的病情可急剧加重,诱发肝性脑病、肾衰竭、感染性休克等并发症而导致患者病死率增加。BSI是肝硬化并发各种感染中较危险、预后较差的感染之一[3],故早期诊断、早期治疗是提高患者生存率的关键。本文通过对肝硬化并发BSI患者的临床表现及治疗预后的分析为临床诊治提供依据。
1 材料与方法
1.1临床资料
回顾性分析2012 年1 月—2014 年12 月在重庆医科大学第二临床学院感染病科住院、临床疑诊并发感染并有血培养的肝硬化失代偿期患者的临床资料、病原菌培养结果和治疗转归等资料。
1.2方法
1.2.1 诊断标准 肝硬化诊断标准参照文献[4],BSI诊断标准则参照文献[5]:①畏寒、发热;②不明原因急性发热,或局部病灶经抗菌药物治疗无效;③中毒性休克;④外周血白细胞及中性粒细胞升高或明显减少;⑤血或骨髓培养细菌阳性。具备前4 项中的1 项加上第5 项即可确诊。
1.2.2 标本采集 在患者寒战、高热时或使用抗生素前采集双份血标本5~10 mL(分双臂采集、2次采血间隔30 min),注入血培养专用瓶内,混匀后立即送检。
1.2.3 细菌培养及分离 采用法国生物梅里埃公司VITEK 2-Compact全自动微生物鉴定仪及药敏分析系统进行细菌鉴定及药敏分析。全自动血培养仪检测5 d未报阳性,转种无细菌生长者为阴性;全自动血培养仪报警提示阳性,及时转种平皿上作细菌分离培养,再进行药敏鉴定。药敏鉴定按照比色法原理计算出差异最小的MIC结果,并按照2012年CLSI-M100-S22药敏标准提供的折点报告病原菌耐药、中介、敏感结果。
1.2.4 治疗方案 综合患者的一般情况,在采集2次血培养标本后经验性使用抗生素,并予以对症支持治疗,随后根据细菌培养和药敏结果调整抗生素。用药期间,每3~5 d复查降钙素原、血常规等感染指标,根据临床疗效和复查结果及时调整抗菌方案。
1.2.5 观察指标 ①血培养菌种及药敏结果;②使用抗生素前后临床症状及体征变化;③血常规、降钙素原等感染指标变化;④预后情况。
1.2.6 疗效判断 用抗菌药物前后每天仔细询问病史,测量体温,用药前外周血白细胞计数大于10×109/L,中性粒细胞比例大于0.75,或降钙素原检测值大于0.5 ng/mL。于用抗菌药物治疗的第3、7天复查血象及降钙素原,于抗菌药治疗第10~14天复查血培养。临床疗效判定:①有效,在综合治疗基础上,患者症状体征消失,复查血象及降钙素原下降或恢复正常,同时复查肝功能好转;②无效,在综合治疗基础上,经积极抗感染治疗(包括使用碳青霉烯类、万古霉素、伏立康唑或卡泊芬净等)3~5 d后,患者症状、体征无改善、甚至恶化。抗菌效果:①病原菌清除,疗程结束复查血培养阴性;②无效,疗程结束复查血培养原病原菌未清除,或伴发新的病原菌感染。
2 结果
2.1 患者一般资料
同期收治的肝硬化失代偿患者疑诊伴有感染,并行血培养者共1 071例,血培养阳性患者154例(154例患者均双份血培养阳性)。154例患者肝功能均为Child-Pugh C级。其中乙型肝炎相关性肝硬化110例,丙型肝炎相关性肝硬化11例,酒精性肝硬化22例,自身免疫性肝病肝硬化5例,隐源性肝硬化3例,乙型肝炎合并丙型肝炎性肝硬化3例。在154例患者中体温在39℃及以上者89例,38~38.9℃ 51例,37.3~37.9℃ 2例,36~37.2℃12例。其中有94例伴有畏寒或寒战,48例患者仅有发热,余12例患者完全无畏寒、寒战、发热表现。154例患者中白细胞计数大于10×109/L 48例(31.2%),中性粒细胞比例大于0.75者133例(86.4%);降钙素原检测大于0.5 ng/mL 74例,占68.5%(74/108),其中检测值大于1 ng/mL以上者65例(60.2%)。
2.2 肝硬化合并感染发生相关因素及原发感染病灶
肝硬化并发BSI患者中每年平均住院次数在2次及以上的有104例,有25例同时患有糖尿病。BSI发生前3例患者有反复静脉药瘾史,59例接受侵袭性操作,其中超选择性肝动脉栓塞术8例,胸腹腔穿刺术40例,经颈静脉肝内门体分流术(TIPS)及深静脉置管各2例,人工血浆置换4例,肝动脉造影1例,全血灌流及胆红素吸附1例,外科胆道开腹手术1例。154例患者中58例有原发感染灶,其中肠道感染7例,呼吸道感染29例,皮肤软组织感染11例,尿路感染7例,骨关节感染1例,自发性细菌性腹膜炎3例(腹水培养阳性),尚有96例原发病灶不明,其中58例有不同程度的腹胀、腹痛、肛门坠胀、里急后重症状或腹部张力高、腹部轻压痛和反跳痛的体征。
2.3细菌学资料
在154例肝硬化合并BSI的患者中共分离出155株病原菌,主要包括革兰阴性菌115株(74.2%),革兰阳性菌40株(25.8%),未分离出真菌。病原菌分布见表1。其中常见革兰阴性菌依次为大肠埃希菌、肺炎克雷伯菌、气单胞菌属,其对常用抗菌药物耐药率见表2;较多见革兰阳性菌依次为金黄色葡萄球菌、缓症链球菌、表皮葡萄球菌,其对常用抗菌药物耐药率见表3。
2.4 治疗与转归
在154例患者中16例(10.4%)使用含酶抑制剂的β内酰胺类抗生素有效,29例(18.8%)因治疗效果欠佳,由其他抗菌药物(包括第一、二、三代头孢菌素,含酶抑制剂的β内酰胺类抗生素,左氧氟沙星,莫西沙星)改为用碳青霉烯类。87例(56.5%)开始即用碳青霉烯类抗生素治疗。154例患者中106例(68.8%)感染有所控制,病情好转出院,即患者畏寒、发热症状消失,精神、食欲好转,腹水消退,肝功能好转,血象、降钙素原恢复正常,复查血培养阴性。死亡患者为17例,病死率11.0%,主要死亡原因为感染性休克、肝性脑病、肝肾综合征、消化道出血,其中因2种及以上并发症死亡的人数达14例。因病情恶化自动出院31例,占20.1%,后两者共占31.1%。死亡及自动出院患者未复查血培养。治疗有效的患者2~3 d体温高峰明显下降或体温恢复正常,5~7 d这些患者体温恢复正常,复查血象及降钙素原明显下降,肝功能也有所好转。
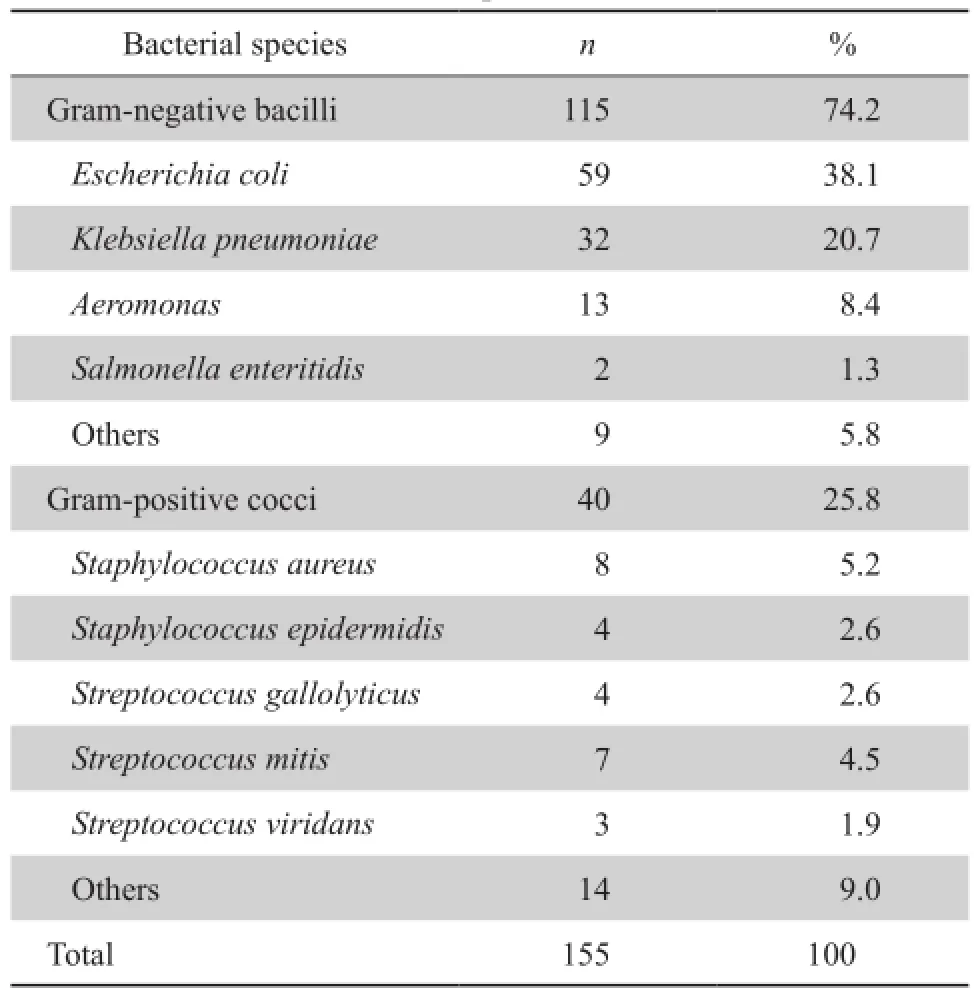
表1 肝硬化血流感染患者血培养阳性细菌种类及构成比Table 1 Species and proportion of bacterial strains isolated from blood in cirrhotic patients with bacteremia

表2 血培养常见革兰阴性菌对抗菌药物耐药率Table 2 Resistance rate of common gram-negative isolates from blood culture to antimicrobial agent

表3 血培养常见革兰阳性菌对抗菌药耐药情况Table 3 Strains of common gram-positive cocci isolated from blood culture resistant to antimicrobial agent
3 讨论
肝硬化患者由于易发生肠道菌群移位及单核巨噬细胞系统的功能障碍[6-7],从而易并发各种细菌感染,有文献报道称,25%~35%肝硬化患者在入院时或住院期间并发感染,比普通人群高4~5倍[8-10];而肝硬化失代偿期患者并发细菌感染后病死率增加了3.75倍,1个月内病死率达30%[11-12]。而随着肝功能减退及门静脉高压的不断进展,发生BSI和自发性细菌性腹膜炎等感染的概率亦逐渐增大[13],其生活质量明显降低、住院次数增加、医疗费用增高[8]。尤其当并发BSI时,其预后极差,病死率明显增加[14]。因此,早期明确诊断,及时使用有效抗生素控制感染在临床上极为关键。本研究中,虽然早期应用了抗生素,患者病情恶化及病死率仍然高达31.1%,除了基础疾病严重外,可能早期诊断和治疗更为重要。
血液细菌培养作为诊断BSI的首要诊断手段,是BSI最直接的检测方法,可提供感染菌种及药敏结果[15],从而为临床医师选择合适的治疗方案提供理论依据。本研究中,肝硬化失代偿期同时行血培养阳性患者共154例,其中部分患者无明显中毒症状,BSI症状体征不够典型,因此临床医师怀疑有感染时应该尽早行血培养,获得病原学结果,减少误诊率。BSI一般有原发病灶,本组患者中有59例患者在发生BSI前接受过侵袭性操作,67.5%患者每年平均住院次数在2次及以上。因此严格无菌操作、减少不必要的侵袭性操作、尽量降低住院次数是减少BSI发生的重要措施之一。而本研究中尚有96例患者原发感染灶不明,其中58例患者有不同程度的腹胀、腹痛、肛门坠胀、里急后重或腹部张力高、腹部压痛和反跳痛的表现,但这些患者腹水培养均为阴性,达不到自发性细菌性腹膜炎的诊断标准,而这类患者临床上需高度怀疑这一诊断,因晚期肝病伴发细菌性腹膜炎时症状体征不够典型,腹水培养阳性率极低[16],故在原发感染病灶中可能还有58例为腹腔感染。因此对于肝硬化失代偿期患者,应尽可能作相应体液的培养以便早期发现病原菌,及时有效地使用抗生素治疗,从而提高疗效,改善预后。
另外,本研究显示中性粒细胞计数百分比大于0.75的患者达86.4%,血清降钙素原升高的患者达68.5%。因此,外周血象及降钙素原检测值的升高如无其他明确感染的情况,应警惕BSI的可能而及时作血培养[17-18]。
从血培养病原菌学结果方面看,肝硬化合并BSI主要病原菌为革兰阴性菌(74.2%),且以大肠埃希菌为主,其次为肺炎克雷伯菌。其他病原菌如气单胞菌、产气肠杆菌、沙门菌、霍乱弧菌等比例很低,因此肠道病原菌感染为肝硬化BSI的主要病原菌。药敏结果显示,对革兰阴性菌总体抗菌活性较好的药物有亚胺培南、哌拉西林-舒巴坦、头孢吡肟、阿米卡星;而氨苄西林、头孢唑林、左氧氟沙星则抗菌活性较差。由于细菌培养需一定的时间,而肝硬化失代偿期患者基础疾病重,有时伴有多种并发症,早期进行有效的抗感染治疗,对于改善病情非常重要。因此,对于这类患者在作相应的培养后,根据患者的综合情况可首先使用碳青霉烯类抗生素或含酶抑制剂的β内酰胺类、第四代头孢菌素等抗感染治疗,从而尽早控制患者的病情。随后可根据培养和药敏结果再作调整,作序贯降阶梯治疗。本研究数据显示肺炎克雷伯菌的耐药率明显低于国内其他研究[19],我们认为主要原因是由于我科大部分危重患者来自于偏远农村,平时甚少使用抗生素;亦可能与我院医师用药习惯的不同有关;另外文献中显示耐药肺炎克雷伯菌株来源主要为重症监护室及呼吸道标本,而本研究中肺炎克雷伯菌全部来自感染科的血液标本,这也是本研究数据与国内其他研究[19]不同的另一主要原因。
综上,肝硬化失代偿期患者并发BSI比例高,但其临床症状体征不典型,且血培养耗时长,而中性粒细胞百分比及降钙素原的参考价值较高、检测迅速,有利于指导临床早期选用抗生素,改善预后。同时肝硬化失代偿期患者BSI病原菌种类多样化、临床表现不一,因此临床医师在临床工作中需警惕易感因素、严格无菌操作,早期诊断、及时发现病情变化及合理选用敏感抗生素,从而提高患者的生存率。
参考文献:
[1]赵宁,李智伟.肝硬化合并感染及抗菌药物治疗的研究现状[J].实用药物与临床,2008,11(5):266-269.
[2]SHIZUMA T, FUKUYAMA N. Investigation into bacteremia and spontaneous bacterial peritonitis in patients with liver cirrhosis in Japan [J]. Turk J Gastroenterol, 2012, 23(2):122-126.
[3]JOHNSON DH, CUNHA BA. Infections in cirrhosis [J]. Infect Dis Clin North Am, 2001, 15(2):363-371.
[4]SUK KT, BAIK SK, YOON JH, et al. Revision and update on clinical practice guideline for liver cirrhosis [J]. KoreanJ Hepatol, 2012 , 18(1): 1-21.
[5]ODA S, AIBIKI M, IKEDA T, et al. The Japanese guidelines for the management of sepsis [J]. Intensive Care, 2014, 2(1):55.
[6]WIEST R, GARCIA-TSAO G. Bacterial translocation (BT) in cirrhosis [J]. Hepatology, 2005, 41(3):422-433.
[7]KANG CI, SONG JH, CHUNG DR, et al. Liver cirrhosis as a risk factor for mortality in a national cohort of patients with bacteremia [J]. J Infect, 2011, 63(5):336-343.
[8]JALAN R, FERNANDEZ J, WIEST R, et al. bacterial infections in cirrhosis: a position statement based on the EASL Special Conference 2013 [J]. J Hepatol, 2014, 60(6): 1310-1324.
[9]FERNANDEZ J, NAVASA M, GOMEZ J, et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis [J]. Hepatology, 2002,35(1):140-148.
[10]FERNANDEZ J, ACEVEDO J, CASTRO M, et al. Prevalence and risk factors of infections by multiresistant bacteria in cirrhosis: a prospective study [J]. Hepatology, 2012, 55(5):1551-1561.
[11]FOREMAN MG, MANNINO DM, MOSS M. Cirrhosis as a risk factor for sepsis and death: analysis of the National Hospital Discharge Survey [J]. Chest, 2003, 124(3):1016-1020.
[12]ARVANITI V, D'AMICOG, FEDE G, et al. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis [J]. Gastroenterology, 2010, 139(4):1246-1256.
[13]吴海清,王晖.肝硬化腹水伴自发性细菌性腹膜炎的诊断及治疗[J].临床肝胆病杂志,2012,28(9):651-653.
[14]MOUNZER R, MALIK SM, NASR J, et al. Spontaneous bacterial peritonitis before liver transplantion does not affect patient surviva [J]. Clin Gastroenterol Hepatol, 2010, 8(7):623-628.
[15]苑文雯,陈澎,王晗,等. 血清降钙素原对肝硬化败血症的诊断价值[J].肝脏,2014,19(1):12-14.
[16]周智,赖宁,张全海,等.186例晚期肝病患者并发原发性腹膜炎的诊断与治疗[J].中华肝脏病杂志,2004,12(6):350-352.
[17]BECKER KL, SNIDER R, NYLEN ES. Proealcitonin assay in systemic infammation, infection, and sepsis : clinical utility and limitations [J]. Crit Care Med, 2008, 36 (3) :941-952.
[18]DELLINGER RP, LEVY MM, RHODES A, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012 [J]. Intensive Care Med,2013, 39(2):165-228.
[19]胡付品,朱德妹,汪复,等. 2014年CHINET中国细菌耐药性监测[J].中国感染与化疗杂志,2015,15(5):401-410.
中图分类号:R515.3
文献标识码:A
文章编号:1009-7708(2016)03-0262-05
DOI:10.16718/j.1009-7708.2016.03.005
收稿日期:2015-07-15 修回日期:2015-11-11
基金项目:国家自然科学基金(81171563、31000397)。
作者单位:重庆医科大学第二临床学院感染病科,重庆市肝病治疗研究中心,重庆 400010。
作者简介:梁丽芬(1989—),女,硕士,主要从事感染病学诊治研究。
通信作者:周智,E-mail:zhouzhi2300@126.com。
Clinical analysis of 154 blood stream infection patients with decompensated liver cirrhosis
LIANG Lifen, ZHOU Zhaogang, LEI Yu, ZHONG Shan, LING Ning, ZHOU Zhi, REN Hong. (Department of
Infectious Diseases, the Second Affliated Hospital of Chongqing Medical University, Chongqing 400010, China)
Abstract:Objective The clinical features, bacteria distribution and antibiotic resistance profle of blood stream infection(BSI)were investigated in the patients with decompensated liver cirrhosis for better management of such infections. Methods The clinical data of BSI were collected in the patients with decompensated liver cirrhosis between January, 2012 and December, 2014,and reviewed retrospectively in terms of risk factors, diagnosis and treatment, pathogen distribution and prognosis. Results Of the 1 071 patients with decompensated liver cirrhosis and suspected bacterial infection, 154 (14.4%) were diagnosed as BSI evidenced by blood culture. Of these patients, the leukocyte count in the peripheral blood was higher than 10×109/L in only 48 (31.2%) patients;neutrophil proportion >0.75 in 133 patients (86.4%); serum procalcitonin level >0.5 ng/mL in 74 patients (68.5%). A total of 155 bacterial strains were isolated, including 115 strains of gram-negative bacilli and 40 strains of gram-positive cocci. Most patients (68.8%) recovered and 31.2% died or discharged from hospital voluntarily. All these BSI patients had Child-Pugh grade C liver function. Some patients also had other serious systemic diseases or repeated hospitalization. Conclusion The prevalence of BSI is high in the decompensated liver cirrhosis patients with poor prognosis. Gram-negative bacilli are the major pathogens of such septicemia. Early diagnosis and proper use of antibiotics based on antimicrobial susceptibility testing are important to improve patient outcome.
Key words:decompensated liver cirrhosis; blood stream infection; pathogen
