2014年北京协和医院细菌耐药性监测
2016-08-08张小江杨启文孙宏莉窦红涛朱任媛宋红梅徐英春
张小江,杨启文,孙宏莉,王 瑶,王 贺,窦红涛,赵 颖,王 澎,张 辉,朱任媛,宋红梅,徐英春
2014年北京协和医院细菌耐药性监测
张小江,杨启文,孙宏莉,王瑶,王贺,窦红涛,赵颖,王 澎,张辉,朱任媛,宋红梅,徐英春
摘要:目的 了解北京协和医院2014年临床分离细菌对抗菌药物的耐药性。方法 共收集8 295株非重复分离菌,采用纸片扩散法或自动化仪器法进行药敏试验,按CLSI 2014年版标准判读药敏结果,采用WHONET 5.6软件进行数据分析。结果 8 295株细菌中,革兰阴性菌占67.4%,革兰阳性菌占32.6%。10种最常见的细菌分别为:大肠埃希菌(18.1%),铜绿假单胞菌(10.8%),肺炎克雷伯菌(10.2%),金黄色葡萄球菌(金葡菌)(9.8%),鲍曼不动杆菌(9.2%),粪肠球菌(6.3%),屎肠球菌(4.1%),凝固酶阴性葡萄球菌(4.1%),阴沟肠杆菌(3.1%)和嗜麦芽窄食单胞菌(2.9%)。耐甲氧西林金葡菌(MRSA)和凝固酶阴性葡萄球菌(MRCNS)的检出率分别为28.4%和66.5%。耐甲氧西林葡萄球菌对β内酰胺类和其他抗菌药物的耐药率明显高于甲氧西林敏感葡萄球菌。仍有81.3%MRSA对甲氧苄啶-磺胺甲�唑敏感。MRCNS中有81.1%菌株对利福平敏感。未发现对万古霉素、替考拉宁和利奈唑胺耐药的葡萄球菌。粪肠球菌对大多数抗菌药物(除外氯霉素)的耐药率明显低于屎肠球菌。发现少数万古霉素耐药肠球菌(VRE),根据表型推测为VanA和VanB 型耐药,未发现对利奈唑胺耐药的肠球菌。β溶血链球菌对青霉素的敏感率为90.8%。产ESBL的大肠埃希菌、克雷伯菌属(肺炎克雷伯菌和产酸克雷伯菌)和奇异变形杆菌的检出率分别为54.2%、31.0%和28.9%。肠杆菌科细菌对碳青霉烯类仍高度敏感,总耐药率≤3.3%。广泛耐药肺炎克雷伯菌的检出率为1.3%。铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别为17.5%和11.8%,对阿米卡星的耐药率5.9%。鲍曼不动杆菌对上述2种碳青霉烯类抗生素的耐药率分别为69.0%和67.4%,对头孢哌酮-舒巴坦和米诺环素的耐药率低,分别为47.8%和28.7%。广泛耐药鲍曼不动杆菌和铜绿假单胞菌的检出率分别是32.3%和1.8%。流感嗜血杆菌中β内酰胺酶的检出率为33.7%。肺炎链球菌对红霉素和克林霉素的耐药率>93 %。结论 细菌对抗菌药物的耐药率呈增长趋势,特别是碳青霉烯类耐药肠杆菌科细菌,应采取有效的医院感染控制措施和加强抗菌药物的合理使用。
关键词:细菌耐药性监测; 碳青霉烯类耐药肠杆菌科细菌; 广泛耐药菌; 药敏试验
我院从2005年开始参加CHINET细菌耐药监测网的工作,监测网每年公布的细菌耐药性监测数据给临床医师合理使用抗菌药物提供了参考依据。现将我院2014年临床分离的8 295株非重复菌的分布及主要细菌对抗菌药物耐药性的监测结果进行总结。
1 材料与方法
1.1材料
1.1.1 菌株来源 收集2014年1月1日—12月31日从北京协和医院临床分离的细菌8 295株(剔除同一患者相同部位重复分离株)。凝固酶阴性葡萄球菌和草绿色链球菌只收集血液、脑脊液和无菌体液标本的菌株。
1.1.2 培养基和抗菌药物纸片 药敏试验用MH琼脂培养基,肺炎链球菌及其他链球菌用含5%脱纤维羊血MH琼脂培养基,流感嗜血杆菌用HTM培养基,抗菌药物纸片均为英国OXOID公司产品。
1.2方法
1.2.1 菌种鉴定和药敏试验 细菌鉴定用法国生物梅里埃公司的VITEK 2-Compact自动分析仪。按CLSI推荐纸片扩散法进行,葡萄球菌属细菌药敏试验用美国BD公司凤凰100仪器。质控菌株为金黄色葡萄球菌(金葡菌)ATCC25923、大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、肺炎链球菌ATCC49619和流感嗜血杆菌ATCC49247。
1.2.2 β内酰胺酶检测 采用头孢硝噻酚纸片(英国OXOID公司产品)检测流感嗜血杆菌的β内酰胺酶。
1.2.3 ESBL检测 按CLSI推荐的纸片筛选和酶抑制剂增效确证试验检测大肠埃希菌、肺炎克雷伯、产酸克雷伯菌和奇异变形杆菌中产ESBL菌株。
1.2.4 青霉素不敏感肺炎链球菌的检测 苯唑西林纸片测定抑菌圈直径≤19 mm的肺炎链球菌菌株,用青霉素E试验条测定其MIC值,按CLSI 2014年非脑膜炎和脑膜炎肺炎链球菌标准,分别判定为对青霉素中介(PISP)或耐药株(PRSP)。
1.2.5 耐万古霉素肠球菌(VRE)检测 万古霉素纸片法测定为非敏感菌株,用万古霉素和替考拉宁E试验条测定MIC值确认。
1.2.6 广泛耐药(XDR)菌株的定义 对除米诺环素外其他抗菌药物全耐药者。碳青霉烯类耐药肠杆菌科细菌(CRE) 定义为对亚胺培南、美罗培南或厄他培南任一种药物耐药者。
1.2.7 药敏结果的判读和数据分析 按2014年版CLSI标准判读药敏结果[1],采用WHONET5.6软件统计分析数据。
2 结果
2.1细菌及其分布
2014年共收集非重复临床分离菌8 295株,其中革兰阳性菌2 701株,占32.6%,革兰阴性菌 5 594株,占67.4%。2 620株(31.6%)分离自门诊患者 ,5 675株(68.4%)分离自住院患者。39.2%菌株分离自呼吸道标本,13.1%分离自尿液标本,11.9%分离自血液标本,4.1%分离自伤口脓液标本,1.1%分离自脑脊液标本,30.6%分离自其他标本。
呼吸道标本主要分离细菌为铜绿假单胞菌、鲍曼不动杆菌和肺炎克雷伯菌,尿液标本主要分离细菌为大肠埃希菌、粪肠球菌和肺炎克雷伯菌,血液标本主要分离细菌为凝固酶阴性葡萄球菌、大肠埃希菌和肺炎克雷伯菌,伤口脓液标本主要分离细菌为金葡菌、大肠埃希菌和铜绿假单胞菌。
门诊患者分离前5位细菌分别是大肠埃希菌、铜绿假单胞菌、金葡菌、鲍曼不动杆菌和肺炎克雷伯菌。住院患者分离前5位细菌分别是大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、金葡菌和鲍曼不动杆菌。肠杆菌科细菌占革兰阴性菌的58.0%,最多见细菌依次为大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌、奇异变形杆菌和黏质沙雷菌。不发酵糖革兰阴性菌占革兰阴性菌的38.1%,最多见细菌依次为铜绿假单胞菌,鲍曼不动杆菌,嗜麦芽窄食单胞菌和洋葱伯克霍尔德菌。革兰阳性球菌中最多见的细菌依次为金葡菌,粪肠球菌、B群链球菌、屎肠球菌、凝固酶阴性葡萄球菌(仅包括血液、脑脊液等无菌体液)和肺炎链球菌。主要细菌分布见表1。
2.2革兰阳性球菌对抗菌药物的敏感率和耐药率
2.2.1 葡萄球菌属 耐甲氧西林金葡菌(MRSA)的检出率为28.4 %(232/817),耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)的检出率为66.5 %(224/337)。MRSA和MRCNS对β内酰胺类、大环内酯类、氨基糖苷类和喹诺酮类等抗菌药物的耐药率均显著高于各自的敏感株(MSSA和MSCNS)。但MRCNS对甲氧苄啶-磺胺甲唑的耐药率显著高于MRSA(68.2 %对16.5 %)。MRSA中有81.3 %菌株对甲氧苄啶-磺胺甲唑敏感,MRCNS中有81.1 %菌株对利福平敏感。金葡菌和凝固酶阴性葡萄球菌中均未发现对万古霉素、替考拉宁和利奈唑胺耐药菌株。见表2。
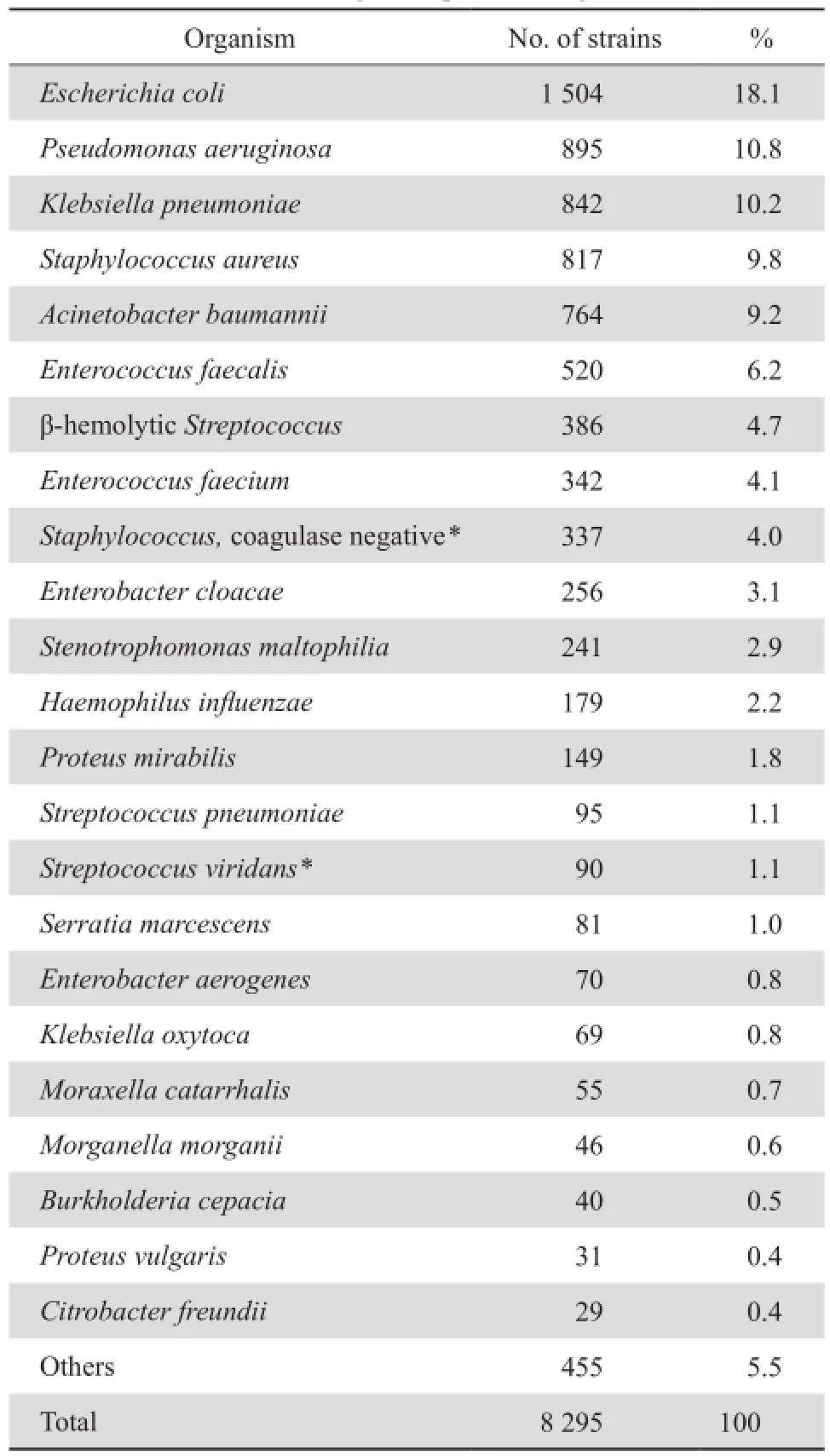
表1 2014年临床分离菌的分布Table 1 Distribution of bacterial species in Peking Union Medical College Hospital during 2014
2.2.2 肠球菌属 925株肠球菌中粪肠球菌和屎肠球菌分别占56.2 %和37.0 %。520株粪肠球菌中发现1株万古霉素耐药株,检出率为0.2 %。342株屎肠球菌中发现13株万古霉素耐药株,检出率为3.8 %。两菌对高浓度庆大霉素的耐药率分别为27.5 %和47.6 %。粪肠球菌对所测试的大多数抗菌药物的耐药率均显著低于屎肠球菌,但对氯霉素的耐药率高于屎肠球菌(31.8 %对5.3 %)。粪肠球菌对氨苄西林和磷霉素的敏感率较高(分别为89.7 %和91.4 %),其中尿液标本分离的粪肠球菌对磷霉素的敏感率为88.1 %。屎肠球菌对替考拉宁有耐药株(2.1 %)。两菌均未发现对利奈唑胺耐药株。见表3。
2.2.3 链球菌属 从血液及无菌体液分离到90株α溶血链球菌,对左氧氟沙星、头孢菌素类抗菌药物的敏感率较高(>78 %)。分离到β溶血链球菌386株,其中A群链球菌19株,B群链球菌362株。β溶血链球菌群对青霉素的敏感率为90.8 %,对红霉素和克林霉素的耐药率分别为68.5 %和62.3 %。对左氧氟沙星的耐药率为49.5 %,对头孢菌素类抗菌药物的敏感率>97.1 %,未发现对万古霉素和利奈唑胺耐药株。95株肺炎链球菌中(94株为非脑膜炎菌株,1株为脑膜炎株),成人(>14岁)分离86株,儿童(≤14岁)9株,成人有1株(脑膜炎株)经青霉素E试验确定为PRSP,有1株(非脑膜炎株)为PISP。肺炎链球菌对红霉素和克林霉素的耐药率很高(95.2 % 和92.9 %)。见表4。2.3革兰阴性杆菌对抗菌药物的敏感率和耐药率2.3.1 肠杆菌科 产ESBL大肠埃希菌的检出率为54.2%(816/1 504),产ESBL克雷伯菌属(肺炎克雷伯菌和产酸克雷伯菌)的检出率为31.1 %(283/911),产ESBL奇异变形杆菌的检出率为28.8%(43/149)。XDR肺炎克雷伯菌的检出率为1.3 %(11/842),XDR大肠埃希菌的检出率为0.1 %(2/1 504)。尿标本分离的大肠埃希菌对磷霉素敏感率为92.2 %。大肠埃希菌对环丙沙星、庆大霉素和哌拉西林的耐药率均>50.0 %。肠杆菌科中不同种细菌对3种碳青霉烯类的耐药率仍然较低(0~9.9%)。3 246株肠杆菌科细菌对3种碳青霉烯的总耐药率最低(2.3 %~3.3 %)。2013年和2014年CRE的检出率分别为2.1 %(66/3 143)和3.1 %(102/3 246)。见表5、表6。

表2 葡萄球菌属对抗菌药物的耐药率和敏感率Table 2 Susceptibility of Staphylococcus isolates to antimicrobial agents

表3 粪肠球菌和屎肠球菌对抗菌药物的耐药率和敏感率Table 3 Susceptibility of Enterococcus species to antimicrobial agents
2.3.2 不发酵糖革兰阴性杆菌 鲍曼不动杆菌XDR株的检出率为32.3 %(247/764),铜绿假单胞菌XDR株的检出率为1.8 %(16/895)。鲍曼不动杆菌对米诺环素和头孢哌酮-舒巴坦的耐药率较低(28.7 %和47.8 %),对亚胺培南和美罗培南的耐药率分别为69.0 %和67.4 %。铜绿假单胞菌对阿米卡星的耐药率最低(5.9 %),对亚胺培南和美罗培南的耐药率分别为17.5%和11.8%。嗜麦芽窄食单胞菌对所测试抗菌药物的敏感率均在90%以上。洋葱伯克霍尔德菌对所测试抗菌药物的敏感率均在87 %以上。见表7。

表4 肺炎链球菌、α和β溶血链球菌对抗菌药物的耐药率和敏感率Table 4 Susceptibility of S. pneumoniae, alpha and beta-hemolytic Streptococcus strains to antimicrobial agents
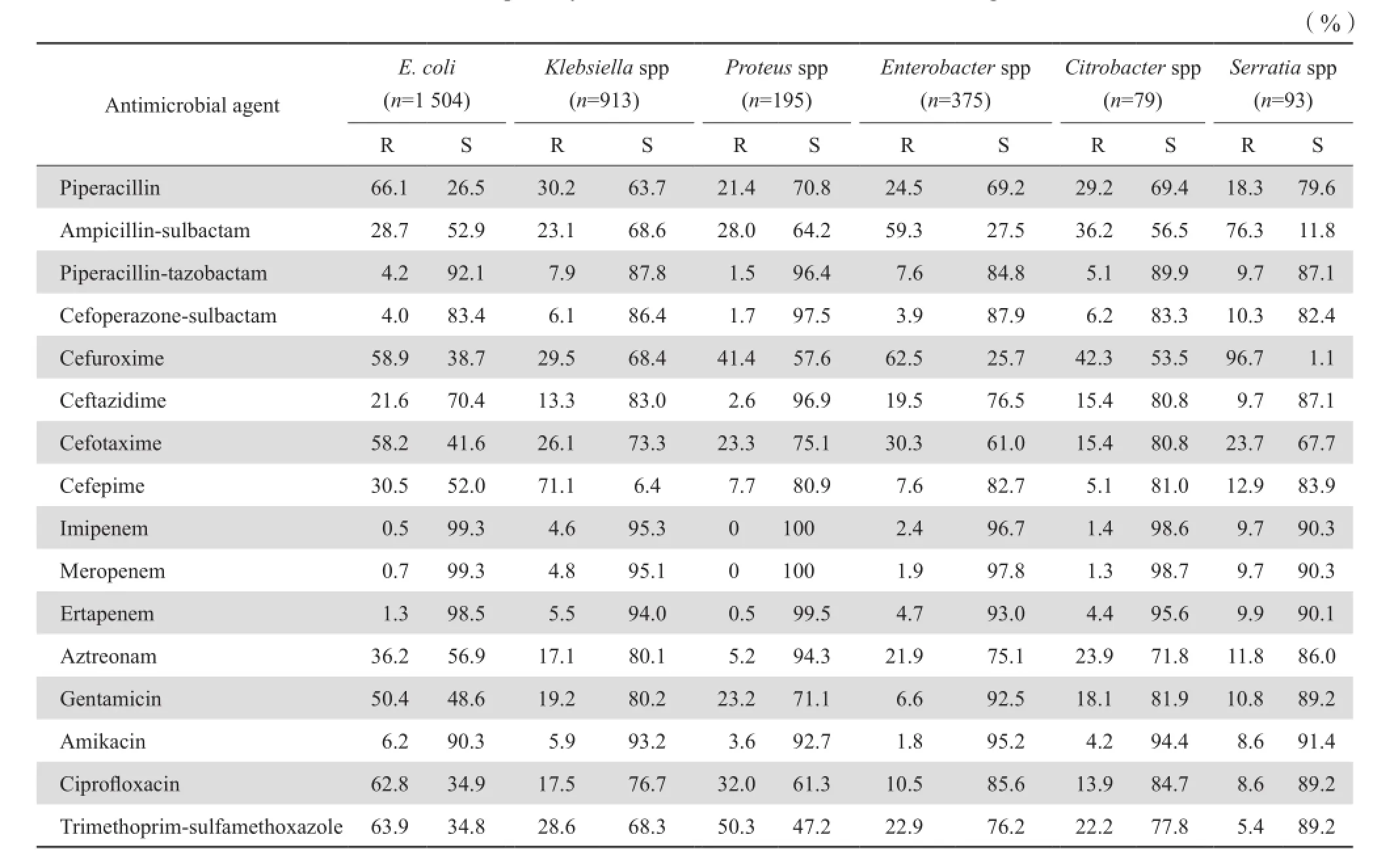
表5 肠杆菌科细菌对抗菌药物的耐药率和敏感率Table 5 Susceptibility of Enterobacteriaceae to antimicrobial agents
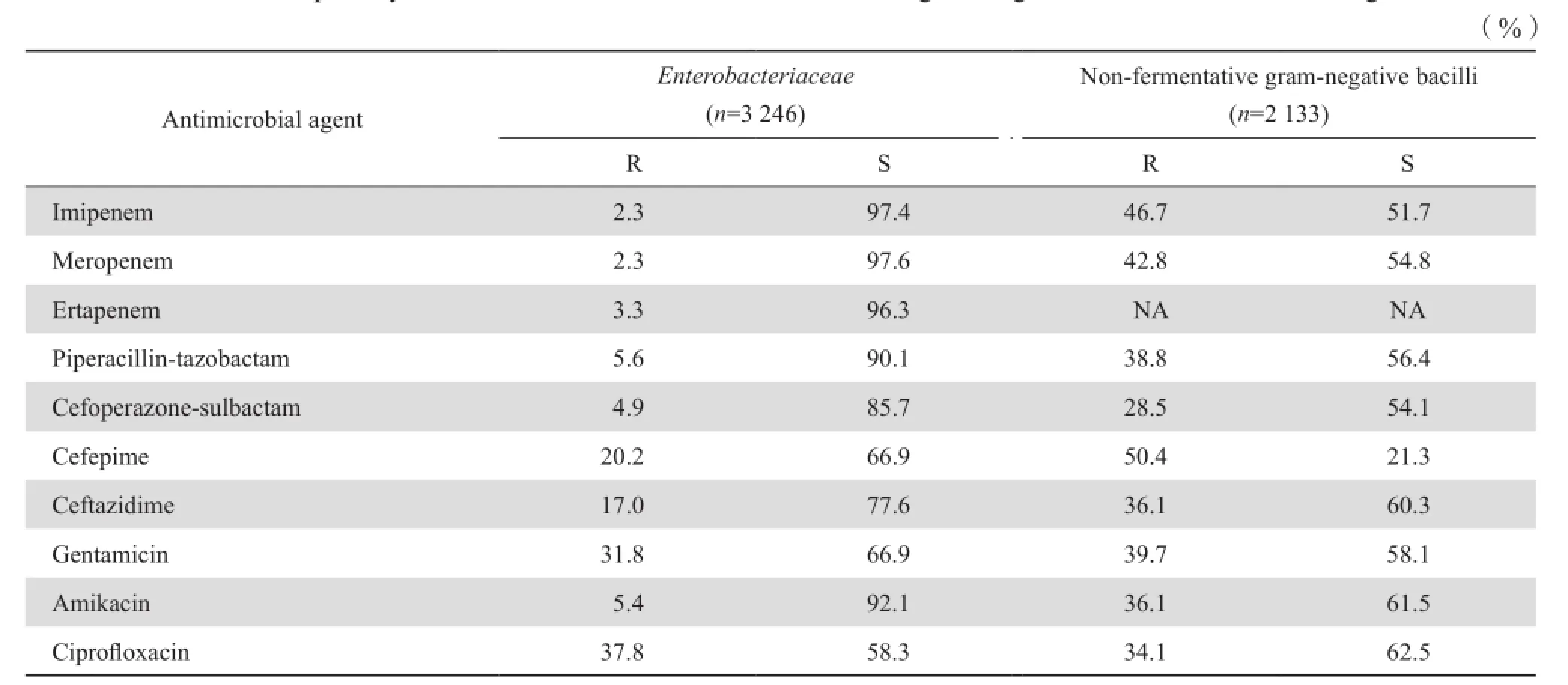
表6 肠杆菌科细菌和不发酵糖革兰阴性杆菌对抗菌药物的耐药率和敏感率Table 6 Susceptibility of Enterobacteriaceae and non-fermentative gram-negative bacilli to antimicrobial agents

表7 不发酵糖革兰阴性杆菌对抗菌药物的耐药率和敏感率Table 7 Susceptibility of non-fermentative gram negative bacilli to antimicrobial agents
2.3.3 流感嗜血杆菌 172株成人分离流感嗜血杆菌中,β内酰胺酶阴性率33.7 %。对氨苄西林的敏感率为64.0 %。见表8。
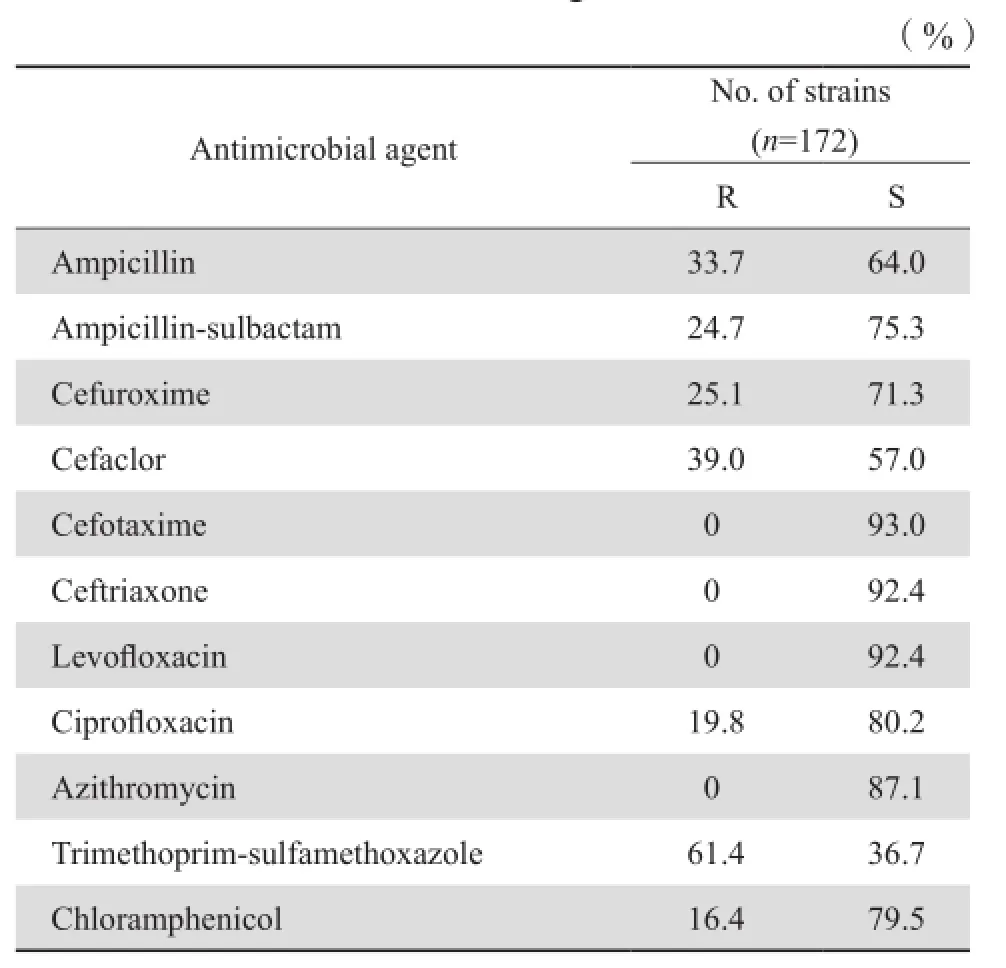
表8 成人分离的流感嗜血杆菌对抗菌药物的耐药率和敏感率Table 8 Susceptibility of H. infuenzae isolated in adults to antimicrobial agents
3 讨 论
本次监测结果显示,2014年我院8 295株非重复分离细菌中,革兰阴性菌占67.4 %,较2013年的71.1 %有所下降;革兰阳性菌占32.6 %,较2013年的28.9 %有所上升。门、急诊患者分离菌(31.6 %)较2013年(35.4 %)有所下降,住院患者分离菌(68.4%)较2013年(64.6%)有所增加[2]。排在前5位的细菌是大肠埃希菌、铜绿假单胞菌、肺炎克雷伯菌、金葡菌和鲍曼不动杆菌,而2013年细菌排序为大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌和金葡菌。
本次我院MRSA和MRCNS的检出率为28.4%和66.5%,MRSA的 检 出 率 与2013年(34.9%)[2]相比明显下降,可能与医护人员注意手卫生、严格无菌操作和患者的隔离措施等有关。我院MRSA主要从ICU、内科和急诊患者检出,MRCNS主要从内科、急诊和外科患者检出。屎肠球菌对氨苄西林的耐药率(89.4 %)显著高于粪肠球菌(10.2 %),粪肠球菌和屎肠球菌中对万古霉素耐药率株分别为0.2 %和4.4 %,屎肠球菌对替考拉宁的耐药率为2.1%。 根据表型推测主要为VanA和VanB型。未发现对利奈唑胺耐药株,但2013年CHINET耐药监测中出现了少数对利奈唑胺耐药的粪肠球菌和屎肠球菌[3]。本次监测结果显示,肺炎链球菌对红霉素、克林霉素和甲氧苄啶-磺胺甲唑的耐药率较高(57.8 %~95.2%)。成人有1株(脑膜炎株)经青霉素E试验确定为PRSP,有1株(非脑膜炎株)经青霉素E试验确定为PISP。本次监测到的85株成人非脑膜炎肺炎链球菌株对青霉素的敏感率为98.8%(84/85),未发现对万古霉素、利奈唑胺耐药菌株。本次监测结果显示,成人流感嗜血杆菌对氨苄西林的耐药率为33.7%,比2013年(40.4%)[2]有明显下降,对甲氧苄啶-磺胺甲唑的耐药率较高(61.4%)。β溶血链球菌对红霉素和克林霉素的耐药率较高(68.5%和62.3%),对青霉素、头孢菌素类、万古霉素和利奈唑胺保持高度敏感(97.1%~100%)。
本次监测中,产ESBL大肠埃希菌、克雷伯菌属(肺炎克雷伯菌和产酸克雷伯菌)和奇异变形杆菌的检出率分别为54.2 %、31.0%和28.9 %,比2013年(49.5 %、25.4 %和22.6 %)[2]略有上升。产ESBL大肠埃希菌主要从内科和外科患者中检出,产ESBL克雷伯菌属主要从ICU和内科患者中检出,产ESBL奇异变形杆菌主要从外科和内科患者中检出。质粒介导的ESBL中常见的是TEM、SHV和CTX型,在我国以CTX-M型最流行,导致对头孢噻肟水解能力强,而对头孢他啶水解能力较弱。本次监测也证明,产ESBL大肠埃希菌、克雷伯菌属(肺炎克雷伯菌和产酸克雷伯菌)和奇异变形杆菌对头孢他啶的耐药率较低(15.6%~36.3%),而对头孢噻肟的耐药率很高(90.6%~99.8%)。CRE中最常见的碳青霉烯酶是KPC型, CRE在全球的传播已成为对临床和公共卫生的重要挑战,CRE感染患者的病死率估计在29 %~52 %[4-5]。CRE的检出率逐年上升,我院2014年的检出率为2.1 %,而2013年为1.3 %。克雷伯菌属是CRE中最常见的分离菌,本次监测显示,CRE菌株包括克雷伯菌属39株、埃希菌属7株、肠杆菌属8株、弗劳地枸橼酸杆菌1株、沙雷菌属9株、摩根菌属2株,其中以肺炎克雷伯菌(38株)最多,CRE菌株在ICU分离最多,以痰和尿标本为主。CRE菌株对阿米卡星和米诺环素的耐药率分别为34.4 %和40.2 %,对其他抗菌药物的耐药率达60.8 %~99.0 %。多重耐药和XDR的CRE菌株给临床治疗带来了困难,有文献报道,采用2~3种抗菌药物联合治疗CRE菌株的感染患者,如黏菌素联合磷霉素,替加环素联合黏菌素,替加环素联合氨基糖苷类等[6-8]。本次尿液标本分离的大肠埃希菌和粪肠球菌对磷霉素的敏感率>93.2 %。
本次监测中,鲍曼不动杆菌XDR株的检出率为32.3 %,与2013年(42.9 %)[2]相比明显下降,菌株主要来自ICU,根据时间统计,可能存在耐药克隆的传播。手卫生、接触隔离仍是感染控制的基础,特别是在ICU中。鲍曼不动杆菌对米诺环素和头孢哌酮-舒巴坦的耐药率为28.7 %和47.8%,对米诺环素耐药率比2013年(20.4 %)[2]有所上升。虽然新的抗菌药物如替加环素等显示有一定的体外抗鲍曼不动杆菌活性,但其临床疗效仍有待继续观察研究。对亚胺培南和美罗培南的耐药率较高(69.0 %和67.4 %),与2013年(70.0 %和72.0%)基本持平。鲍曼不动杆菌对碳青霉烯类抗生素耐药的机制包括,产金属β内酰胺酶(MBL)和水解碳青霉烯类的苯唑西林酶(OXA),外排泵和外膜蛋白表达低下或缺失,上述机制也常常并存。16SrRNA甲基化酶基因armA基因在中国亚胺培南耐药鲍曼不动杆菌中分布广泛,克隆传播是其最主要的传播方式[9]。铜绿假单胞菌也是重要的导致医院感染的条件致病菌,呈现多重耐药,包括对β内酰胺类、碳青霉烯类、头孢菌素类、氨基糖苷类和喹诺酮类。KPC酶能水解碳青霉烯类抗生素,常见于肠杆菌科细菌中,但最近也出现在铜绿假单胞菌和鲍曼不动杆菌中[10]。本次监测结果显示,铜绿假单胞菌XDR株的检出率为1.8%,比2013年(1.2%)[2]略有上升,主要来自ICU。有报道,高产AmpC和(或)ESBL,合并膜孔蛋白OprD的缺失或主动外排泵的激活,是XDR铜绿假单胞菌对β内酰胺类耐药的主要机制[11]。铜绿假单胞菌对阿米卡星的耐药率最低(5.9 %),对亚胺培南和美罗培南的耐药率分别为17.5 %和11.8 %,比2013年(19.4 %和15.6 %)[2]略有下降。铜绿假单胞菌对所测试抗菌药物的敏感率均显著高于鲍曼不动杆菌。嗜麦芽窄食单胞菌对所测试的抗菌药物均高度敏感(>90.5%),洋葱伯克霍尔德菌对所测试的抗菌药物均高度敏感(87.2 %~100 %)。
参考文献:
[1]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing [S]. 2014,M100-S24 .
[2]张小江,杨启文,孙宏莉,等. 2013年北京协和医院细菌耐药性监测[J]. 协和医学杂志,2014,5(4):422-428.
[3]胡付品,朱德妹,汪复,等. 2013年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志,2014,14(5):365-374.
[4]CARVALHAES CG, CAYO R, GALES AC.Klebsiella pneumoniae carbapenemase-producing Klebsiella pneumoniae in the intensive care unit: a real challenge to physicians, scientifc community, and society[J]. Shock, 2013, 39(Suppl 1):32-37.
[5]VAN DUIN D, KAYE KS, NEUNER EA, et al. Carbapenemresistant Enterobacteriaceae: a review of treatment and outcomes[J]. Diagn Microbiol Infect Dis, 2013, 75(2):115-120.
[6]RAFAILIDIS PI, FALAGAS ME. Options for treating carbapenem-resistant Enterobacteriaceae[J]. Curr Opin Infect Dis, 2014, 27(6):479-483.
[7]FALAGAS ME, LOURIDA P, POULIKAKOS P, et al. Antibiotic treatment of infections due to carbapenem-resistant Enterobacteriaceae: systematic evaluation of the available evidence[J]. Antimicrob Agents Chemother, 2014, 58(2):654-663.
[8]YAMAMOTO M, POP-VICAS AE. Treatment for infections with carbapenem-resistant Enterobacteriaceae: what options do we still have? [J]. Critical Care, 2014, 18(3):229.
[9]周华,杜小幸,杨青,等. 亚胺培南耐药鲍曼不动杆菌碳青霉烯酶和16SrRNA甲基化酶研究[J]. 中华流行病学杂志,2009,30(3):269-272.
[10]ROBLEDO IE, AQUINO EE,SANTE MI,et a1.Detection of KPC in Acinetobacter spp.in Puerto Rico[J].Antimicrob Agents Chemother,2010,54(3):1354-1357.
[11]杨菁菁,艾效曼,胡云建,等. 泛耐药铜绿假单胞菌对β内酰胺类抗生素的耐药机制研究[J]. 中国感染与化疗杂志,2013,13(1):14-18.
中图分类号:R378
文献标识码:A
文章编号:1009-7708(2016)03-0315-08
DOI:10.16718/j.1009-7708.2016.03.011
收稿日期:2015-03-27 修回日期:2015-11-09
作者单位:中国医学科学院,北京协和医学院,北京协和医院检验科,北京 100730;
作者简介:张小江(1959—),男,本科,主任技师,主要从事临床微生物检验和细菌耐药性监测工作。
通信作者:徐英春,E-mail:xycpumch@139.com。
Surveillance of bacterial resistance in Peking Union Medical College Hospital during 2014
ZHANG Xiaojiang, YANG Qiwen, SUN Hongli, WANG Yao, WANG He, DOU Hongtao, ZHAO Ying, WANG Peng,ZHANG Hui, ZHU Renyuan, SONG Hongmei, XU Yingchun. (Clinical Microbiology Laboratory, Peking Union Medical College Hospital, China Academy of Medical Sciences & Peking Union Medical College, Beijing 100730,China)
Abstract:Objective To investigate the antimicrobial resistance profle in the clinical bacterial strains isolated from Peking Union Medical College Hospital during 2014. Methods A total of 8 295 nonduplicate clinical isolates were collected. Disc diffusion test (Kirby-Bauer method) and automated systems were employed to study the antimicrobial susceptibility. The data were analyzed by using WHONET 5.6 software according to CLSI 2014 breakpoints. Results Of the 8 295 isolates, 67.4% were gram-negative, and 32.6% were gram-positive. The top 10 most frequently isolated bacteria were: E. coli (18.1%), P. aeruginosa (10.8%), K. pneumoniae (10.2%), S. aureus (9.8%),A. baumannii (9.2%), E. faecalis (6.3%), E. faecium (4.1%), coagulase-negative Staphylococcus (4.1%), E. cloacae (3.1%) and S. maltophilia (2.9%). Methicillin resistant strains in S. aureus (MRSA) and coagulase negative Staphylococcus (MRCNS) accounted for average of 28.4% and 66.5%, respectively. The resistance rates of MR strains to β-lactams and other antimicrobial agents were much higher than those MS strains. Overall, 81.3% of MRSA strains were still susceptible to trimethoprim-sulfamethoxazole, while 81.1% of MRCNS strains were susceptible to rifampin. No staphylococcal strains were resistant to vancomycin, teicoplanin or linezolid. The resistance rate of E. faecalis strains to most of the drugs tested (except chloramphenicol) was much lower than those of E. faecium. Several strains of both E. faecium and E. faecalis were found resistant to vancomycin and teicoplanin, which were Van-A and Van-B types based on their phenotype. No linezolid resistant enterococcal strains were found. Data showed that 90.8% of β-hemolytic Streptococcus strains were susceptible to penicillin. ESBLs-producing strains accounted for 54.2%, 31.0% and 28.9% in E. coli, Klebsiella spp (K. pneumoniae and K. oxytoca) and P. mirabilis, respectively. Enterobacteriaceae isolates were still highly susceptible to carbapenems. Overall, no more than 3.3% of these strains were resistant to carbapenems. A few extensively drugresistant strains of K. pneumoniae (1.3%, 11/842) were identifed. The resistance rates of P. aeruginosa to imipenem and meropenem were 17.5% and 11.8%, respectively. P. aeruginosa isolates showed the lowest resistance rate (5.9%) to amikacin. And 69.0% and 67.4% of A. baumannii isolates were resistant to imipenem and meropenem. A. baumannii isolates showed the lowest resistance rates to cefoperazone-sulbactam and minocycline (47.8% and 28.7%), respectively. The prevalence of extensively drug-resistant strains was 32.3% in A. baumannii and 1.8% in P. aeruginosa. The prevalence of β-lactamase in H. infuenzae was 33.7%. More than 93.0% of S. pneumoniae strains were resistant to erythromycin and clindamycin. Conelusions Bacterial resistance is still increasing in this hospital, especially carbapenem resistant Enterobacteriaceae. It is necessary to take effective hospital infection control measures and use antibiotics rationally.
Key words:bacterial resistance surveillance; carbapenem-resistant Enterobacteriaceae; extensively-drug resistant; antimicrobial susceptibility testing
