丙泊酚抗N-甲基-D-天冬氨酸毒性作用及其与脑源性神经营养因子表达的关系∗∗
2018-10-31房德芳李小雷石薷月
房德芳,江 山,李小雷,石薷月
(江苏联合职业技术学院连云港中医药分院,江苏连云港 222006)
丙泊酚是一种静脉麻醉药物,被广泛用于临床麻醉和镇静,并且对心脏、脑等脏器也有一定的保护作用[1-2],然而对于丙泊酚脑保护的确切作用机制仍不明确。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)在中枢神经系统内有着广泛分布,在神经元生长发育中起着重要作用,并可促进神经元损伤后的再生和修复[3-4]。有研究发现,丙泊酚促进创伤性脑损伤大鼠神经功能和学习记忆认知功能的恢复可能与促进BDNF的表达相关[5]。当中枢神经损伤发生后,可导致兴奋性氨基酸过度释放,刺激N-甲基-D-天冬氨酸(NMDA)受体过度兴奋从而诱发钙离子(Ca2+)大量内流超载,最终引起神经元死亡[6-7]。丙泊酚有拮抗NMDA受体的作用,但其作用是否与调控BNDF的表达有关仍不清楚。本实验采用离体海马脑片损伤模型,观察海马CA1区诱发电位和BDNF表达的变化,以探讨丙泊酚对于NMDA毒性损伤保护作用的可能机制。
1 材料与方法
1.1 材料
1.1.1实验动物与分组 雄性昆明小鼠(徐州医科大学实验动物中心提供),体质量20~26 g,随机分为对照组、损伤组和丙泊酚组(1、5、10 μmol/L)。
1.1.2仪器与试剂 MEZ-8301微电极放大器(日本光电)、SEN-3301刺激器(日本光电)、ZQP-86振动切片机(上海海天电子仪器公司)、HXD-2000处理分析软件(北京华翔公司)。丙泊酚购自英国AstraZeneca公司,NMDA购自美国Sigma公司,兔多克隆一抗购自美国Santa Cruz公司。人工脑脊液(ACSF)成分及含量(mmol/L):NaCl 124 mmol/L,KCl 3.3 mmol/L,NaH2PO41.24 mmol/L,MgSO42.4 mmol/L,NaHCO325.7 mmol/L,CaCl22.4 mmol/L,葡萄糖10.0 mmol/L,pH 7.35~7.45。
1.2 方法
1.2.1离体海马脑片的制备 小鼠麻醉后,断头取脑,然后将脑组织置于95% O2与5% CO2混合气体饱和的ACSF中(0~4 ℃),使用振动切片机切取厚度为400 μm的海马脑片(每组10张脑片),然后将脑片放置在(32.0±0.5)℃的95% O2与5% CO2混合气体饱和ACSF中孵育和恢复2~3 h。实验时将4~5张脑片移入全浸式恒温灌流槽内(32.0±0.5)℃,灌流速度为1.5~2.0 mL/min。
1.2.2实验程序 NMDA毒性实验用含NMDA(0.1、0.5、1.0、2,0 mmol/L)的ACSF灌流脑片,20 min后去除NMDA,再用经95% O2与5% CO2混合气体饱和的ACSF灌流,观察时间至去除NMDA后2 h。实验组给药方法:在NMDA使用前15 min,使用中20 min,去除后15 min这段时间内将不同浓度的丙泊酚(1、5、10 μmol/L)加入灌流液中。对照组无药物处理。
1.2.3顺向群峰电位(OPS)的记录 选取灌流槽内1张脑片,将刺激电极放置在小鼠海马脑片CA3区的Schaffer侧支路径上,记录电极为玻璃微电极(内充2 mmol/L NaCl溶液,电阻为2~10 MΩ),置于CA1区锥体细胞层,可记录到诱发电位。OPS经放大后输入计算机进行数据分析。实验中观察OPS波幅的变化,直至去除NMDA 2 h后OPS的恢复情况。
1.2.4脑片组织损伤测定 采用2,3,5-氯化三苯四氮唑(TTC)染色法测定。去除NMDA 2 h后,灌流槽内的部分脑片用2% TTC染色30 min,漂洗,表面水分用滤纸吸干,脑片称重后,以1 g∶20 mL的比例加入抽提液(乙醇∶二甲亚砜=1∶1),避光密闭保存24 h,抽提液按100 μL 的量分别加入96孔板,酶标仪测定各孔在490 nm处吸光度值。脑片组织损伤率按以下公式计算:组织损伤百分率=(1-A损伤/A对照)×100%。
1.2.5免疫组织化学测试 去除NMDA 2 h后,灌流槽内部分脑片经4%多聚甲醛固定8 h后,用不同浓度的蔗糖进行梯度脱水,连续海马冠状冰冻30 μm切片。采用SP法,切片经3%过氧化氢(H2O2)处理消除内源性过氧化物酶的活性,冲洗后加羊血清进行封闭处理,然后滴加兔多克隆BDNF一抗(1∶200稀释),放置在4 ℃冰箱内过夜,冲洗后滴加羊抗兔二抗,37 ℃下孵育1 h,冲洗后滴加辣根过氧化物酶标记的链霉卵白霉素工作液,37 ℃下孵育1 h,冲洗后二氨基联苯胺(DAB)显色,然后贴片、脱水、透明和封片。
1.3观察指标 电生理实验OPS恢复幅度:去除NMDA 2 h后OPS波幅与初始OPS波幅的百分比。免疫组织化学结果采用图像分析处理系统进行灰度分析,每张切片在高倍镜下计数海马CA1区阳性细胞的染色强度,以背景灰度值减去测量处灰度值后的平均值作为最终灰度值。

2 结 果
2.1NMDA毒性对脑片损伤的影响 在加入NMDA(0.1 mmol/L)后海马脑片CA1区OPS振幅增大,并一直维持到去除NMDA 2 h后。在加入NMDA(0.5 mmol/L)后OPS逐渐减小,去除NMDA 2 h后OPS恢复程度降低,海马脑片损伤率增加。在加入NMDA(1.0、2.0 mmol/L)后OPS在20 min内消失,去除NMDA 2 h后OPS恢复程度均明显降低,海马脑片损伤率明显增加,见表1。
2.2丙泊酚对NMDA毒性损伤后脑片OPS的影响 在损伤组去除NMDA(1 mmol/L)2 h后海马脑片CA1区OPS恢复程度较低。丙泊酚(5、10 μmol/L)可明显提高OPS恢复程度,与损伤组比较,差异有统计学意义(P<0.01),见表2、图1。
2.3丙泊酚对NMDA毒性损伤后脑片组织损伤的影响 在损伤组去除NMDA(1 mmol/L)2 h后海马脑片损伤率较大。丙泊酚(5、10 μmol/L)可使损伤率明显降低,与损伤组比较,差异有统计学意义(P<0.05),见表2。
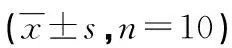
表1 不同浓度NMDA对海马脑片损伤的影响
*:P<0.05,#:P<0.01,与NMDA(0.1 mmol/L) 比较
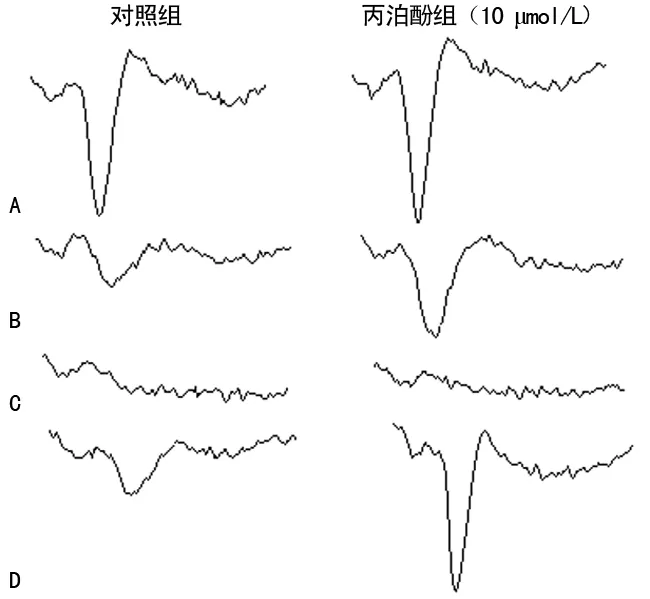
A:NMDA损伤前;B:NMDA损伤4 min;C:NMDA损伤20 min;D:NMDA损伤后2 h图1 NMDA损伤时海马脑片OPS的变化
2.4丙泊酚对NMDA毒性损伤后脑片BDNF表达的影响 在对照组海马脑片上CA1区BDNF阳性细胞有表达。在损伤组加入NMDA(1 mmol/L)后海马脑片BDNF阳性细胞表达略有增高,但与对照组相比无明显差异(P>0.05)。丙泊酚(5、10 μmol/L)可使BDNF阳性细胞表达明显增多,染色加深,与损伤组比较,差异有统计学意义(P<0.05或P<0.01),见表2、图2。
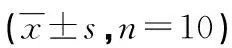
表2 丙泊酚对NMDA毒性损伤后海马脑片损伤率、OPS振幅和BDNF表达的影响
*:P<0.05,#:P<0.01,与损伤组比较;△:P<0.01,与对照组比较

A:对照组;B:丙泊酚组(10 μmol/L);C:损伤组图2 NMDA损伤时海马脑片BDNF表达的变(化SP法×200)
3 讨 论
在离体海马脑片上,当电刺激CA3锥体细胞发出的Schaffer侧枝纤维时,通过突触传递,可在CA1锥体细胞层记录到顺向诱发的场电位,即OPS。海马CA1区是脑损伤的敏感区域,而损伤后OPS的振幅值大小代表突触传递功能的恢复程度[8-9]。实验中在灌流液中加入浓度为0.1 mmol/L NMDA后海马CA1区OPS振幅增加,提示激动NMDA受体,产生兴奋神经元作用。随着NMDA浓度增加,过度激动NMDA受体,转而抑制脑片神经元的OPS,去除NMDA后,脑片组织有明显损伤,OPS恢复程度低,提示对突触传递产生明显抑制效应而表现毒性作用。
丙泊酚作为全身麻醉药物主要通过抑制中枢的兴奋性突触传导和(或)加强抑制性突触传递而发挥麻醉作用[10]。有研究表明,丙泊酚通过激活抑制性γ-氨基丁酸受体(GABAA受体)影响离子型NMDA受体通道电流,对NMDA受体通道也有直接抑制作用[11-12],丙泊酚可通过抑制NDMA受体,从而保护神经细胞。本实验中丙泊酚可明显减轻脑片组织损伤,提高海马CA1区OPS恢复程度,提示丙泊酚可拮抗NMDA诱导的兴奋性毒性作用,从而减轻细胞损伤,有利于突触传递功能的恢复。
有研究表明,BDNF可增强海马突触后NMDA受体的磷酸化,迅速增加神经元之间的突触传递[13]。在脑损伤发生时可导致BDNF的表达广泛增加,而且脑组织抵抗损伤的能力与BDNF表达水平呈正相关[14-15]。在实验中NMDA可使海马脑片CA1区BDNF表达增强,说明当神经元受到外来因素损伤时BDNF水平提高是一种保护性反应。丙泊酚可使BDNF表达明显增强,从而提高脑内BDNF的表达尤其是脑内易损区的BDNF表达,可能是其保护作用的重要途径之一。
当细胞外液中NMDA水平持续增高,构成NMDA毒性环境,造成细胞损伤,抑制细胞间的突触传递,而此时细胞的自我保护机制亦启动,BDNF的表达开始增加。本实验结果提示,丙泊酚可通过增强BDNF的表达,减轻神经元的损伤,使得神经突触之间的连接保持正常,从而促进突触传递效能的恢复。
