苏氨酸氯化生成饮用水中消毒副产物三氯丙酮的机制
2016-08-06丁春生章梦青邹邦文李乃军
丁春生,章梦青,邹邦文,李乃军
苏氨酸氯化生成饮用水中消毒副产物三氯丙酮的机制
丁春生,章梦青,邹邦文,李乃军
(浙江工业大学建筑工程学院,浙江 杭州 310014)
摘要:为了考察饮用水中消毒副产物三氯丙酮(TCAce)的形成过程和影响因素,采用气相色谱-质谱法,以甲基叔丁基醚为萃取剂,1,2-二溴丙烷为内标物,建立了消毒副产物三氯丙酮(TCAce)的测定方法。以 L-苏氨酸为前体,考察在不同反应条件下三氯丙酮的生成效果,并探讨了TCAce的形成途径。结果表明:TCAce的生成量在碱性条件下高于中性和酸性条件,在5.5~8.5的pH范围内,随着pH的增大而逐渐提高。在试验条件下,当氯投加量由5.46 ml增加到21.84 ml时,TCAce的生成量随投氯量的增加而增加。当前体物L-苏氨酸投加量由59.6 mg·L-1增加到476.4 mg·L-1时,TCAce的生成量随投加量的增大而减小,当反应温度由10℃增加到30℃时,TCAce的生成量随之增加。HClO氯化L-苏氨酸形成TCAce的过程包含7个步骤,包括取代、氧化、氨基重氮化和还原等复杂的过程。
关键词:色谱;溶剂萃取;三氯丙酮;前体;过程控制;形成机制
引 言
在饮用水处理中采用氯作为消毒剂会产生多种消毒副产物[1-3],如生成三卤甲烷、卤乙酸、卤代硝基甲烷等,这些消毒副产物对人体有致癌、致畸和致突变作用[4-7]。随着水源污染问题日益突出,需要严格控制常规氯化消毒副产物如三卤甲烷(THMs)、卤乙酸( HAAs) 等在饮用水中的含量。氯代丙酮(CAces)是THMs形成过程中的重要中间产物[8],其中三氯丙酮(TCAce)发生碱催化水解生成 THMs(CHCl3)。同时,氯代丙酮本身也是DBPs,广泛存在于饮用水中,早有研究发现,二氯丙酮(DCAce)和三氯丙酮(TCAce)的细胞毒性和基因遗传毒性较强,能够破坏DNA和染色体,具有致癌、致畸和致突变作用[9]。
目前,国内外较缺乏有关氯代丙酮(CAces)形成机理和控制方法的研究。因此系统地研究CAces形成过程及控制方法,将促进饮用水安全领域的发展。DBPs的前驱物种类众多[10],一些小分子有机物如氨基酸等是原水中前驱物质的重要来源[11-12],氨基酸类化合物是水体中广泛存在的污染物[13]。有研究发现水体中的氨基酸是氯代丙酮类消毒副产物的前体[14-16],苏氨酸是一种常见的氨基酸,广泛地应用于有机化学领域[17]。本文将以L-苏氨酸为前体,考察TCAce的形成过程和影响因素,并探讨TCAce的形成途径。
1 试验部分
1.1 试剂、材料与仪器
试剂与材料:L-苏氨酸、氢氧化钠、盐酸、氯化铵、磷酸氢二钠、磷酸二氢钾和无水硫酸钠均为分析纯试剂,混标(内含TCAce)标准品、甲基叔丁基醚和1,2-二溴丙烷均为市售色谱纯试剂。
试验所用仪器主要为:岛津国际贸易(上海)有限公司GC-MS QP2010plus型气质联用仪;Hach公司Sension 3型pH测定仪;dragon公司1000 μl移液枪;华利达HYG- II Refrigerator shaker型恒温振荡器;Sartorius公司BS223S型电子天平;宁波新芝生物科技有限公司超声波扫频清洗机。
1.2 溶液配制
1.2.1 配制L-苏氨酸溶液 用电子天平称取0.1191 g 的L-苏氨酸固体,将其溶于去离子水中,并加去离子水至1000 ml,即得到119.1 mg·L-1的L-苏氨酸溶液。
1.2.2 配制磷酸缓冲溶液 分别用电子天平称取14.58 g的磷酸氢二钠和3.53 g的磷酸二氢钾,并加蒸馏水至1000 ml,振荡至全部溶解后,所得缓冲溶液的pH即为7.0。
1.2.3 配制氯化铵溶液 用电子天平称取1.0698 g 的NH4Cl固体,并加蒸馏水至50 ml。粉末全部溶解后,所得的溶液为21.396 g·L-1。
1.2.4 配制目标物三氯丙酮 该试验中选用的TCAce标准液浓度为2.0 mg·ml-1,选用甲基叔丁基醚对 TCAce标准液稀释,稀释后浓度达到 20 µg·ml-1,放于棕色瓶中避光冷藏保存。
1.3 实验方法
实验采用液液萃取(LLE)和GC-MS进行检测[18]。取不同浓度的L-苏氨酸溶液(59.6、119.1、238.2、476.4 mg·L-1),加入50 ml的pH=7.0的磷酸缓冲溶液,分别控制溶液的pH(5.5、6.0、6.5、7.0、7.5、8.0、8.5)、投氯量(5.46、10.92、16.38、21.84 ml)和温度(10、20、30℃),定容至1000 ml,此时记为反应开始时间。取反应液100 ml至锥形瓶中,一定时间后(5、10、20、30、50、70、100、160、240 min),加入氯化铵溶液终止反应,氯化铵的投加量约为初始投氯量的2倍,快速振荡锥形瓶,取样分析。
1.4 分析方法
1.4.1 水样的预处理
(1)取25 ml水样置于萃取瓶中,用电子天平称取已在600℃的马弗炉中烘2 h的无水硫酸钠8 g倒入萃取瓶中,放在振荡器 (720 r·min-1) 上振荡,至全部溶解。
(2)移取2 ml MTBE萃取剂(内标1,2-二溴丙烷浓度为150 µg·L-1)于上述已经加入水样的萃取瓶中,然后放在上述已经调好振荡速度的振荡器上振荡5 min,振荡结束后取下静置5 min待其分层。
(3)移取适量的(0.5~1 ml)上层液体(即醚层)于1 ml的样品瓶中,密封后放入GC-MS中分析。
1.4.2 分析条件
(1)色谱条件:进样口的温度为150℃,检测器的温度为250℃,柱头压为109.2 kPa,离子源采用EI电子源,电子能量70 eV;溶剂延迟时间5 min,不分流进样1 µl。
(2)升温程序:柱箱初始温度为35℃,保持5 min;然后以20℃·min-1的速率升高至120℃;再以 30℃·min-1的速率升高至 160℃;最后以 20 ℃·min-1的速率升高至180℃,并保持5 min。
(3)色谱条件:色谱柱为Rtx-5毛细管色谱柱,载气为高纯氦气,定量离子TCAce为m/z 43(参考离子m/z 117),1,2-二溴丙烷为m/z 41,采用SIM模式定量TCAce测定浓度。
1.4.3 绘制工作曲线 用20 µg·ml-1混标溶液配制浓度为5、10、20、40、70、100 µg·L-1的标准溶液用于校正,并采用GC-MS对这6个样品进行分析。按以上试验步骤进行实验,以响应值-浓度绘制TCAce的工作曲线。内标:将1,2-二溴丙烷溶解于甲基叔丁基醚(MTBE)中,进行稀释得到ρ=150 µg·L-1的标准溶液。最后所得到标准曲线相关系数大于0.99,因此该标准曲线的直线线性良好。
图1和图2是100 µg·L-1的含TCAce的消毒剂混标在SIM模式下的气相色谱图。

图1 TCAce在GC-MS中的色谱图Fig.1 Chromatogram of TCAce on GC-MS
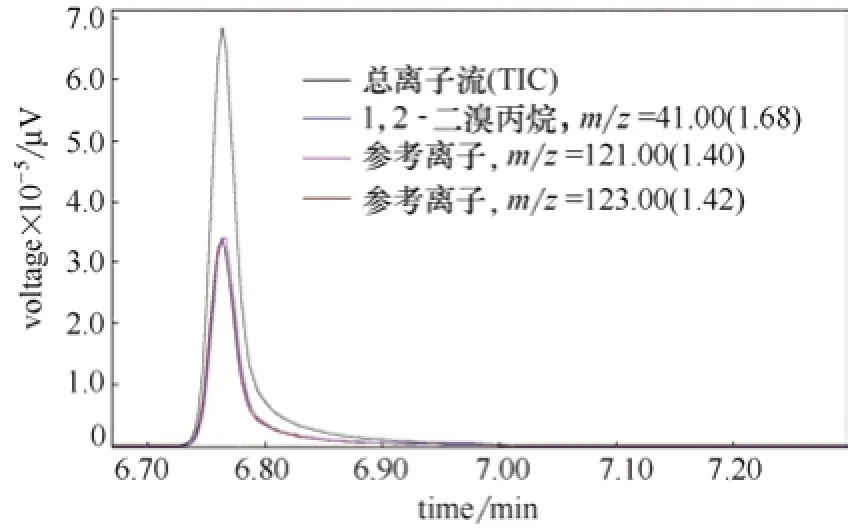
图2 内标1,2-二溴丙烷在GC-MS中的色谱图Fig.2 Chromatogram of TSTD on GC-MS
由图1和图2可知,TCAce的保留时间为6.558 min,内标1,2-二溴丙烷(TSTD)的保留时间为6.765 min,TCAce和内标得到了较好的分离。每个定性的组分的浓度根据其所产生的峰面积与标准物质所产生的峰面积的比进行定量。
2 结果与讨论
2.1 三氯丙酮形成的影响因素
2.1.1 pH对反应过程的影响 在 L-苏氨酸投加量为119.1 mg·L-1,投氯量为21.84 ml,T=20℃,pH=5.5~8.5的条件下,考察pH对L-苏氨酸氯化生成TCAce的影响,所得结果如图3所示。
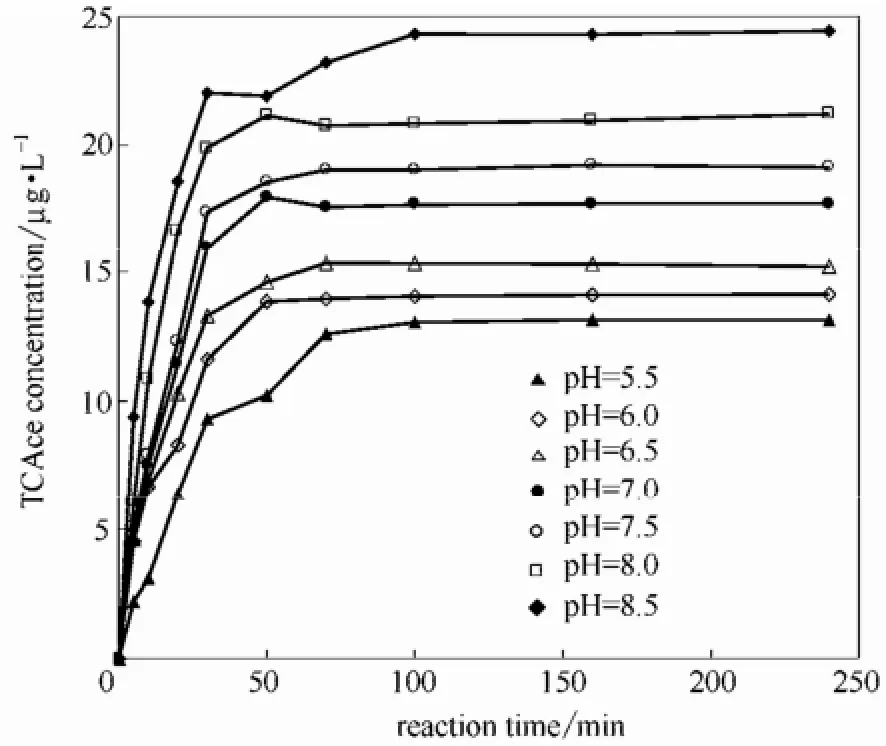
图3 pH对L-苏氨酸氯化生成TCAce的影响Fig.3 Effect of pH on TCAce formation
从图3可知,随着反应时间的增加,TCAce的生成浓度逐步升高,反应的前30 min是快速生成阶段,TCAce的生成量基本上可以达到总量的80%~90%,30~70 min是慢速生成阶段,70 min以后TCAce的生成基本停止。同时pH越大,TCAce的生成浓度也越大,在达到碱性条件时,TCAce的生成量明显升高。这主要是因为次氯酸的弱酸性而产生的氧化和取代反应。
HClO是弱酸,在水中部分电离,因此在不同pH条件下溶液中HClO和ClO-的分布不同,当pH 为5.5时,HClO和ClO-的分布系数分别为0.99,0.88;当pH增加至8.5时,HClO和ClO-的分布系数分别为0.08和0.99[19]。HClO和ClO-在化学反应中不仅有氧化作用而且也会有取代作用。
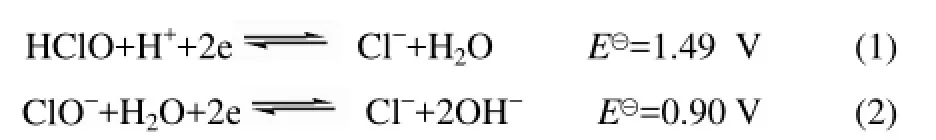
从式(1)和式(2)可知,标准电极电位HClO/Cl-比 ClO-/Cl-的高[20]。因此,HClO主要存在于酸性条件下,因此对于L-苏氨酸而言氧化作用强于取代作用;溶液中ClO-主要存在于碱性条件,ClO-的氧化能力不是很强,因此L-苏氨酸取代作用强于氧化作用。所以,当pH升高TCAce生成量也会随之增加[21]。
2.1.2 投氯量对反应过程的影响 在pH=7.0,投加L-苏氨酸119.1 mg·L-1,T=20℃,加氯5.46~21.84 ml时,考察投氯量对L-苏氨酸生成TCAce的影响,结果如图4所示。
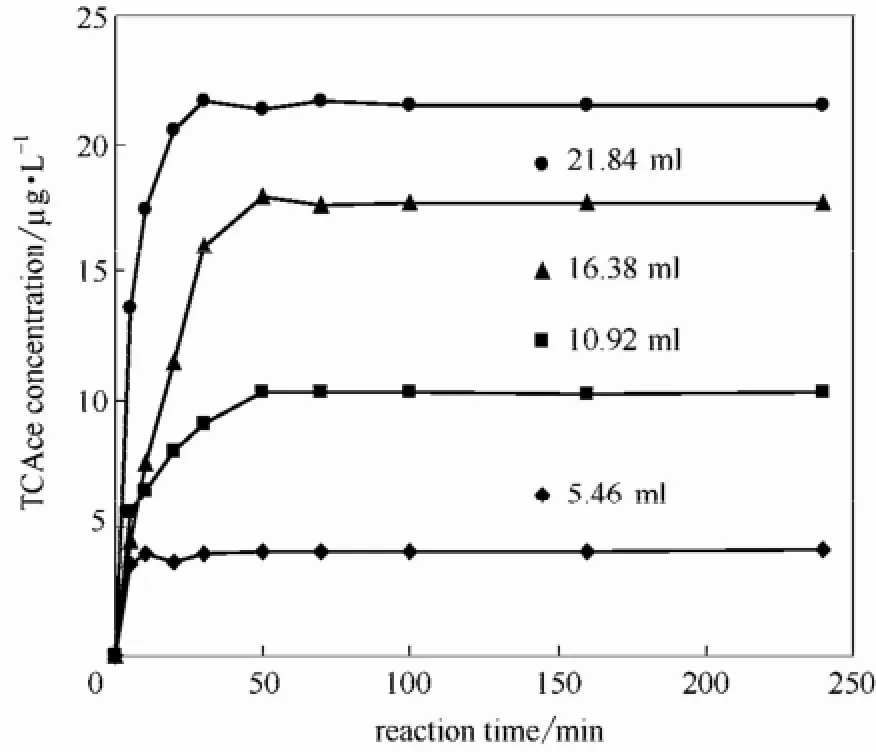
图4 投氯量对L-苏氨酸氯化生成TCAce的影响Fig.4 Effect of chlorine dosage on TCAce formation
从图4可知,反应进行70 min后,氯的投加量由5.46 ml按5.46 ml幅度增加到21.84 ml时,生成的TCAce渐渐增大,分别为4.069、10.328、17.580 和21.680 µg·L-1。可能的原因之一是随着氯投加量的增加,会氯化越来越多的L-苏氨酸,因此生成更多的TCAce[22]。
2.1.3 温度对形成过程的影响 当投加 L-苏氨酸119.1 mg·L-1,加氯21.84 ml,pH=7.0,T=10~30℃时,考察温度的变化对L-苏氨酸氯化生成TCAce的影响,结果见图5。
从图5中可知,反应进行70 min后,当温度从10℃增加到30℃时,生成的TCAce越来越多,分别为8.858、17.580和18.239 µg·L-1。这主要是因为随着温度增加,分子动能也会增加,不同分子之间发生碰撞的概率也会越大,因此,生成的TCAce就越多。所以,温度对L-苏氨酸氯化形成TCAce的过程有很大的影响,在10~30℃范围内,当温度逐渐升高TCAce的生成量也越来越多[23]。
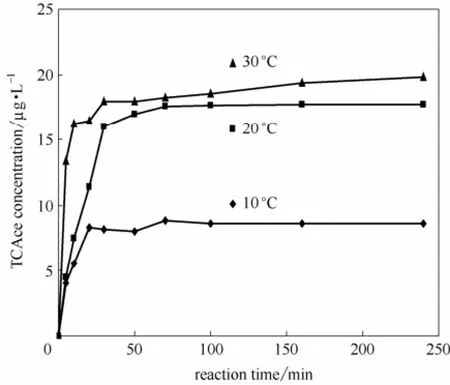
图5 温度对L-苏氨酸氯化生成TCAce的影响Fig.5 Effect of reaction temperature on TCAce formation
2.2 TCAce的形成
生成TCAce的反应过程如下。
前3步的反应为L-苏氨酸被HClO取代生成三氯代L-苏氨酸

然后式(6)生成的产物继续和HClO反应,碳键断裂
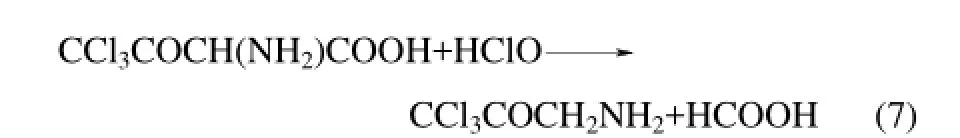
最后两步反应为式(7)生成的产物首先氨基重氮化,然后再还原成H原子,最终生成TCAce
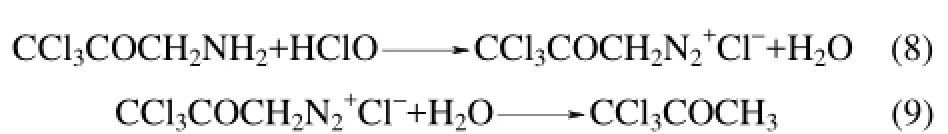
L-苏氨酸氯化生成TCAce的路径如下[24]

3 结 论
(1)在L-苏氨酸氯化生成TCAce过程中,pH、投氯量、温度和L-苏氨酸投加量都是TCAce生成的重要影响因素。TCAce的生成量在碱性条件下比中性和酸性条件下高,随着pH的增大而逐渐提高。当投氯量由5.46 ml增加到21.84 ml时,TCAce的生成量随着投氯量的增加而增加。在L-苏氨酸氯化形成TCAce的过程中温度起着非常重要的作用,从10~30℃温度逐渐升高TCAce的生成量越来越大。
(2)HClO氯化L-苏氨酸形成TCAce首先是HClO与L-苏氨酸发生取代反应,L-苏氨酸被取代生成三氯代 L-苏氨酸;然后,三氯代 L-苏氨酸被HClO氧化;接着,上一步的反应产物在HClO的作用下碳键断裂;最后,上一步反应产物中的氨基重氮化后再被还原,生成TCAce。
References
[1] RICHARDSON S D, PLEWA M J, WAGNER E D, et al. Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: a review and roadmap for research[J]. Mutat. Res.-Rev. Mutat. Res., 2007, 636(1/2/3): 178-242.
[2] 丁春生, 沈嘉辰, 缪佳, 等. 改性活性炭吸附饮用水中三氯硝基甲烷的研究[J]. 中国环境科学, 2013, 33(5): 821-826.
DING C S, SHEN J C, MIAO J, et al. Adsorption of trichloronitromethane in drinking water by modified activated carbon[J]. China Environmental Science, 2013, 33(5): 821-826.
[3] 孟丽苹, 董兆敏, 胡建英. 全国自来水厂卤乙酸浓度调查、风险评估与标准建议[J]. 中国环境科学, 2012, 32(4): 721-726.
MENG L P, DONG Z M, HU J Y. National survey and risk assessment of haloacetic acids in drinking water in China for reevaluation of the drinking water standards[J]. China Environmental Science, 2012, 32(4): 721-726.
[4] 葛元新, 朱志良, 陆雍森, 等. 饮用水消毒的健康风险分析及评价[J]. 净水技术, 2006, 25(3): 1-5.
GE Y X, ZHU Z L, LU Y S, et al. Analysis and assessment of health risk on disinfection of drinking water[J]. Water Purification Technology, 2006, 25(3): 1-5.
[5] MARK J N, MIREILLE B T, NAOMI E E. Chlorination disinfection by products in water and their association with adverse reproductive: a review [J]. Occupational and Environmental Medicine, 2000, 57: 73-85.
[6] ARDIFF R G, CARSON M L, GINERAN M E. Updated weight of evidence for an association between adverse reproductive and developmental effects and exposure and exposure to effects and exposure to disinfection by products [J]. Regul. Toxicol. Pharmacol., 2006, 45: 185-205.
[7] KOIVUSALO M, PUKKALA E, VARTIAINEN T, et al. Drinking water chlorination and cancer historicalcohort study in Finland [J]. Cancer Causes Control, 1997, 8(2): 192-200.
[8] 高乃云, 楚文海. 饮用水中氯代丙酮类消毒副产物的分析方法研究[J]. 水工业市场, 2011, 7: 39-42.
GAO N Y, CHU W H. Analysis method in chlorinated drinking water disinfection by-products of acetone category[J].Water Industry Market, 2011, 7: 39-42.
[9] FRANK L C, DANIEL M, FRANCOISE E. Study of the genotoxic activity of five chlorinated propanones using the SOS chromotest, the ames-fluctuation test and the newt micronucleus test[J]. Mutation Research /Genetic Toxicology and Environmental Mutagenesis, 1994, 341(1): 1-15.
[10] SINGER P C. Humic substances as precursors for potentially harmful disinfection by products[J]. Water Science and Technology, 1999, 40(9): 25-30.
[11] CHU W H, GAO N Y, DENG Y, et al. Precursors of dichloroacetamide, an emerging nitrogenous DBP formed during chlorination or chloramination[J]. Environ. Sci. Technol., 2010, 44(10): 3908-3912.
[12] CHU W H, GAO N Y, DENG Y, et al. Peptide bonds affect the formation of haloacetamides, an emerging class of N-DBPs in drin-king water: free amino acids versus oligopeptides[J]. Sci. Rep., 2015, 5: 14412.
[13] WESTERHOFF P, MASH H. Dissolved organic nitrogen in drinking water supplies: a review[J].Water Supply Res.Technol.-Aqua, 2002, 51: 415-448.
[14] 王超, 胡洪营, 王丽莎, 等. 典型含氮有机物的氯消毒副产物生成潜能研究[J]. 中国给水排水, 2006, 22(15): 9-12.
WANG C, HU H Y, WANG L S, et al. Chlorination byproducts formation potentials of typical nitrogenous organic compounds[J]. China Water &Wastewater, 2006, 22(15): 9-12.
[15] 王海鸥, 陈忠林. 氯胺和联合氯胺控制消毒副产物的研究[J]. 黑龙江大学自然科学学报, 2010, 27(6): 764-773.
WANG H O, CHEN Z L. Study on control of disinfection by-products with chloramines and combined chloramines[J]. Journal of Natural Science of Heilongjiang University, 2010, 27(6): 764-773.
[16] EGOROV A I,TERESCHENKO A A,ALTSHUL L M, et al. Exposures to drinking water chlorination by-products in a Russian city[J]. International Journal of Hygiene and Environmental Health, 2003,206(6): 539-551.
[17] DOSTSON A,WESTERHOF P. Occurrence and removal of amino acids during drinking water treatment[J]. J. Am. Water Work Assoc., 2009, 101: 101-115.
[18] Determination of haloacetic acids and dalapon in drinking water by liquid-liquid extraction, derivatization and gas chromatography with electron capture detection: US EPA Method552. 2 [S]. 1998.
[19] 丁春生. 饮用水中三氯硝基甲烷的形成过程与控制技术研究 [D].昆明: 昆明理工大学, 2012.
DING C S. Research on formation process of trichloromethane, disinfection by-product in drinking water and its control strategies [D]. Kunming: Kunming University of Science and Technology, 2012.
[20] 黄剑明, 需廷国, 胡静, 等. 饮用水氯胺消毒技术应用现状及面临的课题[C]//城镇饮用水安全保障技术研讨会论文集. 深圳, 2004: 418-422.
HUANG J M, XU T G, HU J, et al. Chloramine disinfection of drinking water application status and challenges facing[C]//Urban Drinking Water Safety Technical Symposium. Shenzhen, 2004: 418-422.
[21] CHEN Z, YANG C Y, LU J, et al. Factors on the formation ofdisinfection by-products MX, DCA and TCA by chlorination of fulvic acid fromlake sediments[J]. Chemosphere, 2001, 45: 379-385.
[22] NIKOLAOU A D, LEKKAS T D, GOLFINOPOULOS S K. Kinetics of the formation and decomposition of chlorination by-products in surface waters[J]. Chemical Engineering Journal, 2004, 100: 139-148.
[23] RECKHOW D A, SINGER P C. Mechanisms of organic halide formation during fulvic acid chlorination and implications with respect to preozonation[M]//JOLLEY R L, BULL R J, DAVIS W P, et al. Water Chlorination: Chemistry, Environmental Impact and Health Effects. Chelsea, MI: Lewis Publishers, 1985: 1229-1257.
[24] 徐倩, 徐斌, 覃操, 等. 水中典型含氮有机物氯化生成消毒副产物的潜能研究[J]. 环境科学, 2011, 32(7): 1967-1973.
XU Q, XU B, QIN C, et al. Chlorination byproducts formation potentials of typical nitrogenous organic compounds in water[J]. Journal of Environmental Sciences, 2011, 32(7): 1967-1973.
2015-12-15收到初稿,2016-04-08收到修改稿。
联系人及第一作者:丁春生(1965—),男,博士,教授。
Receievd date: 2015-12-15.
中图分类号:X 131.2;R 123.6
文献标志码:A
文章编号:0438—1157(2016)07—3010—06
DOI:10.11949/j.issn.0438-1157.20151906
基金项目:浙江省自然科学基金项目(Y5110339);浙江省公益性技术应用研究计划项目(2012C23055)。
Corresponding author:Prof. DING Chunsheng, dingcs99@163.com supported by the Natural Science Foundation of Zhejiang Province (Y5110339) and the Public Welfare Technology Applied Research Projects of Zhejiang Province(2012C23055).
Mechanism of chlorination of threonine disinfection by-product trichloroacetone in drinking water
DING Chunsheng, ZHANG Mengqing, ZOU Bangwen, LI Naijun
(College of Civil Engineering and Architecture, Zhejiang University of Technology, Hangzhou 310014, Zhejiang, China)
Abstract:In order to inspect the process of L-threonine chloride to TCAce and its influencing factors, a novel method using methyl tertiary butyl ether (MTBE) as extractant and 1,2-dibromopropane as internal standard for the determination of the disinfection by-products trichloroacetone (TCAce) by gas chromatography mass spectrometry(GC-MS) was described.The formation process of TCAce and its influencing factors were discussed with L- threonine as the precursor during the chloramination process.It was indicated from the formation process that the TCAce amount produced increased with the increase of pH value from 5.5 to 8.5. Under the experimental conditions, it was also shown that when the chlorine dosage increased from 5.46 to 21.84 ml, the TCAce formation amount increased. It was also shown that when the L-threonine dosage increased from 59.6 to 476.4 mg·L-1, the TCAce formation amount decreased. Temperature affected the TCAce formation from L-threonine a lot, especially in the range of 10—30℃. The TCAce formation amount increased with the increase of temperature. The formation process of TCAce chlorided by L-threonine contained substitution, oxidation reaction, amino diazotation, reduction and a series of complicated reaction.
Key words:chromatography; solvent extraction; TCAce; precursor; process control; formation mechanism
