三种混合模式色谱填料色谱性能的比较
2016-08-08董彬彬夏海锋
董彬彬,夏海锋,2
三种混合模式色谱填料色谱性能的比较
董彬彬1,夏海锋1,2
(1江南大学工业生物技术教育部重点实验室,江苏 无锡 214122;2江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
摘要:以γ-缩水甘油醚氧丙基三甲氧基硅烷为中间活化剂,将3-氨基吡啶、2-巯基苯并咪唑和2-巯基-1-甲基咪唑3种杂环配基键合到粒径为5 μm、孔径为30 nm的球形硅胶上,制备3种高效疏水电荷诱导色谱填料。利用溶菌酶、牛血清白蛋白和免疫球蛋白G作为模型蛋白,考察其在3种不同配基色谱柱上的保留行为和分离行为。比较了3种不同性质的模型蛋白在不同色谱柱上的色谱性能的异同。发现以2-巯基-1-甲基咪唑为配基的色谱柱具有良好的pH控制色谱行为和良好的分离性能,初步验证了高效疏水电荷诱导色谱的分离模式及潜在应用。
关键词:生物分离;蛋白质;高效液相色谱;疏水电荷诱导色谱;保留因子;分离行为
引 言
高效液相色谱技术(high performance liquid chromatography,HPLC)是发展于20世纪60年代的一种快速、灵敏的色谱技术[1],广泛应用于小分子[2-4]和大分子[5-7]等各种领域的分析和分离。高效液相色谱从分离模式出发可以分为高效反相色谱、高效亲和色谱、高效离子交换色谱、高效体积排阻色谱等几大类,其中高效反相色谱运用最为广泛。近年来,一些与HPLC相关的新的衍生或复合技术也被逐渐发展起来,如高效液相-质谱联用[8]、超高效液相[9]、高效液相色谱-多壁碳纳米管固相萃取[10]、高效液相毛细管电泳[11]等,不仅丰富了HPLC的研究范畴,也为化合物的精细分离和分析提供了新的技术突破。尽管如此,传统HPLC本身的分离模式通常为单一模式,即利用一种溶质和固相的相互作用关系进行几种溶质之间的分离,在实际应用中,针对不同的分离对象往往需要依据其体系的理化性质选择不同的分离方法。
在蛋白质色谱领域,混合模式色谱(mixed-mode chromatography,MMC)是近二十多年来发展起来的一类新型方法。混合模式指色谱介质上的配基包含两种或两种以上的作用模式[12],能够与目标生物分子发生多种相互作用,并且其功能往往具有互补性或协同性。在此之中,以疏水作用和电荷作用相结合的疏水电荷诱导色谱(hydrophobic charge-induction chromatography,HCIC)是MMC的典型代表[13]。HCIC结合了配基与蛋白质之间的疏水或亲硫作用力以及配基带电基团与蛋白质之间的电荷排斥力两种作用力,能够依靠pH的调节进行蛋白质的吸附与解吸[14-15],在抗体 IgG[16]和IgY[17]、青霉素酰基转移酶[18]等亲和分离中有着成功的应用。典型的疏水电荷诱导配基主要有4-氨基吡啶[14]、2-巯基-1-甲基咪唑[19]、4-巯基乙基吡啶[20]、2-巯基苯并咪唑[21]等。
基于HCIC的技术特点,作者将疏水电荷诱导作用引入到高分辨率的高效液相色谱中,克服了高效液相分离模式单一的缺点,形成了一种疏水作用促进吸附和电荷排斥作用协助洗脱的混合模式的新型色谱,从而利用疏水和电荷两种作用力之间的平衡和转换进行不同蛋白的分离和分析。在前期工作中,郑梦杰等[22]以4-巯基吡啶为配基,以BSA和溶菌酶为模型蛋白对此混合模式色谱进行了色谱行为的初步探索,基本验证了这种分离模式的可行性。本文在此基础上进一步拓展配基范围,利用在常压HCIC模式下表现良好的几种典型的疏水电荷诱导配基,考察3-氨基吡啶、2-巯基苯并咪唑和2-巯基-1-甲基咪唑3种不同杂环化合物作为此类配基的可能性,探索了模型蛋白在不同色谱柱的保留行为和分离行为,进一步解释此类型混合模式色谱的色谱性能。
1 实验材料和方法
1.1 主要试剂与仪器
试剂:硅胶微球(5 μm,30 nm,无锡加莱克色谱科技有限公司);γ-(2,3-环氧丙氧)-丙基三甲氧基硅烷(KH560,上海耀华);2-巯基-1-甲基咪唑、3-氨基吡啶、2-巯基苯并咪唑(阿拉丁试剂);溶菌酶(Lys)(pI 10.8,国药集团化学试剂有限公司);牛血清蛋白(BSA)(pI 4.7,生工生物工程有限公司);免疫球蛋白G(IgG、)(pI 7.0,由本实验室从牛初乳中纯化获得,HPLC纯度98%);其他试剂皆为市售分析纯。
仪器:弗鲁克 FLUKO 搅拌器 R30,上海京工实业有限公司;THZ-82A 水浴恒温振荡器,金坛市顺华仪器有限公司;Agilent 1260 Infinity 液相色谱仪,美国安捷伦科技有限公司。
1.2 硅胶的预处理
将浓盐酸和去离子水配成20%的盐酸溶液与硅胶微球混合,将其加热至 100℃,转子加热搅拌反应回流8 h,然后用大量去离子水进行抽滤,直到洗至中性为止,放置在110℃烘箱中烘8 h,然后置入90℃真空干燥箱中,储存备用。
1.3 硅胶的环氧活化
称取5.0 g预处理过的硅胶微球于250 ml三口圆底烧瓶,量取50 ml干燥的甲苯于三口烧瓶中,在N2保护下,磁力搅拌分散30 min。待到除尽空气后,加入5 ml KH560,将温度升至90℃,用油浴加热回流搅拌 6 h。待反应结束后,使用大量的甲苯和丙酮溶液洗涤,直到无黏稠物质出现为止,放入 120℃烘箱中干燥过夜,然后放在干燥器中冷却备用。
1.4 配基的偶联
将KH560活化的硅胶微球加入到250 ml锥形瓶,加入50 ml pH 7.5的0.1 mol·L-1PBS缓冲液、5 ml二甲亚砜和 0.2 g 配基,在 40℃、转速 180 r·min-1的条件下,反应6 h。待反应结束后,分别用大量的乙醇和去离子水溶液洗涤。加入 100 ml 1% 巯基甘油溶液(含pH 7.5 0.5 mol·L-1NaCl)使环氧基团充分反应完全,反应2 h,反应后用大量去离子水洗涤。35℃真空干燥12 h。2-巯基苯并咪唑和3-氨基吡啶的偶联同按上述方法。
1.5 活化密度和偶联密度的测定
环氧活化密度的测定采用硫代硫酸钠法[22]。取活化后的KH560硅胶M1加入过量的1.3 mol·L-1的硫代硫酸钠溶液,在30℃下180 r·min-1水浴摇床反应4 h,加入两滴酚酞指示剂,用0.01 mol·L-1的盐酸滴定至无色,记录下消耗盐酸的体积V1。活化密度C1根据式(1)计算

环氧基团与配基的偶联密度采用酸碱滴定的方法[14],取已偶联的配基介质M2,加入2.5 ml 0.1 mol·L-1的NaCl缓冲液。用0.1 mol·L-1的盐酸溶液滴定到pH=3.8[14],记录消耗的盐酸体积V2,根据式(2)计算偶联密度C2

1.6 保留因子的测定
保留因子的测定采用等度洗脱3种蛋白BSA、溶菌酶和 IgG。考虑到硅胶微球偶联的配基在pH=2~8最为稳定,因此以pH 2.2时空白硅胶微球色谱柱的保留时间作为T0,峰面积作为A0,以3种色谱柱在各个点的pH保留时间为TR,峰面积为AR,分别以式(3)、式(4)计算在不同的pH流动相中时间保留因子KT和峰面积保留因子KA。

1.7 高效液相色谱条件
色谱柱:4.6 mm×250 mm(无锡加莱克色谱科技有限公司委托填装);检测波长:280 nm;流速: 0.8 ml·min-1;柱温:30℃。保留因子测定流动相组成:各个pH组分的0.01 mol·L-1的K2HPO4-H3PO4缓冲液(以0.1 mol·L-1HCl和0.1 mol·L-1NaOH调节pH)。等度洗脱流动相配制组成:pH 2.5 含10%乙腈的0.01 mol·L-1的K2HPO4-H3PO4缓冲液。梯度洗脱流动相配制组成:A液为pH 4的0.01 mol·L-1的H3PO4-K2HPO4,B液为pH 2的含10%乙腈的0.01 mol·L-1的K2HPO4-H3PO4,梯度时间20 min(A液到B液),随后恒定B液10 min。模型蛋白BSA、溶菌酶和IgG浓度均为1 mg·ml-1,进样量为10 μl,连续进样3次,计算各自的洗脱时间保留因子和峰面积保留因子。
2 实验结果与讨论
2.1 硅胶微球的环氧活化和偶联
已经在前期工作[21]中考察了 KH560进行硅胶微球的环氧活化,活化密度主要受KH560添加量、反应时间和反应温度的影响。本文以 1 ml KH560硅胶、90℃反应6 h的条件,获得了175 μmol·g-1的活化硅胶,在pH=7.5的PBS含10% DMSO缓冲液中,以 n(配基):n(活化环氧基团)=10:1的配比,在 180 r·min-1、最优温度的水浴摇床中反应6 h,进行3-氨基吡啶、2-巯基苯并咪唑、2-巯基-1-甲基咪唑 3种配基的偶联,结果如表1所示。

表1 3种HPHCIC配基的偶联条件、偶联密度及其pKa值Table 1 Reaction condition, ligand density and pKaofthree HPHCIC ligands

图1 3-氨基吡啶时间保留因子Fig.1 Effect of mobile phase pH on retention factor of time on 3-aminopyridine
从表中可以看出,2-巯基苯并咪唑最优配基的密度要远远小于3-氨基吡啶和2-巯基-1-甲基咪唑,造成这种现象的原因是2-巯基苯并咪唑配基的苯环使空间位阻过大,阻碍了巯基基团与环氧基团的反应,虽然升高温度能够使反应速率加快,但同时也加快了水解速率。所以这双重作用导致了2-巯基苯并咪唑配基密与环氧基结合的能力降低。
2.2 流动相pH对3种蛋白的保留因子的影响
图1~图6分别显示了流动相pH对3种模型蛋白(Lys、BSA和IgG)在3种配基(3-氨基吡啶、2-巯基苯并咪唑、2-巯基-1-甲基咪唑)色谱柱上的保留因子的影响。理论上,0≤KT≤+∞,0≤KA≤1。当蛋白质与配基之间无相互作用力时,KT和KA均为 0,即蛋白质不保留;当蛋白质完全吸附于配基上,KT为+∞而KA为1,即蛋白质完全保留。本文中pH的测定范围为2.2~6.0,图1、图3和图5(时间保留因子 KT)中没有标注的点为完全保留,其KT值为+∞;相应地,完全保留时图2、图4和图6中的KA值均为1。

图2 3-氨基吡啶峰面积保留因子Fig.2 Effect of mobile phase pH on retention factor of mass on 3-aminopyridine

图3 2-巯基苯并咪唑时间保留因子Fig.3 Effect of mobile phase pH on retention factor of time on 2-mercapto benzimidazole

图4 2-巯基苯并咪唑峰面积保留因子Fig.4 Effect of mobile phase pH on retention factor of mass on 2-mercapto benzimidazole
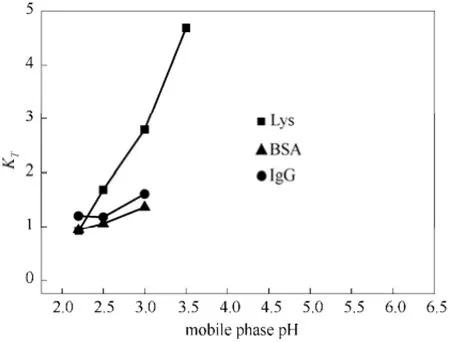
图5 2-巯基-1-甲基咪唑时间保留因子Fig.5 Effect of mobile phase pH on retention factor of time on 2-mercapto-1-methylimidazole

图6 2-巯基-1-甲基咪唑峰面积保留因子Fig.6 Effect of mobile phase pH on retention factor of mass on 2-mercapto-1-methylimidazolel
蛋白质与配基之间的相互作用主要体现在静电作用以及疏水或亲硫作用两个方面。从3种蛋白的pI值可知,当流动相处于较低pH时,3种蛋白的净电荷均为正值,3种杂环配基也均带正电荷,此时蛋白质与配基之间的静电作用是电荷排斥作用。同时,蛋白质与配基的疏水或亲硫作用也受到了环境pH等因素的较大影响:流动相pH通过改变蛋白质的带电性质,影响表面水化层的大小,从而影响疏水区域的暴露水平;同时蛋白质的三维结构也随pH的变化而发生变化,在较低pH下蛋白质的三维结构更易被破坏,疏水基团有可能更多地暴露出来。
蛋白质与配基在不同pH流动相下的作用关系是一个复杂的相互制约的结果。从图1~图6可以发现,保留因子的最低点并不都在pH最低时(pH 2.2)出现。在较低的pH范围内,当pH过低时蛋白质有可能处于变性即三维结构破坏疏水基团暴露的状态,此时尽管pH的减小增加了电荷排斥力,但蛋白质与配基的疏水作用也在增强,因此出峰快慢(KT大小)和出峰量大小(KA大小)取决于疏水作用和电荷排斥作用两者变化幅度大小。而在较高的pH范围内,电荷排斥力迅速下降,蛋白质与配基的相互作用迅速增加,KT和KA值迅速增大,直至不能出峰(完全保留)。比较而言,对于 3-氨基吡啶配基,在低pH段保留因子的变化处于一个相对平稳的状态,3种蛋白中带电荷量更少的BSA的KT和KA先于溶菌酶和IgG升高,体现了电荷排斥力占据了主导作用。对于带咪唑环的2-巯基苯并咪唑和2-巯基-1-甲基咪唑配基,IgG的保留行为在2-巯基-1-甲基咪唑、2-巯基苯并咪唑配基中的表现与其他两种蛋白有较大差异。在过低pH时,IgG会遭到变性,三维结构破坏疏水基团暴露的状态,加强了亲硫吸附和疏水作用力,IgG蛋白的疏水作用力的增强完全盖过了其与配基的电荷排斥,表现出完全吸附(苯并咪唑配基)或大部分吸附(甲基咪唑配基),当pH升高到 3.0~3.5范围,IgG恢复了正常的三维结构,导致亲硫作用急剧减小,有一定的洗出峰,而当升高pH,由于电荷排斥的减小,又表现为较大的或完全的吸附。有文献在研究中报到[23-24],含有咪唑的HCIC配基具有更好的IgG亲和性能,而苯并咪唑由于过于强的疏水性质,尽管吸附量较大,但选择性较弱,本文结果也印证了这一现象。此外,从图5和图6中可以发现,蛋白质在 2-巯基-1-甲基咪唑配基上的保留因子突变宽度较小,即在很小的pH变化范围内,蛋白质完成了从全部保留到不保留,这将有利于蛋白质在梯度范围内被完整洗脱下来,这在后面的结果中也体现出来。

图7 单一流动相下配基对3种蛋白的出峰情况Fig.7 Effect of three proteins’ separation at condition of isocratic elution
蛋白质在配基上的保留因子反映了蛋白质和配基之间的相互作用关系,而不同蛋白质在同一配基上的保留因子的差异正好反映了此配基用于分离不同蛋白质的可能性。不同蛋白质的保留性质差异越大,越有可能产生较大的分离度,而通过条件流动相的pH等条件,又可以进行蛋白之间分离度的调节。从上述结果可发现,3-氨基吡啶虽然有合适的配基密度,但由于氨基基团的作用,其排斥力进一步增加,导致3种蛋白的保留时间失去了选择性。而3种蛋白质在2-巯基苯并咪唑和2-巯基-1-甲基咪唑配基上的保留行为具有更大的差异性,其潜在的分离性能可能更加优越。尽管如此,2-巯基苯并咪唑由于配基密度过小,排斥力小,疏水作用力过强,出峰受到影响,洗脱条件更加剧烈,限制了其应用。
2.3 三种模型蛋白的分离行为
2.3.1 单一流动相下模型蛋白的分离行为 图7是3种不同蛋白在单一流动相条件下在3种不同的配基上的出峰情况。如前所述,蛋白在色谱柱中的保留行为是一个复杂的过程,它与蛋白质和配基之间的疏水相互作用和电荷排斥力直接相关,而且由于蛋白质在色谱柱内与固定相作用时产生的折叠翻转[25-26]等情况,其相互作用又有一些未知的因素会影响蛋白质出峰和峰形。不同蛋白由于分子大小和分子形状的不同,以及硅胶微球具有一定的孔径分布,因此蛋白质之间的分离行为又具有一定的体积排阻作用。同时,从3种配基的保留因子可以发现,蛋白质与配基之间的作用力过于强烈,仅在低pH条件下往往出现无法出峰的情况。此处为减少影响因素,减弱了固定相与流动相之间极性达到减弱其相互作用,加入一定量的乙腈来协助蛋白质的洗出[27]。尽管如此,由于3种蛋白与不同种配基之间的疏水作用力和电荷排斥力大小的不同,导致其分离行为的差异。从图7中可以发现,3种蛋白在不同配基色谱柱的出峰时间均不相同。对于3-氨基吡啶配基[图7(a)],在pH 2.5含有10%乙腈的条件下,IgG和Lys受分子大小而体积排阻的主导先后出峰,而由于BSA的带电量最小,在低电荷排斥的作用下,最后出峰。对于 2-巯基苯并咪唑配基[图 7(b)],在此流动相条件下,由于配基对于 IgG的极大影响,IgG最后出峰,且出峰面积较小。而对于2-巯基-1-甲基咪唑配基[图7(c)],BSA与配基的相互作用表现为更早的出峰,而IgG的出峰时间与苯并咪唑配基类似,但出峰量明显更高。从分离度的角度来看图7(c)中的BSA与Lys基本分开,R=1.42;而Lys与IgG未分开,R=0.67。对比2.2节中3种蛋白质在3种配基上的保留行为,其出峰性质基本与其结果相符合,只是由于乙腈的加入,一定程度上改善了 IgG 和BSA的出峰量。但由于洗脱条件过于单一,不同性质的蛋白质分离度并没有达到理想状态,需要进一步进行考察。
2.3.2 梯度流动相下模型蛋白的分离行为 基于蛋白质在配基上的保留行为,设计了梯度pH流动相洗脱条件,考察模型蛋白的分离行为,如图8所示。对于 3-氨基吡啶配基[图 8(a)],由于带正电荷的氨基的存在以及吡啶基团相对较弱的疏水性质,模型蛋白在梯度范围内均较快的洗脱,其出峰顺序也与蛋白质的带电性质直接相关,依次为 Lys、IgG和BSA。但从图中也发现,Lys和BSA出现了两个峰。推测原因,可能是由于配基分子具有两个位置的正电荷(氨基和吡啶基),导致同种蛋白质在与配基相互接触时可能产生不同的作用力。这种现象的出现不利于蛋白质的分析,因此氨基吡啶配基的应用受到限制。对于2-巯基苯并咪唑[图8(b)],可以发现蛋白质的拖尾非常严重,且出峰的规律性不强,3种蛋白质并没有能够得到很好的分离。这可能与巯基苯并咪唑的高疏水性有关,导致蛋白质在较高pH下被高度地保留,而在此梯度中逐渐被洗脱下来。对于2-巯基-1-甲基咪唑配基[图8(c)],从图中可以总结为:首先Lys、BSA和IgG依次被洗脱下来,其峰形较好,分离明显,且3种蛋白的出峰时间较长,即有较大的保留。蛋白质的保留行为受到了疏水作用、亲硫作用、电荷排斥作用以及分子大小的综合影响。由于IgG与咪唑基团的类特异性亲和作用(疏水和亲硫的结合),因此 IgG在此梯度下有较大的保留,出峰时间达到了21 min,而Lys和BSA受带电荷量的主导,分别先后出峰。图 8(c)中梯度分离度明显要好于等度分离,其中Lys与BSA之间的分离度达到了R=2.29,BSA与IgG之间分离度R=3.96。其次从2.2节保留因子的测定中已经发现,蛋白质在2-巯基-1-甲基咪唑配基上的保留因子随pH的变化有较大的突变,可以认为蛋白质从完全保留到被洗脱发生在较小的pH变化范围内,由此在pH梯度下,蛋白质在相应pH环境中被相对集中地洗脱下来。可见,以2-巯基-1-甲基咪唑为配基的HPHCIC色谱柱很好地再现了蛋白质受疏水电荷诱导作用的行为,更加符合此类混合模式色谱用于蛋白质分离和分析的要求。而且此色谱柱重复性能好,多次重复保留时间误差在0.1 s以内;且使用了一年时间,使用了上千次之久,峰形未有太大的变化,保留时间不提前。

图8 梯度流动相下2-巯基-1-甲基咪唑配基对3种蛋白的出峰情况Fig.8 Effect of three proteins’ separation at condition of gradient elution
3 结 论
本文以KH560为中间活化剂,制备了3种以3-氨基吡啶、2-巯基苯并咪唑和2-巯基-1-甲基咪唑为配基的新型混合模式介质,并利用3种不同性质的模型蛋白质对其色谱性能进行了考察。通过对反应时间、反应温度以及配基与活化基团的比例的考察,优化配基偶联的条件,获得了较高的配基密度。然后通过探索3种蛋白质在3种色谱柱上的保留因子和分离行为,初步获得了3种介质的色谱性能。2-巯基-1-甲基咪唑为配基的色谱柱在单一pH流动相和pH梯度流动相下表现出了较强的受pH控制的蛋白质色谱行为,并且对3种模型蛋白具有较好的出峰性能和分离性能,是一种潜在的蛋白质分离与分析的HPHCIC配基。相较于前期工作,本文选用了更多配基来探索HPHCIC的性能,相应地将配基密度提高了23.5%,把洗脱用乙腈浓度降低到10%,添加了一种新的模型蛋白IgG来考察了3种模型蛋白的保留行为,并获得了良好的分离效果。对于配基密度的影响以及在实际蛋白质分离与分析中的应用等方面,将在后续工作中进一步展开。
References
[1] 仁斌. 高效液相色谱在医药研究中的应用 [M]. 上海: 科学技术出版社, 2003: 1. REN B. High Performance Liquid Chromatography (HPLC) Application in Medical Research [M]. Shanghai: Scientific and Technical Publisher, 2003: 1.
[2] KUMAR S, LATHER V, PANDITA D. Stability indicating simplified HPLC method for simultaneous analysis of resveratrol and quercetin in nanoparticles and human plasma [J]. Food Chemistry, 2016, 197: 959-964. DOI: 10.1016/j.foodchem.2015.11.078.
[3] DING X P, WANG X T, CHEN L L, et al. On-line high-performance liquid chromatography-diode array detection-electrospray ionization-mass spectrometry-chemiluminescence assay of radical scavengers in Epicedium [J]. Journal of Chromatography A, 2011, 1218 (9): 1227-1235. DOI: 10.1016/j.chroma.2011.01.001.
[4] CEVIKKALP S A, LOKER G B, YAMAN M. A simplified HPLC method for determination of tryptophan in some cereals and legumes [J]. Food Chemistry, 2015, 193 (12): 26-29. DOI: 10.1016/ j.foodchem.2015.02.108.
[5] RODRIGUEZ-NOGALES J M, CIFUENTES A, GARCIA M C, et al. Characterization of protein fractions from Bt-transgenic and non-transgenic maize varieties using perfusion and monolithic RP-HPLC. Maize differentiation by multivariate analysis [J]. Journal of Agricultural and Food Chemistry, 2006, 55 (10): 3835-3842. DOI: 10.1021/jf063579e.
[7] HUANG X, BARNARD J, SPITZNAGEL T, et al. Protein covalent dimer formation induced by reversed-phase HPLC conditions [J]. Journal of Pharmaceutical Sciences, 2013, 102 (3): 842-851. DOI: 10.1002/jps.23431.
[8] TEIXID E, MOYANO E, SANTOS F J, et al. Liquid chromatography multi-stage mass spectrometry for the analysis of 5-hydroxymethylfurfural in foods [J]. Journal of Chromatography A, 2008, 1185 (1): 102-108. DOI: 10.1016/j.chroma.2008.01.057.
[9] KUEHNER D, STAHL M, DEMIRCIOGLU D, et al. From cells to muropeptide structures in 24 h: peptidoglycan mapping by UPLC-MS [J]. Scientific Reports, 2014, 8 (12): 7494. DOI: 10.1038/srep07494.
[10] GUI F M, LI G C. Development of magnetic molecularly imprinted polymers based on carbon nanotubes—application for trace analysis of pyrethroids in fruit matrices [J]. Journal of Chromatography A, 2014, 1329: 1-9. DOI: 10.1016/j.chroma.2013.12.079.
[11] MIRA Z, BILJANA J, LJILJANA Z, et al. Application of multicriteria methodology in the development of improved RP-LC-DAD for determination of rizatriptan and its degradation products [J]. Chromatographic, 2008, 68 (11/12): 911-918. DOI: 10.1365/s10337- 008-0823-z.
[12] BISCHOFF R, MCLAUGHLIN L W. Mixed-mode chromatographic matrices for the resolution of transfer ribonucleic acids [J]. Journal of Chromatography, 1984, 317: 251-61. DOI: 10.1016/S0021-9673(01)91664-4.
[13] GUERRIER L, GIROT P, SCHWARTZ W, et al. New method for the selective capture of antibodies under physiological conditions [J]. Bioseparation, 2000, 9 (4): 211-221. DOI: 10.1023/A:1008170226665.
由于不同地层的物理化学性质不同,地基的稳定性也有很大的差异,为满足工程建设的需要,应对不稳固的地基进行处理。通常情况下,通过采取一些列的措施减小土颗粒之间的空隙,提高土层的重度,达到减少地基土体沉降量的目的,并设置排水设避免地表水和地下水对地基稳固性的影响,使地基的稳定性得到提高,并满足施工要求。
[14] GHOSE S, HUBBARD B, CRAMER S M. Protein interactions in hydrophobic charge induction chromatography (HCIC) [J]. Biotechnology Progress, 2005, 21 (2): 498-508. DOI: 10.1021/bp049712+.
[15] BURTON S, HARDING D. Hydrophobic charge induction chromatography: salt independent protein adsorption and facile elution with aqueous buffers [J]. Journal of Chromatography A, 1998, 814 (1/2): 71-81. DOI: 10.1016/S0021-9673(98)00436-1.
[16] CLAUDIA I, JORMA H, LENNART H, et al. Individuals with selective IgA deficiency resolve rotavirus disease and develop higher antibody titers (IgG, IgG1) than IgA competent individuals [J]. Journal of Medical Virology, 2008, 80 (3): 531-535. DOI: 10.1002/jmv.21101.
[17] XIA H F, LIN D Q, CHEN Z M, et al. Purification of immunoglobulin of egg yolk with hydrophobic charge induction chromatography comparison of operation modes with packed bed and expanded bed [J]. Separation Science and Technology, 2012, 47 (16): 2366-2372. DOI: 10.1080/01496395.2012.666310.
[18] COULON D, CABANNE C, FITTON V, et al. Penicillin acylase purification with the aid of hydrophobic charge induction chromatography [J]. Chromatogr. B, 2004, 808: 111-115. DOI: 10.1016/j.jchromb.2004.03.025.
[19] TAO L, LIN D Q, ZHANG L Q, et al. Characterization of immunoglobulin adsorption on dextran-grafted hydrophobic charge-induction resins: cross-effects of ligand density and pH/salt concentration [J]. Journal of Chromatography A, 2015, 1396: 45-53. DOI: 10.1016/j.chroma.2015.03.074.
[20] REN J, YAO P, CAO Y M, et al. Application of cyclodextrin-based eluents in hydrophobic charge-induction chromatography: elution of antibody at neutral pH [J]. Journal Chromatogram A, 2014, 1352: 62-68. DOI: 10.1016/j.chroma.2014.05.060.
[21] XIA H F, LIN D Q, WANG L P, et al. Preparation and evaluation of cellulose adsorbents for hydrophobic charge induction chromatography [J]. Industrial & Engineering Chemistry Research, 2008, 47 (23):9566-9572. DOI: 10.1021/ie800662r.
[22] 郑梦杰, 夏海锋, 吴婷, 等. 高效疏水电荷诱导色谱介质的基团修饰及其色谱行为的初步研究 [J]. 高校化学工程学报, 2014, (5): 1044-1050. DOI: 1003-9015(2014)28:5<1044:GXSSDH>2.0.TX;2-G.
ZHEN M J, XIA H F, WU T, et al. Ligand modification and characteristics of silica gel for high performance hydrophobic charge induction chromatography [J]. Journal of Chemical Engineering of Chinese Universities, 2014, (5): 1044-1050. DOI: 1003-9015(2014)28:5< 1044:GXSSDH>2.0.TX;2-G
[23] XIA H F, LIN D Q, CHEN M Z, et al. Influences of ligand structure and pH on the adsorption with hydrophobic charge induction adsorbents: a case study of antibody IgY [J]. Separation Science and Technology, 2011, 46 (12): 1957-1965. DOI: 10.1080/01496395.2011.579931.
[24] XIA H F, LIN D Q, CHEN M Z, et al. Salt-promoted adsorption of an antibody onto hydrophobic charge-induction adsorbents [J]. Journal of Chemical & Engineering Data, 2010, 55 (12): 5751-5758. DOI: 10.1021/je100708p.
[25] GENG X P, GAO H, WANG B H, et al. Thermodynamic analysis of denatured lysozyme folded on moderately hydrophobic surface at 298K [J]. Journal of Thermal Analysis and Calorimetry, 2009, 95 (2): 345-352.DOI: 10.1007/s10973-008-9231-8.
[26] GENG X P, ZHANG H F, WANG B H, et al. Calorimetric determination of enthalpies of lysozyme folding at a liquid-solid interface [J]. Thermal Analysis & Calorimetry, 2005, 82 (1): 193. DOI: 10.1007/s10973-005-6926-y.
[27] 耿信笃. 计量置换理论及应用 [M]. 北京: 科学出版社, 2004: 25.
GENG X D. Measuring the Displacement Theory and Application [M]. Beijing: Science Press, 2004: 25.
2016-01-21收到初稿,2016-04-12收到修改稿。
联系人:夏海锋。第一作者:董彬彬(1990—),男,硕士研究生。
Received date: 2016-01-21.
中图分类号:TP 273
文献标志码:A
文章编号:0438—1157(2016)07—2893—08
DOI:10.11949/j.issn.0438-1157.20160095
基金项目:国家自然科学基金项目(21206054);江苏省自然科学基金项目(BK20151123);中央高校基本科研业务费专项资金(JUSRP51401A)。
Corresponding author:Prof. XIA Haifeng, hfxia@jiangnan.edu.cn supported by the National Natural Science Foundation of China (21206054), the Natural Science Foundation of Jiangsu Province (BK20151123)and the Fundamental Research Funds for the Central Universities (JUSRP51401A).
Comparison of three silica resins in chromatographic property for mixed-mode chromatography
DONG Binbin1, XIA Haifeng1,2
(1Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China;2National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China)
Abstract:Spherical silica gel with a diameter of 5 μm and pore size of 30 nm was activated by KH-560 and coupled with three kinds of ligands (3-aminopyridine, 2-mercapto benzimidazole and 2-mercapto-1-methylimidazole) to prepare the high performance hydrophobic charge-induction chromatography (HPHCIC) column. The chromatographic properties of three columns were compared and evaluated with three model proteins (Lysozyme, BSA and IgG). The column with 2-mercapto-1-methylimidazole as ligand displayed a proper chromatography and separation behavior which controlled by pH. This work demonstrated that the novel synthetic materials can be utilized as the media of high performance hydrophobic charge induction chromatography.
Key words:bioseparation; protein; high performance liquid chromatography; hydrophobic charge-induction chromatography; retention factor; separation behavior
