氨缓冲体系强化高纯重质碳酸锰的制备
2016-08-06陈南雄谢罗生舒建成李华成王春飞刘作华
陈南雄,谢罗生,舒建成,李华成,王春飞,刘作华
氨缓冲体系强化高纯重质碳酸锰的制备
陈南雄1,谢罗生2,舒建成3,李华成1,王春飞1,刘作华3
(1中信大锰矿业有限责任公司,广西 南宁 530028;2广西自治区质量技术监督局,广西 南宁 530022;3重庆大学化学化工学院,重庆 400044)
摘要:以碳酸钠和高纯硫酸锰为原料,通过共沉淀法在氨缓冲溶液中制备高纯重质碳酸锰。当硫酸锰和碳酸钠溶液浓度都为1.5 mol·L-1、碳酸钠过量系数为110%、溶液pH为8.5、温度为50℃、滴加速率为120 ml·h-1时,得到的碳酸锰视密度达1.67 g·cm-3,振实密度达2.15 g·cm-3。氨缓冲体系增加了溶液的稳定性,抑制了溶液中氢氧化锰和偏氢氧化锰的生成,制备出的高密度碳酸锰形貌趋于球形,粒径分布均匀,D50平均大小为30.32 μm。以本研究制备的碳酸锰为锰原料焙烧得到的四氧化三锰松装密度为1.09 g·cm-3,振实密度为2.18 g·cm-3,锰的含量可达71.85%。
关键词:结晶;沉淀;优化设计;碳酸锰;四氧化三锰
引 言
我国基础锰源材料产量居世界前列,但精细化、高附加值的锰制品却较少。碳酸锰是产量较大的基础锰源材料[1-2]。随着我国对新能源材料需求的扩大,动力锂离子电池得到了快速发展[3-6],锰酸锂因其安全性能好、成本低、环保、能量密度高等优点成为当今锂离子电池正极材料研究的热点之一[7-10]。同时高品质、精细化碳酸锰产品是制备高品质二氧化锰、四氧化三锰的关键锰源材料,对改善锂电池的放电容量、循环性能、电化学活性有重要促进作用。因此,制备高品质、精细化碳酸锰具有重要的战略意义。
目前,碳酸锰的制备方法主要有共沉淀法[11-14]、点接触法[15]、表面活性剂控制法[16]、氧化还原法[17]、均匀沉淀法[18]、控制结晶法[19-20]等。这些方法大部分是研究制备原料的除渣以及滴加顺序,而有关反应体系对碳酸锰的振实密度、形状以及半径影响的研究较少。
本研究在氨缓冲体系下以高纯硫酸锰(MnSO4)和碳酸钠(Na2CO3)为原料,采用温度、浓度以及滴加速率三因素三水平正交实验制备球形碳酸锰颗粒。通过调整加料速度、合成温度控制碳酸锰结晶及晶粒长大,确保碳酸锰晶体视密度增加。同时,以本研究制备的碳酸锰为锰基础材料,在合适条件下焙烧得到四氧化三锰。采用显微镜、粒度仪、粉体振实密度仪等对样品进行表征。
1 实验材料和方法
1.1 实验仪器与试剂
仪器:数显式电热恒温水浴锅(HHS,上海博远实业有限公司),自动加液反应釜(5 L,湘潭萧选磁性材料有限公司),蠕动泵(XY-100,常州市文每机械配件厂),电热恒温鼓风干燥(DH-9076A,上海精密实验设备有限公司),超纯水制造系统(CD-VPT-I,成都超纯科技有限公司)。本研究的关键设备是自动加液反应釜,其合成反应及沉淀结晶都在自动加液反应釜中进行。
试剂:碳酸钠(青岛碱业股份有限公司,分析纯),氨水(湖南汇通科技有限责任公司,分析纯),硫酸锰(湖南汇通科技,高纯电子级),超纯水(自制)。
1.2 碳酸锰晶核的形成
本研究的关键操作是合成反应及沉淀结晶,用恒流泵向控制结晶反应器中连续加入硫酸锰溶液、碳酸钠溶液、氨水,并控制搅拌速度和水温,同时用氨水流速控制反应的pH,从而控制结晶速度。经过洗涤和干燥,得到球形碳酸锰粉体[12]。对于碳酸锰沉淀反应结晶过程中粒子的生长机理,一般认为碳酸锰粒子的形成有3个步骤:首先是碳酸锰晶核的形成,晶核在硫酸锰和碳酸钠加入的反应瞬间即可形成;然后在搅拌和晶核自身布朗运动条件下,通过晶核间相互碰撞吸附长大形成微晶;最后微晶在运动中大量吸附新生的晶核及微晶,形成最终产品碳酸锰粒子而沉入底部[21]。
1.3 实验步骤
配液:配制不同浓度的硫酸锰和碳酸钠溶液,碳酸钠过量系数为110%。
合成反应:分别使用两台恒流泵调节流速,碳酸钠溶液和硫酸锰溶液共滴入搅拌器中,于水浴锅上反应,同时加入氨水保持pH=8.5,共滴结束后继续搅拌2 h,在搅拌过程中,碳酸锰和碳酸钠发生化学反应,生成碳酸锰晶体。反应工艺流程如图1所示。

图1 反应工艺流程Fig.1 Reaction process flow diagram
沉淀结晶:合成反应结束后,室温下低速继续搅拌 4 h,碳酸锰晶核在运动中吸附新生晶核及微晶,形成碳酸锰粒子沉入底部。
陈化:将有沉淀的溶液室温下静置,使沉淀中的分子等有规律地紧密排列,同时使沉淀聚沉,颗粒变大。陈化时间为10 h。
洗涤过滤:采用打浆抽滤3次,每抽滤一次测量滤液电导率。
干燥:干燥温度90℃,时间4 h。
筛选:用标准检验筛进行筛选。
检测:检测样品的 D50、TD(振实密度)以及颗粒形貌。
1.4 分析方法
制备出的碳酸锰振实密度采用粉体振实密度仪(JZ-1,深圳三诺仪器有限公司)测定,电导率采用电导率仪(DDS-307A,上海精密科学仪器有限公司)测定,pH采用pH计(PHS-3C,上海仪电科学仪器股份有限公司)测定,碳酸锰粒度采用激光粒度分析仪(LS900,珠海欧美克仪器有限公司)测定,碳酸锰形貌采用扫描电镜(SU3500,日立高新扫描电子显微镜)进行观测。晶型测定采用X射线粉末衍射(XRD-6000,岛津)。
2 实验结果与讨论
2.1 正交实验设计
碳酸锰振实密度与微晶及粒子的成长过程有密切的关系,微晶和粒子成长时质密无空隙则产品密度大,反之产品密度则小[22-25]。而影响微晶及粒子成长的因素很多,如温度、时间、浓度、加料方式、反应器形式、反应溶液pH大小。因此,本实验采用均匀加料的方式,以反应温度、溶液浓度以及滴加速率为因子进行正交实验。重质碳酸锰正交实验因素水平设计及正交实验结果见表1和表2。
从表2结果可知,对于TD,A2B2C1为最优工艺条件,即反应温度为50℃、浓度为1.5 mol·L-1、滴加速率为120 ml·h-1,TD影响因素主次为A2>C1>B2;对于D50,A2B2C1为最优工艺条件,即反应温度为50℃、浓度为1.5 mol·L-1、滴加速率为120 ml·h-1、D50影响因素主次为A2>C1>B2。因此,综合考虑,A2B2C1为最优工艺组合。

表1 正交实验因素水平Table 1 Factors and levels of orthogonal test

表3 实验结果与分析Table 2 Results and analysis of orthogonal test
2.2 实验结果分析
由表2可知,本研究中TD随反应温度升高先增大后逐渐减小,随滴加速率加快而减小,随溶液浓度增大先增大后逐渐减小;D50随反应温度升高而增大,随滴加速率加快先减小后增大,随溶液浓度增大而增大。造成这种现象的原因可能是温度影响反应过程中晶体生长速率与成核速率的比例[26]。
2.3 最优工艺条件验证
为验证实验结果的重复性和稳定性,在反应温度为50℃、碳酸钠过量系数为110%、浓度为1.5 mol·L-1、滴加速率为120 ml·h-1条件下做了验证实验,结果见表3。

表3 最优工艺条件实验结果Table 3 Experiment result of optimum process conditions

图2 碳酸锰晶粒SEM图Fig.2 SEM image of manganese carbonate
由表3可知,在最优工艺条件下碳酸锰的D50为30.95 μm,视密度达1.67 g·cm-3,TD高达2.15 g·cm-3,实验重现性好。由图 2和后文的图 3可知,碳酸锰颗粒形貌较趋于球形,颗粒直径较大,而且粒径分布均匀。
2.4 合成机理分析
一般体系下采用碳酸钠作为沉淀剂得到的碳酸锰为无定形粉末,湿料带有黏滞性。这是由于强碱盐在水中充分电离出Na+、,而当Mn2+加入时能迅速与成细小沉淀所致,干料视密度小、比表面积大,烘干后产品发黄。在本研究中采用氨缓冲体系条件下制备的碳酸锰为球状颗粒,而且杂质钠的含量达到标准,碳酸锰的视密度可达 1.67 g·cm-3,振实密度达2.15 g·cm-3,粒径分布均匀,D50平均大小为30.32 μm。这是因为在体系中加入氨水后、硫酸铵与氨水形成了NH3·H2O-(NH4)2SO4缓冲体系,在缓冲体系中 Mn2+与 NH3·H2O生成和配合物,同时在该体系中添加氨增加了溶液的稳定性,即Mn2+的水解pH增加,从而抑制了在较低pH条件下氢氧化锰和偏氢氧化锰的生成[27]。同时,碳酸锰晶体生长过程中的界面是否稳定直接关系到碳酸锰晶体的生长形态。随着碳酸钠与硫酸锰过饱和度增加,碳酸锰晶体生长速率和成核速率均增加,但成核速率远大于生长速率,因此加剧了溶液的自发成核倾向,降低了溶液的稳定性。溶液的稳定性降低,系统极易出现杂晶,从而导致形状不规则的碳酸锰晶体的产生。氨缓冲体系增加了溶液稳定性,同时减少了溶液的过饱和度。溶液的过饱和度降低,碳酸锰的生长速率变慢,晶面发展越充分,越有利于形成粒径较大、结晶较为完整、分散性较好的碳酸锰。同时以较小的过饱和度进行缓慢结晶,由于晶核生成率小,所夹母液较少,使碳酸锰晶体品质优异[28-29],原理如图3所示。
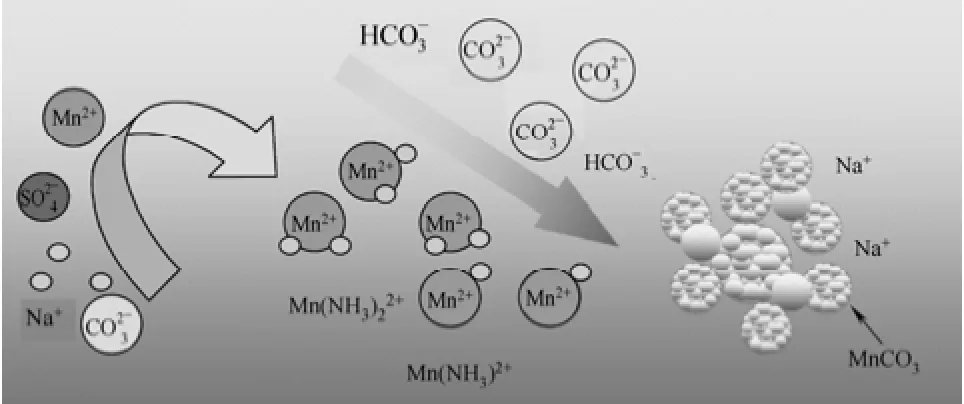
图3 氨缓冲体系制备碳酸锰Fig.3 Preparation of manganese carbonate in ammonia buffer system
对于钠离子,由于碳酸钠溶解度较大,化学式形式也与碳酸锰形式不同。从离子半径来看,钠离子半径为9.8 nm,而2价锰离子半径为9.1 nm,两者相差7.2%左右,大于5%。并且钠离子为+1价,电荷较小,不易造成内吸附。因此采用碳酸钠与高纯硫酸锰在氨水缓冲体系下制备的碳酸锰中杂质钠的含量能够达到标准[30]。
2.5 碳酸锰晶体的焙烧
为验证在缓冲体系下制备的碳酸锰晶体的高纯、高密度性,取上述最优条件下的碳酸锰样品焙烧制备四氧化三锰。焙烧条件:温度为 980℃,时间为6 h,气氛为不另外通空气、冷却过程为氩气保护。根据动力型尖晶石型锰酸锂对高纯、高密度四氧化三锰的要求,分析了样品的振实密度、松装密度,以及Mn、SO42-、Fe、Cu、Na、Ca、K、Zn、Pb含量。碳酸锰晶体焙烧实验条件及结果见表4,焙烧后样品的XRD谱图如图4所示。

图4 碳酸锰焙烧样品的XRD谱图Fig.4 XRD pattern of manganese carbonate

表4 碳酸锰焙烧实验条件及结果Table 4 Experiment conditions and results to manganese carbonate roasting
由表4和图4可知,在氨缓冲体系下制备的碳酸锰经过焙烧后能够得到四氧化三锰,而且得到的四氧化三锰的松装密度为1.09 g·cm-3,比金属锰氧化法生产的四氧化三锰松装密度(0.80 g·cm-3)大;振实密度为2.18 g·cm-3。同时制备出的四氧化三锰中锰含量为71.85%,比金属锰氧化法生产的四氧化三锰中锰含量(71.00%)高;主要杂质 Fe含量(36 mg·L-1)比金属锰氧化法生产的四氧化三锰中Fe含量(5000 mg·L-1)低。因此,在氨缓冲体系中制备的碳酸锰焙烧后能够得到高纯、高密度的四氧化三锰。

图5 四氧化三锰的SEM图Fig.5 SEM image of mangano-manganic oxide

图6 四氧化三锰样品的激光粒度分布图Fig.6 Laser particle size distribution of mangano-manganic oxide
由图5和图6(图中q为微积分分布,Q为累计分布)可知,在氨缓冲体系下制备的碳酸锰经过焙烧后得到的四氧化三锰为一次颗粒的聚焦体,为二次晶粒,其形貌为类球形,晶粒大小为15 μm 左右。此形貌的样品流动性好、振实密度大,是制备锰酸锂电池比较理想的形貌。
3 结 论
(1)以碳酸钠和高纯硫酸锰为沉淀剂,利用控制结晶法在氨缓冲体系中制备碳酸锰。当硫酸锰和碳酸钠溶液浓度都为1.5 mol·L-1、碳酸钠过量系数为110%、溶液pH为8.5、温度为50℃、滴加速率为120 ml·h-1时,制备出的碳酸锰视密度达1.67 g·cm-3,振实密度达2.15 g·cm-3。
(2)氨缓冲体系增加了溶液的稳定性,抑制了溶液中氢氧化锰和偏氢氧化锰的生成,因此制备出的高密度碳酸锰形貌趋于球形,粒径分布均匀,D50平均大小为30.32 μm。
(3)在氨缓冲体系下制备的碳酸锰焙烧后得到的四氧化三锰的松装密度为1.09 g·cm-3,比金属锰氧化法生产的四氧化三锰的松装密度(不大于0.80 g·cm-3)大;振实密度为2.18 g·cm-3。制备出的四氧化三锰中锰含量高达71.85%,比金属锰氧化法生产的四氧化三锰中锰含量(71.00%左右)高;主要杂质Fe含量(36 mg·L-1)比金属锰氧化法生产的四氧化三锰中Fe含量(5000 mg·L-1左右)低。因此,在氨缓冲体系中制备的碳酸锰焙烧后能够得到高纯、高密度的四氧化三锰。
References
[1] GHOSH D, GIRI S, DHIBAR S, et al. Reduced graphene oxide/manganese carbonate hybrid composite: high performance supercapacitor electrode material [J]. Electrochimica Acta, 2014, 47: 557-564. DOI: 10.1016/j.electacta.2014.09.130.
[2] KANG W P, YU D Y W, LI W Y, et al. Nanostructured porous manganese carbonate spheres with capacitive effects on the high lithium storage capability [J]. Nanoscale, 2015, 7 (22): 10146- 10151. DOI: 10.1039/c5nr01843a.
[3] ARAGON M J, PEREZ-VICENTE C, TIRADO J L. Submicronic particles of manganese carbonate prepared in reverse micelles: a new electrode material for lithium-ion batteries [J]. Electrochemistry Communications, 2015, 9(7): 1744-1748. DOI: 10.1016/j.elecom. 2007.03.031
[4] ARAGO M J, LEON B, VICENTE C P, et al. A new form of manganese carbonate for the negative electrode of lithium-ion batteries [J]. Journal of Power Sources, 2011, 196 (5): 2863-2866. DOI: 10.1016/j.jpowsour.2010.11.032.
[5] SHAO L Y, SHU J, MA R, et al. Electrochemical characteristics and intercalation mechanism of manganese carbonate as anode material for lithium-ion batteries [J]. International Journal of Electrochemical Science, 2013, 8(1): 1170-1180.
[6] XIE Z Q, ZHAO J Q, WANG Y. One-step solvothermal synthesis of Sn nanoparticles dispersed in ternary manganese-nickel-cobalt carbonate as superior anode materials for lithium ion batteries [J]. Electrochimica Acta, 2015, 174: 1023-1029. DOI: 10.1016/j. electacta. 2015.06.079.
[7] ZENG G Y, ZHANG J, FU Y Y, et al. Manganese ferrite-graphene nanocomposite as a high-performance anode material for lithium-ion batteries [J]. International Journal of Materials Research, 2015, 106 (8): 915-918. DOI: 10.3139/146. 111251.
[8] ZHAO W W, OYAMA M, YAMADA H, et al. Influence of Ti substitution on the structure and electrochemical properties of lithium-excess layered manganese based oxide for lithium ion batteries [J]. Electrochimica Acta, 2015, 168: 157-166. DOI:10.1016/j. electacta.2015.04.017.
[9] ZHOU H W, DING X A, LIU G C, et al. Preparation and characterization of ultralong spinel lithium manganese oxide nanofiber cathode via electrospinning method [J]. Electrochimica Acta, 2015, 152: 274-279. DOI: 10.1016/j. electacta. 2014.11.147.
[10] ZHOU K W, QIN L Q, WU X H, et al. Structure and magnetic properties of manganese-nickel ferrite with lithium substitution [J]. Ceramics International, 2015, 41(1): 1235-1241. DOI: 10.1016/j.ceramint.2014.09.052.
[11] HAMAMDA S. Preparation of uniform corresponding metalcomplex solutions [J]. Progress in Organic Coatings, 1997, 51(2): 31-41. DOI: 10.1016/S0300-9440(97)00016-7.
[12] 汪文辉.一种高纯碳酸锰的制造方法: CN1283592[P]. 2001-02-14.
WANG W H. A method of preparing high purity manganese carbonate: CN1283592[P]. 2001-02-14.
[13] 李世辉, 王锡芬, 孙卫华, 等. 球形碳酸盐三元前驱体的制备方法: CN102070179A[P]. 2011-05 -25.
LI S H, WANG X F, SUN W H, et al. The preparation method of the spherical carbonate ternary precursor: CN102070179A[P]. 2011-05-25.
[14] 皮银安, 郑贤福, 彭爱国, 等. 一种生产高视密度碳酸锰的方法及其设备: CN1323744A[P]. 2000-05-11.
PI Y A, ZHENG X F, PENG A G, et al. A method of producing high apparent density of manganese carbonate and its equipment: CN1323744A[P]. 2000-05-11.
[15] 吕春玲, 张景林. 亚微米碳酸锰的制备及形貌控制 [J]. 硅酸盐学报, 2007, 35(3): 377-380.
LÜ C L, ZHANG J L. Preparation and shape controlling of submicron manganese carbonate [J]. Journal of the Chinese Society, 2007, 35(3): 377-380.
[16] 马照军, 金达莱, 王勇, 等. CTAB/醇/水体系制备碳酸锰的性质研究 [J]. 浙江理工大学学报, 2006, 23(4): 405-408.
MA Z J, JIN D L, WANG Y, et al. Study on the character of MnCO3synthesized in the system of CTAB, alcohol, de-ionized water [J]. Journal of Zhejiang University of Technology, 2006, 23(4): 405-408.
[17] WANG X, LI Y D. Hydrothermal reduction route to Mn(OH)2and MnCO3nanocrystals [J]. Materials Chemistry and Physics, 2003, 82(8): 419-422. DOI: 10.1016/S0254-0584(03)00263-3.
[18] 彭清静, 傅伟昌, 邹晓勇. 用均匀沉淀法制备高纯碳酸锰 [J]. 吉首大学学报 (自然科学版), 2001, 22(3): 48-50.
PENG Q J, FU W C, ZOU X Y. Study on the preparation of high purity manganese carbonate by precipitation from homogeneous solution [J]. Journal of Jishou University (Natural Science Edition), 2001, 22 (3): 48-50.
[19] TANAKA I, NAKAHARA F, KAGEYAMA H, et al. Preparation of the manganese (Ⅱ) carbonate spherical-particles by interfacial reaction method and properties of them and their calcined products [J]. Nippon Kagaku Kaishi, 1991, (10): 1284-1289.
[20] 何向明, 蒲薇华, 蔡砚, 等. 基于控制结晶法制备的锂离子电池正极材料球形锰酸锂 [J]. 中国有色金属学报, 2005, 15(9): 1390-1395. HE X M, PU W H, CAI Y, et al. Preparation of spherical LiMn2O4for Li-ion batteries based on controlled crystallization [J]. Transactions of Nonferrous Metals Society of China, 2005, 15 (9): 1390-1395.
[21] ATOJKOVIKJ S, NAJDOSKI M, KOLEVA S. Preparation of electrochromic thin films by transformation of manganese (Ⅱ) carbonate [J]. Journal of Physics and Chemistry of Solids, 2013, 74(10): 1433-1438. DOI: 10.1016/j.jpcs.2013.05.001.
[22] 张宏, 赵凯, 陈飞宇, 等. 锰系产品在锂离子电池中的发展与前景[J]. 中国锰业, 2013, 31(4): 6-8.
ZHANG H, ZHAO K, CHENG F Y, et al. Prospect of Mn-series products in development of lithium-ion batteries [J]. China’s Manganese Industry, 2013, 31(4): 6-8.
[23] 梅光贵, 张文山, 曾湘波. 中国锰业技术 [M]. 长沙: 中南大学出版社, 2011: 496.
MEI G G, ZHANG W S, ZENG X B. Chinese Manganese Industry Technology [M]. Changsha: Central South University Press, 2011: 496.
[24] 屈雄. 碳酸锰微晶制备过程的形貌控制研究 [D]. 南宁: 广西大学, 2008.
QU X. Controlling its shape in the process of preparing carbonate manganese [D]. Nanning: Guangxi University, 2008.
[25] 袁明亮, 邱冠周. 高纯微晶碳酸锰制备中的粒度和质量控制 [J].中南工业大学学报(自然科学版), 2001, 32(5): 473-476.
YUAN M L, QIU G Z. Controlling of the particle size in the preparation process of manganese carbonate and its effect on the product quality [J]. Journal of Central South University of Technology (Natural Science Edition), 2001, 32(5): 473-476.
[26] 赵俊海, 吴显明, 陈上, 等. 晶种控制沉淀法制备重质碳酸锰 [J].应用化工, 2013, 42(11): 2039-2041.
ZHAO J H, WU X M, CHEN S, et al. Preparation of dense manganese carbonate by chemical precipitation of crystal seed control [J]. Applied Chemical Industry, 2013, 42 (11): 2039-2041.
[27] 张克从. 晶体生长 [M]. 北京: 人民教育出版社,1981.
ZHANG K C. Crystal Growth [M]. Beijing: People’s Education Press, 1981.
[28] SIVAKUMAR N, KANAGATHARA N, BHAGANNARAYANA G, et al. Growth, crystalline perfection, optical, thermal, laser damage threshold and electrical characterization of melaminium levulinate monohydrate single crystal [J]. Journal of Crystal Growth, 2015, 426: 86-94. DOI: 10.1016/j.jcrysgro. 2015. 05. 025.
[29] THERAS J E M, KALAIYANI D, JAYARAMAN D, et al. Growth and spectroscopic, thermodynamic and nonlinear optical studies of L-threonine phthalate crystal [J]. Journal of Crystal Growth, 2015, 427: 29-35. DOI: 10.1016/j.jcrysgro.2015.06.009.
[30] 孙健哲, 陆晖. 电解锰生产过程中调氨的作用 [J]. 中国锰业, 1991, 9(6): 33-36.
SUN J Z, LU H. The function of ammonia in the production of electrolytic manganese [J].China’s Manganese Industry, 1991, 9 (6): 33-36.
2015-07-02 收到初稿,2016-03-11 收到修改稿。
联系人:刘作华。第一作者:陈南雄(1974—),男,高级工程师。
Received date: 2015-07-02.
中图分类号:TQ 031
文献标志码:A
文章编号:0438—1157(2016)07—3078—06
DOI:10.11949/j.issn.0438-1157.20151048
基金项目:国家科技支撑计划项目(2015BAB17B00);国家自然科学基金项目(51274261,51404043);重庆大学研究生科研创新项目基金(2015)。
Corresponding author:LIU Zuohua, liuzuohua@cqu.edu.cn supported by the National Key Technology Research and Development Program of China (2015BAB17B00), the National Natural Science Foundation of China (51274261,51404043) and the Chongqing University Postgraduates’ Innovation Project (2015).
Strengthen preparation of high purity heavy manganese carbonate in ammonia buffer system
CHEN Nanxiong1, XIE Luosheng2, SHU Jiancheng3, LI Huacheng1, WANG Chunfei1, LIU Zuohua3
(1Citic Dameng Mining Industries Limited, Nanning 530028, Guangxi, China;2Guangxi Autonomous Region Bureau of Quality and Technical Supervision, Nanning 530028, Guangxi, China;3School of Chemistry and Chemical Engineering, Chongqing University, Chongqing 400044, China)
Abstract:High purity and heavy manganese carbonate was prepared via controlling crystallization in ammonia buffer system, with sodium carbonate and high purity manganese sulfate as the starting materials. When the concentration of MnSO4and Na2CO3solution was 1.5 mol·L-1, and Na2CO3excess coefficient was 110% with adding rate of 120 ml·h-1at pH 8.5 and 50℃, the apparent density of manganese carbonate was 1.67 g·cm-3and tap density was 2.15 g·cm-3. Ammonia buffer system increased the stability of the solution, and suppressed the formation of manganese hydroxide and partial manganese hydroxide. The morphology of high density of manganese carbonate was spherical, and particle size with an average size (D50) of 30.32 μm distributed uniformly. Heating the manganese carbonate prepared in this study, the apparent density and tap density of obtained mangano-manganic oxide was 1.09 g·cm-3and 2.18 g·cm-3, respectively.
Key words:crystallization; precipitation; optimal design; manganese carbonate; mangano-manganic oxide
