龙眼DlPPO1基因的克隆及其表达调控分析
2016-08-06田奇琳林玉玲郑庆游苏荣峰赖钟雄
田奇琳,林玉玲,郑庆游,苏荣峰,赖钟雄
(福建农林大学 园艺植物生物工程研究所,福州350002)
龙眼DlPPO1基因的克隆及其表达调控分析
田奇琳,林玉玲,郑庆游,苏荣峰,赖钟雄*
(福建农林大学 园艺植物生物工程研究所,福州350002)
摘要:该研究根据同源克隆技术,利用RT-PCR和RACE技术,以‘四季蜜’龙眼叶片cDNA为模板,获得龙眼多酚氧化酶基因(polyphenol oxidase,PPO)的3个转录本DlPPO1-a、DlPPO1-b和DlPPO1-c的cDNA全长序列(KM387405、KM516087和KM516088)和1条DNA序列DlPPO1(KU837229)。DlPPO1-a、DlPPO1-b和DlPPO1-c的全长分别为1 969、1 960和1 920 bp,包含相同的完整开放阅读框1 800 bp并编码599个氨基酸;该基因与荔枝、橄榄和枣等物种的PPO基因同源性较高。生物信息学分析表明,DlPPO1保守结构域具有多酚氧化酶的典型结构域特征。利用实时荧光定量PCR技术检测DlPPO1表达结果表明,在龙眼体胚发生过程中,DlPPO1从心形胚时期开始上调表达至子叶胚时期达到最高,推测其在龙眼体胚发生中后期可能发挥重要作用; DlPPO1在龙眼叶片中表达量最高,其次是花芽,而在其他组织部位表达量较低。激素和非生物胁迫处理下的表达分析表明,水杨酸(SA)、低浓度茉莉酸甲酯(MeJA)、NaCl、甘露醇及PEG可诱导DlPPO1基因上调表达,这些表达模式暗示其可能参与多种非生物胁迫应答过程。
关键词:龙眼;体细胞胚胎发生;多酚氧化酶;非生物胁迫;实时荧光定量PCR
多酚氧化酶又叫做儿茶酚酶、酪氨酸酶、绿原酸酶和漆酶等,大体上分成两类:儿茶酚氧化酶和漆酶,习惯上把儿茶酚氧化酶称为多酚氧化酶(polyphenol oxidase,PPO),它与漆酶(p-diphenol oxadise 或 Laccase)有明显的区别[1]。PPO是一类由核编码且结合铜离子的结构蛋白,催化单元酚、双元酚等多元酚氧化成醌类,普遍存在于动植物、真菌和细菌中。PPO对植物的生长发育具有重要的意义,如促进乙烯代谢过程[2];而且PPO在植物组织和器官中的分布具有时空特异性,如在番茄中,PPOB基因在大多数组织的维管和里层中表达量高,且在幼嫩组织中表达量高且随着植株的发育表达量降低,而在小麦中,PPO基因在胚芽鞘和胚根中表达强烈[1-2]。PPO可催化木质素和醌类化合物的生成,构成保护性屏障而使细胞免受或减轻病菌病虫的侵害,在植物逆境防御中起着重要作用[3-4];逆境胁迫或病原体侵染等外界因素诱导植物产生PPO活性,其中也涉及到茉莉酸等激素信号途径在植物防御反应中的作用[5]。在植物体内,miRNA 通过调节相应的靶基因来控制植物参与环境胁迫的响应,PPO则是受到miR1444a调控的靶基因,参与杨树对环境胁迫的应答响应[6]。
近年来PPO的研究已经成为热点,许多热带南亚热带木本果树(如龙眼、荔枝、橄榄等),在果实贮藏保鲜及组织培养过程中容易发生褐变,而多酚氧化酶的酶促反应是影响褐变的主要原因[7-8]。龙眼果皮褐变和果肉自溶等问题是导致龙眼采后难以长期贮存的重要原因,关于龙眼果皮和果肉等组织的多酚氧化酶活性研究已有报道,如经50 ℃热水处理10 min可有效降低果皮PPO活性,保持较高的果皮总酚含量,可有效降低采后龙眼果实酚类物质代谢,从而延缓采后龙眼果实果皮褐变的发生;PPO酶等同工酶也与龙眼果实自溶的发生和发展密切相关[9-10]。许多植物PPO的研究主要集中在酶学特性上[11-12],其生理机制尚不明确,近年来许多植物尤其是果树PPO基因已经得到克隆[13-16],但植物PPO在生长发育过程和逆境胁迫表达调控机制方面的研究还很少。荣霞分离获得橄榄PPO基因并发现该基因在橄榄试管苗生长发育过程中发挥重要作用,可能与幼嫩组织的启动分化有关[15];王家保等分离获得荔枝PPO基因,且检测到该基因在果实采后贮藏早期果皮中上调表达,可能提高PPO活性从而加剧荔枝果实采后过程中的果皮褐变[16]。植物胚胎发育过程的遗传调控可以作为探索植物发育过程中形态发生规律及控制机理的基础手段,且龙眼中PPO基因的克隆及表达调控机制未见报道,因此本研究利用龙眼体胚发生系统[17],分离、鉴定一个完整的PPO基因,并对其在龙眼体胚发育过程、不同组织器官、以及逆境胁迫处理下过程中的差异表达进行分析,以期为探索多酚氧化酶与龙眼生长发育及逆境胁迫响应之间的关系提供线索。
1材料和方法
1.1材料
以‘四季蜜’品种龙眼的叶片作为基因克隆的材料,以 ‘红核子’ 品种[17]龙眼胚性愈伤组织、球形胚、心形胚、鱼雷形胚和子叶胚以及‘四季蜜’品种[18]龙眼的根、叶、花和果实等为用于检测基因在龙眼组织不同部位的差异表达材料。对培养18 d的龙眼胚性愈伤组织进行茉莉酸甲酯(MeJA)和水杨酸(SA)两种激素处理:200 mL锥形瓶中加入40 mL MS(蔗糖20 g/mL)液体培养基,液体培养基内依次添加一种激素至终浓度依次为:0、25、50、75和100 μmol/L,3次重复,选取松散、浅黄且颗粒较细的龙眼愈伤大约0.5g轻轻放入培养基中,将锥形瓶置于摇床110 r/min,25 ℃,黑暗培养24 h。胁迫因素处理:200 mL锥形瓶中加入40 mL MS(蔗糖20 g/mL)液体培养基,液体培养基内各添加NaCl(150 mmol/L)、甘露醇(150 mmol/L)、PEG-4000(10%)和ABA(10 μmol/L),3次重复后选取松散、浅黄且颗粒较细的龙眼愈伤大约0.5 g轻轻放入培养基中,将锥形瓶置于摇床110 r/min,25 ℃,黑暗培养1、2、4、8、12、16和24 h后,分别收集以上处理材料用于RNA提取和定量表达分析。
1.2方法
1.2.1DNA和总RNA提取及cDNA合成采用改良CTAB法[19]提取DNA,采用TriPure(Roche)试剂盒提取总RNA,并采用GeneRacer Kit(Invitrogen)进行RT-PCR反转录。qPCR的cDNA合成采用PrimeScript®RT reagent Kit(TaKaRa),具体方法参照说明书。
1.2.2引物设计与PCR扩增根据GenBank报道的PPO氨基酸保守序列和核酸序列分别设计同源克隆引物DlPPO1-F1和简并引物DlPPO1-R1进行DlPPO1部分cDNA序列的扩增,并根据扩增得到的部分cDNA序列设计RACE引物,用于扩增DlPPO1基因cDNA 3′末端和5′末端序列;根据获得的3′末端和5′末端序列设计引物,进行DlPPO1基因开放阅读框的扩增。研究中所用的引物名称及序列见表1,引物委托北京六合华大基因科技股份有限公司合成。PCR 反应程序为:94 ℃预变性3 min;94 ℃变性30 s,57~59 ℃退火30 s,72 ℃延伸1 min,30~35 个循环;72 ℃延伸6 min。
1.2.3目的片段的回收PCR 扩增产物经 1.0%琼脂糖凝胶电泳进行检测,目的条带采用BIOMIGA公司 DNA快速纯化回收试剂盒进行回收,采用pMD18-T Vector(Takara Biotechnology)或者pEASY-T5 Zero Cloning Kit(TransGen Biotech)进行目的片段的克隆。阳性克隆子的测序委托上海博尚生物技术有限公司完成。
1.2.4生物信息学分析采用NCBI的Blast和DNAMAN 6.0对获得的基因全长序列进行分析。DlPPO1蛋白的生物信息学分析,采用以下分析工具进行:蛋白质基本理化性质的分析(ExPASy Protparam, http://web.expasy.org/protparam/),信号肽预测(SignalP 4.1 Server, http://www.cbs.dtu.dk/services/SignalP/),亚细胞定位预测(PSORT, http://psort. hgc.jp/),蛋白质跨膜结构的预测(EMBnet TMpred, http://www.ch.embnet.org/software/ TMPRED_form.html),磷酸位点预测(NetPhos 2.0 Server, http://www.cbs.dtu.dk/services/ NetPhos/),蛋白质保守结构域预测(NCBI-ProteinTools, http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),蛋白质二级结构预测(PSIPRED Protein Structure Prediction Server, http://bioinf.cs.ucl.ac.uk/ psipred/),蛋白质三级结构预测(SWISS-MODEL, http://swissmodel.expasy.org/),分子系统进化树的构建(Mega 5)。
1.2.5实时荧光定量PCR分析实时荧光定量PCR(qPCR)反应参照Lin和Lai[20]的步骤进行,仪器为LightCycler 480(Roche Applied Science, Switzerland)。反应体系:2×SYBR Premix Ex TaqTM(TaKaRa)10 μL,cDNA 1 μL,引物(DlPPO1-QF、DlPPO1-QR)各0.8 μL,总共体积20 μL。qPCR反应程序:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸10 s,40个循环;通过熔解曲线分析确定扩增反应的特异性。以eIF4A、EF-1A和Fe-SOD为内参基因[20]。

表1 DlPPO1基因克隆和qPCR引物列表
2结果与分析
2.1龙眼DlPPO1基因cDNA全长序列的获得
以龙眼叶片cDNA为模板,以DlPPO1-F1和DlPPO1-R1为引物扩增获得1 137 bp的序列,经NCBI的Blast比对推测该序列为龙眼PPO基因保守区部分序列,再根据获得的序列设计RACE引物,获得PPO基因的5′末端序列和3′末端序列,并在其5′末端和3′末端序列设计特异性引物DlPPO1-CF1和DlPPO1-CR1进行ORF验证,起始密码子和终止密码子分别为ATG和TGA,开放阅读框(ORF)长为 1800 bp,编码599个氨基酸;DlPPO1-a、DlPPO1-b和DlPPO1-c的5′端非编码区(5′-UTR)相同,长度为32 bp,3′非编码区(3′-UTR)长度不同,分别为137、128和88 bp, 且polyA长度分别为20、28和23 bp。将该序列推导的编码区氨基酸序列在NCBI进行比对,发现DlPPO1与其他植物如荔枝、橄榄、胡杨等的PPO基因高度同源,其中与荔枝的一致性最高,达94%。经结构域分析推测该基因为龙眼PPO基因,该基因3个转录本序列在GenBank中登录,分别命名为DlPPO1-a、DlPPO1-b和DlPPO1-c,登录号分别为KM387405、KM516087和KM516088。以‘四季蜜’龙眼叶片DNA为模板,以DlPPO1-CF1和DlPPO1-CR1为引物扩增获得1条长度为2 163 bp DNA序列,命名为DlPPO1(GenBank登录号KU837229);DlPPO1基因仅含有1个内含子,长度为214 bp。
2.2生物信息学分析
2.2.1龙眼DlPPO1蛋白基本性质分析采用ExPASy中的蛋白质基本参数分析工具 ProtParam 对DlPPO1基本参数进行计算表明,DlPPO1编码的蛋白为碱性蛋白,具有亲水性,且带正电氨基酸数量(Arg+Lys)均大于带负电的氨基酸数量(Asp+Glu);DlPPO1是不稳定蛋白。采用SignalP 4.1 Server预测表明DlPPO1不含信号肽,不是分泌蛋白。采用PSORT分析显示DlPPO1蛋白定位于叶绿体基质的可能性最大,分值为0.892。在亚细胞定位分析的基础上,利用ExPASy中的TMpred工具进行跨膜结构的预测显示,DlPPO1具有跨膜结构域,可能与膜定位和跨膜转运有关。磷酸化位点预测显示,DlPPO1蛋白共含35个磷酸化位点,其中丝氨酸的磷酸化位点21个,苏氨酸和酪氨酸的磷酸化位点分别为8个和6个,DlPPO1蛋白中丝氨酸的比例明显大于苏氨酸和酪氨酸。对DlPPO1蛋白的二级结构进行预测,其中无规则卷曲所占比例最大,而α螺旋和β折叠所占比例相当;在了解蛋白二级结构的基础上,进一步对其三级结构进行预测,预测的结果与二级结构预测的结论相符。使用NCBI-CD-Search工具进行蛋白保守区域分析,结果显示DlPPO1氨基酸序列中173-382区域与酪氨酸酶超家族的核心序列高度同源,具有PPO蛋白的典型特征,含PPO1_DWL和PPO1_KFDV两个结构域(图1)。
2.2.2龙眼DlPPO1基因相关MicroRNA预测与分析miRNAs作为一种调节分子,参与控制植物的生长发育和逆境胁迫应答。已有研究表明miRNAs在植物花、种子、叶、根和维管等形态建成和发育中均发挥重要作用;且miRNAs除了可以响应激素信号调控并参与控制其他miRNAs的生物合成,还可以通过应答干旱胁迫、病毒侵染等逆境胁迫调控基因表达。因此,研究miRNAs对靶基因的调控作用,对于研究靶基因如何参与植物生长发育调控及环境胁迫响应有重要意义。利用在线软件psRNA Target等[21]对调控DlPPO1的miRNAs进行预测,结果在杨树miRNA数据库中比对发现DlPPO1存在杨树miR1444(ptc-miR1444)的翻译抑制位点,说明在龙眼DlPPO1可能也存在与ptc-miR1444类似抑制位点,受到龙眼中类似miRNA成员的调控。
2.2.3系统进化树分析系统进化分析表明,龙眼DlPPO1与同科的荔枝(JF926153.1)PPO距离较近,与木犀科植物橄榄(JQ319005.1)、鼠李科植物枣(HQ634289.1)和芸香科植物甜橙(XM_006468155.1)等的PPO的遗传距离也较近(图2)。
2.3龙眼体胚发生过程中DlPPO1基因表达模式
植物基因在胚胎发育过程的转录水平变化可为探索其在植物发育过程中的调控机制提供线索。DlPPO1基因在龙眼体胚发生不同时期(胚性愈伤组织、不完全紧实结构、球形胚、心形胚、鱼雷形胚和子叶胚)的相对转录水平进行分析,结果表明,从胚性愈伤组织时期到心形胚时期的DlPPO1基因的转录水平一直相对较低,而从心形胚开始逐渐上调,鱼雷形胚时期的转录水平约为愈伤组织时期的4倍,子叶胚时期达到最高,约为愈伤组织时期的6倍(图3)。说明在龙眼体胚发生过程中,DlPPO1基因主要在后期即子叶胚时期表达。
2.4DlPPO1基因的组织特异性表达分析
为进一步探索DlPPO1基因的组织差异性表达特点,对其在龙眼不同组织部位(根、叶、花芽、成花、幼果、成熟果、果皮、果肉和种子)的相对表达量进行分析,结果表明,DlPPO1基因在叶片中表达量最高,在成花中也有少量存在,在龙眼其他组织部位表达量较低(图4)。说明在龙眼生长发育过程中,DlPPO1基因主要在叶片和花中表达。

分支上的数字代表1 000次Bootstrap重复验证中该节点的可信度百分比值图2 DlPPO1系统进化树Numbers at the nodes represent the bootstrap values based on 1 000 replicationsFig. 2 Phylogenetic tree for DlPPO1

图1 DlPPO1蛋白保守结构域预测Fig. 1 Functional domains prediction for DlPPO1
2.5DlPPO1基因的激素应答及胁迫响应
植物PPO如何应对外界环境的变化及其反应机制的研究具有重要意义。低浓度MeJA诱导DlPPO1的表达,而高浓度MeJA抑制DlPPO1的表达,说明DlPPO1基因具有较复杂的茉莉酸响应机制;随着SA处理浓度的提高,DlPPO1基因表达量整体呈现逐渐上升的趋势,说明SA对DlPPO1具有正调控作用(图5)。不同非生物胁迫的时序表达分析表明,NaCl模拟的盐胁迫和甘露醇模拟的渗透胁迫处理下,随着处理时间的延长DlPPO1基因总体表达量上升,而PEG模拟干旱胁迫也诱导DlPPO1表达,说明DlPPO1参与对盐胁迫、渗透胁迫和干旱胁迫等多种非生物胁迫过程,其中对盐胁迫的响应最为显著。此外,ABA处理下DlPPO1基因的表达水平相对平稳,说明DlPPO1并不直接依赖于ABA激素信号途径(图6)。

EC.松散型胚性愈伤组织;ICpEC.不完全胚性紧实结构;GE.球形胚;HE.心形胚;TE.鱼雷形胚;CE.子叶胚图3 龙眼体胚发生过程中DlPPO1的相对表达量EC. embryogenic callus; ICpEC. incomplete compact pro-embryogenic cultures; GE. globular embryos; HE. heart-shaped embryos; TE. torpedo-shaped embryos; CE. cotyledon embryos.Fig. 3 Relative expression of DlPPO1 at different stages of longan SE
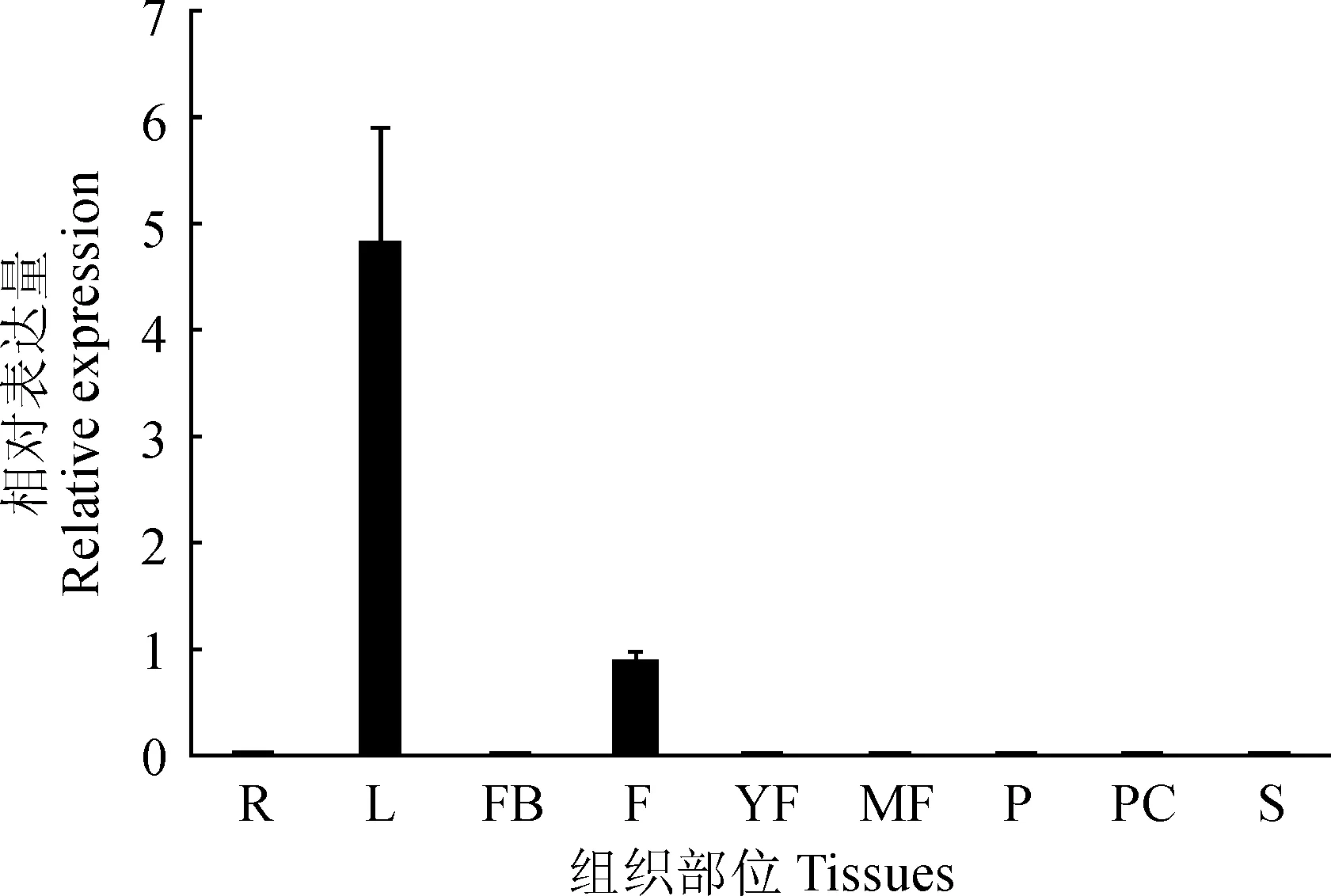
R.根;L.叶;FB.花芽;F.成花;YF.幼果;MF.成熟果;P.果肉;PC.果皮;S.种子图4 龙眼不同组织部位DlPPO1的相对表达量R. Roots; L. Leaves; FB. Floral buds; F. Flowers; YF. Young fruits; MF. Mature fruits; P. Pulp; PC. Pericarp; S. Seeds.Fig. 4 Relative expression of DlPPO1 in different tissues of longan
3讨论
3.1龙眼DlPPO1的潜在功能
生物膜将细胞分隔成带有不同种类蛋白质的细胞器,并发挥各自不同的功能,蛋白质的亚细胞定位分析可以为研究其功能提供线索。由于PPO属于核基因编码的质体酶,基因在细胞质中表达后需经转运至质体靶位点而发挥作用[22],而本研究预测的DlPPO1具有较丰富跨膜结构的特点,正符合该基因的作用特征。质体醌是一种醌分子,与光合作用中的光反应的电子传递链有关。经本研究中预测DlPPO1可能定位于叶绿体基质中的类囊体上,推测DlPPO1有可能参与叶绿体中质体醌的形成,可能间接影响龙眼光合作用的电子传递链反应。
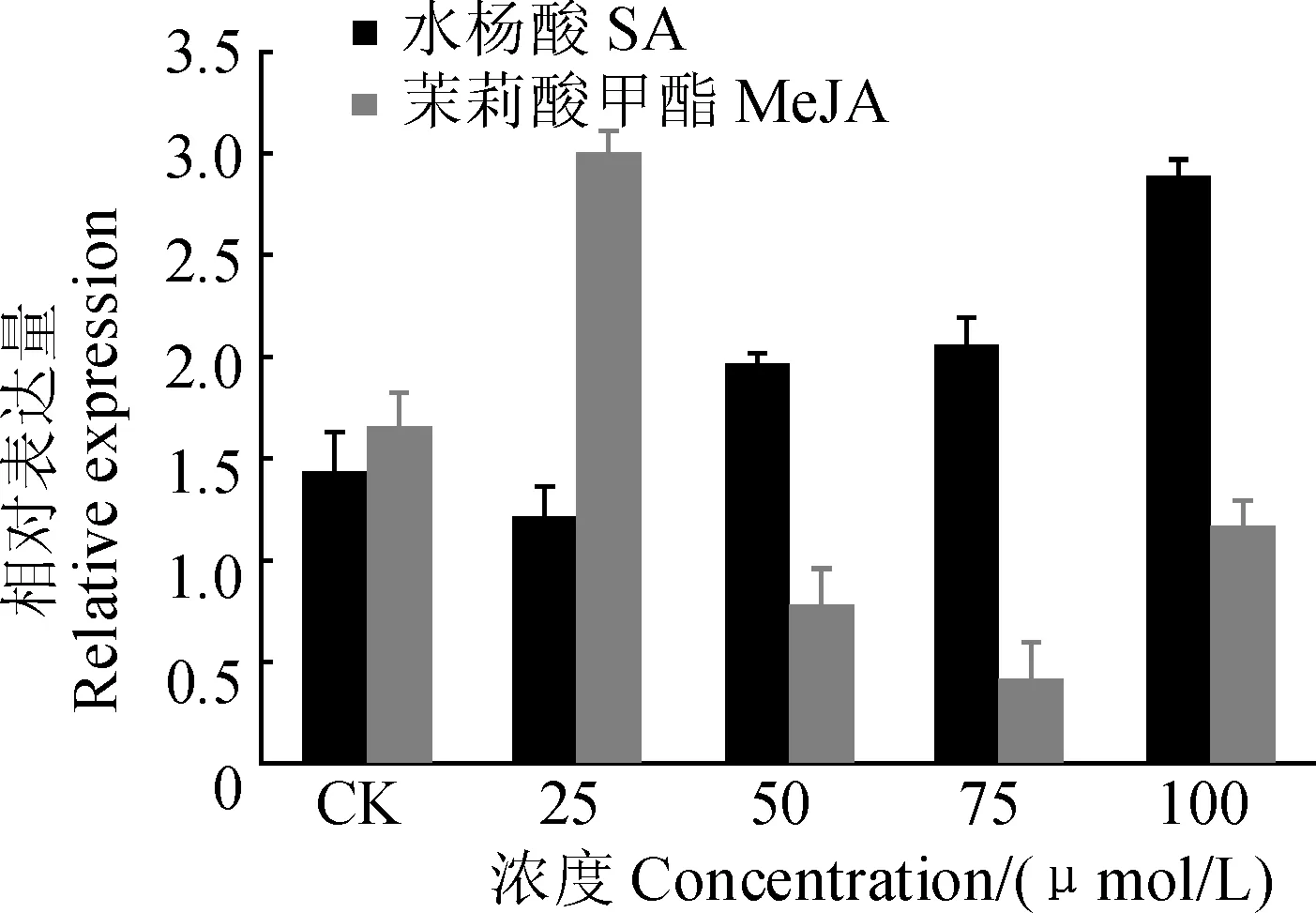
图5 外源激素处理下DlPPO1 mRNA的相对表达量Fig. 5 Relative expression of DlPPO1 in response to exogenous phytohormones
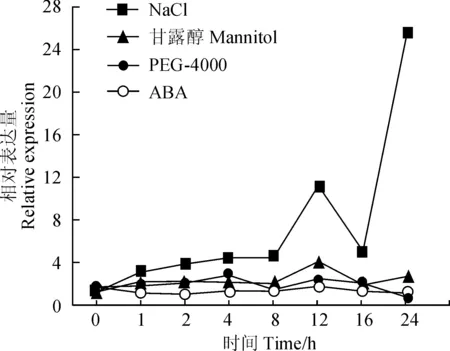
图6 非生物胁迫因素处理下DlPPO1 的相对表达量Fig. 6 Relative expression of DlPPO1 in response to abiotic stress
本研究中DlPPO1蛋白的结构特征符合前人关于PPO的报道。DlPPO1具有PPO蛋白的典型特征,含PPO1_DWL和PPO1_KFDV两个结构域,同时还含有两个保守的铜离子束缚区CuA和CuB双结合位点[23]。另外DlPPO1 在龙眼中可能存在与ptcmiR1444s类似的翻译抑制位点。
3.2DlPPO1的组织表达特性
植物PPO在不同组织中的表达具有特异性,如苹果PPO在幼茎、幼叶、花瓣、枝皮等组织中均有表达,在幼叶中表达量最高而在花瓣中的表达量最低[24];橄榄中幼嫩组织器官的PPO转录水平高于成熟组织[15];荔枝PPO在花和叶中表达量最高,在果肉中表达量最低[16]。尽管果树中有关于PPO在植物若干组织部位的差异性表达研究,但在种子形成之前的胚胎发育阶段的表达调控研究尚未有报道,且龙眼PPO基因的表达调控研究仍为空白。龙眼胚性愈伤组织的转录组数据[25]中并没有发现PPO基因的记录,由此可初步推测,DlPPO1可能在龙眼胚胎发育早期表达量较低或者以其他前体等形式存在。通过对DlPPO1基因的在龙眼体胚发生过程的差异表达进行分析发现,DlPPO1从体胚发育中期开始积累,到子叶胚时期的相对表达量相对早期显著上调,说明DlPPO1在龙眼体胚发育后期开始发挥关键作用,可能为参与幼胚发育及后期萌发等过程中的酚类氧化和木质素形成过程储备营养物质和能量。DlPPO1在龙眼体胚发生过程中的表达调控机制仍需要今后进行进一步深入研究。组织特异性表达分析表明,DlPPO1在龙眼叶片中表达量最高,可能与其亚细胞定位于叶绿体基质有关;其次在花芽表达量较高,可能原因为相对较高的PPO活性有利于花芽分化[26];而DlPPO1基因的在其他组织部位几乎无表达,可见其表达具有组织特异性,且龙眼中可能还存在其他成员以实现PPO在龙眼不同组织部位的氧化还原反应调节。
3.3DlPPO1可能参与胁迫应答
激素在植物应对各种生物和非生物胁迫应答中发挥重要作用,已知茉莉酸(JA)和水杨酸(SA)可作为植物抗病响应所需的信号分子来激活植物防御机制[27];JA和SA分别与植物诱导性系统抗性 (ISR)和系统获得性抗性 (SAR)有关[28];植物体内ABA是应答生物胁迫和非生物胁迫的重要信号分子,许多逆境条件下其含量升高,从而提高植物自身抗逆性以应对外界环境[29]。有研究指出,植物激素信号产生的时间和丰度在决定植物病害程度中起着关键作用[30]。本研究中,DlPPO1的表达受到低浓度MeJA、SA、盐胁迫、渗透胁迫和干旱胁迫的诱导,其中盐胁迫的诱导作用最为显著,而ABA对DlPPO1并没有显著的诱导作用,可见DlPPO1可能不直接依赖于ABA的逆境胁迫信号转导途径,而可能是通过JA或SA的逆境胁迫信号转导途径调控植物对胁迫的抗性。另外,杨树miR1444可能通过作用于PPO基因参与毛果杨对外界环境胁迫的应答[6, 31];本研究在杨树miRNA数据库中预测分析到DlPPO1也存在杨树miR1444翻译抑制位点,可见龙眼中可能也存在miR1444类似成员通过调控龙眼PPO的活动以应对外界环境变化。总之,究竟DlPPO1在龙眼体胚中如何调节植物细胞以应对胁迫,如何应答逆境信号转导等一系列问题还需要进一步研究。
参考文献:
[1]王蕾. 小麦PPO基因变异及Ppo-A1 基因多态性与面粉白度关联性研究[D]. 陕西杨陵: 西北农林科技大学, 2012.
[2]NEWMAN S M, TANTASAWAT P, STEFFENS J C. Tomato polyphenol oxidase B is spatially and temporally regulated during development and in response to ethylene[J].Molecules, 2011, 16(1): 493-517.
[3]FUERST E P, ANDERSON J V, KENNEDY A C,etal. Induction of polyphenol oxidase activity in dormant wild oat (Avenafatua) seeds and caryopses: a defense response to seed decay fungi[J].WeedScience, 2011, 59(2): 137-144.
[4]MAHANIL S, ATTAJARUSIT J, STOUT M J,etal. Overexpression of tomato polyphenol oxidase increases resistance to common cutworm[J].PlantScience, 2008, 174(4): 456-466.
[5]MAYER A M. Polyphenol oxidases in plants and fungi: Going places? A review[J].Phytochemistry, 2006, 67(21): 2 318-2 331.
[6]崔秀娜, 袁丽钗, 苏晓娟,等. miR1444a参与毛果杨对锌胁迫的响应[J]. 中国科学:生命科学, 2012,42(10):850-860.
CUI X N, YUAN L C, XU X J,etal. miR1444a is involved in the response ofPopulustrichocarpato zinc stress. [J].ScientiaSinicaVitae, 2012, 42(10): 850-860.
[7]孙健, 李丽, 等. 荔枝、龙眼采后酶促褐变反应化学机理研究进展[J]. 南方农业学报, 2012, 43(10):1 561-1 568.
SUN J, LI L,etal. Chemical mechanism advances of enzymatic browning reaction in postharvest lychee and longan fruits[J].JournalofSouthernAgriculture, 2012, 43(10): 1 561-1 568.
[8]张振霞, 洪萍. 橄榄总多酚含量及多酚氧化酶活性与组培褐变的关系[J]. 中国农学通报, 2010, 26(22):54-57.
ZHANG ZH X, HONG P. The connection between concentration of total polyphenol, activity of polyphenol oxidase and browning of explants inCanariumalbum(Lour.) Rauesch[J].ChineseAgriculturalScienceBulletin, 2010, 26(22): 54-57.
[9]赵云峰, 林河通, 林艺芬,等. 热处理延缓采后龙眼果实果皮褐变及其与酚类物质代谢的关系[J]. 现代食品科技, 2014(5):218-224.
ZHAO Y F, LIN H T, LIN Y F,etal. Effect of heat treatment on browning delaying and phenolics metabolism in pericarp of harvested longan fruit[J].ModernFoodScienceandTechnology, 2014, (5): 218-224.
[10]陈子健, 吴振先, 等. 龙眼果肉自溶与部分氧化还原酶同工酶变化的关系[J]. 热带作物学报, 2014,(7):1 434-1 438.
CHEN Z J, WU ZH X,etal. Relationship between longan pulp-breakdown and the changes of some oxidoreductase isozymes[J].ChineseJournalofTropicalCrops, 2014,(7): 1 434-1 438.
[11]ANDERSON J V, MORRIS C F. Purification and analysis of wheat grain polyphenol oxidase (PPO) protein[J].CerealChemistry, 2003, 80(2): 135-143.
[12]NISHIMURA M, FUKUDA C, MURATA M,etal. Cloning and some properties of Japanese pear (Pyruspyrifolia) polyphenol oxidase, and changes in browning potential during fruit maturation[J]. JournaloftheScienceofFoodandAgriculture, 2003, 83(11): 1 156-1 162.
[13]李桂琴, 李会宣, 许冬倩,等. 鸭梨多酚氧化酶基因CDS区的克隆及表达[J]. 果树学报, 2008, 25(4):577-580.
LI G, LI H X, XU D Q,etal. Cloning and expression of polyphenol oxidase gene of CDS from Yali Pear [J].Journaloffruitscience, 2008, 25(4): 577-580.
[14]高宇琼, 林玉玲, 赖钟雄. 金花茶多酚氧化酶基因的克隆及其体胚发生过程中的表达分析[J]. 福建农林大学学报:自然科学版, 2014, 43(6):602-608.
GAO Y Q, LIN Y L, LAI ZH X. Cloning and expression ofPPOgene during somatic embryogenesis inCamellianitidissimaChi.[J].JournalofFujianAgricultureandForestryUniversity(Natural Science Edition), 2014, 43(6): 602-608.
[15]荣霞, 赖钟雄, 林玉玲,等. 橄榄多酚氧化酶基因(PPO)克隆及其试管苗离体保存过程中的表达分析[J]. 热带作物学报, 2014, 35(4):738-745.
RONG X, LAI Z X, LIN Y L,etal. Cloning and expression of polyphenol oxidase(PPO)gene during different process of preservation ininvitroChinese Olive(Canariumalbum)[J].ChineseJournalofTropicalCrops, 2014, 35(4): 738-745.
[16]WANG J, LIU B, XIAO Q,etal. Cloning and expression analysis of litchi (LitchiChinensisSonn.) polyphenol oxidase gene and relationship with postharvest pericarp browning[J].PloSone, 2014, 9(4): e93982.
[17]LAI Z, CHEN C, ZENG L,etal. Somatic embryogenesis in longan [DimocarpuslonganLour.][M]//. In: Somatic Embryogenesis in Woody Plants Springer, 2000: 415-431.
[18]LIN Y, LAI Z, TIAN Q,etal. Endogenous target mimics down-regulate miR160 mediation of ARF10, -16, and -17 cleavage during somatic embryogenesis inDimocarpuslonganLour[J].FrontiersinPlantScience, 2015, 6(e219).
[19]陈桂信, 吕柳新, 赖钟雄,等. 柰基因组DNA的提取与纯化[J]. 江西农业大学学报, 2004, 26(3):329-333.
CHEN G X, LV L X, LAI Z X,etal. Extraction and purification of genomic DNA in Nai(PrunussalicinaLindl. var.cordata)[J].ActaAgriculturaeUniversitatisJiangxiensis, 2004, 26(3): 329-333.
[20]LIN Y, LAI Z. Reference gene selection for qPCR analysis during somatic embryogenesis in longan tree[J].PlantScience, 2010, 178(4): 359-365.
[21]DAI X, ZHAO P X. psRNATarget: a plant small RNA target analysis server[J].NucleicAcidsResearch, 2011, 39(suppl 2): W155-W159.
[22]SOMMER A, NE’EMAN E, STEFFENS J C,etal. Import, targeting, and processing of a plant polyphenol oxidase[J].PlantPhysiology, 1994, 105(4): 1 301-1 311.
[23]LIAO Z, CHEN R, CHEN M,etal. Molecular cloning and characterization of the polyphenol oxidase gene from sweetpotato[J].MolecularBiology, 2006, 40(6): 907-913.
[24]马长青, 柏素花, 戴洪义. ‘嘎拉’苹果多酚氧化酶基因MdPPO的克隆与表达分析[J]. 植物生理学报, 2013,(8):803-810.
MA C Q, BAI S H, DAI H Y. Cloning and expression analysis of polyphenol oxidase gene (PPO) identified from ‘Gala’ apple[J].PlantPhysiologyJournal, 2013, (8): 803-810.
[25]LAI Z, LIN Y. Analysis of the global transcriptome of longan (DimocarpuslonganLour.) embryogenic callus using Illumina paired-end sequencing[J].Bmc.Genomics, 2013, 14(2): 178-189.
[26]臧纱纱, 赵尊练, 江山,等. 线辣椒花芽分化过程的形态观察及部分代谢产物和酶活性的变化[J]. 西北农林科技大学学报:自然科学版, 2014,(4):171-178.
ZANG S S, ZHAO Z L, JIANG S,etal. Morphology and changes in metabolites during floral bud differentiation of chili pepper[J].JournalofNorthwestA&FUniversity(Natural Science Edition), 2014,(4):171-178.
[27]RIVAS-SAN VICENTE M, PLASENCIA J. Salicylic acid beyond defence: its role in plant growth and development[J].JournalofExperimentalBotany, 2011, 62(10): 3 321-3 338.
[28]DOORNBOS R F, GERAATS B P, KURAMAE E E,etal. Effects of jasmonic acid, ethylene, and salicylic acid signaling on the rhizosphere bacterial community ofArabidopsisthaliana[J].MolecularPlant-MicrobeInteractions, 2011, 24(4): 395-407.
[29]CUTLER S R, RODRIGUEZ P L, FINKELSTEIN R R,etal. Abscisic acid: emergence of a core signaling network[J].AnnualReviewofPlantBiology, 2010, 61(1): 651-679.
[30]MUR L A J, PAUL K,etal. The outcomes of concentration-specific interactions between salicylate and jasmonate signaling include synergy, antagonism, and oxidative stress leading to cell death[J].PlantPhysiology, 2006, 140(1): 249-262.
[31]SHANFA L, YING-HSUAN S, CHIANG V L. Stress-responsive microRNAs inPopulus[J].PlantJournalforCell&MolecularBiology, 2008, 55(1): 131-151.
(编辑:宋亚珍)
文章编号:1000-4025(2016)06-1098-07
doi:10.7606/j.issn.1000-4025.2016.06.1098
收稿日期:2016-03-05;修改稿收到日期:2016-04-26
基金项目:国家自然科学基金(31272149,31572088);福建省重大科技专项(2015NZ0002-1)
作者简介:田奇琳(1990-),女,博士,主要从事果树生物技术研究。 *通信作者:赖钟雄,博士,研究员,博士生导师,主要从事园艺植物生物技术与遗传资源研究。E-mail:Laizx01@163.com
中图分类号:Q785;Q786
文献标志码:A
Cloning and Expression Analyses ofDlPPO1 fromDimocarpuslonganLour.
TIAN Qilin, LIN Yuling, ZHENG Qingyou, SU Rongfeng, LAI Zhongxiong*
(Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou 350002, China)
Abstract:Based on homology cloning techniques, we isolated the polyphenol oxidase gene (3 transcripts:DlPPO1-a,DlPPO1-b, and DlPPO1-c; Genbank:KM387405, KM516087, and KM516088) from leaves of longan (‘Sijimi’ cultivar) by RT-PCR and RACE.The full-length cDNA sequence of DlPPO1-a,DlPPO1-b, and DlPPO1-c were 1 969 bp, 1 960 bp and 1 920 bp, respectively, containing a 1 800 bp open reading frame (ORF) which encoded 599 amino acids; DlPPO1 shared high homology with PPO gene of Litchi chinensis, Canarium album, and Populus euphratica, etc. Bioinformatic analysis revealed that the deduced DlPPO1 protein with conserved domains shared the typical characteristics of the PPO family. QPCR analysis indicated that during somatic embryogenesis (SE) in longan, the expression level of DlPPO1 rose from the stage of heart embryo and then reached the highest at the stage of the cotyledon embryo, which suggested that DlPPO1 might play important roles during the middle and late stages of longan SE. It was detected that DlPPO1 abundantly accumulated in longan leaves, followed by flower buds; there was lower expression in other longan tissues. After exposure to phytohormones and abiotic stress, the expression of DlPPO1 was induced by salicylic acid (SA), methyl jasmonte (MeJA), NaCl, mannitol, and PEG treatments. Consequently, it suggested that DlPPO1 might participate in abiotic stress responsiveness.
Key words:longan; somatic embryogenesis; polyphenol oxidase; abiotic stress, real-time quantitative PCR
