叶下珠药材HPLC指纹图谱的比较研究
2016-08-06左家哺饶力群
范 适,左家哺,饶力群
(1 湖南环境生物职业技术学院 园林学院,湖南衡阳 421005;2 湖南农业大学 生物科学技术学院,长沙 410128)
叶下珠药材HPLC指纹图谱的比较研究
范适1,2,左家哺1,饶力群2*
(1 湖南环境生物职业技术学院 园林学院,湖南衡阳 421005;2 湖南农业大学 生物科学技术学院,长沙 410128)
摘要:采用反相高效液相色谱法,对叶下珠药材不同产地、不同采收期、不同部位指纹图谱进行测定和比较分析,并与中成药叶下珠胶囊的HPLC指纹图谱进行了比较研究。结果显示:(1)建立了叶下珠药材的HPLC特征指纹图谱,标定18个共有峰,利用对照品指认4个峰;11批(来源地不同)叶下珠样品的HPLC图谱相似度(相合系数,均值)在0.89~0.99之间。(2)7批不同采收期的叶下珠药材的HPLC指纹图谱相似度在0.94以上,各共有峰的峰面积大多随生长期而增加,至10月5日达到最高,建议叶下珠药材应于每年的10月上旬进行采收。(3)不同部位叶下珠药材HPLC指纹图谱相似度分析发现,叶、果的相似度较高(0.98~0.99),根、茎的相似度较低(0.86~0.87),说明根、茎中各成分含量较低,建议采收叶下珠药材的地上部分即可。(4)比较叶下珠胶囊和叶下珠药材的指纹图谱,发现二者的化学成分非常相似,但峰面积差异较大,其差异可能是由于加工过程所致。该研究所建立的HPLC指纹图谱分析方法简便、重现性好,可用于叶下珠药材及中成药的鉴定与质量评价。
关键词:叶下珠;HPLC;指纹图谱
叶下珠(PhyllanthusurinariaL.)为大戟科叶下珠属植物,别名珍珠草、夜合草、阴阳草,一年生草本,全草入药[1]。现代药理实验证明叶下珠具有抗乙肝病毒和保肝护肝的药理作用,且无毒副作用,是一种值得深入开发的天然药物[2]。目前,对叶下珠的研究主要集中在化学成分、药理作用及临床应用等方面[3-7],质量控制方面的研究较少,有文献报道对叶下珠总黄酮[8]、生物碱[9]、总鞣质[10]、总酚[11]、没食子酸和柯里拉京[2,12]的含量进行测定,刘慧等[13]建立了叶下珠不同产地药材HPLC指纹图谱,其药材产地限于陕西、重庆、湖北三地,其分析的成分为水溶性成分,不能完全反映原药材的特征。本文采用高效液相色谱法对叶下珠药材不同产地、不同采收期、不同部位指纹图谱进行了系统研究,并与中成药叶下珠胶囊HPLC指纹图谱[14]进行了比较研究,为叶下珠药材及中成药的鉴定与质量评价提供依据。
1材料和方法
1.1试验材料
不同产地叶下珠药材,共11批(表1),收集时间为2005年9月~10月,采集部位为叶下珠全草。不同采收期的叶下珠药材,共7批:于2005年7月20日至10月20日每隔15 d采收1次,采自湖南环境生物职业技术学院校园内,采集部位为叶下珠全草。不同部位叶下珠药材,共4批:于2005年10月上旬采于湖南环境生物职业技术学院校园内,分成根、茎、叶及果4个部分。以上药材经湖南环境生物职业技术学院高迟教授鉴定为叶下珠(PhyllanthusurinariaL .)。

表1 叶下珠药材样品信息表
叶下珠胶囊,共10批,由昆明四创药业有限公司提供,批号分别为(S1~S10):20060202B01、20060102B08、20051001B06、20050904B04、20050902B20、20050601B12、20050502B23、20050403B02、20050203B21、20050102B08。
1.2主要试剂
甲醇、乙腈(HPLC级),购自湖南省化工研究院精细化工研究所;磷酸、醋酸、甲醇(AR级),购自国药集团化学试剂有限公司;对照品:叶下珠对照药材(批号121374-200401),没食子酸(批号110831-200302),柯里拉京(批号111623-200301),购自中国药品生物制品检定所;原儿茶酸(批号050410),咖啡酸(批号110885-200102),购自上海友思生物技术有限公司。
1.3主要仪器
岛津LC-VP系列高效液相色谱仪(包括DAD检测器、二元泵、Class-VP工作站,日本岛津公司);色谱柱Hypersil ODS2 250 mm×4.60 mm,5 μm 粒径(购自大连化物所);Sartorius CP225D电子天平(德国赛多利斯公司);KQ3200超声波清洗器(昆山市超声仪器有限公司);EASYpure II RF/UV型Barnstead超纯水处理器(美国赛默飞世尔)。
1.4试验方法
1.4.1色谱条件(1)叶下珠药材色谱柱Hypersil ODS2(250 mm×4.60 mm,5 μm);流动相采用乙腈(A)-0.1%磷酸水溶液(B)二元系统梯度洗脱:0~10 min A由3%升至11%,10~30 min由11%升至13%,30~45 min由13%升至20%,45~55 min由20%升至30%,55~65 min由30%升至50%,65~70 min由50%降至3%;柱温25 ℃;流量0.8 mL/min;检测波长280 nm;进样量10 μL。
(2)叶下珠胶囊色谱柱Hypersil ODS2(250 mm×4.60 mm,5 μm);流动相采用乙腈(A)-0.1%磷酸水溶液(B)二元系统梯度洗脱:0~10 min A由3%升至11%,10~30 min由11%升至13%,30~45 min由13%升至21%,45~55 min由21%升至31%,55~65 min由31%升至50%;柱温35 ℃;流量0.8 mL/min;检测波长280 nm;进样量10 μL。
1.4.2参照物溶液的制备精密称取没食子酸、原儿茶酸、咖啡酸和柯里拉京对照品适量,置10 mL量瓶中,用甲醇溶解并定容至刻度,摇匀,浓度分别为0.085、0.075、0.080、0.076 mg/mL,备用。
1.4.3供试品溶液的制备叶下珠药材:叶下珠药材样品45 ℃烘干,磨成细粉,过60目筛,精密称取样品细粉250 mg,置具塞锥形瓶中,加入50%甲醇15 mL称质量,回流提取1.0 h,取出放冷,称质量,用50%甲醇补足减失的质量,过滤, 取上清液用微孔滤膜(0.45 μm)滤过,即得。
叶下珠胶囊:精密称取叶下珠胶囊样品250 mg,置具塞锥形瓶中,加入50%甲醇20 mL称质量,回流提取1.0 h,取出放冷,称质量,用50%甲醇补足减失的质量,过滤,取上清液用微孔滤膜(0.45 μm)滤过,即得。
1.4.4方法学验证(1)精密度试验同一批样品(1号,产地为湖北武昌)按“1.4.1”项下色谱条件,连续进样5次,测定指纹图谱,计算各共有峰相对保留时间及相对峰面积的RSD。
(2)稳定性试验同一批样品(1号,产地为湖北武昌)按“1.4.1”项下色谱条件,分别在0、2、4、8、16、24 h测定指纹图谱,计算各共有峰相对保留时间及相对峰面积的RSD。
(3)重现性试验取同一批样品(1号,产地为湖北武昌)按“1.4.3”项下方法制备5份供试液,按“1.4.1”项下色谱条件测定指纹图谱,计算各共有峰相对保留时间及相对峰面积的RSD。
1.4.5指纹图谱相似度评价及聚类分析采用“计算机辅助相似性评价系统”软件进行指纹图谱相似度评价(版本1.315,中南大学中药现代化研究中心梁逸曾教授提供),采用SPSS 20.0统计分析软件进行聚类分析。
2结果与分析
2.1方法学验证
2.1.1精密度试验同一批样品按“1.4.1”项下色谱条件,连续进样5次,测定指纹图谱,结果以8号峰(柯里拉京)为参照峰,各共有峰相对保留时间的RSD为0.04%~0.36%,相对峰面积的RSD为0.11%~1.99%,表明仪器系统精密度良好,符合指纹图谱的技术要求。
2.1.2稳定性试验同一批样品按“1.4.1”项下色谱条件,分别在0、2、4、8、16、24 h测定指纹图谱,结果以8号峰(柯里拉京)为参照峰,各共有峰相对保留时间的RSD为0.11%~0.49%,相对峰面积RSD为0.15%~2.20%,表明供试品溶液在24 h内稳定,符合指纹图谱的技术要求。
2.1.3重现性试验取同一批样品按“1.4.3”项下方法制备5份供试液,按“1.4.1”项下色谱条件测定指纹图谱,结果以8号峰(柯里拉京)为参照峰,各共有峰相对保留时间的RSD为0.06%~0.59%,相对峰面积RSD为0.18%~2.66%,表明该方法重现性良好,符合指纹图谱的技术要求。
2.2不同产地叶下珠药材HPLC指纹图谱
取11批叶下珠药材,按照“1.4.3”项下方法制备供试品溶液,按“1.4.1”项下色谱条件进行测定,记录指纹图谱。
2.2.1共有峰的确定根据11批叶下珠药材高效液相分析,确定18个共有峰,构建了叶下珠HPLC色谱图的特征指纹图谱(图1)。根据对照品保留时间指认了其中的的4个峰:2号峰为没食子酸,3号峰为原儿茶酸,6号峰为咖啡酸,8号峰为柯里拉京(图1)。由于8号峰柯里拉京峰面积较大,出峰时间适中,因此,选择8号峰为参照峰,标记为S。计算各共有峰的相对保留时间和相对峰面积,结果见表2和表3。统计各批样品的18个共有峰面积占总峰面积比,结果为90.5%~95.8%(表4),符合指纹图谱的技术要求。
2.2.2相似度计算及对照指纹图谱的生成经实验得到11批叶下珠药材指纹图谱(图3)。采用中位数法和均值法生成对照图谱,采用相关系数法和相合系数法分别计算各批次与对照图谱的相似度,结果见表5。
2.2.3不同产地叶下珠药材指纹图谱相似度评价11批叶下珠药材相似度在0.838 7~0.985 2(相关系数,中位数法)、0.845 3~0.985 3(相关系数,均值法)、0.884 7~0.989 0(相合系数,中位数法)、0.893 3~0.988 3(相合系数,均值法),说明本实验建立的叶下珠药材指纹图谱18个共有峰以及对照指纹图谱可反映其指纹特征,具有鉴定评价意义。其中,8号药材(产地为云南昆明)相似度较低,无论采用哪种相似度评价方法,其相似度都在0.9以下,可能与其产地云南昆明的独特气候条件有关。
2.2.4不同产地叶下珠药材指纹图谱聚类分析将11批不同产地叶下珠药材样品各峰的相对峰面积值导入SPSS 20.0软件,选用ward法聚类方法,欧式距离为度量标准,聚类分析结果见图2。从树状聚类图中看到,11批样品大致可分为三类(距离为8),与指纹图谱相似度存在相关性。第一类由2、4、7、10号样品组成,从指纹图谱相似度来看(相关系数、中位数),四批样品的相似度都较高,在0.966 2~0.983 9之间;从产地来看,2、10号样品都来自广东,7号样品来自江西,4号样品为对照药材,说明广东、江西的药材及对照药材质量较好。第二类由1、3、8、11号样品组成,1、11号样品相似度较高,在0.95以上(相关系数、中位数),产地为地理位置上紧邻的湖北、湖南,3、8号样品相似度较低,分别为0.885 9、0.838 7(相关系数、中位数),产地为浙江、云南。第三类由5、6、9号样品组成,相似度都不高,在0.887 7~0.946 3之间(相关系数、中位数),产地为广西、海南及湖南邵阳廉桥药材市场。

C.混合对照品;S.叶下珠药材;2.没食子酸;3.原儿茶酸;6.咖啡酸;8.柯里拉京图1 混合对照品色谱图和叶下珠特征指纹图谱C. Mixture of reference substances; S. P. urinaria L.; 2. Gallic acid; 3. Protocatechuic; 6. Caffeic acid; 8. CorilaginFig. 1 HPLC fingerprint of mixture of reference substances and representative HPLC fingerprint of P. urinaria L.

峰号Peaknumber样品编号Samplenumber1234567891011平均值Average10.1230.1240.1230.1230.1240.1240.1230.1230.1240.1230.1230.12320.3190.3170.3160.3160.3170.3170.3180.3150.3170.3160.3180.31730.4470.4440.4450.4450.4450.4450.4450.4450.4450.4460.4450.44540.5630.5610.5620.5610.5620.5620.5610.5610.5620.5620.5610.56250.6520.6500.6510.6520.6470.6540.6530.6490.6490.6520.6480.65160.8240.8300.8240.8240.8210.8270.8240.8290.8320.8230.8380.82770.9830.9810.9840.9810.9810.9820.9840.9800.9820.9820.9810.9828(S)1.0001.0001.0001.0001.0001.0001.0001.0001.0001.0001.0001.00091.1511.1481.1491.1481.1501.1501.1481.1471.1491.1531.1481.149101.2941.2981.2901.2911.2921.2921.2931.2931.2951.2911.2951.293111.4181.4081.4151.4091.4091.4111.4081.4211.4131.4071.4121.412121.4321.4261.4261.4271.4281.4361.4271.4261.4281.4221.4331.428131.4851.4731.4731.4721.4761.4761.4751.4731.4781.4761.4721.475141.5151.5091.5091.5131.5151.5051.5061.5111.5141.5241.5061.512151.5821.5701.5731.5731.5761.5821.5781.5801.5731.5811.5721.576161.6191.6281.6181.6181.6221.6221.6151.6251.6221.6111.6241.620171.6411.6331.6471.6381.6351.6381.6471.6331.6431.6341.6451.639181.6811.6721.6811.6801.6771.6731.6791.6871.6841.6831.6861.680
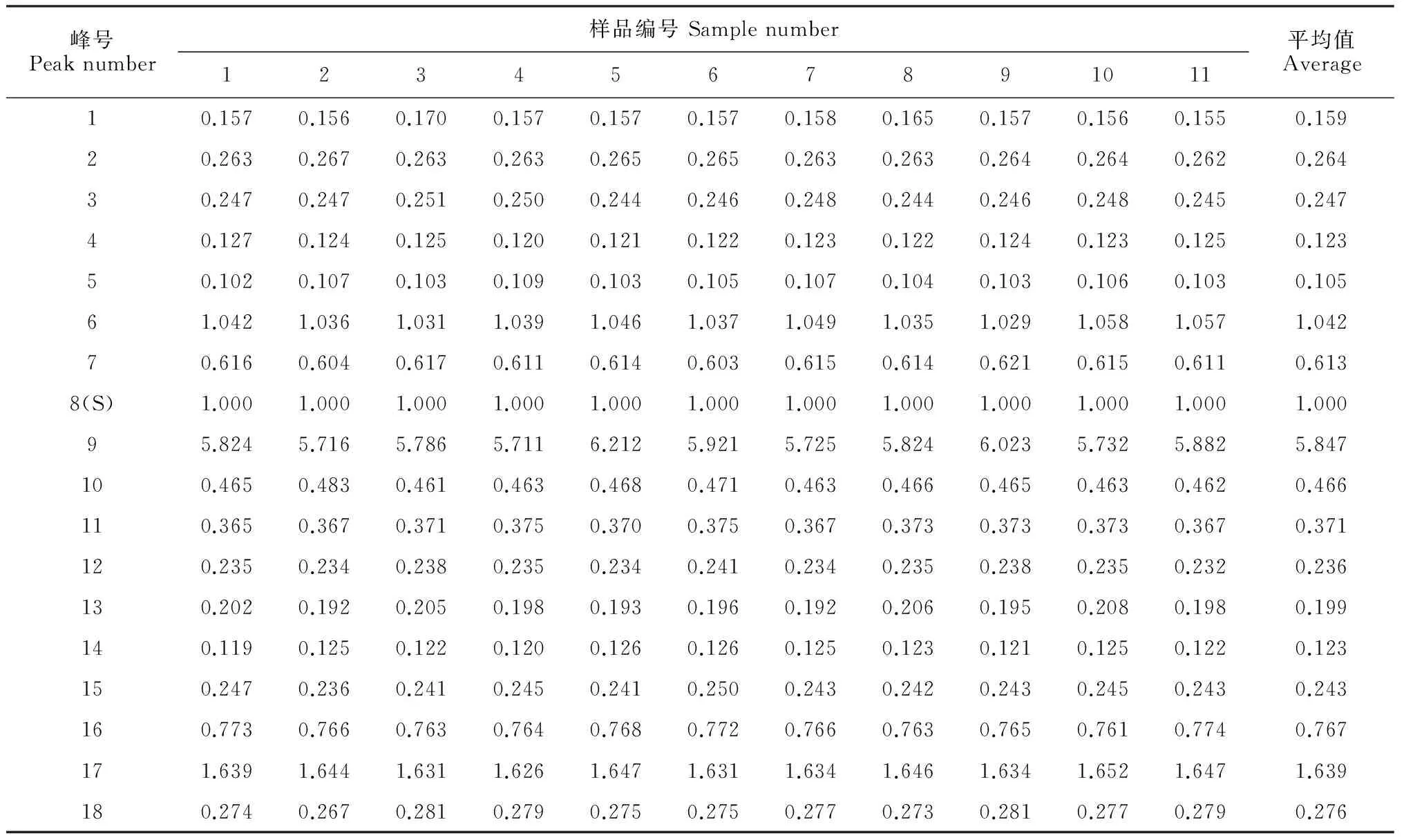
表3 11批叶下珠药材指纹图谱共有峰相对峰面积

表4 11批叶下珠药材共有峰面积占总峰面积比

图2 不同产地叶下珠药材HPLC指纹图谱聚类分析树状图Fig. 2 Hierarchical clustering analysis of P. urinaria L. from different habitats
2.3不同采收期叶下珠药材HPLC指纹图谱
2.3.1相似度评价7批不同采收时间的叶下珠药材的HPLC指纹图谱见图4,相似度评价结果见表6,从表6可以看出,7批不同采收时间的叶下珠药材其相似度在0.948 3~0.996 3,无论采用哪种相似度评价方法,其相似度都在0.94以上,说明样品之间具有较高的相似度。

1~11为叶下珠不同产地药材样品编号;R为对照图谱(红色:均值法;蓝色:中位数法)图3 不同产地叶下珠药材HPLC指纹图谱叠加图1 to 11 is sample number of P. urinaria L. from different habitats; R is control fingerprint(red: average method; blue: median method)Fig. 3 Superimposed HPLC fingerprint of P. urinaria L. from different habitats
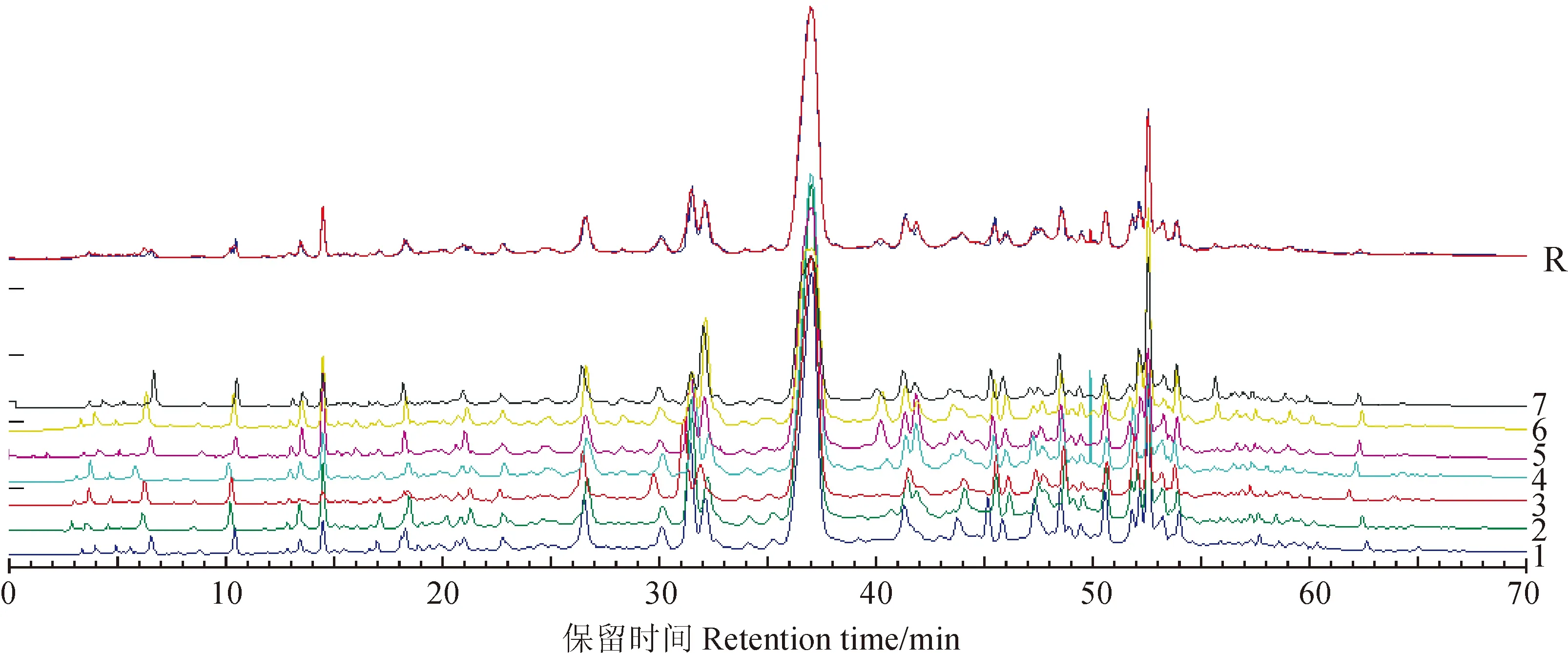
1. 7月20日;2. 8月5日;3. 8月20日;4. 9月5日;5. 9月20日;6. 10月5日;7. 10月20日;R为对照图谱(红色:均值法;蓝色:中位数法)图4 不同采收期叶下珠药材HPLC指纹图谱叠加图1. 20 July; 2. 5 August; 3. 20 August; 4. 5 September; 5. 20 September; 6. 5 October; 7. 20 October; R is control fingerprint(red: average method; blue: median method)Fig. 4 Superimposed HPLC fingerprint of P. urinaria L. in different harvest times
2.3.2不同采收期叶下珠药材指纹图谱比较比较共有峰在不同采收期的峰面积,可以发现,共有峰的峰面积(即成分的含量)大多随生长期而增加,至10月5日达到最高,过后则明显降低(图6)。叶下珠药材传统的采收期为夏秋[1],从不同采收期的指纹图谱来看,建议叶下珠药材的采收期为每年的10月上旬。

表5 不同产地叶下珠药材HPLC指纹图谱相似度计算结果

表6 不同采收期叶下珠药材HPLC指纹图谱相似度计算结果
注:1~7号样品同图4
Note: Sample 1~7 are the same as that of Figure 4

表7 不同部位叶下珠药材HPLC指纹图谱相似度计算结果
2.3.3不同采收期叶下珠药材指纹图谱聚类分析将7批不同采收期叶下珠药材样品各峰的相对峰面积值导入SPSS 20.0软件,选用ward法聚类方法,欧式距离为度量标准,聚类分析结果见图5。从树状聚类图中看到,7批样品大致可分为四类(距离为4),与样品的采收期、各共有峰峰面积(各成分含量)及指纹图谱相似度存在相关性。第一类由采收期为7月20日、8月5日的1、2号样品组成,第二类由采收期为8月20日、9月5日、9月20日的3、4、5号样品组成,第三类为采收期10月5日的6号样品,第四类为采收期10月20日的7号样品。第一类的1、2号样品、第二类的3、4、5号样品其采收期相近、各共有峰峰面积及指纹图谱相似度也相近,第三类的6号样品、第四类的7号样品,由于其各共有峰峰面积较高,与其它样品差异明显,因此单独列为一类,这与图5的分析结果“共有峰的峰面积大多随生长期而增加,至10月5日达到最高,过后则明显降低”一致。从指纹图谱相似度结果来看(表6),采收期为10月5日的6号样品的相似度最低,主要是由于其大多数共有峰峰面积在采收期10月5日时达到最高(图6),明显高于其它样品,从而导致指纹图谱相似度较低,因此6号样品单独列为一类,与指纹图谱相似度分析结果一致。

图5 不同采收期叶下珠药材HPLC指纹图谱聚类分析树状图Fig. 5 Hierarchical clustering analysis of P. urinaria L. from different harvest times

1~16.峰号图6 不同采收期叶下珠药材部分共有峰峰面积比较1-16.Peak numberFig. 6 Comparison of some mutual peak of P. urinaria L. in different harvest times
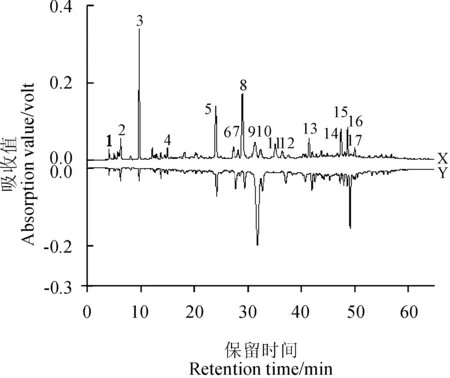
X.叶下珠胶囊(S7号样品);Y.叶下珠药材(4号样品);3.没食子酸;4.原儿茶酸;8.柯里拉京图8 叶下珠胶囊和叶下珠药材的特征HPLC图谱比较X. YeXiaZhu Capsules(sample S7); Y. P. urinaria L.(sample 4); 3. Gallic acid; 4. Protocatechuic; 8. CorilaginFig. 8 Comparison of representative HPLC fingerprint of YeXiaZhu Capsules and P. urinaria L.

A.根;B.茎;C.叶;D.果图7 不同部位叶下珠药材HPLC指纹图谱叠加图A.Root; B.Stem; C.Leaf; D.FruitFig. 7 Superimposed HPLC fingerprint of P. urinaria L. from different parts
2.4不同部位叶下珠药材HPLC指纹图谱
2.4.1相似度评价叶下珠药材不同部位的HPLC指纹图谱见图7,相似度评价结果见表7,从表7可以看出,叶、果相似度较高,都在0.948 6以上,根、茎的相似度较为接近,茎的相似度在0.832 9~0.914 4,根的相似度最低,在0.842 3~0.883 8,它们在相似度上的差异有两方面的原因,一是各成分在含量上的差异,二是部分共有峰如1和14号峰在根的样品中没有出现,导致根的相似度较低。
2.4.2不同部位药材指纹图谱比较由图7可知,叶下珠不同部位的HPLC图谱基本一致,如1、2、3、6、7、8、9、10、12、16、17、18号峰都能在药材不同部位的图谱中找到,但峰面积的差别很大,各共有峰峰面积最高是叶,其次为果、茎,最低是根,且叶中各共有峰峰面积较其它部位高出很多,例如,2号峰(没食子酸),叶片中最高,果次之,根、茎最低,约为叶的1/5;3号峰(原儿茶酸),叶中很高,其它部位仅是痕量或几乎没有;8号峰(柯里拉京)为叶下珠主要活性成分之一[2],叶片中最高,根中最低,约为叶的1/5。在根中,保留时间65 min处有一特征峰。
2.5叶下珠胶囊与叶下珠药材的特征指纹图谱比较
对叶下珠胶囊的特征指纹图谱[14]和叶下珠药材的特征指纹图谱进行了对比分析(图8),由图8可知,叶下珠胶囊与叶下珠对照药材的化学成分非常相似,叶下珠药材的指纹峰基本上在叶下珠胶囊中都能找到,两者的差异主要体现在3号、5号、8号、9号、11号及16号峰的峰面积上。11号峰在叶下珠胶囊中存在,但叶下珠药材中没有;3号(没食子酸)、5号和8号峰(柯里拉京)的峰面积叶下珠胶囊比叶下珠药材高出很多,特别是3号峰,两者的峰面积相差10倍以上,但是9号、16号峰的峰面积比叶下珠药材低。
3讨论
3.1叶下珠药材的HPLC指纹图谱
根据11批供叶下珠药材确定18个共有峰构成叶下珠药材的特征指纹图谱,根据对照品保留时间指认了其中的4个共有峰:2号峰没食子酸,3号峰原儿茶酸,6号峰咖啡酸,8号为柯里拉京,选择8号峰为参照峰,采用计算机辅助的相似度评价软件进行相似度评价,其相似度在0.89~0.99范围内(相合系数,均值),达到相似度的基本要求。因此,本试验建立的叶下珠药材HPLC指纹图谱能够用于叶下珠药材的鉴定及质量评价。根据聚类分析结果,11批不同产地药材可分为3类,广东、江西的药材及对照药材归为一类,其指纹图谱相似度较高,说明产地为广东、江西的药材及对照药材质量较好。
3.2叶下珠药材的采收时期
从叶下珠药材不同采收期的指纹图谱来看,各共有峰的峰面积(即成分的含量)大多随生长期而增加,至10月5日达到最高,过后则明显降低,建议叶下珠药材的采收期为每年的10月上旬。
3.3叶下珠药材的采收部位
对不同部位叶下珠药材HPLC指纹图谱相似度进行分析,发现叶、果的相似度较高,在0.98~0.99之间(相合系数,均值),根、茎的相似度较低,在0.86~0.87之间(相合系数,均值),原因在于根、茎中各成分含量较低。叶下珠药材的药用部位是全草,其根、茎、叶、果的比例大体上是根占10~20%,茎占40~50%,叶占30~40%,果所占的比例较小,约占5%,地上部分茎、叶、果加起来所占比例在80%以上,根所占比例不到20%,且各成分含量又很低,因此,从各部位的指纹图谱及所占比例分析,建议只采收叶下珠药材的地上部分。
3.4叶下珠胶囊与叶下珠药材在指纹图谱上的差异
叶下珠胶囊是单味植物药,其加工工艺[15]为“取叶下珠粗粉5 000 g,用10倍量80%乙醇分3次浸渍,每次16 h,滤过,滤液回收乙醇,浓缩成相对密度为1.20~1.25(40 ℃)的清膏,加6倍量水沉淀,取上清液,减压浓缩至相对密度为1.30~1.35(40 ℃)的稠膏,加入叶下珠200 g细粉,混匀,干燥,粉碎,过筛,装入胶囊,即得”,该工艺采用浸渍提取法,不会破坏化学成分的结构,因而,叶下珠胶囊与叶下珠药材的化学成分非常相似,叶下珠胶囊采用醇提水沉法,以沉淀方式除去树脂、叶绿素等脂溶性杂质,使有效成分进一步富集,因此,一些指纹峰如3号峰(没食子酸)和8号峰(柯里拉京),其峰面积高出叶下珠药材数倍以上,因此,叶下珠胶囊与叶下珠药材在指纹图谱上的差异是由于其加工过程所致。
参考文献:
[1]全国中草药汇编编写组. 全国中草药汇编(上册)[M].北京:人民卫生出版社,1978:263.
[2]范适. 叶下珠保肝护肝有效成分的分离及HPLC指纹图谱研究[D].长沙:湖南农业大学,2007.
[3]仲英, 左春旭, 李风琴,等. 叶下珠化学成分及其抗乙肝病毒活性的研究[J]. 中国中药杂志,1998,23(6): 363-364.
ZHONG Y, ZUO C X, LI F Q,etal. Studies on chemical constituents ofPhyllanthusurinariaL. and its antiviral activity against hepatitis B virus[J].ChinaJournalofChineseMateriaMedica, 1998,23(6): 363-364.
[4]SYAMASUNDAR KV, SINGH B, THAKUR RS,etal. Antihepatotoxic principles ofPhylantusniruriherbs[J].Ethnoparmacol, 1985,14(1): 41.
[5]周世文, 徐传福, 周宁,等. 叶下珠对小鼠实验性肝损伤的保护作用[J]. 中药材, 1994, 17(12): 31-32.
ZHOU S W,XU C F, ZHOU N,etal.Studies on protective effects ofPhyllanthusurinariaL. on experimental liver injury in mice[J].JournalofChineseMedicinalMaterials, 1994, 17(12): 31-32.
[6]范适, 李兰岚, 饶力群,等.抗乙肝植物药叶下珠化学成分和药理作用研究进展[J].南华大学学报:自然科学版, 2006,20(2):83-87.
FAN S,LI L L, RAO L Q,etal.Advance in study of chemical constituents and pharmacological effect ofPhyllanthusurinariaL. against HBV[J].JournalofNanhuaUniversity(Science and Technology). 2006,20(2):83-87.
[7]任丽娟. 叶下珠属植物化学成分研究和临床应用[C]. 全国植物资源和植物化学学术讨论会论文摘要集,1995: 11-15.
[8]牛晓峰,赵锐山,李维凤,等.叶下珠不同生长期及贮存期总黄酮含量测定[J].西北药学杂志, 2000, 15(2):60.
NIU X F, ZHAO R S, LI W F,etal.Determination of total flavonoids in different growth period and storage period ofPhyllanthusurinariaL.[J].NorthwestPharmaceuticalJournal, 2000, 15(2):60.
[9]邓光辉,胡炜,刘榕城,等.溴麝香草酚蓝比色法测定叶下珠生物碱的含量[J].时珍国医国药,2009,20(5):1 193-1 194.
DENG G H, HU W, LIU R Cetal. Determination of alkaloids ofPhyllanthusurinariaL. in bromothymol colorimetric method[J].LishizhenMedicineandMateriaMedicaResearch, 20(5):1 193-1 194.
[10]牛晓峰,李维凤,李延.叶下珠不同生长期及保存期总鞣质含量测定[J].西北药学杂志,2000,15(增刊): 14.
NIU X F, LI W F, LI Y. Determination of total tannide in different growth period and storage period ofPhyllanthusurinariaL.[J].NorthwestPharmaceuticalJournal, 2000, 15(Suppl.):14
[11]王坤凤,林琛,吴玲芳,等.不同产地叶下珠药材中总酚含量测定[J].中国实验方剂学杂志,2013,19(13):110-112.
WANG K F, LIN C, WU L F,etal. Determination of total phenols fromPhyllanthusurinariain different locations[J].ChineseJournalofExperimentalTraditionalMedicalFormulae,2013,19(13):110-112.
[12]范适,左家哺,易诚,等.HPLC法同时测定叶下珠胶囊中没食子酸和柯里拉京的含量[J].湖南农业大学学报:自然科学版,2007,33(5):636-638.
FAN S, ZUO J P, YI C,etal. Determination of contents of gallic acid and corilagin in Yexiazhu Capsules by HPLC[J].JournalofHunanAgriculturalUniversity(Natural Sciences), 2007, 33(5):636-638.
[13]刘慧, 盛卫国, 彭松. 叶下珠药材HPLC指纹图谱的研究[J]. 中药材, 2007, 30(2):150-154.
LIU H, SHENG W G, PENG S. Study on HPLC Finger prints ofPhyllanthusurinaria[J].JournalofChineseMedicinaMaterials, 2007, 30(2):150-154.
[14]范适, 左家哺, 易诚,等. 叶下珠胶囊的HPLC指纹图谱研究[J].湖南中医药大学学报, 2008, 28(1): 35-37,40.
FAN S, ZUO J P, YI C,etal. Study on fingerprints of Yexiazhu Capsules by HPLC[J].JournalofTCMUniv.ofHunan, 2008, 28(1): 35-37,40.
[15]国家食品药品监督管理局. 中华人民共和国国家药品监督管理局标准(试行)[S]. WS-11435(ZD-1435)-2002.
(编辑:潘新社)
文章编号:1000-4025(2016)06-1206-10
doi:10.7606/j.issn.1000-4025.2016.06.1206
收稿日期:2016-01-18;修改稿收到日期:2016-06-05
基金项目:湖南省教育厅青年基金(04B018);衡阳市科技计划(2007KJ014)
作者简介:范适(1969-),男,博士,副教授,主要从事植物天然产物的研究与利用。E-mail:593077425@qq.com *通信作者:饶力群,教授,博士生导师,主要从事植物天然产物的研究与开发。E-mail:raoliqun@163.com
中图分类号:Q503
文献标志码:A
Comparative Study on HPLC Fingerprint ofPhyllanthusurinaria
FAN Shi1,2, ZUO Jiapu1, RAO Liqun2*
(1 Landscape Department, Hunan Polytechnic of Environment and Biology, Hengyang, Hunan 421005, China;2 College of Biological Science and Technology, Hunan Agricultural University, Changsha 410128, China)
Abstract:The HPLC fingerprint of Phyllanthus urinaria from different habitats, different harvest times, different parts was determined and compared by RP-HPLC. The comparative study was done with the HPLC fingerprint of Yexiazhu Capsules also. The representative HPLC fingerprint of P. urinaria was established. The results showed: (1) There were 18 mutual peaks, four of which were identified by reference substance. The similarity of 11 samples from different habitats was in the range of 0.89 to 0.99. (2) The similarity of 7 samples from different harvest times was greater than 0.94. The peak area of most mutual peaks increased with growth period, the highest was in 5 October. It was suggested the best harvest time was on early October annually. (3) The similarity of samples from different parts was analyzed and evaluated. The similarity of leaf and fruit was higher in the range of 0.98 to 0.99, and the similarity of root and stem was in the range of 0.86 to 0.87. Lower content of components in root and stem brought about the difference in similarity. It was suggested only collecting the aerial parts. (4) The chemical constituents of Yexiazhu Capsules were nearly consistent with that of reference herb of P. urinaria, but the peak area of some peaks varied very much because of processing of Yexiazhu Capsules. So, this method is simple, accurate, and reproducible, which can be used for the quality control and evaluation of P. urinaria and its Chinese proprietary medicines.
Key words:Phyllanthus urinaria L.; high performance liquid chromatography; fingerprint
