补骨脂素对去势雌鼠E2、ERβ、TNF-α、IL-17的影响
2016-08-06杨琳曾英李劲平刘珊王文杰杨岩冰莫新民
杨琳 曾英 李劲平 刘珊 王文杰 杨岩冰 莫新民
1. 湖南中医药大学, 长沙 410007 2. 中南大学药学院, 长沙 410013
补骨脂素为补骨脂的主要化学成分,具有促进成骨细胞增殖、分化,可用于骨质疏松症治疗[1-3]。近年有研究表明补骨脂素可与雌激素受体(ER)结合,启动雌激素受体元件,具有拟雌激素活性[4-6]。壮骨止痛胶囊是本课题组研发的治疗原发性骨质疏松的已上市六类中药新药,补骨脂是壮骨止痛胶囊中的君药,而补骨脂素是壮骨止痛胶囊的主要定量控制指标之一。课题组已有研究表明补骨脂素对于双侧去卵巢骨质疏松大鼠模型具有良好抗骨质疏松作用[7]。近年来的研究表明免疫系统在骨质疏松发生发展中发挥了重要作用,肿瘤坏死因子-α(TNF-α)、白介素-17(IL-17)在骨质疏松发生发展过程中扮演了重要角色,本研究通过观察补骨脂素对去势骨质疏松雌鼠血清雌激素(E2)、ERβ、TNF-α、IL-17水平及骨组织ERβ、TNF-α、IL-17基因表达的影响,探讨补骨脂素抗绝经后骨质疏松作用机理。
1 材料与方法
1.1 实验动物
SPF级雌性SD大鼠72只,3月龄,体重210~250 g,购自湖南斯莱克景达实验动物有限公司,动物质量合格证号NO.43004700005517,湖南中医药大学动物实验中心许可证号:SCXK(湘)2013-0004。
1.2 药品
壮骨止痛胶囊(四川美大康药业股份有限公司,批准文号:Z20050118)、补骨脂素(中国药品生物制品检定所,纯度>98%),戊酸雌二醇(拜耳医药保健有限公司广州分公司,批准文号:J20130009),青霉素钠(哈药集团制药总厂,批号:A1301022417)。
1.3 试剂
大鼠肿瘤坏死因子-α检测试剂盒(上海邦奕生物科技有限公司,批号:201410),大鼠白介素-17检测试剂盒(上海邦奕生物科技有限公司,批号:201406),大鼠ERβ免疫组化试剂盒(上海雅吉生物科技有限公司),雌二醇E2检测试剂盒(上海邦奕生物科技有限公司,批号:201406),TRIZOL试剂(美国Invitrogen公司,批号:28218),Go Taq Green MasterMix(美国Promega公司,批号:0000110146),DNA Marker I(天能生物科技有限公司,批号:20140714),琼脂糖(天能生物科技有限公司,批号:111860),TBE液(天能生物科技有限公司,批号:20140714),水合氯醛(天津市科密欧化学试剂有限公司,批号:20120110),无水乙醇(上海振兴化工一厂,批号:201408301),氯仿(国药集团化学试剂有限公司,批号:T20101202),异丙醇(国药集团试剂有限公司,批号:20120627),液氮(长沙日臻气体有限公司)。
1.4 仪器
凝胶成像分析系统(美国Bio-Rad),PCR 扩增仪(北京六一仪器厂,型号:WD-9402A),核酸蛋白分析仪(Eppendorf Biophotometer plus,型号:GPS-9160MBE),立式压力蒸汽灭菌器(上海申安医疗器械厂,型号:LDZX-30KBS),全自动雪花制冰机(常熟市雪科电器有限公司,型号:IMS-30),电泳仪槽(北京六一仪器厂,型号:DYY-8c),电泳槽(北京六一仪器厂,型号:DYCP-31DN),电子天平(奥豪斯仪器有限公司,型号:CP214),-80度冰箱(Thermo scientific),-20度冰箱(Haier 低温冷柜),-4度冰箱(Haier 冷藏箱),微波炉(Midea 417-ykk),移液枪(规格0.5~10 ul;20~200ul;100~1 000 ul),液氮生物容器(YDS-10 型 编号:20060282)。
1.5 分组及造模方法
72只雌性SD雌鼠,按体重随机分为假手术组、模型组、戊酸雌二醇对照组、壮骨止痛胶囊对照组、补骨脂素高剂量组、补骨脂素低剂量组共6组,每组12只。每只大鼠分别用2%的水合氯醛腹腔注射麻醉(0.35 ml/100 g)后,在无菌条件下从距离第一腰椎两侧外1 cm处纵向切开,除假手术组仅切除少许脂肪组织外,其余各组大鼠完整摘除双侧卵巢,彻底止血后分两层缝合切口。术后各组大鼠切口严格用络合碘消毒,连续3 d肌注兽用青霉素 (4万u/只/天)抗炎,5 d后拆线。
1.6 给药方法
各组均从术后一周开始给药,每天灌胃1次,连续13周。除假手术组和模型组每天灌胃相应体积蒸馏水外,其余各组开始灌胃相应药物(1 ml/100 g)。剂量按人鼠体表面积折算,戊酸雌二醇对照组按0.21 mg/kg给药,壮骨止痛胶囊对照组按相当于生药6.6 g/kg给药,补骨脂素高、低剂量组分别按8 mg/kg和4 mg/kg给药。
1.7 指标检测
实验过程中,所有大鼠自由饮水摄食,每10天称体重1次。给药l3周后,每组选取10只大鼠分别用2%的水合氯醛腹腔注射麻醉(0.35 ml/100 g)后,切开腹腔,分离腹主动脉插管取血2 ml,待凝固后500 g/min离心分离血清,ELISA法检测血清中E2、TNF-α、IL-17的含量。提取左股骨组织mRNA样本进行RT-PCR反应检测TNF-α、ERβ、IL-17的基因表达,取右股骨脱钙切片免疫组化检测ERβ。
1.7.1RT-PCR:(1)总RNA提取:取-80℃保存的左股骨,在研钵中加入液氮研碎,加入1 ml Trizol,按Trizol说明书抽提总RNA,采用紫外分光光度计测定其浓度及纯度,A260/A280均在1.8~2.0之间。(2)cDNA合成:采用20 μL逆转录反应体系,内含2 μg待测RNA,操作严格按照逆转录合成说明书执行。(3)引物序列及扩增条件:按照PCR反应条件,取2 μL cDNA模板配成25 μL反应体系进行目的基因扩增。ERβ有意义链5′- TCACCGTCGAGCCTTAGTTC -3′,反意义链5′- TCTGCATAGAGGAGCGATGA -3′;TNF-α有意义链5′-ACGTCGTAGCAAACCACCAA-3′,反意义链5′-CTGGGAGTAGATAAGGTACA-3′;IL-17有意义链5′ATCCATGTGCCTGATGCTGT-3′,反意义链5′-GTTATTGGCCTCGGCGTTTG-3′;内对照β-actin有意义链5′- CCTAGCACCATGAAGATCAA -3′,反意义链5′- TTTCTGCGCAAGTTAGGTTTT -3′。ERβPCR扩增循环参数:95℃预变性5 min,95℃变性30 s、50℃退火30 s、72℃延伸30 s,35个循环,最后72℃延伸10 min。TNF-αPCR扩增反应循环参数:95℃预变性5 min,95℃变性30 s、53℃退火30s、72℃延伸30 s,35个循环,最后72℃延伸10 min,扩增片段141 bp。IL-17PCR扩增循环参数:95℃预变性5 min,95℃变性30 s、55℃退火30 s、72℃延伸30 s,35个循环,最后72℃延伸10 min,扩增片段106 bp。β-acin扩增循环参数:95℃预变性5 min,95℃变性30 s、55℃退火30 s、72℃延伸30 s,35个循环,最后72℃延伸10 min,扩增片段227 bp。(4)半定量分析:各取PCR产物3 ul,用2%的琼脂糖电泳及溴化已锭染色,经凝胶成像系统(Bio-Rad) 进行拍照,用Image Lab 5.0软件进行定量分析。计算ERβ、TNF-α、IL-17产物电泳条带灰度与β-actin产物电泳条带灰度比值。
1.7.2免疫组化检测ERβ:取大鼠的完整右股骨,去除附着的肌肉和筋膜后浸泡在10%福尔马林PBS中脱钙后按常规切片、脱蜡至水洗后经抗原修复。加3%H202PBS溶液室温孵育10 min,PBS冲洗3次,滴加正常山羊血清(1∶10)室温孵育10 min。滴加兔抗大鼠ERβ抗体,阴性对照切片采用正常羊血清代替一抗,4℃孵育过夜。然后PBS浸洗3次,再滴加生物素标记羊抗兔IgG,室温反应30 min,PBS浸洗3次,然后滴加HRP链霉菌抗生物素蛋白,室温反应20 min;PBS浸洗3次;然后用0.06%DAB显色8 min;苏木精复染,酒精脱水,二甲苯透明后中性树胶封片。Olympus BX51型显微镜下观察、拍照,在Image-Pro Plus4.5进行图像分析。
1.8 统计方法
2 结果
2.1 补骨脂素对大鼠血清E2测定结果
与假手组相比,模型组大鼠血清E2水平非常显著降低(P<0.01)。与模型组相比,壮骨止痛胶囊显著升高血清E2水平(P<0.05),补骨脂素高剂量组血清E2水平显著升高(P<0.05),补骨脂素低剂量组血清E2水平升高趋势明显,但没有统计学差异。见表1。

表1 不同组别补骨脂素对去卵巢雌鼠血清E2水平的影响(n=6)Table 1 Effect of psoralen on the serum level of E2 in ovariectomized rats of different groups (n=6).
注:与模型组比较,**P<0.01,*P<0.05
2.2 补骨脂素对大鼠股骨ERβ表达的影响
与假手组相比,模型组股骨ERβ的mRNA转录和表达均显著降低(P<0.01或P<0.05)。与模型组相比,戊酸雌二醇组ERβ的表达显著升高(P<0.01或P<0.05);壮骨止痛胶囊组股骨ERβ基因表达显著升高(P<0.05);补骨脂素高剂量组股骨ERβ基因表达显著升高(P<0.05),补骨脂素低剂量组对股骨ERβ基因表达没有统计学差异,见表2。各组ERβmRNA表达电泳图见图1,股骨ERβ免疫组化染色见图2。
2.3 补骨脂素对大鼠血清TNF-α水平及基因表达的影响
与假手组相比,模型组血清TNF-α水平和股骨TNF-α基因表达均非常显著升高(P<0.01)。与模型组相比,戊酸雌二醇组血清TNF-α水平和股骨
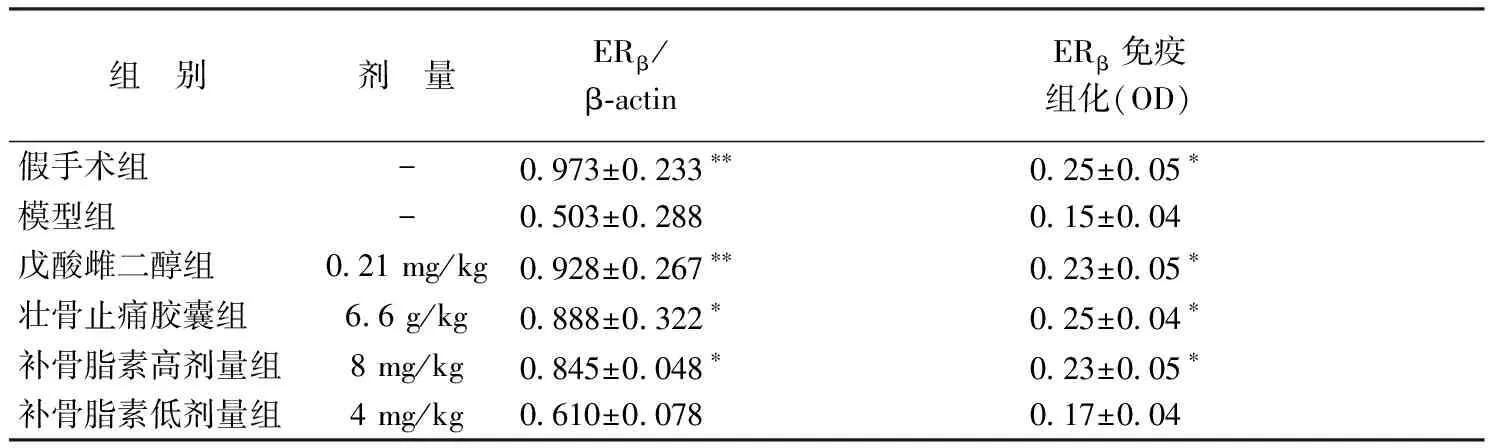
表2 不同组别补骨脂素对去卵巢雌鼠股骨ERβ表达的影响(n=6)Table 2 Effect of psoralen on ERβ in the femur in ovariectomized rats of different groups (n=6).
注:与模型组比较,**P<0.01,*P<0.05
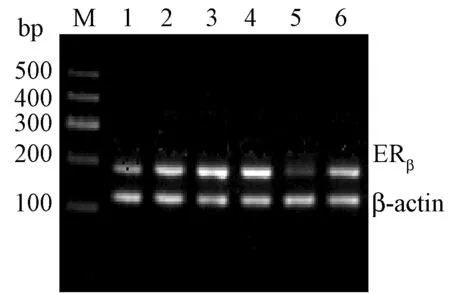
图1 各组ERβmRNA表达电泳图谱 1:补骨脂素低剂量;2:补骨脂素高剂量;3:戊酸雌二醇;4:假手术组;5:模型组;6:壮骨止痛方;M=DNA MarkerFig.1 The ERβ mRNA expression in each group. 1: Psoralen low dose; 2: Psoralen high dose; 3: Sham operation group; 4:Estradiol group; 5:Model group; 6:ZGZT capsule group; M: DNA Marker.
TNF-α基因表达均非常显著降低(P<0.01);壮骨止痛胶囊组股骨TNF-α基因表达非常显著降低(P<0.01),血清TNF-α水平显著降低(P<0.05);补骨脂素高剂量组血清TNF-α水平和股骨TNF-α基因表达均显著降低(P<0.05),补骨脂素低剂量组血清TNF-α水平显著降低(P<0.05),而股骨TNF-α基因表达没有统计学差异,见表3。各组TNF-αRNA表达电泳趋势图谱见图3。
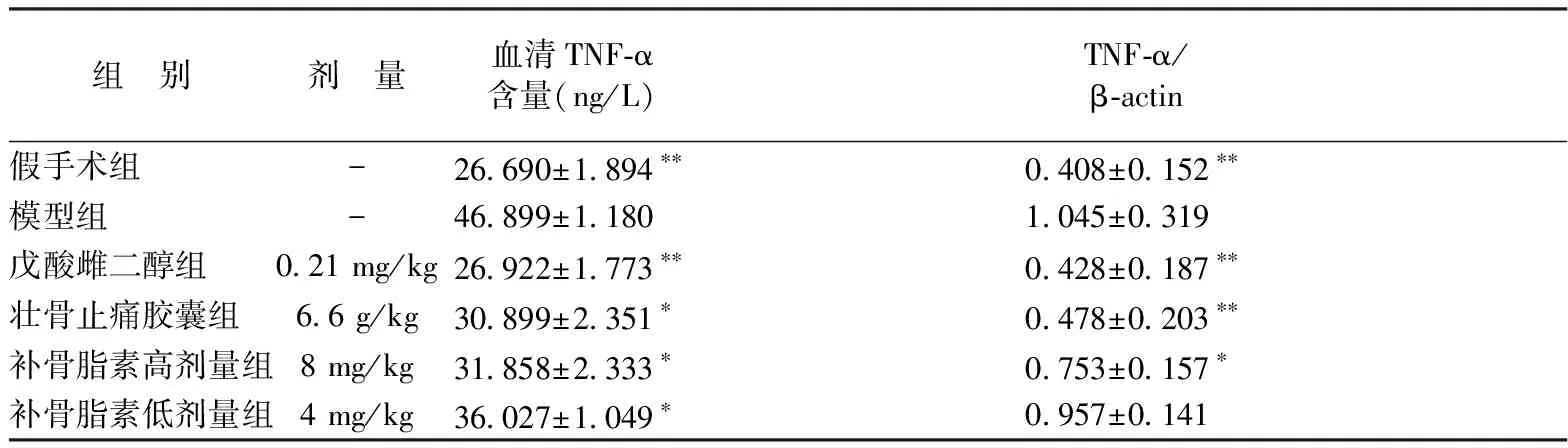
表3 不同组别补骨脂素对去卵巢雌鼠血清TNF-α水平及股骨TNF-α基因表达的影响(n=6)Table 3 Effect of psoralen on serum TNF-α and the gene expression of TNF-α in ovariectomized rats of different groups (n=6).
注:与模型组比较,**P<0.01,*P<0.05
2.4 补骨脂素对大鼠血清IL-17水平及其基因表达的影响
与假手组相比,模型组血清IL-17水平和股骨IL-17基因表达均非常显著升高(P<0.01)。与模型组相比,戊酸雌二醇组血清IL-17水平和股骨IL-17基因表达均非常显著降低(P<0.01);壮骨止痛胶囊组股骨IL-17基因表达非常显著降低(P<0.01),血清IL-17水平显著降低(P<0.05);补骨脂素高剂量组血清IL-17水平非常显著降低(P<0.01),而股骨IL-17基因表达显著降低(P<0.05),补骨脂素低剂量组血清IL-17水平和股骨IL-17基因表达均显著降低(P<0.05),见表4。各组IL-17 mRNA表达电泳图谱见图4。

表4 不同组别补骨脂素对去势雌鼠血清IL-17水平及股骨IL-17基因表达的影响(n=6)Table 4 Effect of psoralen on serum IL-17 and the gene expression of IL-17 in ovariectomized rats of different groups (n=6).
注:与模型组比较,**P<0.01,*P<0.05
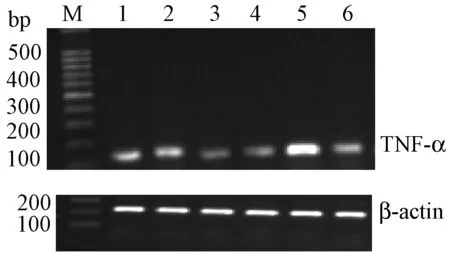
图3 各组TNF-αRNA表达电泳趋势图谱 1:补骨脂素低剂量组;2:补骨脂素高剂量组;3:假手术组;4:阳性对照组;5:模型组;6:壮骨止痛方组;M:DNA Marker Fig.3 The TNF-α mRNA expression in each group. 1: Psoralen low dose; 2: Psoralen high dose; 3: Sham operation group; 4:Estradiol group; 5:Model group; 6:ZGZT capsule group; M: DNA Marker.
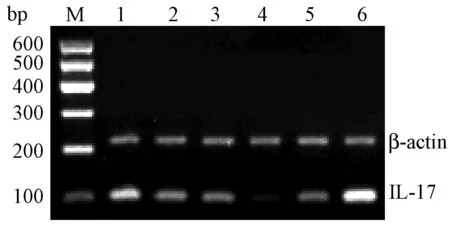
图4 各组IL-17 mRNA表达电泳图谱 1:补骨脂素低剂量组;2:补骨脂素高剂量组;3:壮骨止痛方组;4:假手术组;5:阳性对照组;6:模型组;M:DNA Marker Fig.4 The IL-17 mRNA expression in each group. 1: Psoralen low dose; 2: Psoralen high dose; 3: Sham operation group; 4:Estradiol group; 5:Model group; 6:ZGZT capsule group; M: DNA Marker.
3 讨论
补骨脂素是补骨脂的主要活性成分,可与雌激素受体(ER)结合,启动雌激素受体元件调控一系列基因的表达而发挥拟雌激素活性[4]。研究表明补骨脂素能促进成骨细胞增殖分化,增加成骨细胞骨保护素(OPG)的表达,抑制核因子 kB 受体激活因子配体(RANKL)的表达而抑制破骨细胞的分化和成熟,从而抑制骨吸收发挥抗骨质疏松的作用[8]。
雌激素受体有ERα和ERβ两种亚型,在骨组织内主要是ERβ,大部分分布在胞浆中,少部分分布在细胞膜。雌激素受体与雌激素结合后,雌激素受体转位到细胞核内调控一系列靶基因的表达。绝经后妇女的体内不仅雌激素水平大幅下降,而且组织细胞内的ER也下降[9-10]。由于ER是一种基因转录调控因子,其表达水平的下降必然影响到受其调控的一系列基因的表达。因此,在补充体内雌激素的同时,适当提高体内ER水平能更好地延缓绝经后骨质疏松的发展。本研究结果表明,大鼠去卵巢3个月后,其体内血清E2水平和股骨ERβ水平显著下降。给予戊酸雌二醇能显著提升ERβ的表达水平。壮骨止痛胶囊不仅提高去卵巢骨质疏松大鼠体内E2水平,而且促进去卵巢骨质疏松大鼠股骨内ERβ的表达。补骨脂素高剂量(8 mg/kg)也具有同时升高骨质疏松大鼠体内E2和ERβ水平的作用。补骨脂素在低剂量(4 mg/kg)时对体内E2和ERβ的调节作用没有显著影响。
IL-17主要由辅助性T17细胞(Th17)分泌,IL-17受体广泛存在于人体各种组织与细胞中,包括软骨细胞、骨细胞、成骨细胞、破骨细胞等。已有实验证实雌激素缺乏可以上调IL-17,促进RANKL的表达和骨的重吸收,且特异性拮抗IL-17或者IL-17受体缺失的小鼠在切除卵巢后不会发生骨质疏松[11]。因此,IL-17作为Th17细胞与骨细胞之间的调节因子,可以作为抗骨质疏松药物的一个新的作用靶点。本实验模型组大鼠血清IL-17非常显著升高(P<0.01),而且股骨的IL-17基因表达也显著增强(P<0.01),表明去卵巢造成体内雌激素缺乏导致股骨内的T17细胞的IL-17基因表达增强,从而提高骨微环境的IL-17水平,促进破骨细胞的骨吸收。补充戊酸雌二醇则非常显著抑制股骨内的T17细胞的IL-17基因表达,降低血清IL-17水平。补骨脂素高剂量(8 mg/kg)和低剂量(4 mg/kg)均能抑制去卵巢大鼠股骨T17细胞的IL-17基因表达和血清IL-17水平。
TNF-α是目前发现的一种强有力的骨吸收诱导剂,在雌激素缺乏的小鼠中,T细胞分泌的TNF-α通过与骨髓单核细胞表面的TNF受体结合,加强RANKL诱导的破骨细胞的形成[12]。雌激素缺乏时,激活和增殖T细胞,T细胞增多,TNF-α、等细胞因子分泌增多[13],促进破骨细胞的形成和活化,增强破骨细胞主导的骨吸收过程。本实验中,去卵巢模型大鼠血清TNF-α水平及股骨TNF-α基因表达升高非常显著(P<0.01)。给予戊酸雌二醇后,去卵巢模型大鼠血清TNF-α水平及股骨TNF-α基因表达下降非常显著(P<0.01),这进一步证实雌激素缺乏后T细胞功能失衡在骨代谢失常中扮演了重要角色。补骨脂素高剂量(8 mg/kg)显著降低去卵巢大鼠血清TNF-α水平(P<0.05),同时股骨TNF-α基因表达也明显下调(P<0.05)。
本实验表明补骨脂素呈现明显的量效关系提高去卵巢大鼠血清雌激素水平,同时对去卵巢大鼠TNF-α、IL-17的调节也呈现量效关系。补骨脂素在低剂量(4 mg/kg)对E2和ERβ的影响与模型组相比没有统计学差异,但其仍然能够抑制TNF-α、IL-17基因表达和降低血清TNF-α、IL-17水平。这种现象提示补骨脂素可能从两个方面发挥抗骨质疏松作用:一方面补骨脂素通过调节体内雌激素和雌激素受体水平对TNF-α、IL-17基因表达进行调节,其中包括补骨脂素与雌激素受体结合;另一方面,补骨脂素可能通过其它非雌激素信号途径调节TNF-α、IL-17基因表达。相关的具体作用细节需要借助有关转基因实验动物和体外细胞实验进一步研究。
