NK⁃1受体在截断尾末端小鼠扣带回前部神经元Fos蛋白表达中的作用
2016-08-05张雅娟吴敏范吴孟霏杨宇商丽宏王兵潘建
张雅娟,吴敏范,吴孟霏,杨宇,商丽宏,王兵,潘建
(1.沈阳市第五人民医院神经内科,沈阳 110023;2.沈阳医学院生理学教研室,沈阳 110034;3.辽宁何氏医学院2014级药学专业,沈阳 110163)
NK⁃1受体在截断尾末端小鼠扣带回前部神经元Fos蛋白表达中的作用
张雅娟1,吴敏范2,吴孟霏3,杨宇2,商丽宏2,王兵1,潘建1
(1.沈阳市第五人民医院神经内科,沈阳 110023;2.沈阳医学院生理学教研室,沈阳 110034;3.辽宁何氏医学院2014级药学专业,沈阳 110163)
目的研究截断尾末端能否引起小鼠扣带回前部(ACC)神经元Fos蛋白表达的改变,以及NK⁃1受体在该变化中的作用。方法用免疫组化技术研究截断小鼠尾末端2.5 cm后0.25 h、0.5 h、1 h和2 h ACC神经元Fos蛋白表达的变化,以及GR82334 NK⁃1受体拮抗剂尾静脉、蛛网膜下腔注射对该变化的影响。结果截断小鼠尾末端后0.25 h和0.5 h ACC神经元Fos蛋白表达显著增加,1 h达高峰,2 h后开始消退;GR82334尾静脉注射完全拮抗了截断小鼠尾末端引起的ACC神经元Fos蛋白表达的显著增加,但GR82334蛛网膜下腔注射拮抗作用不完全。结论截断小鼠尾末端能够引起ACC神经元Fos蛋白表达呈时间依赖性显著增加;外周与中枢NK⁃1受体参与此过程,但是,尚存其他受体和递质参与的中枢传导通路引起ACC神经元Fos蛋白表达的显著增加。
扣带回前部;幻肢痛;Fos蛋白;免疫组化;NK⁃1受体
网络出版地址
60%~80%的截肢患者术后伴有幻肢痛(phan⁃tom limb pain,PLP)[1⁃2]。有研究[3⁃4]报道,扣带回前部(anterior cingulate cortex,ACC)是重要的痛觉中枢,PLP患者的ACC神经元活动发生明显改变[5],截肢大鼠ACC对外周刺激及中枢刺激反应增强[6],截断小鼠尾末端常用于研究PLP产生的中枢机制[7]。目前,PLP发病机理仍不清楚。研究[8-9]表明,即刻早基因(c⁃fos)及Fos蛋白的表达标志着伤害性感受神经元兴奋,速激肽NK⁃1受体参与伤害性电刺激大鼠隐神经引起的ACC神经元Fos蛋白表达显著增高的过程。但是,截断小鼠尾末端能否引起ACC神经元Fos蛋白表达的改变及速激肽NK⁃1受体是否参与该过程尚未见报道。因此,本研究应用免疫组织化学技术对此进行探讨,以期阐明速激肽NK⁃1受体在伤害性信息传递和调制中的作用,深入研究PLP的产生机理,为临床治疗PLP提供科学实验依据。
1 材料与方法
1.1实验动物分组
昆明种成年小鼠54只,雌性,体质量(27±6)g,沈阳医学院实验动物中心提供(动物生产许可证号:SCXK辽2010⁃0001)。将小鼠行1%戊巴比妥钠腹腔麻醉(40 mg·kg-1),随机将小鼠均分为9组:空白对照组;用剪刀截断小鼠尾末端2.5 cm后0.25 h、0.5 h、1 h、2 h实验组(即断尾后0.25 h组、0.5 h组、1 h组、2 h组);1%GR82334尾静脉注射(1 mg·kg-1)后10 min,截断小鼠尾末端2.5 cm后0.5 h实验组(即GR82334 iv组);与GR82334 iv组同体积生理盐水尾静脉注射后10 min,截断小鼠尾末端2.5 cm后0.5 h对照组(即NS iv组);GR82334蛛网膜下腔注射(10 μg·10 μL-1)后10 min,截断小鼠尾末端2.5 cm后0.5 h实验组(即GR82334 ith组);与GR82334 ith组同体积生理盐水蛛网膜下腔注射后10 min,截断小鼠尾末端2.5 cm后0.5 h对照组(即NS ith组)。
1.2小鼠ACC Fos蛋白表达检测
将上述各组小鼠迅速断头,在冰台上取脑,置入4℃,4%多聚甲醛中过夜固定。连续冠状-20℃冰冻切片的厚度为15 μm,用免疫组化方法常规染片及洗片等,最后用树胶封片。使用显微图像分析仪(×400)检测切片ACC的阳性细胞积分光密度和面积百分比。
1.3统计学分析
2 结果
2.1截断尾末端后不同时间小鼠ACC神经元的Fos蛋白表达
与空白对照组比较,截断尾末端后0.25 h,ACC神经元的Fos蛋白表达显著增加(P<0.05);截断尾末端后0.5 h,ACC神经元的Fos蛋白表达进一步增加(P<0.01);截断尾末端后1 h,ACC神经元的Fos蛋白表达达到高峰(P<0.01);截断尾末端后2 h,ACC神经元的Fos蛋白表达开始消退,但是,仍然高于空白对照组(P<0.05,图1)。该结果提示,截断小鼠尾末端能够引起ACC神经元的Fos蛋白表达呈时间依赖性显著增加。
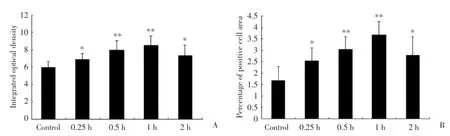
图1 截断尾末端后不同时间小鼠ACC神经元的Fos蛋白表达Fig.1 Fos protein expression in mice ACC neurons at various time after amputation of the tail extremity
2.2蛛网膜下腔注射GR82334对截断尾末端增加小鼠ACC神经元的Fos蛋白表达的影响
与空白对照组比较,截断尾末端后0.5 h ACC Fos蛋白表达显著增强,Fos蛋白表达积分光密度和阳性细胞面积百分比显著增高(P<0.01);NK⁃1受体拮抗剂GR82334蛛网膜下腔注射10 min后再截断尾末端0.5 h后,ACC Fos蛋白表达也显著增强(P<0.05),但是,ACC Fos蛋白表达增强的幅度明显低于单纯截断尾末端0.5 h后ACC Fos蛋白表达增强的幅度(P<0.05),也低于蛛网膜下腔注射同体积生理盐水10 min再截断尾末端后0.5 h引起的ACC Fos蛋白表达增强的幅度(P<0.05),见图2。
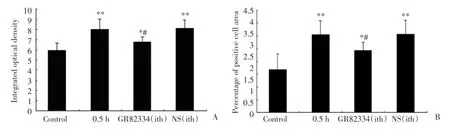
图2 蛛网膜下腔注射GR82334对截断尾末端增加ACC神经元的Fos蛋白表达的影响Fig.2 Effect of GR82334 intrathecal injection on increase in Fos protein expression in mice ACC neurons induced by amputation of the tail extremity
2.3尾静脉注射GR82334对截断尾末端小鼠ACC神经元的Fos蛋白表达的影响
与空白对照组相比较,截断尾末端后0.5 h ACC Fos蛋白表达显著增强,Fos蛋白表达积分光密度和阳性细胞面积百分比显著增高(P<0.01);NK⁃1受体拮抗剂GR82334尾静脉注射10 min再截断尾末端后0.5 h,ACC Fos蛋白表达轻度增强,但是,Fos蛋白表达积分光密度和阳性细胞面积百分比无统计学差异(P>0.05)。而同体积的生理盐水尾静脉注射10 min后再截断尾末端后0.5 h引起ACC Fos蛋白表达显著增强,Fos蛋白表达积分光密度和阳性细胞面积百分比有统计学差异(P<0.01),见图3。
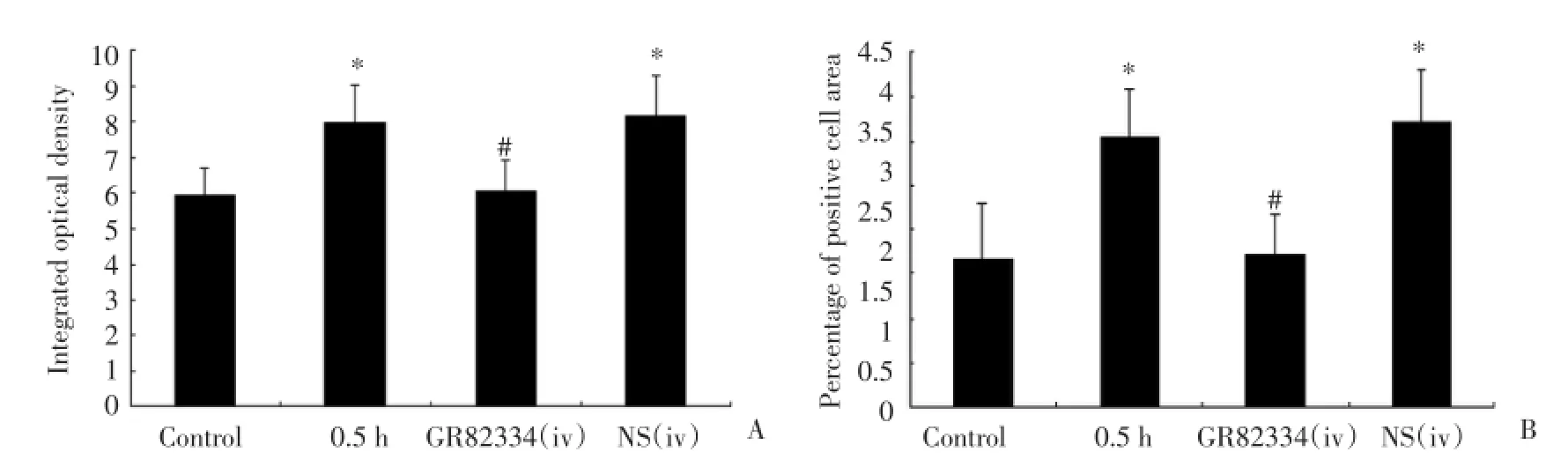
图3 尾静脉注射GR82334对截断尾末端增加ACC神经元的Fos蛋白表达的影响Fig.3 Effect of GR82334 caudal veins injection on increase in Fos protein expression in mice ACC neurons induced by amputation of the tail extremity
3 讨论
有研究[8]报道,Fos蛋白表达可作为中枢神经系统对刺激产生反应的疼痛标志物,标志着伤害性感受神经元兴奋,表达Fos蛋白的部位常是与伤害性传入信息传递、整合等有关的区域;截肢大鼠ACC神经元活动发生明显改变[6]。但是,截断小鼠尾末端能否引起ACC神经元Fos蛋白表达的改变尚未见报道。本研究观察到在空白对照组ACC神经元有少量的Fos蛋白表达;截断小鼠尾末端后0.25 h、0.5 h ACC神经元Fos蛋白表达显著增加,1 h达高峰,2 h后开始消退。因此认为在正常情况下ACC神经元存有Fos蛋白较低水平的表达;ACC神经元能够感受小鼠断尾传入的伤害性信息,引起Fos蛋白表达呈时间依赖性显著增加,ACC神经元参与断尾后中枢神经系统的可塑性变化。本研究结果为深入研究PLP提供了实验依据。
PLP是截肢后常见并发症之一。目前,关于PLP产生的原因仍不清楚,尚无理想的治疗方法。速激肽NK⁃1受体与痛觉过敏等有关[10⁃11]。但是,截断尾末端增加ACC神经元的Fos蛋白表达过程是否有NK⁃1受体参与尚未见报道。本研究结果发现,NK⁃1受体拮抗剂GR82334尾静脉注射能够拮抗截断尾末端引起的ACC神经元Fos蛋白表达显著增加,提示外周NK⁃1受体参与了截断尾末端引起的ACC神经元Fos蛋白表达的显著增加过程。由于GR82334不容易通过血脑屏障,因此进一步研究了GR82334蛛网膜下腔注射对截断尾末端诱导ACC神经元Fos蛋白表达增加的影响。研究结果显示,截断尾末端诱导ACC神经元Fos蛋白表达增加可被GR82334蛛网膜下腔注射拮抗,提示中枢NK⁃1受体也参与截断尾末端引起的ACC神经元Fos蛋白表达的显著增加过程。但是,GR82334蛛网膜下腔注射没有完全阻断Fos蛋白表达的显著增加,提示可能尚存其他受体和递质参与中枢传导通路引起ACC神经元Fos蛋白表达的显著增加。断尾后中枢神经系统的可塑性变化非常复杂,NK⁃1受体可能为治疗PLP的潜在靶点之一。
[1]RICHARDSON C,CRAWFORD K,MILNES K,et al.A clinical evaluation of postamputation phenomena including phantom limb pain after lower limb amputation in dysvascular patients[J].Pain Manag Nurs,2015,16(4):561-569.DOI:10.1016/j.pmn.2014.10. 006.
[2]VIANA R,PAYNE MW.Use of calcitonin in recalcitrant phantom limb pain complicated by heterotopic ossification[J].Pain Res Manaq,2015,20(5):229-233.
[3]BARTHAS F,SELLMEIJER J,HUGEL S,et al.The anterior cingu⁃late cortex is a critical hub for pain⁃induced depression[J].Biol Psychiatry,2015,77(3):236-245.DOI:10.1016/j.biopsych.2014. 08.004.
[4]NAVRATILOVA E,XIE JY,MESKE D,et al.Endogenous opioid activity in the anterior cingulate cortex is required for relief of pain [J].J Neurosci,2015,35(18):7264-7271.DOI:10.1523/JNEU⁃ROSCI.3862⁃14.2015.
[5]KRINGELBACH ML,JENKINSON N,GREEN AL,et al.Deep brain stimulation for chronic pain investigated with magnetoenceph⁃alography[J].Neuroreport,2007,18(3):223-228.
[6]LI J,WU M,ZHUO M,et al.Alteration of neuronal activity after dig⁃it amputation in rat anterior cingulate cortex[J].Int J Physiol Patho⁃physiol Pharmacol,2013,5(1):43-51.
[7]ZHUO M.Cortical depression and potentiation:basic mechanisms for phantom pain[J].Exp Neurobiol,2012,21(4):129-135.DOI:10.5607/en.2012.21.4.129.
[8]MATTSON MP.Excitotoxic and excitoprotective mechanisms:abun⁃dant targets for the prevention and treatment of neuro⁃degenerative disorders[J].Neuromolecular Med,2003,3(2):65-94.
[9]银欢,李娜然,马积昊,等.GR82334对强电流刺激大鼠隐神经增强扣带回前部Fos蛋白表达的影响[J].沈阳药科大学学报,2014,31(11):905-909.DOI:10.14066/j.cnki.cn21⁃1349/r.2014. 11.011.
[10]KHASABOV SG,SIMONE DA.Loss of neurons in rostral ventro⁃medial medulla that express neurokinin⁃1 receptors decreases the development of hyperalgesia[J].Neuroscience,2013,250:151-165.DOI:10.1016/j.neuroscience.2013.06.057.
[11]MUNOZ M,COVENAS R.Involvement of substance P and the NK⁃1 receptor in human pathology[J].Amino Acids,2014,46(7):1727-1750.DOI:10.1007/s00726⁃014⁃1736⁃9.
(编辑于溪)
Role of NK⁃1 Receptor in Fos Protein Expression of Anterior Cingulate Cortex Neurons of Mice Induced by Amputation of the Tail Extremity
ZHANG Yajuan1,WU Minfan2,WU Mengfei3,YANG Yu2,SHANG Lihong2,WANG Bing1,PAN Jian1
(1.Department of Neurology,The Fifth People′s Hospital of Shenyang City,Shenyang 110023,China;2.Department of Physiology,Shenyang Medical College,Shenyang 110034,China;3.Majoring in Pharmacy,Grade 2014,He University,Shenyang 110163,China)
ObjectiveTo study whether amputation of the tail extremity could induce change of Fos protein expression in mice ACC neurons,and explore the role of NK⁃1 receptor in the change.MethodsImmunohistochemistry technique was adopted to study Fos protein expression change in mice ACC neurons at 0.25 h,0.5 h,1 h,2 h after amputation of the tail extremity 2.5 cm,and also the effect of NK⁃1 receptor antagonist GR82334(iv)or GR82334(ith)in the change.ResultsFos protein expression in mice ACC neurons was significantly increased at 0.25 h,0.5 h after the amputation,and reached its peak at 1 h after the amputation,then started to decrease at 2 h after the amputation.GR82334(iv)com⁃pletely antagonized the significant augment in Fos protein expression in mice ACC neurons after the amputation,but the antagonism of GR82334 (ith)was incomplete.ConclusionAmputation of the tail extremity could significantly increase the Fos protein expression of mice ACC neurons in a time⁃dependent manner.Both peripheral and central NK⁃1 receptors were involved in the process.However,there are also central conduction pathways of other receptors and neurotransmitters involved in the significant augment in Fos protein expression in mice ACC neurons after amputa⁃tion.
anterior cingulate cortex;phantom limb pain;Fos protein;immunohistochemistry;NK⁃1 receptor
R338;Q432
A
0258-4646(2016)08-0700-04
10.12007/j.issn.0258⁃4646.2016.08.007
辽宁省自然科学基金(L2015020391);沈阳市科技攻关项目(F13⁃220⁃9⁃45)
张雅娟(1969-),女,主任医师,硕士.
吴敏范,E-mail:minfanwu0594@sina.com.cn
2015-11-21
网络出版时间:
