骨髓间充质干细胞联合超短波对大鼠脊髓损伤后早期GFAP和ED⁃1的影响
2016-08-05孙师万峪岑赵利娜尹艳梅陆宇冯智萍周禹鑫张志强张立新
孙师,万峪岑,赵利娜,尹艳梅,陆宇,冯智萍,周禹鑫,张志强,张立新
(中国医科大学附属盛京医院康复科,沈阳 110022)
骨髓间充质干细胞联合超短波对大鼠脊髓损伤后早期GFAP和ED⁃1的影响
孙师,万峪岑,赵利娜,尹艳梅,陆宇,冯智萍,周禹鑫,张志强,张立新
(中国医科大学附属盛京医院康复科,沈阳 110022)
目的探讨骨髓间充质干细胞(BMSCs)联合超短波治疗对大鼠脊髓损伤(SCI)后4周功能恢复、胶质纤维酸性蛋白(GFAP)和ED⁃1表达的影响。方法30只雌性SD大鼠,随机分为5组:假手术组、对照组、超短波组、BMSCs组、超短波+BMSCs组,采用改良Allen′s法制作大鼠SCI模型,术后1 d、1周、2周、3周、4周用BBB评分法评价后肢运动功能的恢复情况。术后4周取材,行GFAP和ED⁃1免疫组化染色,测定其蛋白表达的积分光密度值,进行比较分析。结果术后4周超短波组、超短波+ BMSCs组的BBB评分显著高于对照组,差异有统计学意义(均P<0.001),BMSCs组与对照组比较无统计学差异。仅超短波+ BMSCs组GFAP的阳性表达显著低于对照组,差异有统计学意义(P<0.05)。超短波组、BMSCs组、超短波+BMSCs组ED⁃1表达水平明显低于对照组,差异有统计学意义(均P<0.05)。结论单纯超短波治疗即可明显改善SCI后神经功能恢复;超短波及BMSCs移植治疗均可减轻炎症,以超短波作用最为显著,二者联合治疗在促进功能恢复上并未显现出协同作用,但是在减轻炎性反应和胶质瘢痕形成上有协同作用。
脊髓损伤;骨髓间充质干细胞;超短波;胶质纤维酸性蛋白;ED⁃1
网络出版地址
脊髓损伤(spinal cord injury,SCI)因其病理机制非常复杂、致残致死率高,成为医学界的难题和热点之一。近年来,干细胞科学的飞速发展为医学界及广大SCI患者带来了希望[1]。本课题组在前期研究中,将骨髓间充质干细胞(bone marrow stromal cells,BMSCs)移植治疗与传统理疗方法超短波治疗结合,结果证实,在大鼠SCI后7周,BMSCs联合超短波治疗可减少炎症的表达,且BMSCs可分化成星形胶质样细胞,但对减少瘢痕的形成无明显意义[2]。本文旨在研究SCI后4周,BMSCs联合超短波治疗对大鼠SCI后早期功能恢复及炎症、瘢痕的影响,探讨其对大鼠SCI后早期和晚期的影响有无差异及趋势变化,并探讨其作用机制,为临床应用提供理论依据。
1 材料与方法
1.1实验动物、试剂及仪器设备
4周龄SD幼鼠3只及8~10周龄SD大鼠35只(中国医科大学附属盛京医院中心实验室提供),胎牛血清、DMEM/F12培养基、胰酶(美国Hyclone公司),小鼠抗大鼠ED⁃l单克隆抗体(美国Millpore公司),山羊抗大鼠胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体(美国Santa Cruz公司),兔抗山羊二抗试剂盒(武汉博士德生物工程公司),SABC试剂盒(北京博奥森生物技术有限公司),DAB显色剂(福州迈新生物技术开发有限公司),石蜡切片机(RM2245,德国Leica公司),显微图像成像系统(DMD108,德国Leica公司),光学显微镜(BS⁃60,日本Olympus公司),电子分析天平(德国Satorius公司),医用五官超短波治疗仪(上海医用设备厂,频率为40.68 MHz,最大输出功率为40 W)。
1.2方法
1.2.1BMSCs的分离和制备:取4周龄、体质量90~110 g的SD幼鼠3只,10%水合氯醛腹腔麻醉(0.33 mL/100 g)后乙醇浸泡。在无菌条件下取出干骺端完整的股骨,剥离骨表面的肌肉组织,PBS漂洗后剪去骨骺端,暴露骨髓腔。用含10%胎牛血清的DMEM/F12(1∶1)培养液5 mL冲洗骨髓腔,将冲洗出来的骨髓悬液进行反复抽吸,以打散细胞制成单细胞悬液,接种于培养瓶内(密度为8×103/cm2),置于5%CO2、37℃、饱和湿度培养箱中培养。48 h后更换培养液,之后每24 h换液1次,直至细胞贴壁、近80%~90%融合时,用胰酶-EDTA混合液在37℃消化2 min,进行传代培养直至第3代。
1.2.2SCI动物模型的制备:取8周龄雌性SD大鼠35只,体质量180~250 g,10%水合氯醛腹腔麻醉(0.33 mL/100 g)。无菌条件下打开T9~T11平面椎管,暴露T10节段脊髓,采用改良Allen′s法制作SCI模型[3],打击强度为l0 g重量、10 cm高度自由落体打击。大鼠立即出现后肢痉挛和一过性鼠尾摆动视为造模成功,苏醒后BBB评分为0~1分。术后伤口局部青霉素冲洗防止感染,3 d内每天经腹腔注射青霉素8万U,术后每日早晚排尿2次,直至正常的排尿反射建立。术后仔细观察大鼠伤口愈合情况,预防褥疮、泌尿系感染等并发症。35只大鼠中,苏醒后评分过高2只,死亡3只,剔除后共30只。
1.2.3分组及干预方法:假手术组6只,模型组24只随机分成对照组、超短波组、BMSCs组、超短波+ BMSCs组,每组保证纳入数据分析的大鼠各6只。假手术组仅单纯咬除椎板,不做脊髓打击,无脊髓损伤。对照组打击脊髓造成SCI,不给予任何治疗。超短波组于损伤后24 h给予脊髓受损部位小剂量超短波治疗,将大鼠固定于特制的塑料固定器内,不需麻醉,直径为4 cm的圆形电极板在脊髓受损部位两侧对置,与皮肤的间隙为2 cm,第1档调谐后实际输出功率约为11.58 W,每日1次,每次7 min,直至取材前1 d)。BMSCs组损伤后1周使用微量注射器将传至第3代的BMSCs(细胞密度为1× 106/μL)5 μL垂直注射入损伤区域中心。超短波+ BMSCs组于相应时间点给予相同方法的小剂量超短波治疗及相同数量的BMSCs移植。
1.2.4取材:SCI后4周,10%水合氯醛腹腔麻醉,仰卧位暴露心脏和肝脏,首先经心脏-升主动脉灌注4℃预冷的生理盐水约200 mL,肝脏颜色变浅,更换4℃预冷的4%多聚甲醛固定液约200 mL,至大鼠四肢震颤、僵硬。取出脊髓,以T10损伤处为中心,向头尾端切取共长l cm的组织,置于4%多聚甲醛固定液中4℃固定24 h,石蜡包埋,沿脊髓长轴纵向连续切片,片厚3 μm。
1.3观察指标
1.3.1BBB评分:术后第1天及1、2、3、4周对模型组大鼠进行BBB行为学评分[4],评分采用双人双盲法,观察时间为4 min。0分为全瘫,21分为正常大鼠。
1.3.2免疫组化分析:每个标本选取脊髓组织切片共10张,常规脱蜡,高压抗原修复8 min,3%H2O2溶液中孵育20 min,10%胎牛血清封闭20 min,分别滴加小鼠抗大鼠ED⁃l单克隆抗体(1∶2 000,美国Mill⁃pore公司)、山羊抗大鼠GFAP多克隆抗体(1∶400,美国Santa Cruz公司),阴性对照用PBS代替一抗,4℃过夜;复温2 h后PBS冲洗3次,分别滴加SABC试剂(北京博奥森生物技术有限公司)、兔抗山羊二抗试剂(武汉博士德生物工程公司),具体步骤按照试剂盒说明进行操作;DAB显色,苏木素复染,二甲苯透明,中性树胶封片。使用显微图像成像系统(DMD108,德国Leica公司)对每张切片进行拍照(400×),每张切片随机选取4个视野。采用Image⁃Pro Plus 6.0软件进行图像处理,测量积分光密度值(integrated optical density,IOD)并计算其平均值。
1.4统计学分析
采用GraphPad Prism 5.0统计软件对数据进行单因素方差分析,若有意义,进一步采用Bonferroni检验方法进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1行为学评分
模型组大鼠在SCI后均出现双下肢瘫痪,术后1d BBB评分为0~1分,说明SCI动物模型造模成功。术后1~4周,随时间延长各组运动功能均显示不同程度恢复。术后2~4周,各时间点超短波组和超短波+BMSCs组BBB评分均明显好于对照组(P<0.001),而BMSCs组与对照组相比无统计学差异(P>0.05),说明SCI术后4周内,改善大鼠运动功能的治疗中以超短波作用为主,超短波治疗和BMSCs移植二者并未显现出协同作用(表1)。
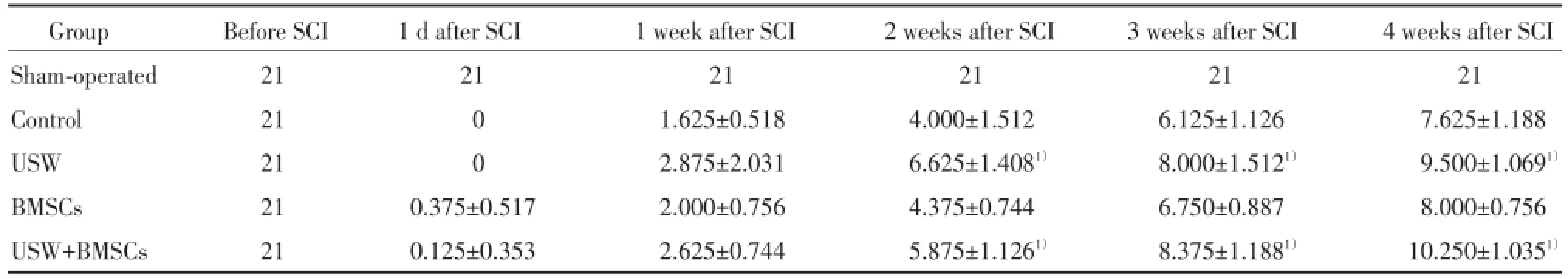
表1 不同时间点各组BBB运动功能评分Tab.1 BBB scores of all groups at different time points after SCI
2.2免疫组化染色
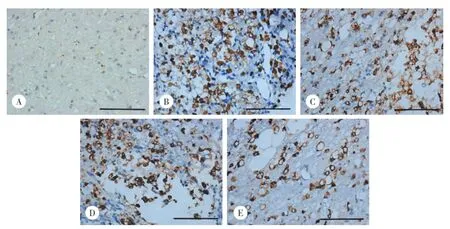
图1 各组损伤区域ED⁃1免疫组化染色 ×400Fig.1 Immunohistochemical staining of ED⁃1 around damage area in all groups×400
免疫组化染色后(图1)显微镜下可见,假手术组只有极少量ED⁃1阳性细胞,零散分布,而4个模型组中ED⁃1表达明显增多,在损伤脊髓空洞周围呈局域性散在分布,细胞体积较假手术组增大。假手术组、对照组、超短波组、BMSCs组、超短波+BMSCs组IOD值分别为19 110±9 104、120 203±9 471、88 354±10 003、99 064±11 934、67 926±8 384。可见各组ED⁃1表达均较假手术组升高,但超短波组、BMSCs组、超短波+BMSCs组ED⁃1表达水平明显低于对照组,有统计学差异(均P<0.05)。其中超短波+BMSCs组ED⁃1下降尤为显著,与超短波组及BMSCs组相比均有统计学差异(均P<0.05)。
SCI后4周,镜下观察GFAP阳性细胞形态(图2),假手术组GFAP阳性细胞在脊髓各处均有表达,细胞排列较整齐,胞体较小,其突起较为纤细、伸向四周;而4个模型组中GFAP阳性细胞的数量明显增多,以空洞周围尤为显著,细胞体积明显增生、肥大,突起数目及细胞间的连接增多,其中超短波+ BMSCs组GFAP阳性细胞形态逐渐接近假手术组。假手术组、对照组、超短波组、BMSCs组、超短波+ BMSCs组IOD值分别为30 520±7 412、287 125± 20 772、270 329±37 617、261 855±17 524、241 009± 10 505。可见假手术组的GFAP阳性表达较少,SCI后表达明显增多;SCI后4周,超短波组、BMSCs组、超短波+BMSCs组GFAP阳性细胞表达均低于对照组,但只有超短波+BMSCs组与对照组比较差异有统计学意义(P<0.05)。
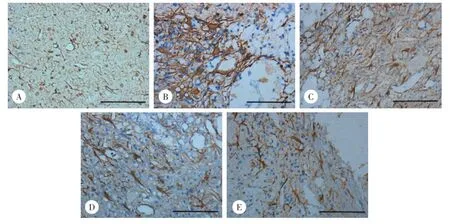
图2 SCI术后4周各组损伤区域GFAP免疫组化染色 ×400Fig.2 Immunohistochemical staining of GFAP around damage area in all groups×400
3 讨论
BMSCs可以分化为外胚层来源的神经组织细胞[5],具有来源广泛、取材方便、分离纯化容易、具有多向分化潜能、排斥反应小、不存在伦理学争议等优点,因而成为干细胞移植治疗的最适细胞种子[6]。超短波作为高频电的一种,广泛应用于临床,主要用于改善血液循环、减轻炎症及水肿。其作用机制分为热效应及非热效应,小剂量超短波发挥作用的机制以非热效应为主,即治疗时无明显的温热感,但可引起生理功能或病理过程的变化[7]。其机制为高频电磁场的方向不断发生变化,电场两端电位差电压也不断变化,从而产生超高频的电振荡波,处于高频电场中的生物体会在电振荡波的作用下发生细胞内物质共振和液体表面张力的改变,场强变大,细胞伸展,场强变小,细胞恢复原状。小剂量超短波的治疗频率所产生的低场强电场(40 mW/cm2)可使细胞充分伸缩,对细胞和组织产生特殊刺激,从而引起特殊生物学作用。研究已经证实,超短波单独治疗周围神经损伤能够促进神经营养因子分泌及神经再生[8],SCI后7周BMSCs与超短波联合治疗,能促进SCI大鼠后肢功能的恢复并减轻炎症[2]。
SCI后导致功能障碍的主要病理机制为SCI后的继发性损伤,即原发的机械性损伤后发生的中性粒细胞、单核细胞等炎性细胞浸润、自由基等有毒物质释放、血管壁通透性增加致局部组织出血水肿等,导致损伤部位的微环境发生变化,使脊髓的功能进一步恶化[9⁃10]。而小胶质细胞和脊髓中的巨噬细胞是促炎性因子和氧化应激的重要来源。正常情况下,小胶质细胞处于静息状态,负责清除中枢神经系统中的斑块、感染性物质和损坏的神经。SCI后原本静息的小胶质细胞被迅速激活[11],而过多激活或失控的小胶质细胞会通过分泌炎性细胞因子、神经毒素等引起神经毒性,导致神经元死亡[12]。ED⁃l是小胶质细胞/巨噬细胞的特异性标记物,小胶质细胞的活化及巨噬细胞聚集后ED⁃1的表达增加[13]。
星形胶质细胞是中枢神经系统的主要胶质细胞,对神经元起支持、保护、营养和参与代谢的作用[14]。SCI后,星形胶质细胞的功能活跃及胶质化,形成瘢痕组织。活化的星形胶质细胞形成的胶质瘢痕具有两方面的作用:一方面可分泌大量的神经营养因子改善局部微环境,并使损伤组织重新获得形态上的稳定性;另一方面,胶质瘢痕形成了一个新的屏障,阻断了断端间的神经联系和新生神经的延伸[15],同时会产生大量轴突生长抑制因子[16],阻碍轴突再生,从而影响功能恢复。因此,明确有益的治疗时机,控制并减少瘢痕的形成,对SCI后神经功能的恢复尤为重要。
本研究在大鼠SCI后4周内予以超短波和BMSCs移植联合治疗,并进行BBB行为学评分。结果显示,SCI术后1~4周随时间的延长,各组的运动功能均呈不同程度恢复。术后2~4周,超短波组及超短波+BMSCs组BBB评分恢复明显,与对照组比较均有统计学差异(P<0.001),但超短波组及超短波+BMSCs组比较无统计学差异。同时,BMSCs组与对照组比较,BBB评分虽有增高趋势,但无统计学差异(P>0.05)。说明SCI后4周内,在改善大鼠行为学功能上,以超短波的作用为主。这与前期研究中大鼠SCI后7周内行为学改善的变化趋势一致,但与已有的一些研究结论不符,其机制可能因为超短波具有改善血液循环、增强组织营养、减轻炎症水肿的作用,超短波组及时且持续的治疗使受损脊髓组织的炎性反应得到控制,从而减轻了SCI后的继发性损伤,同时还能挽救损伤部位周围水肿带的组织细胞,避免其缺血缺氧坏死,从而减轻了损伤程度;而BMSCs组行为学评分无明显改善可能与术后1周行BMSCs移植时造成脊髓组织的二次损伤有关;超短波+BMSCs组因为持续的超短波治疗,及时减轻了二次损伤导致的炎症水肿等不利因素影响,前期研究提示超短波还能促进BMSCs存活[2],而存活的BMSCs具有分泌神经营养因子、改善微环境等作用,故联合治疗效果尤为明显。
在炎症的控制方面,SCI后4周超短波组、BMSCs组、超短波+BMSCs组ED⁃1表达水平明显低于对照组,差异均有统计学意义(均P<0.05)。其中超短波+BMSCs组ED⁃1下降最为显著,与超短波组及BMSCs组比较差异均有统计学意义(均P<0.05)。上述结果提示,超短波治疗和BMSCs移植均可减少小胶质细胞、巨噬细胞的活化,减轻炎性反应,改善损伤组织局部微环境,而且二者综合作用效果更强。这与既往研究报道相符,BMSCs移植后可以促进小胶质细胞向有利于SCI修复的方向发展[17],表现出免疫调节、组织修复和功能重塑的作用[18]。而小剂量超短波治疗可以增强免疫功能,使吞噬细胞吞噬能力增强,同时血液循环改善、组织营养增强,促使炎症产物排出,有利于炎症控制、消散[7]。而与前期研究[2]结果比较,大鼠SCI后7周,各干预组ED⁃1表达水平的下降与对照组比较差异有统计学意义(P<0.01),结果与本研究相同,但其结果中BMSCs组ED⁃1的减少趋势要优于超短波组,而本研究中则是超短波组ED⁃1的下降趋势优于BMSCs组,提示在控制并减轻炎症方面,SCI后早期超短波的效果较好,而SCI晚期BMSCs的疗效要优于超短波。这可能也是本研究中超短波组和超短波+BMSCs组运动功能恢复更好的原因之一。
GFAP是星形胶质细胞主要的骨架蛋白,其表达的活性高低可反映细胞的激活和胶质化程度。研究结果显示,SCI后4周超短波组、BMSCs组及超短波+BMSCs组GFAP阳性细胞的表达较对照组均有下降趋势,超短波+BMSCs组与对照组比较有统计学差异(P<0.05),提示超短波和BMSCs联合治疗有协同作用,可减少瘢痕的形成。其机制可能为BMSCs具有多分化潜能,植入的BMSCs可分化为星形胶质样细胞[2],在其转化为增殖状态前可改善局部微环境及分泌神经营养因子,故移植BMSCs后瘢痕组织有所减轻。而超短波+BMSCs组效果显著,提示超短波亦可改善损伤组织局部微环境。前期研究结果中[2],大鼠SCI后7周,超短波+BMSCs组GFAPmRNA表达虽较其他组减少,但各组比较差异均无统计学意义,提示超短波与BMSCs联合治疗在控制瘢痕形成上早期的疗效要优于晚期。这可能因为早期BMSCs分化的星形胶质样细胞尚未转化为增殖状态,可分泌较多的神经营养因子、改善微环境的作用较强,而晚期BMSCs分化的星形胶质样细胞转化为增殖状态,形成胶质瘢痕,作用以填充损伤部位、重获组织的稳定性为主。后续研究中,我们将深入探讨其原理。
综上所述,BMSCs移植和小剂量超短波对SCI后的治疗均有一定效果,二者联合治疗具有协同作用,可通过减少瘢痕形成、抑制炎性细胞因子、减轻炎症来促进功能的恢复,这对SCI的临床治疗具有指导意义。同时,二者在不同时间点的作用优势也不同,未来我们还将继续进行超早期的研究,探讨上述因子在SCI后各时期的变化趋势及超短波和BMSCs发挥作用的确切机制。
[1]GARBOSSA D,FONTANELLA M,FRONDA C,et al.New strate⁃gies for repairing the injured spinal cord:the role of stem cells[J]. Neurol Res,2006,28(5):500-504.DOI:10.1179/016164106X11 5152.
[2]YIN YM,LU Y,ZHANG LX,et al.Bone marrow stromal cells trans⁃plantation combined with ultrashortwave therapy promotes function⁃al recovery on spinal cord injury in rats[J].Synapse,2015,69(3):139-147.DOI:10.1002/syn.21802.
[3]ALLEN AR.Surgery of experimental lesion of spinal cord equiva⁃lent to crush injury of fracture dislocation of spinal column:a pre⁃liminary report[J].JAMA,1911,57(11):878-880.DOI:10.1001/ jama.1911.04260090100008.
[4]BASSO DM,BEATTIE MS,BRESNAHAN JC.A sensitive and reli⁃able locomotor rating scale for open field testing in rats[J].J Neu⁃rotrauma,1995,12(1):1-21.DOI:10.1089/neu.1995.12.1.
[5]PHINNEY DG,ISAKOVA I.Plasticity and therapeutic potential of mesenchymal stem cells in the nervous system[J].Curr Pharm Des,2005,11(10):1255-1265.DOI:10.2174/1381612053507495.
[6]PARR AM,TATOR CH,KEATING A.Bone marrow⁃derived mesen⁃chymal stromal cells for the repair of central nervous system injury [J].Bone Marrow Transplant,2007,40(7):609-619.DOI:10.1038/sj.bmt.1705757.
[7]梁维娣,张志强.超短波和旋磁对局灶性脑缺血再灌注损伤的影响[J].中华物理医学与康复杂志,2006,28(4):225-228.
[8]ZHANG LX,TONG XJ,SUN XH,et al.Experimental study of low dose ultrashortwave promoting nerve regeneration after acellular nerve allografts repairing the sciatic nerve gap of rats[J].Cell Mol Neurobiol,2008,28(4):501-509.DOI:10.1007/s10571⁃007⁃9226⁃ 1.
[9]EL MASRI WS,KUMAR N.Traumatic spinal⁃cord injury[J].Lan⁃cet,2011,377(9770):972-974.DOI:10.1016/S0140⁃6736(11)60248⁃1.
[10]DAVID S,BOUCHARD C,TSATAS O,et al.Macrophages can modify the nonpermissive nature of the adult mammalian central nervous system[J].Neuron,1990,5(4):463-469.DOI:10.1016/ 0896⁃6273(90)90085⁃T.
[11]SCHWARTZ M,YOLES E.Immune⁃based therapy for spinal cord repair:autologous macrophages and beyond[J].J Neurotrauma,2006,23(3/4):360-370.DOI:10.1089/neu.2006.23.360.
[12]POPOVICH PG,GUAN Z,MCGAUGHY V.The neuropathological and behavioral consequences of intraspinal microglial/macrophage activation[J].J Neuropathol Exp Neurol,2002,61(7):623-633. DOI:10.1093/jnen/61.7.623.
[13]YU Q,LIU L,DUAN Y,et al.Wnt/β⁃catenin signaling regulates neuronal differentiation of mesenchymal stem cells[J].Biochem Biophys Res Commun,2013,439(2):297-302.DOI:10.1016/j. bbrc.
[14]BIGINI P,BASTONE A,MENNINI T.Glutamate transporters in the spinal cord of the wobbler mouse[J].Neuorreport,2001,12 (9):1815-1820.DOI:10.1097/00001756⁃200107030⁃00011.
[15]SHEARER MC,FAWCETT JW.The astrocyte/meningeal cell in⁃terface⁃a barrier to successful nerve regeneration?[J].Cell Tissue Res,2001,305(2):267-273.DOI:10.1007/s004410100384.
[16]MCKEON RJ,HÖKE A,SILVER J.Injury⁃induced proteoglycans inhibit the potential for laminin⁃mediated axon growth on astrocyt⁃ic scars[J].Exp Neurol,1995,136(1):32-43.DOI:10.1006/ exnr.1995.1081.
[17]ABRAMS MB,DOMINGUEZ C,PERNOLD K.Multipotent mesen⁃chymal stromal cells attenuate chronic inflammation and injury⁃induced sensitivity to mechanical stimuli in experimental spinal cord injury[J].Restor Neurol Neurosci,2009,27(4):307-321. DOI:10.3233/RNN⁃2009⁃0480.
[18]MARTINEZ FO,HELMING L,GORDON S.Alternative activation of macrophages:an immunologic functional perspective[J].Annu Rev Immunol,2009,27:451-483.DOI:10.1146/annurev.immu⁃nol.021908.132532.
(编辑陈姜)
Effects of Bone Marrow Stromal Cells Transplantation Combined with Ultrashort Wave Therapy on the Expression of GFAP and ED⁃1 after Spinal Cord Injury in Rats
SUN Shi,WAN Yucen,ZHAO Lina,YIN Yanmei,LU Yu,FENG Zhiping,ZHOU Yuxin,ZHANG Zhiqiang,ZHANG Lixin
(Department of Rehabilitation,Shengjing Hospital,China Medical University,Shenyang 110022,China)
ObjectiveTo investigate the effects of bone marrow stromal cells(BMSCs)transplantation combined with low dose ultrashort wave (USW)radiation on functional recovery and the expression of glial fibrillary acidic protein(GFAP)and ED⁃1 after spinal cord injury(SCI)in rats,and further discuss its action mechanism.MethodsFemale Sprague⁃Dawley rats(n=30)were randomly divided into 5 groups:sham⁃oper⁃ated,as well as control,USW,BMSCs,and USW+BMSCs that were subjected to spinal cord injury(SCI).Basso⁃Beattie⁃Bresnahan(BBB)tests were carried out before the operation and at 1 d,1 week,2 weeks,3 weeks,4 weeks after SCI.4 weeks later,animals were sacrificed and tissues were collected to make paraffin section.Immunohistochemical staining was performed to observe the expression of GFAP and ED⁃1.Results4 weeks after SCI,BBB scores were significantly higher in the USW and USW+BMSCs groups than in the control group(bothP<0.001).No signifi⁃cant difference was observed between the BMSCs group and control group.On the expression of GFAP,only USW+BMSCs group showed signifi⁃cantly decreased compared with the control group(P<0.05).All treatment groups exhibited lower ED⁃1 expression than the control group(all P<0.05).ConclusionOur results indicate that USW radiation alone can obviously improve neural functional recovery after SCI.The USW radi⁃ation and BMSCs transplantation treatment can reduce inflammation,and USW radiation is more effective.The combination therapy did not show a synergistic action on promoting functional recovery,but do have an effect on reducing the inflammatory response and glial scar formation.
spinal cord injury;bone marrow stromal cells;ultrashort;glial fibrillary acidic protein;ED⁃1
R651.2
A
0258-4646(2016)08-0678-06
10.12007/j.issn.0258⁃4646.2016.08.002
国家自然科学基金青年科学基金(81101462)
孙师(1986-),女,医师,本科.
张立新,E-mail:zhanglx@sj⁃hospital.org
2015-12-21
网络出版时间:
