TBX1基因在透明细胞型肾细胞癌组织中的表达及意义
2016-08-05姜红堃田红宇郭燕平王妍张宇曦姜红
姜红堃,田红宇,郭燕平,王妍,张宇曦,姜红
(中国医科大学附属第一医院1.儿科;2.病理科;3.泌尿外科,沈阳 110001)
TBX1基因在透明细胞型肾细胞癌组织中的表达及意义
姜红堃1,田红宇1,郭燕平1,王妍2,张宇曦3,姜红1
(中国医科大学附属第一医院1.儿科;2.病理科;3.泌尿外科,沈阳 110001)
目的通过检测TBX1基因在透明细胞型肾细胞癌(ccRCC)癌组织中的表达,探讨该基因在ccRCC发病中的分子遗传学机制。方法应用实时定量聚合酶链反应(qRT⁃PCR)法检测12例ccRCC癌组织及对应的癌旁正常肾组织中TBX1mRNA表达;Western blot法检测肾组织TBX1蛋白表达。结果与癌旁正常肾组织比较,TBX1mRNA及蛋白表达水平在ccRCC癌组织中均明显增强(均P<0.05)。结论TBX1基因过度表达可能为ccRCC发生的一种潜在致病机制。
TBX1基因;透明细胞型肾细胞癌;实时定量聚合酶链反应;Western blot
网络出版地址
KeywordsTBX1;clear cell renal cell carcinoma;RT⁃PCR;Western blot
肾细胞癌(renal cell carcinoma,RCC)起源于肾小管上皮细胞[1⁃2],是肾脏最常见的实体瘤,约占全部肾脏恶性肿瘤的90%。很多RCC直至疾病晚期才出现症状,而放疗、化疗及生物学治疗效果均不理想,统计数据[3]显示RCC术后的复发和转移率高达40%。因此早期诊断和治疗对于改善患者的预后非常重要。RCC包括几种不同的具有特定组织病理学和基因特征的亚型,透明细胞型肾细胞癌(clear cell renal cell carcinoma,ccRCC)为RCC最常见的病理类型,占75%~85%[3]。其具体病因尚不明确,有研究[4]证实遗传因素为高危因素之一。人类TBX1基因定位于22q 11.21,是染色体22q11.2微缺失综合征(主要为DiGeorge综合征及腭心面综合征)中的重要基因[5]。研究[6]表明TBX1基因在小鼠胚胎肾脏发育过程中的表达水平呈波动趋势,在肾脏发育成熟后仅微量表达,该基因可能通过Smad通路参与肾脏发育。本研究利用实时定量聚合酶链反应(real⁃time quantitative polymerase chain reac⁃tion,qRT⁃PCR)法、Western blot法检测ccRCC癌组织和对应的癌旁正常肾组织中TBX1基因的表达,以明确该基因在ccRCC发生、发展中的分子遗传学机制,为ccRCC的早期诊断提供理论依据。
1 材料与方法
1.1临床资料及标本留取
本研究的标本来源及使用受试对象均知情并签字同意,并经由学院学术伦理委员会讨论批准。本实验所留取的12例ccRCC肿瘤组织及癌旁正常肾组织(距肿瘤边缘≥3 cm)标本来源于本院及中国医科大学附属盛京医院泌尿外科2011年10月至2012年9月期间行根治性肾癌切除术的患者,男8例,女4例,年龄23~78岁,平均(53.1±15.2)岁。按所留取标本经病理诊断确定肿瘤病理类型为ccRCC。按照Fuhrman核分级系统分级[7],高分化7例,中分化2例,低分化3例。依据2010年AJCC肾癌的TNM分期标准,Ⅰ期2例,Ⅱ期5例,Ⅲ期3例,Ⅳ期2例。将切除的新鲜组织置于经焦炭酸二乙醋(pyro carbonic acid diethyl ester,DEPC)处理过的EP管中后,迅速转移至-80℃冰箱保存待检。
1.2qRT⁃PCR检测TBX1mRNA表达
1.2.1引物设计与合成:使用Primer5.0软件设计TBX1基因及β⁃actin基因序列特异性引物由上海生工生物工程公司合成。TBX1引物,上游5′TAGC GAGAAATATGCCGAGGA 3′,下游5′CGTGATCC GATGGTTCTGGT 3′,产物长度94 bp。β⁃actin引物,上游5′CTCCATCCTGGCCTCGCTGT3′,下游5′GCTG TC ACCTTCACCGTTCC 3′,产物长度268 bp。
1.2.2提取总RNA及反转录反应:按照Trizol RNA抽提试剂盒(美国Invitrogen公司)使用说明书提取总RNA。检测260 nm和280 nm波长的光密度,紫外分光光度仪扫描后,根据A260/280比值检测RNA浓度。立即将提取的RNA进行反转录或转移至-80℃冰箱保存备用。参照TaKaRa反转录试剂盒(大连宝生物有限责任公司)使用说明将总RNA反转录为cDNA,反应条件:42℃60 min,99℃5 min,4℃5 min,总体积为20 μL。所得cDNA于-20℃冰箱冻存备用。
1.2.3PCR:依据SYBR Green PCR Master mix染料法说明书(美国Applied Biosystems公司),以反转录所得cDNA为模板,进行PCR扩增。反应体系为,2× SYBR Green PCR Master mix 12.5 μL;cDNA 0.5 μL;引物各1.0 μL;ddH2O 11.0 μL。置于荧光定量实时PCR仪(美国Applied Biosystems公司,7900型)进行扩增,扩增条件,60°C 2 min→93°C 10 min→90° C 15 s→53°C 1 min,循环40次。PCR扩增产物结果显示,标准曲线具良好的线性关系,熔解曲线均具单一特异峰,表明扩增产物具特异性。以β⁃actin为内参,校正所得扩增样本Ct值。将肾细胞癌组织基因值与癌旁正常肾组织基因值进行比值计算。
1.3Western blot检测
1.3.1肿瘤组织及癌旁组织总蛋白的提取:切取约100 mg肿瘤组织和癌旁组织,研磨至粉末状,加入蛋白裂解液1 mL,将组织置于干冰上,在超声波粉碎机下粉碎,电动匀浆,于4°C下12 000g离心15 min,吸取上清液为样品;蛋白抽提试剂盒购自美国Active Motif公司。利用考马斯亮蓝法测定蛋白质含量。
1.3.2电泳、转膜:制备出十二烷基硫酸钠⁃聚丙烯酰胺(SDS⁃PAGE)电泳凝胶,并将其加样于40 μg抽提的蛋白溶解物中电泳4 h,然后转至硝酸纤维素膜(美国Amersham公司)。
1.3.3杂交及显色:取下硝酸纤维素膜,TBS浸泡10 min,50 g/L脱脂奶封闭1 h,TBS洗2次,5 min/次,加入一抗(山羊源性TBX1或β⁃actin抗体,稀释度为1∶300,美国Abcam公司),室温孵育2 h。TBST洗涤2次,5 min/次,加入二抗(兔抗羊IgG抗体,稀释度为1∶2 000,美国Abcam公司),室温孵育1 h。TBST洗涤2次,每次5 min。利用ECL显色试剂(美国Amersham公司)显影曝光,凝胶图像扫描仪(美国Gene公司)定量分析。
1.4统计学分析
采用SPSS 17.0统计软件进行数据分析。所得数据均以±s表示。采用t检验进行组间比较,P<0.05表示差异有统计学意义。
2 结果
2.1qRT⁃PCR实验结果
与癌旁正常肾组织(1.00±0.01)比较,ccRCC癌组织(1.825±0.216)TBX1mRNA表达水平明显增强,差异有统计学意义(P<0.05)。
2.2Western blot检测结果
各条带灰度值分析结果表明,ccRCC癌组织(2.27±0.26)TBX1蛋白表达较癌旁正常肾组织(1.00±0.27)增强,差异有统计学意义(P<0.05),见图1。

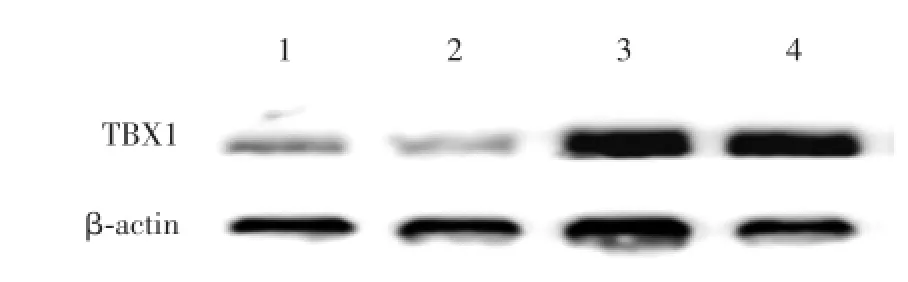
图1 Western blot法检测ccRCC癌组织及癌旁正常肾组织TBX1蛋白的表达Fig.1 Detection of TBXl protein expression in renal cell carcino⁃ma tissues and normal kidney tissues adjacent to carci⁃noma by Western blot
3 讨论
T⁃box家族各成员共享一个独特的DNA结构域,该家族基因编码的转录因子为胚胎发育所必需,参与调控胚胎发育多种进程[8]。作为T⁃box家族成员,该基因主要调控第二心区细胞的增殖及分化,是导致心脏流出道异常的先天性心脏病的主要基因。此外该基因参与牙齿、耳、甲状旁腺及胸腺等多种组织和器官的发育,在精神疾病的发病中亦扮演一定角色[9⁃15]。目前关于TBX1基因的研究多围绕该基因与胚胎期心脏发育及先天性心脏发育异常进行,而关于此基因与胚胎期肾脏发育及肾脏相关疾病的研究较少。FU等[6]研究表明,TBX1基因在胚鼠肾脏发育过程中表达水平呈波动趋势,作为转录因子TBX1可与HOXD10相互作用,通过激活Smad通路参与肾脏发育过程;TBX1基因在肾脏发育成熟后仅微量表达。本课题组前期研究[16]发现,在庆大霉素诱导的急性肾小管损伤模型鼠中TBX1基因被再激活,并通过TGF⁃β⁃Smad2/3途径参与肾小管的损伤修复过程。
肾细胞癌具有遗传性和散发性两种发病形式,研究表明3号染色体短臂缺失为透明细胞肾细胞癌中最常见的染色体畸变;BHD基因是肾细胞癌的易感基因,为抑癌基因,其编码的蛋白产物为follicu⁃lin,该蛋白在正常肾组织中表达,其功能丧失可能为多种病理类型肾细胞癌发病的共同基础;此外研究证实MET基因、FH基因及XP11.2易位/TFE3融合基因等均可能参与肾细胞癌的发生发展。IGA⁃RASHI[17]在对肾细胞癌及多种肿瘤细胞系的研究表明,PAX2基因在肾细胞癌中呈特异性表达且有增高趋势,为原发及转移的RCC的特异性标志物。该基因在肾脏发育过程中参与前、中、后肾的发育,其表达失衡可导致多囊肾、先天性肾病综合征等先天性肾发育异常[18]。该基因亦为肾脏间质-上皮转化的关键因子,其高表达可促进细胞增殖,从而导致肾脏肿瘤的发生。研究证实PAX2基因表达异常与泌尿生殖系统恶性肿瘤的发生密切相关[19]。课题组前期研究发现,PAX2作为转录因子可直接与TBX1基因上游的转录调控区结合,正向调节TBX1基因的表达,可能在肾脏发育及肾脏疾病发生过程中扮演重要角色[20]。本研究采用qRT⁃PCR法及Western blot法检测ccRCC肿瘤组织TBX1mRNA及蛋白表达,结果显示与癌旁正常肾组织比较,ccRCC癌组织TBX1mRNA及蛋白表达均显著增强(P< 0.05)。由此推测,在ccRCC的发生过程中,PAX2基因过度表达,导致其下游TBX1基因表达增强,激活某一通路,促使肾小管上皮细胞增殖,从而导致肿瘤的发生。然而关于TBX1基因究竟通过何种途径参与ccRCC的发生发展尚待深入探讨。
[1]RIEGEL W,KRUGER B.Dialysis and renal transplantation:update 2014[J].Dtsch Med Wochenschr,2014,139(23):1228-1230. DOI:10.1055/s⁃0034⁃1370087.
[2]JONASCH E,FUTREAL PA,DAVIS IJ,et al.State of the science:an update on renal cell carcinoma[J].Mol Cancer Res,2012,10 (7):859-880.DOI:10.1158/1541⁃7786.MCR⁃12⁃0117.
[3]PARK JH,LEE C,SUH JH,et al.Decreased ARID1A expression correlates with poor prognosis of clear cell renal cell carcinoma[J]. Hum Pathol,2015,46(3):454-460.DOI:10.1016/j.humpath.2014. 12.002.
[4]MELKONIAN SC,WANG X,GU J,et al.Mitochondrial DNA copy number in peripheral blood leukocytes and the risk of clear cell re⁃nal cell carcinoma[J].Carcinogenesis,2015,36(2):249-255. DOI:10.1093/carcin/bgu248.
[5]GAO S,LI X,AMENDT BA.Understanding the role of Tbx1 as a candidate gene for 22q11.2 deletion syndrome[J].Curr Allergy Asthma Rep,2013,13(6):613-621.DOI:10.1007/s11882⁃013⁃0384⁃6.
[6]FU Y,LI F,ZHAO DY,et al.Interaction between Tbx1 and Hoxd10 and connection with TGFβ⁃BMP signal pathway during kidney de⁃velopment[J].Gene,2014,536(1):197-202.DOI:10.1016/j. gene.2012.06.069.
[7]ERDO AN F,DEMIREL A,POLAT O.Prognostic significance of morphologic parameters in renal cell carcinoma[J].Int J Clin Pract,2004,58(4):333-336.DOI:10.1111/j.1368⁃5031.2004.00008.x.
[8]CAI CL,ZHOU W,YANG L,et al.T⁃box genes coordinate regional rates of proliferation and regional specification during cardiogenesis [J].Development,2005,132(10):2475-2487.DOI:10.1242/ dev.01832.
[9]CHEN M,YANG YS,SHIH JC,et al.Microdeletions/duplications involving TBX1 gene in fetuses with conotruncal heart defects which are negative for 22q11.2 deletion on fluorescence in⁃situ hy⁃bridization[J].Ultrasound Obstet Gynecol,2014,43(4):396-403. DOI:10.1002/uog.12550.
[10]FAGMAN H,NILSSON M.Morphogenetics of early thyroid devel⁃opment[J].J Mol Endocrinol,2011,46(1):R33-R42.
[11]RADOSEVIC M,ROBERT⁃MORENO A,COOLEN M,et al.Her9 represses neurogenic fate downstream of Tbx1 and retinoic acid signaling in the inner ear[J].Development,2011,138(3):397-408.DOI:10.1242/dev.056093.
[12]CAO H,FLOREZ S,AMEN M,et al.Tbx1 regulates progenitor cell proliferation in the dental epithelium by modulating Pitx2 acti⁃vation of p21[J].Dev Biol,2010,347(2):289-300.DOI:10.1016/j.ydbio.2010.08.031.
[13]WANG H,CHEN D,MA L,et al.Genetic analysis of the TBX1 gene promoter in ventricular septal defects[J].Mol Cell Biochem,2012,370(1⁃2):53-58.DOI:10.1007/s11010⁃012⁃1397⁃5.
[14]GUO T,MCDONALD⁃MCGINN D,BLONSKA A,et al.Genotype and cardiovascular phenotype correlations with TBX1 in 1,022 ve⁃lo⁃cardio⁃facial/DiGeorge/22q11.2 deletion syndrome patients[J]. Hum Mutat,2011,32(11):1278-1289.DOI:10.1002/hu⁃mu.21568.
[15]HIRAMOTO T,KANG G,SUZUKI G,et al.Tbx1:identification of a 22q11.2 gene as a risk factor for autism spectrum disorder in a mouse model[J].Hum Mol Genet,2011,20(24):4775-4785. DOI:10.1093/hmg/ddr404.
[16]JIANG HK,LI L,LI⁃LING J,et al.Increased Tbx1 expression may play a role via TGFβ⁃Smad2/3 signaling pathway in acute kidney injury induced by gentamicin[J].Int J Clin Exp Pathol,2014,7(4):1595-1605.
[17]IGARASHI T,UEDA T,SUZUKI H,et al.Aberrant expression of Pax⁃2 mRNA in renal cell carcinoma tissue and parenchyma of the affected kidney[J].Int J Urol,2001,8(2):60-64.DOI:10.1046/ j.1442⁃2042.2001.00244.x.
[18]STAYNER C,IGLESIAS DM,GOODYER PR,et al.Pax2 gene dosage influences cystogenesis in autosomal dominant polycystic kidney disease[J].Hum Mol Genet,2006,15(24):3520-3528. DOI:10.1093/hmg/ddl428.
[19]SHARMA R,SANCHEZ⁃FERRAS O,BOUCHARD M.Pax genes in renal development,disease and regeneration[J].Semin Cell Dev Biol,2015,44(8):97-106.DOI:10.1016/j.semcdb.2015.09. 016.
[20]JIANG HK,LI L,YANG HL,et al.Pax2 may play a role in kidney development by regulating the expression of TBX1[J].Mol Biol Rep,2014,41(11):7491-7498.DOI:10.1007/s11033⁃014⁃3639⁃y.
(编辑武玉欣)
Expression of TBX1 Gene in Kidney Tissues in Patients with Clear Cell Renal Cell Carcinoma and Its Clinical Significance
JIANG Hongkun1,TIAN Hongyu1,GUO Yanping1,WANG Yan2,ZHANG Yuxi3,JIANG Hong1
(1.Department of Pediatrics,The First Hospital,China Medical University,Shenyang 110001,China;2.Department of Pathology,The First Hospital,China Medical University,Shenyang 110001,China;3.Department of Urological Surgery,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo analyze the expression ofTBX1gene in kidney tissues in patients with clear cell renal cell carcinoma(ccRCC)and in⁃vestigate its molecular genetics mechanism during the tumor development.MethodsReal⁃time quantitative polymerase chain reaction(qRT⁃PCR)was used to detect the expression ofTBX1mRNA in 12 cases of clear cell renal cell carcinoma tissues and the corresponding normal kidney tissues adjacent to carcinoma.The protein expression of TBX1 was assayed by Western blot in both groups.ResultsBothTBX1mRNA level and the protein level were significantly up⁃regulated in ccRCC tissues compare to those in normal kidney tissues adjacent to carcinoma(allP<0.05).ConclusionOver⁃expression ofTBX1gene might be a potentially pathogenic mechanism of ccRCC.
R737.11
A
0258-4646(2016)08-0692-03
10.12007/j.issn.0258⁃4646.2016.08.005
国家自然科学基金(81300130);教育部高校博士点专项基金(20122104110001);辽宁省省直医院改革重点临床科室诊疗能力建设项目(LNCCC⁃D06⁃2015)
姜红堃(1974-),女,副教授,博士. E-mail:jianghongkun007@163.com
2015-11-29
网络出版时间:
