HPLC法测定万通炎康片中苦玄参苷ⅠA的含量
2016-08-03翟金燕广西万通制药有限公司广西南宁530003
翟金燕(广西万通制药有限公司,广西 南宁 530003)
HPLC法测定万通炎康片中苦玄参苷ⅠA的含量
翟金燕
(广西万通制药有限公司,广西 南宁530003)
[目的]建立万通炎康片中苦玄参苷ⅠA的含量测定方法。[方法]采用HPLC法,色谱柱为Wondasil GL Sciences C18柱(5.0μm,250 mm×4.6 mm);流动相为乙腈-0.3%磷酸(35∶65);流速为1.0 m l/min,检测波长为264 nm;进样量为10μl;柱温为30℃。[结果]苦玄参苷ⅠA在0.2338~1.4028μg间与峰面积呈良好的线性关系(r=0.9992),加样回收率为98.27%,RSD= 1.52%(n=6)。[结论]本法操作简便,精密度好,可作为万通炎康片的质量控制方法之一。
万通炎康片;苦玄参苷ⅠA;HPLC
万通炎康片由苦玄参、肿节风组成,具有疏风清热、解毒消肿功效,用于外感风热所致的咽部红肿、牙龈红肿、疮疖肿痛[1]。苦玄参苷ⅠA是苦玄参的有效成分[2],本实验采用HPLC测定万通炎康片中苦玄参苷ⅠA的含量,为控制该品的质量提供依据。现报道如下。
1 仪器与试药
1.1仪器LC-10ATVP高效液相色谱仪(日本岛津公司);SPD-10AVP紫外检测器;SB3200超声震荡器(上海必能信公司);BS210S电子天平(德国赛多利斯公司)。
1.2试药苦玄参苷ⅠA对照品(供含量测定用,批号:11745-200501);万通炎康片为广西万通制药有限公司产品(批号:130618);乙腈、甲醇为色谱纯试剂(美国Fisher公司);水为二次重蒸蒸馏水;其余试剂为分析纯。
2 方法与结果
2.1色谱条件色谱柱:WondasilGLSciencesC18柱(5.0μm,250 mm×4.6 mm);流动相:乙腈-0.3%磷酸(35∶65);检测波长:264 nm;柱温:30℃;流速:1.0ml/min;进样量:10μl;理论塔板数按苦玄参苷ⅠA峰计算应不低于3 500。
2.2对照品溶液的制备精密称取苦玄参苷ⅠA对照品适量,加甲醇制成每1m l含90μg的溶液,即得。
2.3供试品溶液的制备取本品20片,除去包衣,精密称定,研细,精密称取0.5 g,置具塞锥形瓶中,精密加入甲醇20ml,超声处理1 h,放冷,滤过,滤液置25m l量瓶中,加甲醇稀释至刻度,滤过,取续滤液,即得。
2.4阴性溶液的制备按处方比例制备缺苦玄参药材的阴性对照样品,研细,取约0.5 g,精密称定,按2.3项供试品溶液的制备方法进行提取,制成阴性溶液。
2.5系统适应性试验精密吸取对照品溶液、供试品溶液和阴性溶液各10μl,按2.1项色谱条件分析,色谱图见图1。由图1可见,供试品中苦玄参苷ⅠA与其它杂质峰达到基线分离,分离度大于1.5,按苦玄参苷ⅠA计算理论塔板数不低于3 500。在与苦玄参苷ⅠA相应位置上,阴性样品无干扰。
2.6线性关系考察取苦玄参苷ⅠA对照品,精密称定为29.22 mg,置25ml量瓶中,加甲醇溶解并稀释至刻度,摇匀。精密量取0.5ml、1.0 ml、1.5m l、2.0m l、2.5ml、3.0ml对照品溶液,分别置于25ml量瓶中,用甲醇稀释至刻度,摇匀,分别精密吸取10μl,按上述色谱条件测定峰面积值,以进样量(μg)为横坐标,峰面积积分值为纵坐标,绘制标准曲线,见图2。并求得标准曲线回归方程为:Y=363675X-328.73,r= 0.9992;表明苦玄参苷ⅠA在0.2338~1.4028μg之间呈良好的线性关系。
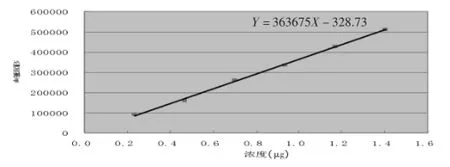
图2 苦玄参苷ⅠA标准曲线
2.7精密度试验取苦玄参苷ⅠA对照品溶液(93.504μg/ml)分别连续进样6次,测得峰面积分别为337 166、331 630、333 327、330 231、321 619、324 701,平均峰面积值为329 779,RSD=1.73%(n=6)。相对偏差<2%,表明仪器精密度良好。
2.8稳定性试验取同一批供试品(批号:130618),按2.3项方法制得供试品溶液,分别于0 h、1 h、2 h、3 h、4 h、5 h、6 h后精密吸取供试品溶液10μl进样,测得峰面积分别为:636 108、612 140、616 686、618 911、612 027、613 247、618 186,平均峰面积值为636 108,RSD=1.49%(n=7),结果表明苦玄参苷ⅠA在6 h内保持稳定。
2.9重复性试验取同一批供试品(批号:130618)适量,研细,分别取6份,每份重约0.5 g,精密称定,按样品测定方法进行提取,测定,计算,结果见表1。

表1 重复性试验结果 (n=6)
2.10加样回收率试验取已知含量的样品(批号:130618;8.3366 mg/g)6份,各0.25 g,精密称定,分别精密加入苦玄参苷ⅠA对照品溶液2ml(浓度为1.0044mg/ml),按供试品制备方法提取,测定,结果见表2。
2.11样品测定取10批不同批号的供试品,按供试品溶液的制备项下方法进行提取,再按2.1项色谱条件测定苦玄参苷ⅠA含量,结果见表3。

序号 取样量(g) 原有量(mg) 对照品加入量(mg) 平均峰面积 测出量(mg) 回收率(%)平均回收率(%)RSD(%)1 0.2501 2.0852 2.0088 2864941 4.0594 98.27 2 0.2504 2.0871 2.0088 2862066 4.0791 99.16 3 0.2501 2.0853 2.0088 2852707 4.0648 98.54 4 0.2502 2.0862 2.0088 2874677 4.0748 98.99 5 0.2506 2.0893 2.0088 2878607 4.0849 99.34 6 0.2505 2.0880 2.0088 2823411 4.0027 95.32 98.27 1.52
表2加样回收试验结果(n=6)
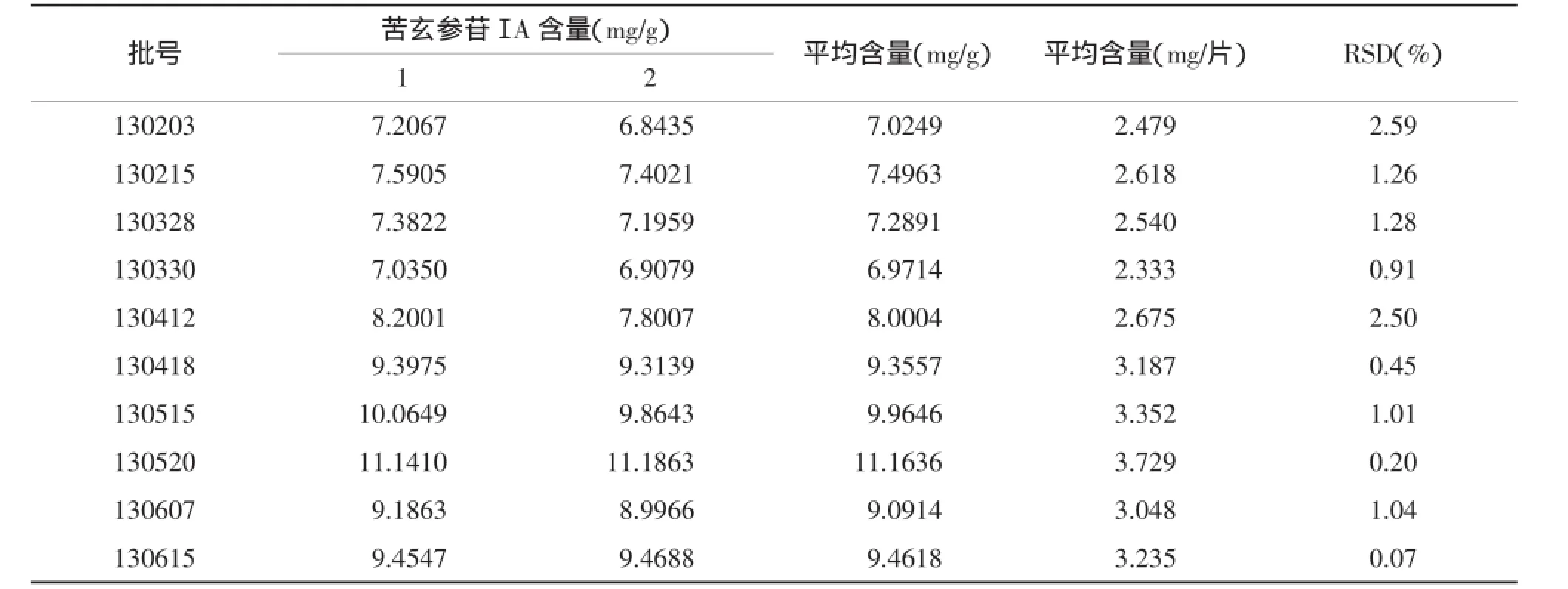
表3 10批样品中苦玄参苷ⅠA含量测定结果 (n=2)
3 结论
3.1提取方法的考察本实验分别采用加热回流1 h和超声处理1 h处理样品,结果显示,提取的有效成分差别不大,所以本研究选取较为便捷的超声处理方式。
3.2色谱柱的选择实验中比较了3根不同色谱柱的分离效果:大连依力特C18柱(5μm,4.6mm×250mm),德国MNC18柱(5μm,4.6mm×250 mm),Wondasil GL Sciences C18柱(5μm,4.6mm×250mm);结果表明,Wondasil GL Sciences C18柱分离效果良好,供试品中苦玄参苷ⅠA与其它杂质峰达到基线分离,分离度大于1.5,按苦玄参苷ⅠA计算理论塔板数不低于3 500。
3.3限度的制定根据10批样品测定结果,样品中苦玄参苷ⅠA含量最高为11.1636mg/g(即3.729mg/片),最低为6.9714 mg/g(即2.333mg/片),考虑到不同药材的来源苦玄参苷ⅠA含量不一,以及工业化生产的损失,故将样品中苦玄参苷ⅠA含量的限度适当降低,暂规定苦玄参苷ⅠA含量限度为每片不得低于1.0mg。
[1]方宏,梁小燕.苦玄参药材中苦玄参苷ⅠA和ⅠB的含量分析[J].广西植物,28(5):708-710.
[2]潘小姣,曾金强,韦志英,等.从苦玄参中制备苦玄参苷ⅠA的实验研究[J].广西中医药,2008,31(4):49-50.
(编辑陈明伟)
R284.1
A
2095-4441(2016)02-0070-03
2016-01-23
