电针迎香穴对大鼠嗅觉功能和嗅黏膜成纤维生长因子的干预效应研究
2016-08-03杨晓航牛文民刘思洋朱先伟王卫刚刘智斌陕西中医药大学陕西咸阳7046西安医学院陕西西安700陕西中医药大学附属医院陕西咸阳7000
杨晓航,牛文民,王 渊,刘思洋,朱先伟,王 强,王卫刚,刘智斌(.陕西中医药大学,陕西 咸阳 7046;.西安医学院,陕西 西安 700;.陕西中医药大学附属医院,陕西 咸阳 7000)
电针迎香穴对大鼠嗅觉功能和嗅黏膜成纤维生长因子的干预效应研究
杨晓航1,牛文民1,王渊1,刘思洋2,朱先伟1,王强1,王卫刚3,刘智斌1
(1.陕西中医药大学,陕西 咸阳712046;2.西安医学院,陕西 西安710021;3.陕西中医药大学附属医院,陕西 咸阳712000)
[目的]探讨电针迎香穴对大鼠嗅觉功能和嗅黏膜成纤维生长因子(FGFs)的干预效应和作用通路。[方法]将50只SD大鼠随机分为正常对照组、嗅觉功能障碍组、嗅觉功能障碍+眶下神经切断组、嗅觉功能障碍+针刺组、嗅觉功能障碍+眶下神经切断+针刺组5组,每组10只。采用Triton X-100鼻腔注射法复制大鼠嗅觉功能障碍动物模型和大鼠嗅觉功能障碍+眶下神经切断动物模型。通过电针迎香穴干预后,分析各组大鼠埋藏食物小球实验、嗅觉迷宫实验结果及ELISA法检测的FGFs含量。[结果]埋藏食物小球实验及嗅觉迷宫实验结果表明电针迎香穴可以显著缩短嗅觉功能障碍模型大鼠寻找食物小球的时间(P<0.01),并且电针迎香穴干预后模型大鼠嗅黏膜组织中FGFs含量明显升高(P<0.01)。[结论]电针迎香穴可显著提高嗅觉功能障碍模型大鼠嗅黏膜组织中FGFs含量,其作用与三叉神经通路的完整性有关。
电针;迎香穴;嗅觉功能障碍;成纤维生长因子
嗅觉在人类的行为、情感等各种生理及心理状态中均发挥着重要作用。嗅觉功能障碍可直接导致患者认知障碍、生存质量下降,例如由于嗅觉功能障碍直接导致味觉异常,进而引起营养失调和体质衰退等。临床中嗅觉功能障碍自报患病率为15.3%,实际患病率可能更高[1-4]。针刺迎香穴广泛应用于临床治疗嗅觉功能障碍[5-8]。迎香穴最早见于《针灸甲乙经》,另名冲阳,属手阳明大肠经,手、足阳明之会,位于鼻翼外缘中点旁,当鼻唇沟中;主治鼻塞、鼻衄、鼻渊、鼻息肉、口眼斜、面痒浮肿及胆道蛔虫症等。《针经指南》云“鼻室无闻,迎香可引”;《扁鹊神应针灸玉龙经》云“不闻香臭从何治,须向迎香穴内攻”,其中所谓“不闻香臭”即现代医学的嗅觉功能障碍(包括嗅觉减退和丧失)。在本研究中,笔者以嗅觉功能障碍模型Sprague-Dawley(SD)大鼠为研究对象,通过对电针迎香穴干预前及干预2周后5组大鼠间嗅觉行为学、成纤维生长因子(fibroblast growth factors,FGFs)含量等指标进行比较,为阐明电针迎香穴治疗嗅觉功能障碍的效应和作用通路提供实验依据。
1 实验对象与方法
1.1实验动物SD大鼠,约250 g,雄性。置于可控的SPF级环境条件下,室温保持在21±3°C,光/暗周期为13/11 h,灯光于早晨6时切换,自由饮水采食。所有的实验均获得陕西中医学院实验动物伦理委员会批准,并严格遵守陕西省实验动物管理办法。
1.2器材和试剂Morris水迷宫实验系统(北京现代太极电子有限公司);Multiskan MK3全自动酶标仪(美国Bio-Rad公司)。Rat glial cell line-derived neurotrophic factor(GDNF)ELISA KIT(武汉巴菲尔生物技术有限公司)。
1.3方法
1.3.1动物分组将50只SD大鼠随机分为正常对照组、嗅觉功能障碍组、嗅觉功能障碍+眶下神经切断组、嗅觉功能障碍+针刺组、嗅觉功能障碍+眶下神经切断+针刺组等5组,每组10只。
1.3.2嗅觉障碍模型制作参照秦照萍等[9]和Cummings的方法[10],将大鼠用0.3%戊巴比妥钠麻醉后,用微量注射器(注射器针头磨钝)对双侧鼻孔一次性灌注100μl0.7%Triton X-100(PBS配制),灌流时间为1min。
1.3.3眶下神经切断模型常规消毒大鼠两侧眶下皮肤区域,沿两侧眶下缘做一水平切口,长约0.5 cm,钝性分离皮下脂肪,暴露眶下孔,仔细分离眶下神经及其同名动静脉,避开血管,切断眶下神经。
1.3.4电针方法迎香穴定位:大鼠鼻孔外侧上端,有毛与无毛交界处。电针方法:迎香穴向内上方斜刺0.3 cm,电针参数:1 mA,疏密波;正极和负极各接一侧迎香穴,刺激时间10 m in,1次/日。以上电针处理均在造模成功后第1天进行。5天为1个疗程,疗程间休息2天,共进行2个疗程。未行电针治疗组常规饲养至电针疗程结束[11-12]。
1.3.5埋藏食物小球实验采用大小一致的新鲜鼠料(0.5 g),以减少外源性食物味道的干扰。测试前3 d限制大鼠进食,每只给予鼠料0.2 g/d,自由饮水;同时这3 d内将单只大鼠分别置入测试时采用的鼠笼(45 cm×24 cm×20 cm)中熟悉10min。测试前将0.5 g的食物小球埋藏在鼠料表面以下5 cm处并随机更换置放食物小球的位置,记录大鼠进入鼠笼内开始到大鼠用前爪抓住食物小球并啃噬的时间,等大鼠吃完食物后再将其放回笼中。休息4 h后,将食物小球随机置放在鼠料表面不同位置,重复实验作为对照。所有实验以300 s(5次测试的平均值)内未找到食物小球的大鼠即定为嗅觉丧失。
1.3.6嗅觉迷宫实验参考文献[13-14]方法改良自制圆形迷宫,其中等分为6个小格,将测试用的新鲜鼠料(0.5 g)随机放置在大鼠不能直接看见的小格后面而仅靠其嗅觉才能找到。实验时,大鼠首先被放置在迷宫的中间,记录大鼠进入迷宫内到用前爪抓住食物小球并啃噬的时间。等大鼠吃完食物后再将其放回笼中,并取出食物残渣和大鼠的排泄物,用70%的乙醇和水清洁迷宫防止对后面测试的干扰。阳性对照是将食物小球放置于小格之外,大鼠能够直接看见的部位。所有实验以300 s(5次测试的平均值)内未找到食物小球的大鼠即定为嗅觉丧失。
1.3.7酶联免疫吸附法(ELISA)检测2个疗程结束后,常规碘伏消毒局部皮肤,2%戊巴比妥钠深度麻醉(100 mg/kg)后,取口腔入路断颈去额部皮肤、肌肉及下颌骨后,将头颅取下。用血管钳将一侧鼻腔完全打开,于鼻腔后上的颅底部,可见鼻中隔最后上部的嗅区呈黄色,与呼吸道黏膜有较明显的区别。将此嗅区鼻中隔(嗅黏膜和骨质)完整取下,在显微镜下将两侧的嗅黏膜自骨片上完整刮下。将组织切成碎片并用特定比例的PBS匀浆(每10mg组织对应100μl PBS)。将匀浆液用超声波进一步进行处理来破坏细胞膜。之后,将匀浆液1 500×g离心15 min,取上清并存储在-80°C超低温冰箱。按照ELISA试剂盒说明书操作对组织中FGFs含量进行分析。
2 结果
2.1行为学实验结果各组大鼠在埋藏食物小球实验、嗅觉迷宫实验中寻找食物小球的时间比较见表1。在两项行为学实验中,与正常对照组比较,嗅觉功能障碍组与嗅觉功能障碍+眶下神经切断组大鼠寻找食物小球的时间均超过300 s,有极显著性差异(P<0.01),可以判断为嗅觉丧失。嗅觉功能障碍模型大鼠经过针刺干预后,与嗅觉功能障碍组比较,有极显著性差异(P<0.01)。嗅觉功能障碍+眶下神经切断+针刺组大鼠寻找食物小球所用时间依然均超过300 s。
表1 各组大鼠寻找食物小球的时间比较 (s,±s)

表1 各组大鼠寻找食物小球的时间比较 (s,±s)
注:与正常对照组比较,①P<0.01;与嗅觉功能障碍组比较,②P<0.01
组 别 n 埋藏食物小球实验嗅觉迷宫实验正常对照组 10 38.2±3.4 52.2±4.8嗅觉功能障碍组 10 >300① >300①嗅觉功能障碍+眶下神经切断组 10 >300① >300①嗅觉功能障碍+针刺组 10 44.5±5.2② 68.4±4.2②嗅觉功能障碍+眶下神经切断+针刺组 10 >300 >300
2.2各组FGFs含量结果见图1。与正常对照组比较,嗅觉功能障碍组与嗅觉功能障碍+眶下神经切断组中大鼠组织中FGFs含量升高,有显著性差异(P<0.05);与嗅觉功能障碍组比较,针刺迎香穴治疗后的嗅觉功能障碍+针刺组大鼠组织中FGFs含量升高,有极显著性差异(P<0.01),而嗅觉功能障碍+眶下神经切断+针刺组大鼠组织中FGFs含量没有显著性差异。
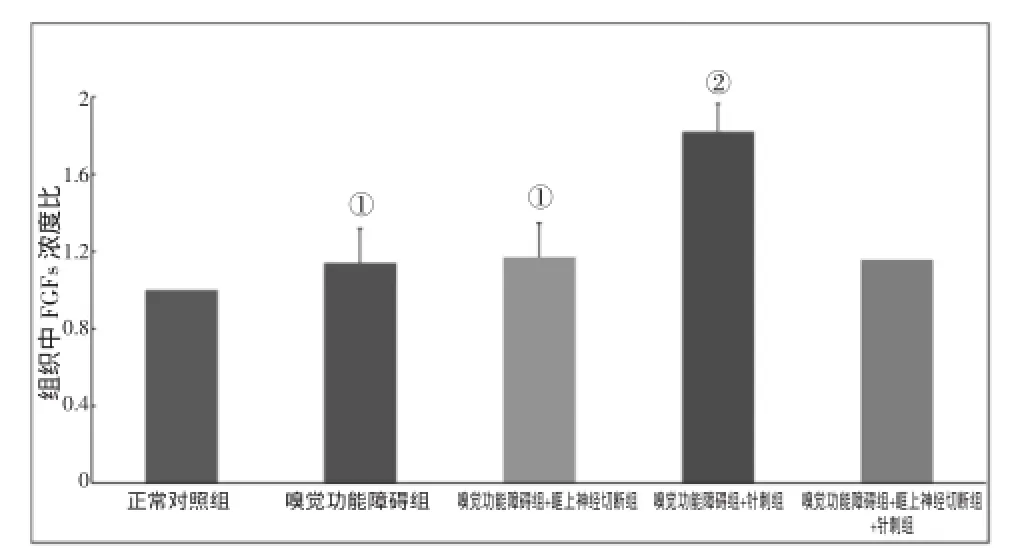
图1 各组FGFs含量相对浓度比比较
3 讨论
本研究中埋藏食物小球和嗅觉迷宫两项行为学实验结果均表明,模型组大鼠寻找食物小球时间超过300 s,证实经0.7%Triton X-100的PBS溶液鼻腔灌流的SD大鼠可以成功复制嗅觉功能障碍模型。单纯嗅觉功能障碍模型大鼠经过电针迎香穴干预后,与模型组比较寻找食物小球时间显著缩短,说明电针迎香穴有助于嗅黏膜化学损伤后嗅觉功能的恢复。同时电针迎香穴在模型大鼠行眶下神经切断术后,其改善嗅觉功能障碍的效应消失。神经解剖学研究表明:迎香穴位于三叉神经上颌支的眶下神经分布区域,因此眶下神经是迎香穴的感觉传入神经。而三叉神经的眼支分出鼻睫神经分布于鼻腔黏膜,包含嗅上皮区域,由此形成鼻腔内嗅觉神经与三叉神经重叠分布模式。大量研究已表明,嗅觉的产生是嗅觉神经和三叉神经两大系统协同作用的结果[15-17]。在中枢和外周的嗅觉信息的处理中,两个系统可以相互影响,三叉神经的刺激能反射性地影响心血管反应、呼吸速率、鼻肿胀、鼻分泌和喷嚏[18-21],有学者发现三叉神经可能经局部轴突反射合并P物质(SP)的释放参与调制嗅黏膜上皮嗅受体细胞的活动,从而影响嗅觉功能,调节嗅觉系统对气味分子的反应[22-23]。因此,可以推测三叉神经-眶下神经通路的完整性与电针迎香穴干预嗅觉功能障碍的效应密切相关。
嗅感神经元(Olfactory Receptorneurons,ORN)是体内已明确的唯一具备持续再生能力的神经元[16]。FGFs是调节ORN再生的主要细胞因子,其在嗅黏膜的表达促进ORN前体神经元的增殖和分化。本次研究结果表明,电针迎香穴可显著提高模型大鼠嗅黏膜组织中FGFs含量,且该效应同样依赖于三叉神经-眶下神经通路的完整性。
[1]刘巧平,刘建华.针刺内迎香治疗嗅觉下降[J].北京中医药大学学报:中医临床版,2011,18(2):21-22.
[2]李占勋.针刺治疗嗅觉麻痹32例[J].中国针灸,2001,21 (10):43-45.
[3]Vent J,Wang DW,Damm M.Effects of traditional Chinese acupuncture in post-viral olfactory dysfunction[J].Otolaryngol Head Neck Surg,2010,142(4):505-509.
[4]Jonathan Silas,RichardL Doty.No evidence for specific benefit of acupuncture over vitamin B complex in treating personswith olfactory dysfunction[J].Otolaryngology-Head and Neck Surgery,2010,3(2):84-90.
[5]牛文民,刘智斌,杨晓航,等.嗅三针治疗嗅觉功能障碍100例[J].陕西中医,2008,29(8):1054-1055.
[6]刘智斌,牛文民,杨晓航.嗅三针对痴呆大鼠大脑边缘叶胆碱能系统功能的影响[J].中国中医基础医学杂志,2009,15(3):206-207.
[7]刘智斌,牛文民,杨晓航,等.嗅三针对AD模型大鼠海马bcl-2,Bax表达的干预效应[J].针刺研究,2011,36(1):7-11.
[8]倪道凤,刘剑峰,王剑,等.国内嗅觉障碍研究[J].中国医学文摘:耳鼻咽喉科学,2007,22(4):212-213.
[9]秦照萍,叶树明,杜继曾.Triton损伤成年大鼠嗅上皮对嗅球钙结合蛋白-D和小白蛋白表达的影响[J].中国药理学与毒理学杂志,2005,19(3):226-228.
[10]Cummings D M,Emge D K,Small SL,etal.Pattern of olfactory bulb innervation returns after recovery from reversible peripheral deafferentation[J].J Comp Neurol,2000,42(3):362-373.
[11]Nathan B P,Yost J,Litherland M T,et al.Olfactory function in a poE knockoutm ice[J].Behav Brain Res,2004,150(1):1-7.
[12]郭义.实验针灸学[M].北京:中国中医药出版社,2008:30.
[13]Lu D C,Zhang H,Zador Z,et al.Impaired olfaction in mice lacking aquaporin-4 water channels[J].FASEB J,2008,22(9):3216-3223.
[14]Schaefer M L,Bittger B,SilverW L,et al.Trigeminal collaterals in the nasal epithelium and olfactory bulb:a potential route for directmodulation of olfactory information by trigeminal stimuli[J].JComp Neurol,2002,444(3):221-226.
[15]Bouvet JF,Delaleu JC,Holley A.Olfactory receptor cell function is affected by trigeminal nerve activity[J].Neurosci Lett,1987,77(2):181-186.
[16]Reisert J,Yau K W,Margolis F L.Olfactory marker protein modulates the cAMP kinetics of the odour-induced response in cilia ofmouse olfactory receptor neurons[J]. The Journal of Physiology,2007,585(3):731-740.
[17]Moran D T,Rowley JC,Jafek BW,et al.The fine structure of the olfactorymucosa inman[J].JNeurocytol,1982 (11):721-746.
[18]Costanzo R M,Grazizdei P P.A quantitative analysis of changes in the olfactory epithelium following bulbectomy in hamster[J].Journal of Comparative Neurology,1983,215(4):370-376.
[19]Holcomb JD,Mumm JS,Calof A L.Apoptosis in the neuronal lineage of the mouse olfactory epithelium:regulation in vivo and in vitro[J].Developmental Biology,1995,172 (6):307-314.
[20]苗旭涛,魏永祥,张聪.外伤性嗅觉障碍大鼠嗅黏膜的组织学变化[J].中国耳鼻咽喉头颈外科,2007,14(1):57-61.
[21]Murrell W,Bushell G R,Livesey J,et al.Neurogenesis in adulthuman[J].NeurorePort,1996,7(6):1189-1194.
[22]Newman M P,Feron F,Mackay-Sim A.Growth factor regulation of neurogenesis in adult olfactory epithelium[J]. Neuroscience,2000,99(2):343-350.
[23]MacDonald K P,Murrell W G,Bartlett P F,et al.FGF2 promotes neuronal differentiation in explant cultures of adult and embryonic mouse olfactory epithelium[J].J Neurosci Res,1996,44(1):27-39.
(编辑熊瑜)
R254.9
A
2095-4441(2016)02-0005-03
2016-04-02
国家自然科学基金(编号:81273859);陕西省教育厅专项科学研究项目(编号:11JK0679)
刘智斌,博士,教授,研究方向:针灸推拿治疗脊柱疾病和老年病的基础与临床研究
