高脂饮食引发肠道菌群结构改变与结直肠癌发生的相关性研究
2016-07-25朱庆超彭佳远钱海鑫
夏 阳,朱庆超,汪 昱,彭佳远,钱海鑫
·论著·
高脂饮食引发肠道菌群结构改变与结直肠癌发生的相关性研究
夏 阳,朱庆超,汪 昱,彭佳远,钱海鑫
200233江苏省苏州市,苏州大学(夏阳);上海交通大学附属第六人民医院外科(朱庆超,汪昱,彭佳远);苏州大学附属第一医院外科(钱海鑫)
【摘要】目的采用高脂饮食干预结直肠癌模型大鼠,观察其结直肠癌发生、发展及肠道菌群结构改变情况,分析高脂饮食引发肠道菌群结构改变与结直肠癌发生的相关性。方法2014年9月—2015年9月,选取4周龄SPF级雄性Wistar大鼠120只,按照随机数字表法分为4组:普通饮食+乙二胺四乙酸(EDTA)非诱导肿瘤组(SDC组)、普通饮食+1,2-二甲基肼(DMH)诱导肿瘤组(SDT组)、高脂饮食+EDTA非诱导肿瘤组(HFDC组)、高脂饮食+DMH诱导肿瘤组(HFDT组),每组30只。SDC组和SDT组大鼠给予含13.5%脂肪的普通饲料,HFDC组和HFDT组大鼠给予含45.0%脂肪的高脂饲料。SDT组和HFDT组大鼠给予40 mg/kg DMH腹腔注射,1次/周,连续注射10周;SDC组和HFDC组大鼠给予等量的EDTA+0.9%氯化钠溶液腹腔注射。获取大鼠整段结直肠,收集大鼠肠道粪便样本,病理学检查结直肠组织,利用QIAamp DNA Mini Kit试剂盒进行基因组DNA抽提,然后进行基因组DNA鉴定、聚合酶链式反应(PCR)扩增16S rRNA V3可变区,采用焦磷酸测序和生物信息学分析比较高脂饮食与普通饮食干预下肠道菌群结构的差异及其与结直肠癌发生的相关性。结果HFDT组平均结直肠癌数目多于SDT组〔(3.0±0.4)与(2.0±0.4),t=2.143,P=0.038〕。焦磷酸测序结果分析显示,4组大鼠Shannon多样性指数比较,差异有统计学意义(P<0.05);其中SDC组、SDT组大鼠Shannon多样性指数高于HFDT组(P<0.05)。SDC组检测到1 407个门、134 581个属菌群;SDT组检测到808个门、128 582个属菌群;HFDC组检测到1 519个门、125 197个属菌群;HFDT组检测到896个门、91 957个属菌群。基于光转换单位(OTU)群落聚类分析结果显示,SDT组厚壁菌门、放线菌门、螺旋体门相对丰度较SDC组降低,拟杆菌门、梭杆菌门相对丰度较SDC组升高(P<0.05);HFDT组厚壁菌门相对丰度较HFDC组降低,变形菌门、拟杆菌门、梭杆菌门相对丰度较HFDC组升高(P<0.05);HFDT组放线菌门相对丰度较SDT组降低,梭杆菌门相对丰度较SDT组升高(P<0.05)。结论高脂饮食干预下结直肠癌诱导大鼠发生肿瘤的数量多于普通饮食的结直肠癌诱导大鼠,高脂饮食能够引起肠道菌群结构改变,增加多种潜在性致病菌,特别是梭杆菌门,提示高脂饮食及其导致的肠道菌群结构改变在结直肠癌的发生、发展中有一定的促进作用。
【关键词】结直肠肿瘤;膳食,高脂;菌群失调
夏阳,朱庆超,汪昱,等.高脂饮食引发肠道菌群结构改变与结直肠癌发生的相关性研究[J].中国全科医学,2016,19(20):2473-2480.[www.chinagp.net]
XIA Y,ZHU Q C,WANG Y,et al.Relationship between the intestinal flora structure changing and the occurrence of colorectal cancer by the intervention of high-fat diet[J].Chinese General Practice,2016,19(20):2473-2480.
目前,结直肠癌已成为世界范围内发病率第3位的恶性肿瘤,而且预后不佳、病死率较高[1-2]。近期,流行病学研究已经为高脂饮食与结直肠癌患病风险升高之间的相关性提供了新的证据[3]。尽管高脂饮食能够增加罹患结直肠癌风险的具体机制尚不清楚,但是有学者指出两者之间的相关性与癌基因表达增强[4]、胆汁酸的分泌[5]、氧化应激[6]以及肠道菌群结构改变,从而最终形成了促癌微环境有关[7-8]。人体肠道内微生物群落被认为由至少1014个细菌组成,这些菌群由超过1 000种、人均150种的细菌组成[9]。尽管目前此方面的研究相对较少,但是越来越多的证据表明肠道内菌群在结直肠癌的发生、发展中起重要作用[10-12]。检测人体微生物的高通量测序技术已经为揭示正常个体内和罹患各种疾病状态下微生物的种、系、型鉴定做出了巨大的贡献[13-14]。然而,绝大多数有关肠道微生物与结直肠癌风险之间的研究是人群内的相关性研究,且对于研究者而言,既要排除人群背景差异,又要单独分析高脂饮食导致结直肠癌人群肠道菌群改变的研究十分困难。因此,使用相同背景的模型动物,并建立能够模拟人群结直肠癌发病过程的结直肠癌模型动物,就为单独分析高脂饮食对结直肠癌的影响提供了有利的实验工具。本研究利用化学致癌剂1,2-二甲基肼(DMH)诱导Wistar大鼠发生结直肠癌,并加以高脂饮食干预,进而对肠道粪便样本中16S rRNA进行了焦磷酸测序,通过生物信息学分析,以期筛选出在结直肠癌发生、发展过程中起重要作用的菌群。
1材料与方法
1.1实验动物2014年9月—2015年9月选取4周龄SPF级雄性Wistar大鼠120只,购自上海Shriek实验动物公司,体质量180~200 g,饲养于苏州大学医学院实验动物中心清洁级环境中。动物日常护理和实验条件参照《实验动物环境及设施(GB 14925-2001)》[15],本研究通过苏州大学医学院实验动物伦理委员会认证。
1.2饲料及主要试剂含13.5%脂肪的普通饲料购于美国LabDiet公司(St.Louis,MO,USA),含45.0%脂肪的高脂饲料购于美国Research Diets公司(New Brunswick,NJ,USA);DMH购于Sigma-Aldrich公司(美国),QIAamp DNA Mini Kit试剂盒、QIAquick Gel Extraction Kit试剂盒购于Qiagen公司(德国),RNA引物购于上海英骏生物科技有限公司,Fas tPfu Polymerase聚合酶购于北京全式金生物技术有限公司(TransGen Biotech),AxyPrep DNA Gel提取试剂盒购于Axygen公司(美国),GS FLX Tianium SV emPCR试剂盒、GS FLX Tianium Filters SV试剂盒购于Roche公司(瑞士)。
1.3实验分组及处理所有大鼠经过适应性饲养1周后,按照随机数字表法分为4组:普通饲料+乙二胺四乙酸(EDTA)非诱导肿瘤组(SDC组)、普通饲料+DMH诱导肿瘤组(SDT组)、高脂饲料+EDTA非诱导肿瘤组(HFDC组)、高脂饲料+DMH诱导肿瘤组(HFDT组),每组30只。SDC组和SDT组大鼠给予含13.5%脂肪的普通饲料;HFDC组和HFDT组大鼠给予含45.0%脂肪的高脂饲料。SDT组和HFDT组大鼠给予40 mg/kg DMH腹腔注射,1次/周,连续注射10周;SDC组和HFDC组大鼠给予等体积的0.9%氯化钠溶液+0.01%EDTA腹腔注射,1次/周,连续注射10周。
1.4取材第12、14、16、18、20周每组采用随机数字表法抽取3只大鼠处死,第22周将各组剩余大鼠全部处死。每只大鼠腹腔注射氨苄噻嗪15 mg/kg+克他命100 mg/kg麻醉,完全麻醉后,心脏采血至大鼠死亡,腹部十字切口剖开腹腔,获取大鼠整段结直肠,将结直肠放置于无菌巾单上,肿瘤组织完整取材,并获取肠道粪便样本。以磷酸盐缓冲液(PBS)冲洗肠道,将结直肠组织放于10%甲醛溶液固定,用于组织学检查明确病理性质。
1.5实验方法
1.5.1结直肠组织病理学检查将普通载玻片放入防脱片剂——3-氨基丙基三乙氧基硅烷(APES)工作液(用时配制)中停留20~30 s,取出后稍停,放入纯丙酮溶液以去除载玻片中未结合的APES。通风橱中晾干,即制备完成防脱载玻片,装盒备用,注意防尘;固定后的结直肠组织依次经过脱水、透明、透蜡、包埋、切片、展片、贴片(贴于防脱载玻片上)、脱蜡、复水后,用0.5%伊红乙醇溶液对比染色30 s~1 min,75%乙醇漂洗5~10 min,95%乙醇溶液中浸泡10 min×2次(室温),100%乙醇中浸泡10 min×2次(室温),100%二甲苯浸泡10 min×2次(室温)后,再经过分化、漂洗、苏木素复染、脱水、透明、中性树胶封固以完成苏木素-伊红(HE)染色;最后进行切片判读:病理切片的判读由两位资深病理专家单独进行评定,并以最终达成一致意见为准。
1.5.2基因组DNA抽提使用QIAamp DNA Mini Kit试剂盒进行基因组DNA抽提:称取500 mg玻璃珠于2 ml离心管中,加入0.2~1.0 g粪便样本,再加入1 ml SLX Mlus Buffer,用最大速度(3 000 r/min)涡旋3~5 min,以充分溶解粪便样本;混合后70 ℃温育10 min,并以10 000 r/min离心5 min(离心半径为10 cm),然后转移上清液于1个新的2 ml离心管中并加入0.7倍体积的异丙醇,颠倒混匀20~30次,如果样本DNA浓度过低,于-20 ℃放置1 h,取出上清液,把离心管倒置在吸水纸上1 min,吸干液体,不必干燥DNA沉淀,真空完全冷冻干燥后,将DNA沉淀溶于100 μl无菌水或者TE缓冲液中,加入10 μl 20 mg/L无DNA酶的核糖核酸酶A(RNAaseA),37 ℃温育30 min,得到总的DNA液,各取2 μl用1%(质量体积比)琼脂糖凝胶电泳检测DNA纯度与完整性,并取2 μl用Synergy 2 Multi-Mode Microplate Reader(Bio Tek,USA)测定DNA的浓度。所有提取的DNA样本置于-20 ℃冷冻保存,用于后续分析。
1.5.3基因组16S rRNA V3可变区PCR扩增和焦磷酸测序每组采用随机数字表法选取10只大鼠,利用454焦磷酸测序方法深度分析各组肠道菌群的多样性,首先需要对肠道菌群基因组16S rRNA V3可变区基因进行PCR扩增。PCR扩增引物为肠道菌群16S rRNA V3的通用引物27F 5′-AGAGTTTGATCCTGGCTCAG-3′,533R 5′-TTACCGCGGCTGCTGGCAC-3′。为实现多样本的高通量测序,需要合成带有“5′ 454 A/B接头-特异引物3′”的融合引物,A端为测序端,需要加标签,B端引物可共用。本实验在引物两端加上了测序接头(接头A 5′-GCCTCCCTCGCGCCATCAG-3′,接头B 5′-GCCTTGCCAGCCCGCTCAG-3′)和Barcode标签,Barcode标签为不同样本的唯一标识号,由10个碱基组成,根据Roche公司官网(www.454.com)指导的Barcode标签设计,本实验优化了所使用的PCR扩增反应体系,PCR扩增在ABI GeneAmp®9700反应仪(Applied Biosystems,USA )上进行,经过PCR扩增以后,每个磁珠含有成百万单一序列的DNA簇,乳液扩增液经打破,DNA双链变性,使每个磁珠带有单一序列单链DNA簇。将磁珠和测序试剂放入含有350万个光纤小孔的Pico Titer Plate板中,光纤小孔与磁珠直径相近,保证了每个孔含有一个磁珠,然后Pico Titer Plate板上Roche 454 GS FLX测序平台进行检测。根据碱基配对时释放的焦磷酸将荧光素氧化而释放的光信号,读取序列的生物学信息。
1.5.4生物信息学分析利用已经建立的流程和程序将原始序列根据每个标本的识别标记(Barcode标签)及引物序列进行整理,去掉低质量的序列,并将其分配至每个样本之中。对序列进行质控,符合以下标准的序列予以保留:两端引物和Barcode标签完全匹配;两端引物不完全匹配(部分碱基错配时),用Mothur在序列中搜索引物,设置字长,能够找到匹配引物的序列予以保留;引物均完整时,两端Barcode标签的编辑区域(插入、删除、缺失、错配)不超过1个碱基;序列中不确定碱基的数目少于2个;序列长度大于100 bp。经以上步骤可以得到合格的有效序列。基于光转换单位(Optical Transform Unit,OTU)群落聚类分析结果〔OTU是在系统发育学或群体遗传学研究中,为了便于进行分析,人为给某一个分类单元(品系、属、种、分组等)设置的同一标志。要了解一个样本结果中的菌种、菌属等数目信息,就需要对序列进行归类操作(cluster)。通过归类操作,将序列按照彼此的相似性分归为许多小组,一个小组就是一个OTU〕,对测序深度进行检测,计算Shannon多样性指数(用来估算样本中微生物多样性指数之一,Shannon多样性指数越大,说明群落多样性越高)。利用各组中每一个样本OTU的相对丰度信息构建非加权的Unifrac距离矩阵,基于Unifrac距离矩阵进行主成分分析(PCA),PCA是一种对数据进行简化分析的技术,可以有效地找出数据中最主要的元素和结构,去除噪音和冗余,将原有的复杂数据降维,揭示隐藏在复杂数据背后的简单结构;通过分析不同样本中OTU(97%相似度水平)组成可以反映样本间的差异和距离,PCA运用方差分解,将多组数据的差异反映在二维坐标轴上,坐标轴能够最大反映方差值的两个特征值;如样本组成越相似,反映在PCA图中的距离越近。
“一个人对世界的看法相当程度上来自他对他所在的家庭的看法,说得更确切些,个人的体验和人生经历,尤其是童年时代的生命感觉(印象),决定了他日后的世界观。一个人会最终脱离对母亲的依赖和父亲的权威,成为自己的父母,从而使人的灵魂成长,达到成熟。”[7]53费洛姆的观点在卡夫卡身上很说明问题,从某种程度上说,卡夫卡从未真正意义上地长大和成年,他绝不是能够主宰自己命运的强者。他不自主地受到父亲的巨大影响,深陷其中;他终生在作品中表现出对父亲巨大影响的无可逃匿。
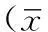
2结果
2.14组不同时间结直肠癌检出情况第12周即已发现结直肠癌,其中SDT组3只被处死大鼠中1只发现结直肠癌,HFDT组2只发现结直肠癌,SDC组和HFDC组大鼠均未发现结直肠癌;结直肠癌主要集中出现于第14周以后,组织学病理切片检查均证实为腺瘤/癌(见表1)。SDT组和HFDT组大体形态可见结直肠黏膜上出现散在息肉状赘生物,尤以HFDT组还同时合并溃疡状病理损伤。经组织学切片和HE染色证实,肠黏膜上出现的赘生物和溃疡为不同分化程度的结直肠瘤/癌,以腺癌为主要病理类型(见图1、2,本文彩图详见本刊官网www.chinagp.net电子期刊相应文章附件)。通过肉眼仔细观察全结直肠黏膜面,以直径为1 mm及以上的赘生物或溃疡物计为结直肠癌,结果显示,HFDT组平均结直肠癌数目多于SDT组〔(3.0±0.4)与(2.0±0.4)〕,差异有统计学意义(t=2.143,P=0.038)。
表14组不同时间结直肠癌检出情况(n/N)
Table 1The number of rats with CRC in different time period in four groups

组别第12周第14周第16周第18周第20周第22周aSDC组0/30/30/30/30/30/15SDT组1/31/32/33/33/312/13HFDC组0/30/30/30/30/30/15HFDT组2/31/33/33/33/312/12
注:n=检出结直肠癌大鼠数;N=该组处死大鼠总数;SDC组为普通饲料+乙二胺四乙酸非诱导肿瘤组,SDT组为普通饲料+1,2-二甲基肼诱导肿瘤组,HFDC组为高脂饲料+乙二胺四乙酸非诱导肿瘤组,HFDT组为高脂饲料+1,2-二甲基肼诱导肿瘤组;a第22周处死各组剩余大鼠,SDC组15只;SDT组死亡2只,剩余13只;HFDC组15只;HFDT组死亡3只,剩余12只
注:SDC组为普通饲料+乙二胺四乙酸非诱导肿瘤组,SDT组为普通饲料+1,2-二甲基肼诱导肿瘤组,HFDC组为高脂饲料+乙二胺四乙酸非诱导肿瘤组,HFDT组为高脂饲料+1,2-二甲基肼诱导肿瘤组;箭头所指为结直肠黏膜中息肉状或溃疡状腺癌
图14组大鼠结直肠大体形态
Figure 1The general form of rats′ colorectum in four groups
2.2焦磷酸测序结果分析本实验共生成51 123个OTU、40个标本平均每个标本1 278个OTU。Good′s coverage指数分析显示,各组的测序覆盖率均超过了94.50%,提示本次测序的16S rRNA序列代表了各组中绝大多数菌群的种、系、型,覆盖率较高。稀释性曲线所示,在此测序深度下,每个样本的Shannon多样性指数的测定则已经达到了稳定(见图3)。4组大鼠Shannon多样性指数比较,差异有统计学意义(P<0.05);其中SDC组、SDT组大鼠Shannon多样性指数高于HFDT组,差异有统计学意义(P<0.05);SDC组与SDT组,SDC与HFDC组,SDT组与HFDC组,HFDC组与HFDT组大鼠Shannon多样性指数比较,差异无统计学意义(P>0.05,见表2)。
表2 4组大鼠Shannon多样性指数比较
注:与SDC组比较,aP<0.05;与SDT组比较,bP<0.05
2.34组大鼠菌群整体结构分析从图4可看出肿瘤组与非肿瘤组的菌群之间存在着共有部分,此部分亦可认为是与肠道组织功能相关的基础菌群,该分析的前两个主成分(PC1,PC2)分别解释了总变量的37.19%和22.77%。基于OTU(97%相似度水平)相对丰度的PCA也揭示了SDT组和SDC组之间的菌群结构存在差异(PC1=47.67%,PC2=25.88%)。与此同时,虽然HFDC组和HFDT组之间、SDC组和HFDC组之间的菌群结构存在着某些重叠,但仍可见到其之间的整体构成存在差异(PC1、PC2分别为:HFDC组和HFDT组,52.49%、25.58% ;HFDT组和SDC组,51.96%、33.55%)。此外,SDT组和HFDT组之间的菌群整体结构存在差异(PC1=50.25%,PC2=22.00%)。
2.44组大鼠菌群检测情况SDC组检测到1 407个门、134 581个属菌群;SDT组检测到808个门、128 582个属菌群;HFDC组检测到1 519个门、125 197个属菌群;HFDT组检测到896个门、91 957个属菌群。4组大鼠门水平相对丰度排名前十位菌群情况见图5,4组大鼠属水平相对丰度排名前十位菌群情况见图6。
2.5SDC组与SDT组的门水平菌群相对丰度比较根据OTU分类分析的结果,SDC组与SDT组共包含前五位的门水平菌群为厚壁菌门、放线菌门、拟杆菌门、螺旋体门、梭杆菌门。SDT组厚壁菌门、放线菌门、螺旋体门相对丰度较SDC组降低,拟杆菌门、梭杆菌门相对丰度较SDC组升高,差异均有统计学意义(P<0.05,见表3)。

Table 3Comparison of relative abundance of bacterial flora between SDC group and SDT group
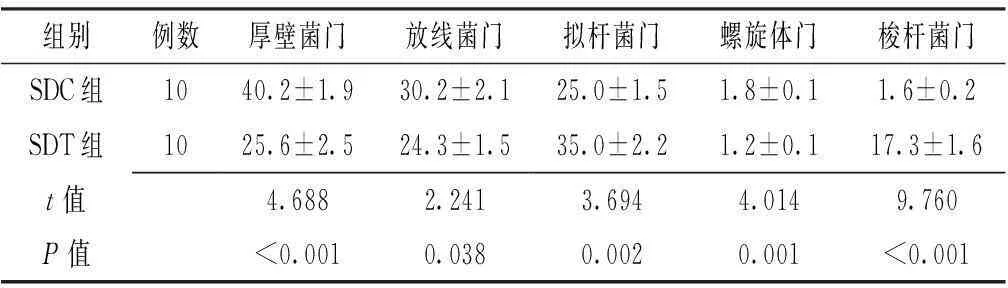
组别例数厚壁菌门放线菌门拟杆菌门螺旋体门梭杆菌门SDC组1040.2±1.930.2±2.125.0±1.51.8±0.11.6±0.2SDT组1025.6±2.524.3±1.535.0±2.21.2±0.117.3±1.6t值4.6882.2413.6944.0149.760P值<0.0010.0380.0020.001<0.001
2.6HFDC组与HFDT组的门水平菌群相对丰度比较根据OTU分类分析的结果,HFDC组与HFDT组共包含前五位的门水平菌群为厚壁菌门、变形菌门、拟杆菌门、放线菌门、梭杆菌门。两组放线菌门相对丰度比较,差异无统计学意义(P>0.05);HFDT组厚壁菌门相对丰度较HFDC组降低,变形菌门、拟杆菌门、梭杆菌门相对丰度较HFDC组升高,差异均有统计学意义(P<0.05,见表4)。
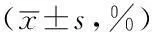
Table 4Comparison of relative abundance of bacterial phylum between HFDC group and HFDT group
组别例数厚壁菌门变形菌门拟杆菌门放线菌门梭杆菌门HFDC组1071.9±2.718.8±2.8 4.2±0.3 1.0±0.20HFDT组1020.4±1.528.4±2.230.7±2.41.6±0.422.6±1.8t值16.5202.74310.8901.4099.760P值<0.0010.013<0.0010.176<0.001
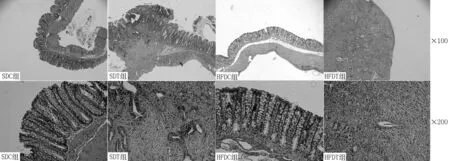
图2 4组大鼠结直肠组织病理改变(HE染色)
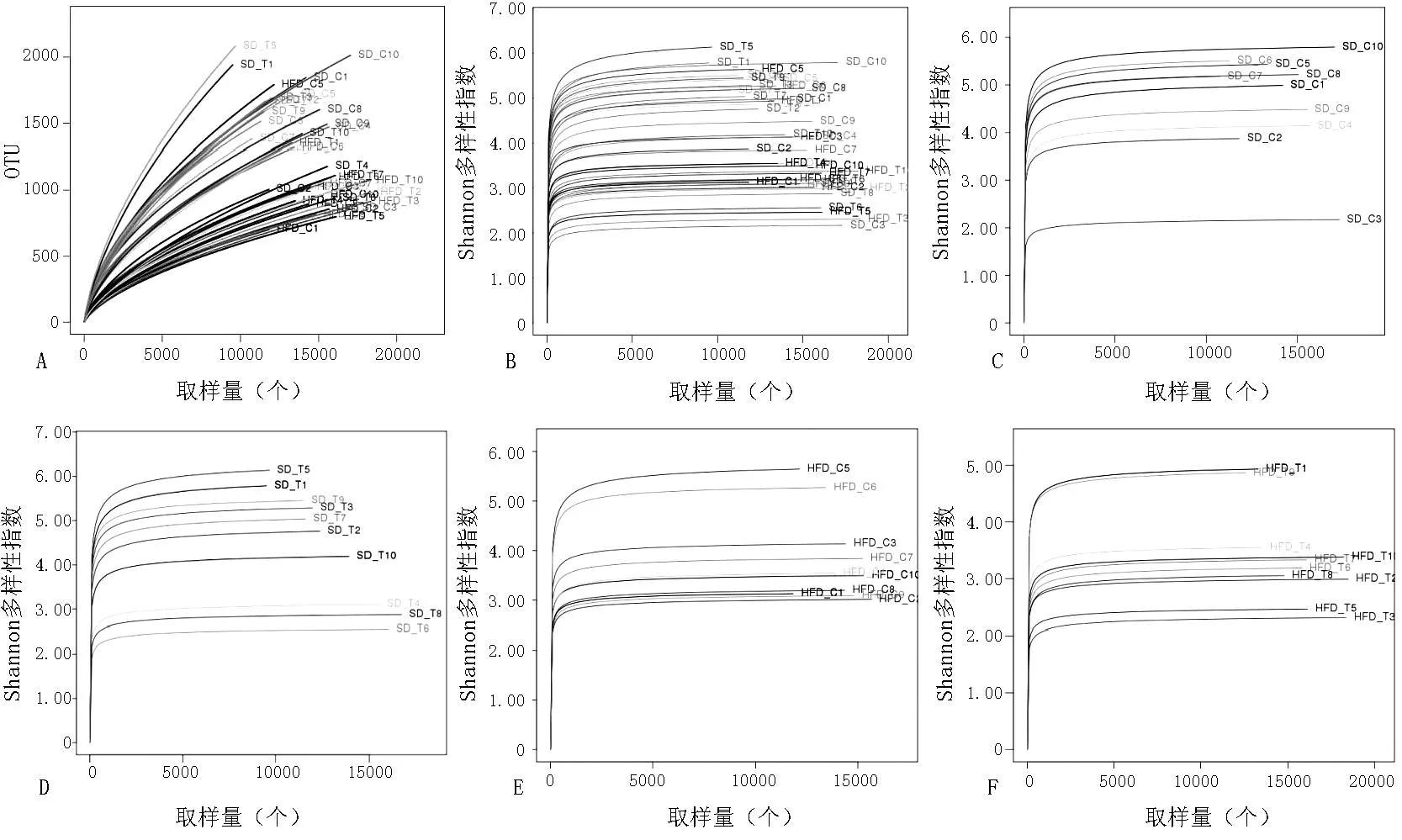
注:A为稀释性曲线,B为各样本总Shannon多样性指数曲线,C为SDC组Shannon多样性指数曲线,D为SDT组Shannon多样性指数曲线,E为HFDC组Shannon多样性指数曲线,F为HFDT组Shannon多样性指数曲线
图3各样本稀释性曲线及Shannon多样性指数曲线
Figure 3The rarefaction curve and Shannon multiple index curve of different samples
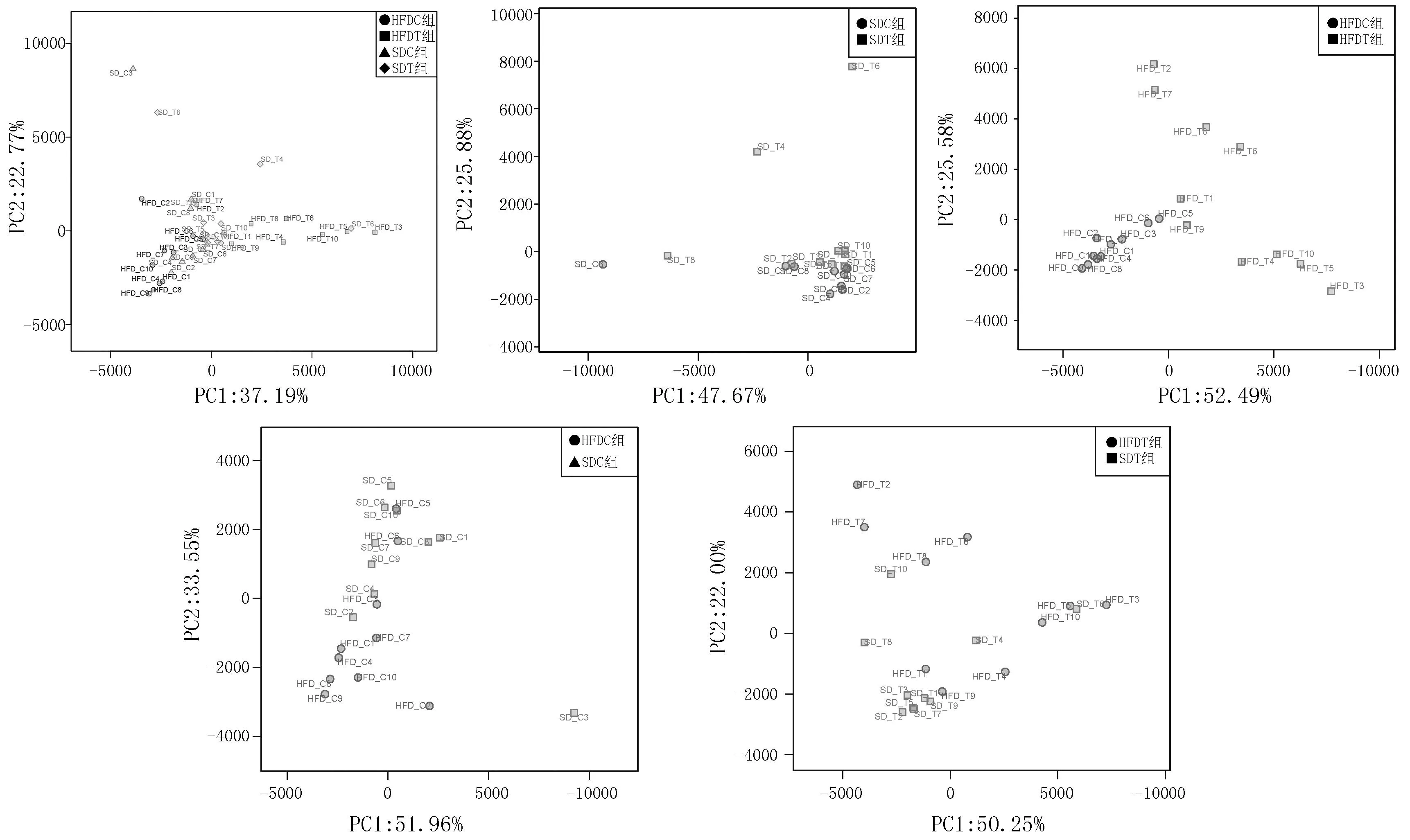
图4 基于OTU(97%相似度水平)相对丰度的PCA

Table 5Comparison of relative abundance of bacterial phylum between SDT group and HFDT group
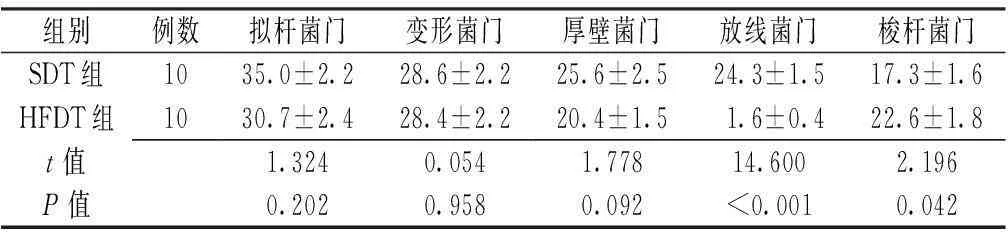
组别例数拟杆菌门变形菌门厚壁菌门放线菌门梭杆菌门SDT组1035.0±2.228.6±2.225.6±2.524.3±1.517.3±1.6HFDT组1030.7±2.428.4±2.220.4±1.5 1.6±0.4 22.6±1.8t值1.3240.0541.77814.6002.196P值0.2020.9580.092<0.0010.042
3讨论
本研究使用DMH诱导大鼠结直肠癌模型,并加以高脂饮食干预,通过比较结直肠癌形成情况以及肠道菌群构成,初步解析高脂饮食干预引发肠道菌群结构改变与结直肠癌发生的关系。
目前,使用DMH诱导大鼠结直肠癌模型已被证实是一种可靠的、被广泛认可的动物模型,与其他类似的模型相比,DMH诱导大鼠结直肠癌模型更接近人群自然状态下结直肠癌的发生、发展过程,减少了诸如皮下移植瘤或尾静脉注射肿瘤细胞等伴随的人工干预误差[16-17]。因此,DMH诱导大鼠结直肠癌模型被广泛用来评估环境或者饮食因素影响结直肠癌发病的研究。

图5 4组大鼠门水平相对丰度排名前十位菌群情况
Figure 5Top ten bacterial phylum and their relative abundance in four groups

图6 4组大鼠属水平相对丰度排名前十位菌群情况
Figure 6Top ten bacterial genus and their relative abundance in four groups
关于肠道菌群结构改变与结直肠癌之间关系的研究,已有部分报道。如WEI等[18]曾报道使用诱癌剂诱导大鼠产生肠道癌前病变,并分析比较诱导组和对照组大鼠肠道菌群构成,发现存在明显菌群结构分离情况;TURNBAUGH等[19]研究发现,在高脂饮食干预的大鼠肠道中厚壁菌门和拟杆菌门的含量比值显著升高;另有研究证实,在具有罹患结直肠癌风险的人群结直肠黏膜中也存在着诸如肠杆菌科或拟杆菌属亚种等潜在性致病菌的定植[20];KASAI等[21]也报道,在结直肠癌患者中拟杆菌属和普氏菌属的丰度显著高于健康人群等。
本研究结果显示,HFDT组平均结直肠癌数目明显多于SDT组。根据PCA前两个主要成分PC1和PC2的结果,观察到不同饮食干预组之间的肠道微生物菌群结构存在显著差异。本研究中,SDT组拟杆菌门、梭杆菌门相对丰度较SDC组升高,HFDT组拟杆菌门、梭杆菌门、变形菌门相对丰度较HFDC组升高;同时,HFDT组梭杆菌门较SDT组升高,放线菌门相对丰度较SDT组降低,提示结直肠癌大鼠肠道菌群中不同门水平相对丰度有升高也有降低,但梭杆菌门相对丰度在肿瘤组(SDT组和HFDT组)中均升高。提示高脂饮食在影响肠道菌群结构方面有着重要的作用,且推测在高脂饮食干预的大鼠中较高的结直肠癌发生率与改变了的菌群结构之间存在正相关,肠道菌群失衡是结直肠癌发病的一个重要致病因素。此外,本研究进一步证实了在高脂饮食条件下某些在结直肠癌发生发展过程中起着重要作用的潜在致病菌(特别是梭杆菌)的相对丰度明显增加。值得注意的是,既然绝大多数的结直肠癌患者中能够检测到梭杆菌门相对丰度的升高,梭杆菌门具备了作为结直肠癌潜在诊断标志物的特征。多种因素参与了正常结直肠黏膜上皮细胞向结直肠癌的转化过程,且越来越多的证据显示肠道菌群与疾病的起始和进展密切相关。研究显示在结直肠癌组织中可检出梭杆菌属,其可能与炎症性肠病(IBD)存在着密切的联系,而IBD属常见的结直肠疾病之一,且与结直肠癌的发生也有一定的相关性[22]。基于梭杆菌属能够诱导机体肠道炎性反应[23],进而促进其与人体结直肠上皮细胞黏附和侵入等,KOSTIC等[24]认为梭杆菌属能通过炎症调节机制而促进结直肠癌形成,尽管目前还没有找到人群研究中与结直肠癌之间相关性的直接证据,但后续新的研究应该能解开其中的重要致病机制。
综上所述,本研究揭示了高脂饮食引发肠道菌群结构改变与结直肠癌发生发展之间的重要关系,但不足的是未涉及具体的作用机制研究,需在后续的研究中补充完善,为寻找新的结直肠癌干预、治疗靶点提供理论依据。
作者贡献:夏阳、钱海鑫进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;朱庆超、汪昱、彭佳远进行实验实施、评估、资料收集;钱海鑫进行质量控制及审校。
本文无利益冲突。
参考文献
[1]CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]ARAN V,VICTORINO A P,THULER L C,et al.Colorectal cancer:epidemiology,disease mechanisms and interventions to reduce onset and mortality[J].Clin Colorectal Cancer,2016.
[3]KYRØ C,SKEIE G,LOFT S,et al.Adherence to a healthy Nordic food index is associated with a lower incidence of colorectal cancer in women:the Diet,Cancer and Health cohort study[J].Br J Nutr,2013,109(5):920-927.
[4]LIU Z,BROOKS R S,CIAPPIO E D,et al.Diet-induced obesity elevates colonic TNF-alpha in mice and is accompanied by an activation of Wnt signaling:a mechanism for obesity-associated colorectal cancer[J].J Nutr Biochem,2012,23(10):1207-1213.
[5]O′KEEFE S J,LI J V,LAHTI L,et al.Fat,fibre and cancer risk in African Americans and rural Africans[J].Nat Commun,2015,6:6342.
[6]SUNG M K,YEON J Y,PARK S Y,et al.Obesity-induced metabolic stresses in breast and colon cancer[J].Ann N Y Acad Sci,2011,1229:61-68.
[7]WEBER C.Nutrition.Diet change alters microbiota and might affect cancer risk[J].Nat Rev Gastroenterol Hepatol,2015,12(6):314.
[8]ARTHUR J C,JOBIN C.The complex interplay between inflammation,the microbiota and colorectal cancer[J].Gut Microbes,2013,4(3):253-258.
[9]陈立平,王伟,夏冰.肠道微生态在炎症性肠病诊断与治疗中的应用[J].中华消化杂志,2013,33(12):808-810.
[10]BULTMAN S J.The microbiome and its potential as a cancer preventive intervention[J].Semin Oncol,2016,43(1):97-106.
[11]VERBEKE K A,BOOBIS A R,CHIODINI A,et al.Towards microbial fermentation metabolites as markers for health benefits of prebiotics[J].Nutr Res Rev,2015,28(1):42-66.
[12]ZHU Y,MICHELLE LUO T,JOBIN C,et al.Gut microbiota and probiotics in colon tumorigenesis[J].Cancer Lett,2011,309(2):119-127.
[13]GRUNDBERG I,KIFLEMARIAM S,MIGNARDI M,et al.In situmutation detection and visualization of intratumor heterogeneity for cancer research and diagnostics[J].Oncotarget,2013,4(12):2407-2418.
[14]MANNA S K,TANAKA N,KEAUSZ K W,et al.Biomarkers of coordinate metabolic reprogramming in colorectal tumors in mice and humans[J].Gastroenterology,2014,146(5):1313-1324.
[15]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.实验动物环境及设施:GB 14925-2001[S].北京:中国标准出版社,2001.
[16]SUZUI M,MORIOKA T,YOSHIMI N.Colon preneoplastic lesions in animal models[J].J Toxicol Pathol,2013,26(4):335-341.
[17]ROSCILLI G,MARRA E,MORI F,et al.Carnitines slow down tumor development of colon cancer in the DMH-chemical carcinogenesis mouse model[J].J Cell Biochem,2013,114(7):1665-1673.
[18]WEI M,WANIBUCHI H,NAKAE D,et al.Low-dose carcinogenicity of 2-amino-3-methylimidazo[4,5-f] quinoline in rats:Evidence for the existence of no-effect levels and a mechanism involving p21(Cip / WAF1) [J].Cancer Sci,2011,102(1):88-94.
[19]TURNBAUGH P J,RIDAURA V K,FAITH J J,et al.The effect of diet on the human gut microbiome:a metagenomic analysis in humanized gnotobiotic mice[J].Sci Transl Med,2009,1(6):6ra14.
[20]YURDAKUL D, YAZGAN-KARATAS A,SAHIN F.Enterobacter strains might promote colon cancer[J].Curr Microbiol,2015,71(3):403-411.
[21]KASAI C,SUGIMOTO K,MORITANI I,et al.Comparison of human gut microbiota in control subjects and patients with colorectal carcinoma in adenoma:Terminal restriction fragment length polymorphism and next-generation sequencing analyses[J].Oncol Rep,2016,35(1):325-333.
[22]YAEGER R,SHAH M A,MILLER V A,et al.Genomic alterations observed in colitis-associated cancers are distinct from those found in sporadic colorectal cancers and vary by type of inflammatory bowel disease[J].Gastroenterology,2016.
[23]BASHIR A,MISKEEN A Y,HAZARI Y M,et al.Fusobacterium nucleatum,inflammation,and immunity:the fire within human gut[J].Tumour Biol,2016,37(3):2805-2810.
[24]KOSTIC A D,CHUN E,ROBERTSON L,et al.Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment[J].Cell Host Microbe,2013,14(2):207-215.
(本文编辑:陈素芳)
Relationship Between the Intestinal Flora Structure Changing and the Occurrence of Colorectal Cancer by the Intervention of High-fat Diet
XIAYang,ZHUQing-chao,WANGYu,etal.
SoochowUniversity,Suzhou200233,China
【Abstract】ObjectiveTo observe the effect of high-fat diet on the incidence of colorectal cancer(CRC) in an animal model,and to investigate the change of intestinal flora and the relationship with the occurrence of CRC.MethodsFrom September 2014 to September 2015,120 SPF male Wistar rats which were four weeks old were randomly divided into four groups:normal diet+EDTA not induced tumor group(SDC group);normal diet+DMH induced tumor group(SDT group);high fat diet+EDTA not induced tumor group(HFDC group);high fat diet+DMH induced tumor group(HFDT group).Each group included 30 rats.SDC group and SDT group were fed with normal diet which contained 13.5% fat while HFDC group and HFDT group were fed with high fat diet which contained 45.0% fat.SDT group and HFDT group were intraperitoneal injected with DMH 40 mg/kg every week for ten weeks,the SDC group and the HFDC group were intraperitoneal injected with 0.9% sodium chloride with EDTA at the same amount.Rats′ whole period of colorectum was taken and stool samples were collected.Tissues of colorectum was examined by athologist.Genomic DNA was extracted using the QIAamp DNA Mini Kit according to the manufacturer′s instructions.Afterwards,the determination of genomic DNA,PCR amplification of 16S rRNA V3 region and the pyrosequencing and bioinformatic analysis were performed in order to compare the differences of intestinal flora structure under high-fat diet and normal diet and the correlation between intestinal flora structure and CRC.ResultsThe average tumor numbers was higher in HFDT group than in SDT group 〔(3.0±0.4) and(2.0±0.4),t=2.143,P=0.038〕.Moreover,the result of pyrosequencing showed that the differences of Shannon diversity index among four groups were significant(P<0.05).The Shannon diversity index was higher in SDC group and SDT group than in HFDT group(P<0.05).In SDC group,1 407 bacteriophyta and 134 581 genuses were detected;In SDT group,808 bacteriophyta and 128 582 genuses were detected;In HFDT group,896 bacteriophyta and 91 957 genuses were detected,and in HFDC group 1 519 bacteriophyta and 125 197 genuses were detected.According to the result of OTU classification analysis,relative abundance of firmicutes,actinobacteria,and spirochaetes in SDT group were lower than in SDC group,relative abundance of bacteroides and fusobacterium in SDT group were higher than in SDC group(P<0.05).The relative abundance of firmicutes in HFDT group was lower than in HFDC group,relative abundance of bacteriodetes,fusobacteria and proteobacteria in HFDT group were higher than in HFDC group(P<0.05).Relative abundance of actinobacteria in HFDT group was lower than in SDT group,relative abundance of fusobacteria in HFDT group was higher than in SDT group(P<0.05).ConclusionHigh-fat diet increases the risk of CRC for rats in this study.The structure of intestinal flora changes through taking high fat diet and the relative abundance of multiple potential pathogenic bacteria also increases,especially for fusobacteria.High-fat diet may cause intestinal flora disorder which plays a certain role in the occurrence and development of CRC.
【Key words】Colorectal neoplasms;Diet,high-fat;Microbial dysbiosis
基金项目:国家自然科学基金资助项目(81230057)
通信作者:钱海鑫,215006江苏省苏州市,苏州大学附属第一医院外科;E-mail:qianhaixin1@hotmail.com
【中图分类号】R 735.37
【文献标识码】A
DOI:10.3969/j.issn.1007-9572.2016.20.024
(收稿日期:2016-02-16;修回日期:2016-05-10)
·膳食与营养·
