苦菜总黄酮对去卵巢豚鼠骨代谢生化指标的影响
2016-07-23刘仰斌张志花
刘仰斌,张志花
(赣南医学院 基础医学院,江西 赣州 341000)
·基础医学·
苦菜总黄酮对去卵巢豚鼠骨代谢生化指标的影响
刘仰斌,张志花
(赣南医学院基础医学院,江西赣州341000)
【摘要】目的:探讨苦菜总黄酮对去卵巢豚鼠骨代谢的影响。方法:用去卵巢方法建立豚鼠骨代谢紊乱动物模型,30只雌豚鼠,随机分为5组:正常对照组、骨质疏松模型组、阳性药物组、低剂量苦菜总黄酮组(0.1 mg/kg)、高剂量苦菜总黄酮组(0.3 mg/kg)。建模1周后,分别给予生理盐水、雌激素和不同剂量的苦菜总黄酮,给药6周后,检测豚鼠骨长度和骨质量指数,同时检测血清电解质、碱性磷酸酶(AKP)、骨钙素(BGP)和肝组织抗酒石酸酸性磷酸酶(TrACP-5b)等生化指标。结果:①苦菜总黄酮可以增大股骨和胫骨长度指数;②苦菜总黄酮可提高降钙素的含量;③苦菜总黄酮能升高血清AKP,降低TrACP-5b的含量。结论: 苦菜总黄酮可通过调节骨形成和骨吸收途径,改善去卵巢豚鼠骨代谢的紊乱,显示类雌激素样功效,对绝经后骨质疏松症可能起治疗作用。
【关键词】苦菜;总黄酮;去卵巢;豚鼠;骨代谢
【DOI】10.3969/j.issn.1002-0217.2016.03.002
随着年龄的增长,女性卵巢的功能在减退,尤其是绝经后雌激素的下降,导致其各代谢系统出现改变,如血脂增高、动脉硬化、骨质疏松等[1-2]。临床上多用雌激素来治疗女性因雌激素下降而引起的症状,但各种合成的雌激素不良反应较大,使其在临床上的应用受限。苦菜在国内分布很广,日常生活中人们长期应用。我们在前期的研究中发现苦菜总黄酮具有降血脂、抑菌、抗病毒、抗肿瘤、改善血液系统等作用[3-7],可以降低去卵巢豚鼠的Lee′s指数并改善其血脂代谢情况[8]。为进一步研究和推广苦菜的作用,我们通过建立去卵巢豚鼠的骨质疏松模型,观察苦菜总黄酮对去卵巢豚鼠骨代谢的生化指标影响,为苦菜总黄酮在临床上的应用提供实验依据。
1材料与方法
1.1药品与试剂苦菜总黄酮按照文献[3]的方法先配制好,实验前用双蒸水稀释至实验各组所需浓度。戊酸雌二醇片(拜耳医药保健有限公司广州分公司,批号:030A),降钙素(calcitonin,CT)、血清骨钙素(bone gla protein,BGP)、抗酒石酸性磷酸酶(tartrate-resistant acid phosphatase,TrACP-5b)、血清碱性磷酸酶(alkaline aphosphatase,AKP)测试盒(均为上海酶联生物科技有限公司)。水合氯醛(天津海晶精细化工厂,批号:20061215),其他试剂均为市售分析纯。
1.2主要仪器设备Gemini XPS荧光酶标仪(美谷分子仪器上海有限公司);超速低温离心机(美国贝克曼库尔特有限公司);SN-695型智能放免γ测量仪(上海核辐光电仪器有限公司);HD-F2600全自动生化分析仪(济南汉方医疗器械有限公司)。
1.3动物分组豚鼠30只,SPF级,均为雌性,自由饮食,体质量350~400 g,由赣南医学院实验动物中心提供,许可证号为SYXK(赣)2007-0002。根据实验动物使用的3R原则,在实验前所有豚鼠均给予人道的关怀,实验前适应性饲养1周。实验时30只豚鼠随机分为5组(每组6只):①正常对照组(假手术组),②骨质疏松模型组(卵巢切除组),③阳性药物对照组[卵巢切除+戊酸雌二醇,80 mg/(kg·d)],④低剂量组(卵巢切除+苦菜总黄酮,0.1 mg/kg),⑤高剂量组(卵巢切除+苦菜总黄酮,0.3 mg/kg)。
1.4方法
1.4.1动物模型制备术前豚鼠禁食1 d,不禁水。用10%的水合氯醛(0.35 mL/100 g)麻醉后,于平卧位消毒,打开腹腔,行腹侧双侧卵巢切除;正常对照组仅探查卵巢,不切除,余操作同模型组。术后1周各组行阴道脱落细胞检查,以明确卵巢切除成功。阳性药物组按80 mg/kg戊酸雌二醇混悬液灌胃,苦菜总黄酮组分另按0.1 mg/kg、0.3 mg/kg剂量灌胃,给药体积为0.5 mL/100g 体质量,对照组及骨质疏松模型组大鼠给予等体积的生理盐水,每天1次,连续6周。
1.4.2血清生化检测给药6周后,麻醉大鼠,腹腔动脉取血,2000 r/min,4 ℃,离心15 min,分离血清,于-80 ℃冰箱保存。全自动生化分析仪检测血清钙、镁和磷的水平;酶分析方法检测血清AKP和TrACP-5b活性。
1.4.3放射免疫学方法检测血清BGP和CT的含量:取血清,解冻后,3000 r/min,离心10 min,取上清100 μL于已编写号码的放免专用试管中,加入相应的抗血清100 μL,混匀,再分别加入125I标记的BGP、CT,混匀,另设总放射值管、非特异反应管(不加入抗血清)及标准管(S0~S5),4 ℃孵育24 h。除总放射管值外,每管加入免疫分离剂500 μL,充分混匀,室温放置20 min后,4 ℃,3000 r/min,离心10 min,弃上清,在SN-695型智能放免γ测量仪上测定cpm(每分钟多少次衰变)值,半对数绘制标准曲线,分别计算每管血清BGP、CT的含量。
1.4.4骨质量及长度指数检测分别称量腰椎、股骨、胫腓骨质量,测量股骨、胫腓骨长度,计算腰椎、股骨、胫腓骨质量指数(骨质量/豚鼠质量),股骨和胫腓骨长度指数(骨质量/骨质长度)。
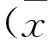
2结果
2.1血清Ga2+、Mg2+、磷含量与正常对照组相比,模型组豚鼠血清Ca2+和Mg2+含量降低、磷含量升高(P<0.05);与模型组相比,阳性药物组血Ca2+水平升高,磷下降(P<0.05),苦菜总黄酮各组血Ca2+含量升高(P<0.05),磷含量与模型组无明显差异,见表1。
表1苦菜总黄酮对去卵巢豚鼠血清电解质含量的影响

分组nGa2+/(mmol/L)Mg2+/(mmol/L)磷/(mmol/L)正常对照组64.83±0.311.78±0.092.54±0.31模型组64.08±0.34*1.70±0.10*2.90±0.22*阳性药物组64.70±0.68#1.74±0.042.76±0.18#低剂量组65.09±0.39#1.66±0.012.95±0.21高剂量组64.85±0.58#1.75±0.052.85±0.20F3.7122.9332.994P<0.05<0.05<0.05
注:*P<0.05与正常对照组相比,#P<0.05与模型组相比。
2.2血清AKP活性和肝组织TrACP-5b活性与正常对照组相比,模型组豚鼠血清AKP活性降低(P<0.01),肝组织TrACP-5b活性升高(P<0.05);与模型组相比,阳性药物组肝组织TrACP-5b活性降低(P<0.01),苦菜总黄酮各组AKP活性升高(P<0.01),肝组织TrACP-5b活性降低(P<0.05),见表2。
表2苦菜总黄酮对去卵巢豚鼠血清AKP及肝脏TrACP-5b活性的影响
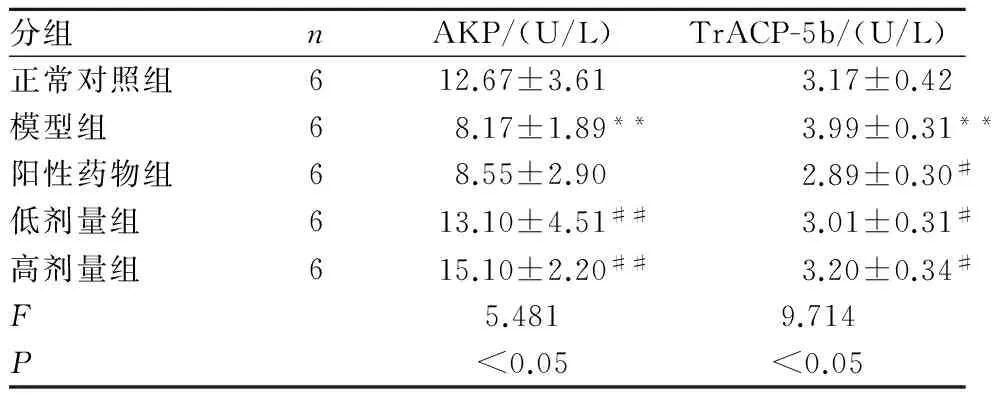
分组nAKP/(U/L)TrACP-5b/(U/L)正常对照组612.67±3.613.17±0.42模型组68.17±1.89**3.99±0.31**阳性药物组68.55±2.902.89±0.30#低剂量组613.10±4.51##3.01±0.31#高剂量组615.10±2.20##3.20±0.34#F5.4819.714P<0.05<0.05
注:*P<0.05,**P<0.01与正常对照组相比,#P<0.05,##P<0.01与模型组相比。
2.3血清BGP和CT含量与正常对照组相比,模型组豚鼠血清CT含量降低(P<0.05);与模型对照组相比,阳性药物组血清CT含量升高(P<0.01),苦菜总黄酮各组CT含量升高(P<0.01),见表3。
2.4骨密度、骨长度和骨质量指数与正常对照组相比,模型组豚鼠的股骨和胫骨长度指数均减小(P<0.05,P<0.01);实验6周后与模型组相比,阳性药物组、苦菜总黄酮各组股骨、胫骨长度指数均提高(P<0.05,P<0.01),见表4。
表3苦菜总黄酮对去卵巢豚鼠BGP、CT的影响

分组nBGP/(ng/mL)CT/(pg/mL)正常对照组68.39±1.63138.02±23.43模型组611.09±2.1989.13±11.06*阳性药物组68.55±1.51124.61±25.94##低剂量组69.82±1.55111.09±14.97##高剂量组610.32±1.79124.01±19.29##F2.6155.256P>0.05<0.05
注:*P<0.05与正常对照组相比,##P<0.01与模型组相比。
表4苦菜总黄酮对去卵巢豚鼠骨长度和骨质量指数的影响
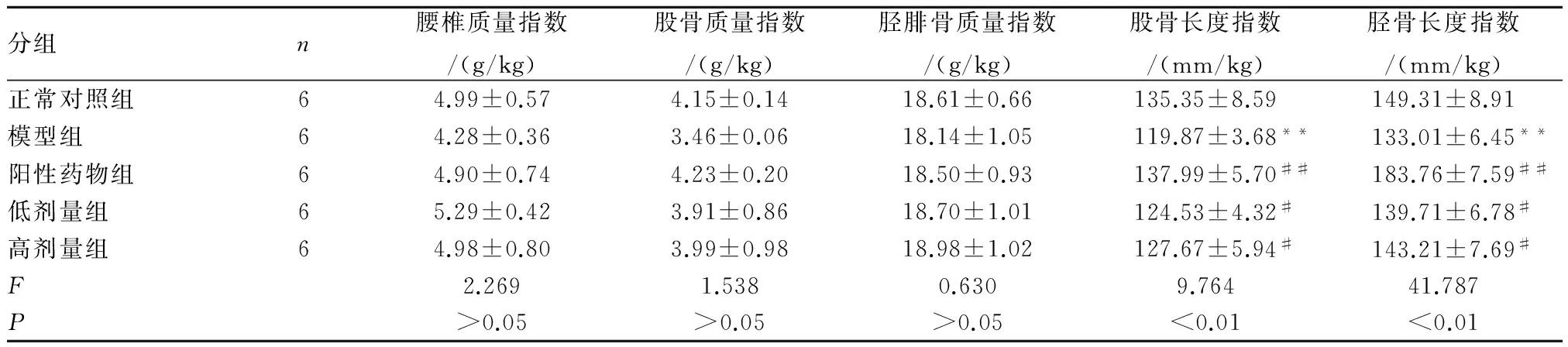
分组n腰椎质量指数/(g/kg)股骨质量指数/(g/kg)胫腓骨质量指数/(g/kg)股骨长度指数/(mm/kg)胫骨长度指数/(mm/kg)正常对照组64.99±0.574.15±0.1418.61±0.66135.35±8.59149.31±8.91模型组64.28±0.363.46±0.0618.14±1.05119.87±3.68**133.01±6.45**阳性药物组64.90±0.744.23±0.2018.50±0.93137.99±5.70##183.76±7.59##低剂量组65.29±0.423.91±0.8618.70±1.01124.53±4.32#139.71±6.78#高剂量组64.98±0.803.99±0.9818.98±1.02127.67±5.94#143.21±7.69#F2.2691.5380.6309.76441.787P>0.05>0.05>0.05<0.01<0.01
注:**P<0.01与对照组相比,#P<0.05,##P<0.01与模型组相比。
3讨论
正常情况下,骨形成和骨吸收通过各种调节信号紧密相连。当骨吸收活跃并引起骨密度降低和骨组织微结构破坏时,就会导致骨质疏松症的发生,随之而来就是骨脆性增加和骨折风险增加。骨质疏松症并发脆性骨折可使患者致残,严重危及患者生活质量[9]。尽管骨质疏松症已经是严重威胁老年人健康的疾病,但是如何诊断和评估骨质疏松症危害性却一直没有定论。国内外比较常用的是通过双能X线进行骨密度检测[10],但是最近研究认为它仅仅能检测受测部位的骨代谢,不能做全身骨质情况评估,更不能很好地预测患者骨折的风险,因此评估骨质疏松的风险往往需要综合个体情况及骨生化指标来完成[11]。骨转换指标(bone turnover markers,BTMs)虽然不是诊断骨质疏松的标准,临床效用有限,但是抗骨质疏松治疗后,可以通过骨转换指标全面评价人体骨的代谢情况,从而间接判断抗骨质疏松效果并预测骨折的风险,因此得到不少学者的高度重视[12]。
目前用于制作骨质疏松模型的动物很多,其中实验鼠因操作简单,成本低,实验要求差异性最少而成为最常用的模型动物。实验鼠模型制作方法很多,可行卵巢、睾丸、垂体切除,也可使用激素类药物达到骨丢失的目的,但最终仍是通过生化检查、骨形态计量学等方法监测和评价该动物模型在预防或治疗骨质疏松症的效果[13]。本研究中,我们仅通过切除成年雌性豚鼠的卵巢模拟妇女绝经后的状态,获得了去卵巢骨质疏松豚鼠模型,实验过程中各组豚鼠均保持平稳状态,没有出现豚鼠异常或死亡现象,显示本模型稳定性好,可重复操作。
成骨细胞(Osteoblast,OB)和破骨细胞(Osteoclast,OC)是骨代谢最重要的核心细胞,骨代谢的关键就是这两种细胞代谢变化的结果[14-15]。目前反映成骨细胞的标志物较多,如AKP、BGP、Ⅰ型前胶原羧基末端肽(PICP)等,其中AKP和BGP因拥有较好的生物稳定性、较低的个体差异性且检测方法简单成为评估成骨细胞活性的重要指标[16],PICP作为成骨代谢产物也是反映成骨细胞活性的重要指标,但是其结果易受干扰,如半衰期只有6~8 min[17],且在体内受不同时间变化而变化,研究发现PICP人体含量凌晨比中午高20%,Vasikaran S等研究认为PICP可能不仅仅来源于骨代谢,因此没有很好的特异性,一定程度上限制了其在实践中的运用[18]。TrACP是目前临床上判断成骨细胞和破骨细胞活性的重要生化标志物,也是骨质疏松症重要监测指标之一。体外实验证明,在骨吸收过程中,破骨细胞活跃,同时大量分泌TrACP,因此TrACP 水平可反映破骨细胞活性和骨吸收状态[19]。绝经期后的女性因内源性雌激素减少,骨重建失衡,骨吸收大于骨形成,会出现TrACP显著增加。在正常人血清中,TRACP 以两种基化形式存在:TRACP-5a 和TRACP-5b。其中TRACP-5b 主要由破骨细胞分泌,故测定血清中的TRACP-5b 活性,可以反映体内OC 活性和骨吸收状态。目前研究认为TRACP-5b 的活性直接反映了OC 在骨组织中的数量,是反映OC活性的特异性指标,目前已经成为第二代骨吸收生化标志[19]。
本实验中,我们观察了苦菜总黄酮对去卵巢豚鼠骨代谢的生化指标影响,实验结果发现,苦菜总黄酮可改善去卵巢豚鼠骨代谢有关的生化指标,可以提高AKP活性,降低肝组织TrACP-5b活性,说明其可以提高成骨细胞活性,抑制破骨细胞活性,达到改善骨代谢作用。结果提示苦菜总黄酮可通过调节骨代谢水平而改善绝经后妇女因体内雌激素缺乏所导致的骨质疏松症的可能,但其具体作用机制尚需进一步探讨。
总之,苦菜总黄酮对去卵巢成年动物的骨代谢失衡有改善作用,能够提高成骨细胞数量和功能,产生类雌激素对破骨细胞的抑制作用。通过对成骨细胞和破骨细胞的作用,在整体上对绝经后的高转换型骨质疏松症进行改善,降低骨折风险,这为进一步临床运用提供理论基础。另外苦菜总黄酮水溶性很好,利用度高,不良反应少,来源天然,价格便宜,因此具有较好的开发前景。
【参考文献】
[1]王帅,赵红丽,李潞,等. 绝经期后女性同型半胱氨酸、高敏C反应蛋白水平与冠状动脉病变及传统危险因素的关系[J]. 中国实验方剂学杂志,2013,19(6):301-304.
[2]孙玉芹,韩海玲,宋文刚,等. 绝经期前、后女性急性心肌梗死患者临床特点及危险因素[J].中国妇幼保健,2012, 27(19):2991-2993.
[3]刘仰斌,李启华,刘欣. 苦菜总黄酮对大鼠心肌缺血再灌注损伤的保护作用[J]. 郑州大学学报:医学版, 2010, 45(1):107-110.
[4]刘仰斌,刘欣,李启华,等. 苦菜水提取物对大鼠抗氧化作用的实验研究[J]. 宜春学院学报, 2010, 32(8): 50-51.
[5]刘仰斌,徐燕,陈学洪,等. 苦菜水提取物对力竭运动训练大鼠血脂和血液生化指标的实验研究[J].宜春学院学报, 2011, 33(4): 72-74.
[6]刘仰斌,徐燕,陈学洪,等. 苦菜提取物对大鼠实验性结肠炎肠组织的保护作用[J]. 湘南学院学报:医学版,2011,13(2):6-8.
[7]刘仰斌,张志花,周建荣,等.苦菜总黄酮对离体缺血再灌注损伤心肌生化指标的影响[J]. 齐齐哈尔医学院学报, 2014, 35(16): 2352-2354.
[8]刘仰斌,张志花,周建荣,等. 苦菜总黄酮对去卵巢豚鼠脂代谢影响的实验研究[J]. 中国妇幼保健,2013, 28(34): 5703-5706.
[9]张智海,刘忠厚,李娜. 中国人骨质疏松症诊断标准专家共识[J]. 中国骨质疏松杂志,2014, 20(9): 1007-1010.
[10] LORENTZON M,CUMMINGS SR.Osteoporosis:the evolution of a diagnosis[J].J Intern Med,2015,277(6):650-661.
[11] EDWARDS MH,DENNISON EM,SAYER AA,etal.Osteoporosis and Sarcopenia in Older Age[J].Bone,2015,14(15):129-130.
[12] 张萌萌. 中国老年学学会骨质疏松委员会骨代谢生化指标临床应用专家共识[J].中国骨质疏松杂志,2014, 20(11): 1263-1272.
[13] LELOVAS PP,XANTHOS TT,THOMA SE,etal.The Laboratory Rat as an Animal Model for Osteoporosis Research[J].Comp Med,2008,58:424-430.
[14] ALBERT JS,BHATTACHARYYA N,WOLFE LA,etal.Impaired osteoblast and osteoclast function characterize the osteoporosis of Snyder-Robinson syndrome[J].Orphanet J Rare Dis,2015,10(1):27.
[15] TANG P,XIONG Q,ZHANG L,etal.The role of microRNAs in osteoclasts and osteoporosis[J].RNA Biol,2014,11(11):1355-1363.
[16] BROWN JP,ALBERT C,NASSAR BA,etal.Bone turnover markers in the management of osteoporosis[J].Clin Biochem,2009,42:929-942.
[17] SEIBEL MJ.Biochemical markers of bone turnover:part 1:biochemistry and variability[J].Clin Biochem Rev,2005,26:97-122.
[18] VASIKARAN S,EASTELL R,BRUYRE O,etal.Markers of bone turnover for the IOF-IFCC Bone Marker Standards Working Group.Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment:a need for international reference standards[J].Osteoporos Int,2011,22:391-420.
[19] GILLIAN WHEATER,MOHSEN ELSHAHALY,STEPHEN P TUCK.The clinical utility of bone marker measurements in osteoporosis[J].J Transl Med,2013,11:201.
Effects of total flavonoids in the Sonchus oleraceus L.on biochemical index of bone metabolism in ovariectomized guinea pigs
LIU Yangbin,ZHANG Zhihua
School of Preclinical Medicine,Gannan Medical University,Ganzhou 341000,China
【Abstract】Objective:To observe the effect of the total flavonoids in the Sonchus oleraceus L.on bone metabolism in ovariectomized guinea pig.Methods:Thirty female guinea pigs were randomly divided into 5 groups,namely control group,ovariectomized model group,positive drug group,and difference dosage groups of total favonoids from Sonchus oleraceus L.(0.1 mg/kg or 0.3 mg/kg).One week following ovariectomy,the pigs were intragastrically administrated with saline,estradiol valerate or total favonoids from Sonchus oleraceus L.respectively,once a day for six weeks.Then all pigs were sacrificed,and the sera were obtained to detect the electrolytes,bone gla protein (BGP),calcitonin(CT),alkaline aphosphatase (AKP),and liver tissues were taken to observe the tartrate-resistant acid phosphatase (TrACP-5b).Bone length and mass index were also determined in all pigs.Results:Total favonoids from Sonchus oleraceus L.was capable of increasing the length index of the femur and tibia,improving the calcitonin content,and elevating serum AKP level and reducing liver TrACP-5b content.Conclusion:Total favonoids from Sonchus oleraceus L.can improve bone metabolism in ovariectomized pigs through regulating bone formation and resorption,which indicates that this agent can produce estrogen-like effect and be potential therapeutic results for postmenopausal osteoporosis.
【Key words】Sonchus oleraceus L.;total flavonoids;ovariectomy;guinea pig;bone metabolism
文章编号:1002-0217(2016)03-0210-04
基金项目:江酉省卫生厅科技计划课题(20122033)
收稿日期:2015-10-08
作者简介:刘仰斌(1970-),男,副教授,硕士,(电话)15979776628,(电子信箱)15979776628@163.com.
【文献标识码】【中图号】R 285.5A
