射干合剂的定性及定量质量控制标准研究
2016-07-22朱鹏程唐跃年
朱鹏程 吴 敏 唐跃年 林 鋆 赵 欣
射干合剂的定性及定量质量控制标准研究
朱鹏程1吴敏1唐跃年2林鋆3赵欣1
[Abstract]Objective To exp1ore new methods for improving the qua1ity standards of Shegan Mixture.Methods Shegan was qua1itative1y identified by TLC using Ch1oroform-Butanone-Methano1(3∶1∶1)as deve1oping so1vent on si1ica ge1 G p1ate,Qianhu was qua1itative1y identified by TLC using Ch1oroform-Methano1(8∶2)as deve1oping so1vent on si1ica ge1 G p1ate,Baibu was qua1itative1y identified by TLC using Methy1benzene-Trich1oromethane-Acetone-Methano1(3∶7∶2∶1)as deve1oping so1vent on si1ica ge1 G p1ate.Tectoridin in Shegan Mixture was quantified by HPLC with ODS-Ⅱco1umn (4.6 mm×250 mm,5 μm),f1ow ve1ocity was 1.0 mL/min.The moving phase was Acetonitri1e-G1acia1 acetic acid-Water (18∶1.37∶82)and determining wave 1ength was 266 nm.Results Shegan,Qianhu and Baibu were identified in Shegan Mixture.F1uorescent spots were c1ear and stab1e.HPLC method was stab1e and re1iab1e.The Tectoridin,s content in Shegan Mixture was 0.0982 mg/mL.Conclusion Those methods in this study can be used as addition of qua1ity contro1 standard of Shegan Mixture,which provide scientific basis to improve qua1ity and efficacy of Shegan Mixture.
[Key words]Shegan mixture;Qua1ity contro1;Qua1itative ana1ysis;Quantitative ana1ysis
射干合剂是新华医院的院内制剂,是著名儿科名家时毓民的经验方,由炙麻黄、射干、黄芩、前胡、杏仁、僵蚕、蔊菜、蝉蜕、炙百部组成,具有宣肺祛痰止咳、降气平喘的功效。常用于感冒、急性支气管炎及哮喘性支气管炎引起的咳喘、多痰等症状。多年临床应用,临床疗效确切[1]。目前其质量标准只采用TLC法鉴别了黄芩和麻黄两味药材,没有含量测定项目,质量标准控制标准有待提高。本研究旨在报道其制备工艺,并通过研究相关成分的薄层色谱和高效液相色谱的色谱条件,进一步完善其质量控制要求。
1 仪器及试剂
1.1仪器
高效液相色谱仪(Agi1ent LC1200,美国安捷伦科技有限公司);电子分析天平(Mett1er-To1edo XS,德国梅特勒公司);明澈TM-D24UV纯水系统(Merck Mi1-1ipore);超声波清洗器(UP600YHE,南京垒君达超声电子设备有限公司)。
1.2试药
射干合剂(本品,新华医院中药房,批号:20141224);射干、前胡、百部对照药材(新华医院中药房);射干苷(中国药品生物制品检定所,110715-200815,含量95.2%);射干合剂(上海静安制药有限公司,141224);甲醇(上海振兴化工厂一厂,AR,201309201);乙醇(AR);氯仿(AR);三氯甲烷(江苏强盛功能化学股份有限公司,AR,20110901);丁酮、丙酮(南京化学试剂有限公司,AR,080410235);三氯化铝(江苏强盛功能化学股份有限公司,AR,20101011);甲苯(上海振兴化工厂一厂,AR,201111202);水为自制高纯水。
2 方法与结果
2.1处方及其制备
以1000 mL量射干合剂制备工艺报道如下:
2.1.1处方
炙麻黄75 g、射干75 g、黄芩200 g、前胡150 g、杏仁75 g、僵蚕150 g、蔊菜300 g、蝉蜕75 g、炙百部150 g、蔗糖100 g、甜菊素5 g和苯甲酸1 g。
2.1.2制备工艺
麻黄加水浸泡1 h,煎煮两次,每次加10倍量水,第一次0.5 h,第二次1.5 h,合并煎液,滤过,浓缩至相对密度1.16,浓缩液备用。麻黄药渣与其余8味煎煮两次,第一次加10倍量水,煎煮1.5 h,第二次加8倍量水,煎煮40 min,合并煎液,过滤,浓缩滤液至相对密度1.08~1.10(80~85℃)。加2倍量乙醇搅匀沉降24 h,取上清,回收乙醇,减压浓缩至相对密度约为1.16(80~85℃)。加麻黄浓缩液共煮沸10 min,静置24 h,取上清过滤备用。取蔗糖加水煮沸制成糖液,加入甜菊素5 g和苯甲酸1 g,与上述药液合并,加水至总量1000 mL,搅拌均匀,过滤即得。
2.2射干、前胡和百部的薄层板鉴别
2.2.1射干的TLC鉴别
2.2.1.1供试液的制备取本品60 mL蒸干,加甲醇20 mL,超声处理30 min,过滤,滤液蒸干,残渣加甲醇1 mL使溶解作为供试液。
2.2.1.2对照液的制备 取射干对照药材5 g,加水50 mL煮沸30 min,过滤,滤液蒸干,残渣加甲醇20 mL,同法制得对照液。
2.2.1.3TLC操作参照薄层色谱法[2](《中国药典》2015年版一部附录ⅥB)。毛细定量管分别吸取供试液和对照液各2 μL条状上样,供试液从左向右上样5次,对照液右侧上样1次。薄层板选用硅胶G板,展开剂为氯仿-丁酮-甲醇 (3∶1∶1)。展开箱中预饱和30 min,上行展开8 cm。取出晾干,喷三氯化铝,置紫外灯(365 nm)下检视、拍照。本实验下射干供试液在紫外灯下TLC谱图中在与各自对照液谱图相应的位置上显相同的荧光斑点。见图1(封三)。
2.2.2前胡的TLC鉴别
2.2.2.1供试液的制备取本品35 mL蒸干,加乙醇10 mL,超声处理15 min,过滤,滤液蒸干,残渣加乙醇1 mL使溶解作为供试液。
2.2.2.2对照液的制备 取前胡对照药材2 g,加水50 mL煮沸30 min,过滤,滤液蒸干,残渣加乙醇10 mL,同法制得对照液。
2.2.2.3TLC操作参照薄层色谱法[2](《中国药典》2015年版一部附录ⅥB)。毛细定量管分别吸取供试液和对照液各5 μL点样,供试液从左向右上样5次,对照液右侧上样1次。薄层板选用硅胶G板,展开剂为氯仿-甲醇(8∶2)。展开箱中预饱和15 min,上行展开8 cm,置紫外灯(365 nm)下检视、拍照[3-4]。本实验下前胡供试液在紫外灯下TLC谱图中在与各自对照液谱图相应的位置上显相同的荧光斑点。见图2(封三)。
2.2.3百部的TLC鉴别
2.2.3.1供试液的制备 取本品20 mL蒸干,加80%乙醇30 mL加热回流1 h,过滤,滤液挥干乙醇,残留液加1%盐酸10 mL稀释,过滤,滤液用三氯甲烷提取2次,每次10 mL,合并三氯甲烷,蒸干,残渣加甲醇1 mL溶解,即得供试液[5]。
2.2.3.2对照液的制备 取百部对照药材2g,加水50mL煮沸30min,过滤,滤液蒸干,残渣加80%乙醇30 mL,同法制得对照液。
2.2.3.3TLC操作参照薄层色谱法[6](《中国药典》2015年版一部附录ⅥB)。毛细定量管分别吸取供试液和对照液各6 μL点样,供试液从左向右上样5次,对照液右侧上样1次。薄层板选用硅胶G板,展开剂为甲苯-三氯甲烷-丙酮-甲醇(3∶7∶2∶1)。展开箱中预饱和30 min,上行展开8 cm。晾干喷改良碘化铋钾试液显色,日光下检视,拍照。百部供试液日光下TLC谱图中在与各自对照液谱图相应的位置上显相同颜色的斑点。薄层色谱图见图3(封三)。
2.3射干合剂中射干苷的HPLC测定
2.3.1色谱条件
ODS-Ⅱ色谱柱(4.6 mm×250 mm,5 μm);流动相:乙腈-冰醋酸-水(18∶1.37∶82);检测波长:266 nm;流速:1.0 mL/min;进样量:20 μL,室温[7-8]。
2.3.2对照品溶液的制备
精密称量射干苷的对照品0.1 mg,用甲醇制成0.1 mg/mL的对照品母液,再用甲醇稀释为0.01 mg/mL的对照品溶液。
2.3.3供试品的制备
精密量取射干合剂1 mL,甲醇定容至10 mL,超声,离心,取上清液备用。
2.3.4检测波长的确定
用紫外分光光度计将射干苷对照品溶液在200~400 nm波长范围内扫描,结果表明其在274 nm波长处有最大紫外吸收,故选择274 nm作为射干苷的检测波长。
2.3.5系统适应性实验
按“2.3.1”项下色谱条件,分别精密吸取对照品溶液与供试品溶液各20 μL进样测定,记录色谱图。HPLC色谱图见图4~5。

图4 射干苷样品的HPLC色谱图
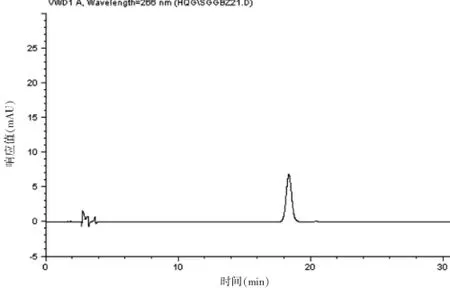
图5 射干苷对照品HPLC色谱图
2.3.6线性关系考察
精密吸取对照品溶液(0.023 mg/mL)2、4、8、16、24 μL按“2.3.1”项下色谱条件进样,以进样量(X)为横坐标,峰面积(Y)为纵坐标绘制标准曲线图,计算得回归方程:Y=4349.7X+23.662,r=0.999。表明射干苷在0.0208~0.2496 μg范围内具有良好的线性关系。
2.3.7空白干扰试验
取除射干外处方中中药饮片,按处方制备成阴性对照糖浆剂,按“2.3.1”项下色谱条件进样分析,阴性对照色谱图中在射干苷的保留时间位置上无峰出现,表明阴性对照溶液在本色谱条件下无干扰。射干合剂射干阴性对照品HPLC色谱图见图6。

图6 射干合剂射干阴性对照品HPLC色谱图
2.3.8精密度试验
精密吸取射干合剂对照品溶液(0.0104 mg/mL),重复进样5次,进样量10 μL,计算射干苷峰面积的相对标准偏差(RSD)=1.10%(n=5),表明精密度良好。
2.3.9稳定性试验
精密吸取对照品溶液20 μL,于制备后0、2、4、6、8、12 h分别进样测定。计算射干苷峰面积RSD= 1.1%,表明供试品稳定性良好。
2.3.10重现性试验
精密量取射干合剂1 mL(批号:141224),共6份,制备供试品溶液,在本色谱条件下进样测定,测得样品中射干苷含量为0.0985 mg/mL,RSD=0.88%,表明方法重现性良好。
2.3.11加样回收率试验
精密称取已知射干苷含量的射干合剂1 mL(批号:141224),精密加入不同量的射干苷对照品,制备6份供试品溶液,按“2.3.1”项下色谱条件进行测定,计算射干苷的含量。结果见表2。

表2 加样回收率实验结果(n=6)
2.3.12样品含量测定
精密吸取供试品溶液各20 μL,按本色谱条件测定射干苷含量,结果表明射干合剂中射干苷平均含量为0.0982 mg/mL。
3 讨论
射干合剂是新华医院院内制剂,化裁于《金匮要略》中射干麻黄汤,组方包括射干、麻黄、前胡、黄芩、杏仁、江剪刀草、百部等中药。治疗感冒咳嗽、急性支气管炎及哮喘性支气管炎疗效确切。但目前其质控标准中仅关注麻黄和黄芩两味药物的定性或定量研究[9]。射干麻黄汤中,麻黄与射干共同作为君药[10],射干功善清热化痰,可治痰热壅肺,与麻黄、黄芩合用,有止咳化痰平喘之功效,临床应用效果良好。前胡降气化痰,白前润肺下气止咳,对于新咳久咳均有疗效[11],因此对射干、前胡、白前三药严格的质量控制是射干合剂发挥良好临床疗效的重要保障。
本研究采用薄层色谱法对射干合剂中射干、前胡、白前的成分与各生药饮片进行了初步鉴别对比,结果显示本试验中的薄层色谱条件下射干合剂中均检出了射干、前胡、白前的相应成分,本试验条件可以作为射干合剂中射干、前胡、白前定性鉴别的质量控制方法。
射干是常用中药,其生药是鸢尾科植物射干,主要产自于湖北、河南、江苏、安徽等地,近几版《中国药典》均有收载。射干味苦性寒,入肝、肺经。具有清热解毒、利咽、消痰之功效[12]。主治咽喉肿痛、痰盛咳喘的方剂中多以射干为君药,有很好的疗效。现代研究发现射干含有丰富的异黄酮类化合物[13-14],具有明显的抗炎、抗病毒作用。其主要成分在体外也有抗透明质酸酶的作用[15],对透明质酸酶所致大鼠足浮肿有明显抑制作用。射干苷为其主要成分之一,可用作射干合剂的质量控制指标。
射干苷又名鸢尾苷[16],具有一定的抗炎、抗氧化[17]、抑菌[18-19]、抗病毒[20]的作用,对本研究还采用HPLC法测定了射干合剂中射干苷的含量,初步建立起了测定射干合剂中射干苷的HPLC方法和条件,方法学实验表明本方法和条件稳定可靠,可以作为射干合剂中测定射干苷的质量标准。
综上所述,本研究方法可以作为射干合剂质控标准的补充,对于保障射干合剂质量安全和疗效具有意义。
[1]阎秀菊,吴敏,马碧涛,等.射干合剂治疗咳嗽的疗效观察[J].国际中医中药杂志,2014,36(4):347-349.
[2]田成旺,郭建华,张科,等.射黄含片的质量标准研究[J].中成药,2013,2(35):302-306.
[3]周燕.前胡及其混淆品石防风的鉴别[J].中国药业,2008,17(14):62-63.
[4]宋吉莲,邢晔忠.介绍一种前胡薄层色谱鉴别方法[J].时珍国医国药,2000,11(2):143.
[5]孙妍,马佳慧,王猛.小儿清肺分散片的薄层鉴别研究[J].黑龙江中医药,2014,43(3):46.
[6]国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2015:57-59.
[7]蔡鹰,丁安伟.射干药材HPLC指纹图谱研究[J].中国药房,2008,19(18):1398-1400.
[8]冯华,石尚友,聂明华,等.土知母药材中射干苷定性与定量分析研究[J].世界科学技术-中医药现代化,2014,(1):78-87.
[9]唐跃年,金木梁,张青.HPLC法测定射干合剂中多指标成分的含量[J].中国临床药学杂志,2010,19(4):233-236.
[10]邓中甲.方剂学[M].北京:中国中医药出版社,2012:39-40.
[11]高学敏.中药学[M].北京:中国中医药出版社,2012:353,360.
[12]钟鸣,关旭俊,黄炳生,等.中药射干现代研究进展[J].中药材,2001,24(12),904-907.
[13]张杰,曾铖,常义生,等.射干化学成分研究[J].安徽农业科学,2015,43(24):57-59.
[14]杨万军,张伟东,王莹,等.射干麻黄配伍对射干异黄酮类成分在大鼠体内药代动力学的影响[J].中成药,2012,34(11):2094-2099.
[15]刘超,孙培冬,章姝敏.鸢尾苷的提取分离及其对透明质酸酶活性的影响[J].应用化工,2012,41(1):133-136.
[16]李强,夏晓晖.新编常用中药有效成分手册[M].北京:中国协和医科大学出版社,2008:472.
[17]段丽红,李仲秋,吴正治,等.鸢尾苷抗氧化活性的研究[J].天然产物研究与开发,2014,26:2046-2049,2081.
[18]秦文艳,赵金明,齐越,等.射干提取物体内体外抑菌作用的研究[J].中国实验方剂学杂志2011,4(17):147-150.
[19]张宏,甘雨,乔敏,等.射干提取物抑菌实验研究[J].实验动物科学,2012,29(2):5-7.
[20]徐倩.射干不同有效成分体外抗病毒药效学作用分析[J].亚太传统医药,2015,11(18):9-10.
1.上海交通大学医学院附属新华医院中医科,上海200092;2.上海交通大学医学院附属新华医院药剂科,上海200092;3.上海静安制药有限公司上海 200120
目的研究完善射干合剂的质量标准。 方法以氯仿-丁酮-甲醇(3∶1∶1)为展开剂在硅胶G板上定性鉴别射干合剂中射干成分,以氯仿-甲醇(8∶2)为展开剂再硅胶G板上定性鉴别射干合剂中前胡成分,以甲苯-三氯甲烷-丙酮-甲醇(3∶7∶2∶1)为展开剂在硅胶G板上定性鉴别射干合剂中百部成分;建立HPLC法,采用ODS-Ⅱ色谱柱(4.6 mm×250 mm,5 μm),以乙腈-冰醋酸-水(18∶1.37∶82)为流动相,检测波长266 nm,流速1.0 mL/min,进样量20 μL,测定射干合剂中射干苷的含量。结果射干合剂中均检出了射干、前胡、白前的相应成分,斑点或荧光清晰稳定。此HPLC法稳定可靠,射干合剂中射干苷的平均含量为0.0982 mg/mL。结论本研究使用的方法条件可以作为射干合剂指控标准的补充,为提高射干合剂质量和疗效提供科学依据。
射干合剂;质量控制;定性;定量
R927
A
1673-7210(2016)04(c)-0020-05
Qualitative and quantitative quality control study of Shegan Mixture
ZHU Pengcheng1WU Min1TANG Yaonian2LIN Jun3ZHAO Xin1
1.Department of TCM,Xinhua Hospita1 Affi1iated to Medicine Schoo1 of Shanghai Jiaotong University,ShangHai200092,China;2.Department of Pharmacy,Xinhua Hospita1 Affi1iated to Medicine Schoo1 of Shanghai Jiaotong University,ShangHai200092,China;3.Shanghai Jing'an Pharmaceutica1 Co.LTD,ShangHai200120,China
上海市科学技术委员会科研计划项目课题(134 01902700)。
朱鹏程 (1990.11-),男,上海交通大学医学院2014级中西医结合临床专业在读硕士研究生,主要从事中西医结合防治小儿呼吸系统及神经系统类疾病的研究。
吴敏(1960.3-),女,硕士,博士生导师,上海交通大学医学院附属新华医院中医科主任,主任医师,主要从事中西医结合防治小儿呼吸系统及神经系统类疾病的研究。
2016-01-22本文编辑:赵鲁枫)
