富血小板血浆制备方法稳定性的研究
2016-07-22潘红娟王雅丽刘铁梅
潘红娟,王雅丽,吕 爽,刘铁梅
(吉林大学中日联谊医院 输血科,吉林 长春130033)
富血小板血浆制备方法稳定性的研究
潘红娟,王雅丽,吕爽,刘铁梅*
(吉林大学中日联谊医院 输血科,吉林 长春130033)
富血小板血浆(platelet rich plasma,PRP)含有超过生理浓度数倍的血小板,作为一种自体血来源的产品,因获取过程创伤较小、制备简便及具有生物学治疗潜能等方面的优点,被广泛用于组织再生、创面修复、感染治疗和功能重建等领域[1,2]。但目前实验及临床大都使用自体血液提取生长因子,这无疑会对患者机体形成二次创伤[3],为了用尽可能少的血液制备出血小板含量较高且能满足临床需要量的PRP,本文将对PRP的制备方法提供新的参考。
1材料与方法
1.1实验标本
取15例健康成年男性自愿者的外周血各40 ml,年龄 18-50岁,平均34岁。其纳入标准为 :①血红蛋白>120 g/L,血小板>100×109/L。②采血前5 d 内未服用影响血小板功能和凝血系统的药物。③无传染性疾病、相关血液疾病、严重心血管疾病及感染等。所有自愿者知情并同意采血用于本实验。
1.2主要试剂与仪器
一次性采血袋(天津金耀氨基酸有限公司),50 ml无菌离心管(Thermo scientific公司),20 ml一次性注射器(山东新华安得医疗用品有限公司),9#腰椎穿刺针(苏州伟康医疗器械有限公司),一次性塑料管(江苏康健医疗用品有限公司);TDZ5-WS 台式低俗离心机(湖南赫西仪器装备有限公司),苏净安泰超净工作台(北京华威兴业科技有限公司),BC-6800 全自动血液分析仪(上海同舸医疗器械有限公司)。
1.3PRP 制备方法
1.3.1制备PRP
将200 ml一次性采血袋中的CPD-A抗凝剂除去22 ml,使其剩余6 ml;用装有 5 ml抗凝剂的 一次性采血袋于每例志愿者肘前静脉采血40 ml。摇匀后,取2 ml 抗凝血作全血细胞分析,3 ml用于细菌培养,40 ml 注入 50 ml无菌离心管中,剩余的1 ml血液弃掉,于常温下制备 PRP。根据血液中各组分的沉降系数不同,以660 g/min 离心10 min 后,全血分为 3 层,上层为上清液,下层为红细胞,两层交界处一浅黄色层即 PRP 层。用20 ml 注射器吸取下层红细胞,约剩余红细胞层(1±0.3) ml。将剩余血液以相同条件离心后,可见在底部红细胞表面有白膜样物质,即为血小板和白细胞沉积层 ;其上部为透明的血浆层。再次以20 ml 注射器吸取上层大部分乏血小板血浆,保留离心管中约 (6±0.2) ml 血浆。静置15 min后轻摇离心管约 5 min,使血小板充分重悬于剩余血浆中,即得到 PRP。上述除采血外,其他操作均在无菌室及超净工作台进行。
1.3.2血细胞分析
分别将2 ml 抗凝静脉血和制备的 PRP 采用全自动血液分析仪进行血常规分析,测定血小板及白细胞浓度。
1.3.3细菌培养
对3 ml抗凝血及制备的PRP进行细菌培养,一周后记录结果,整个过程均在无菌条件下进行。
1.4统计学方法
采用 SPSS17.0 统计软件进行分析。数据以均数±标准差表示,对全血和 PRP 中血小板及白细胞浓度比较采用配对t检验,并对全血和 PRP 中血小板及白细胞浓度、PRP 中血小板和白细胞的回收率及富集系数采用 Pearson 检验进行相关分析。
2结果
2.1血细胞分析
经对全血及PRP中的血小板、白细胞的测定结果如图1、图2所示:由图可以看出PRP中血小板及白细胞与全血中血小板及白细胞呈正相关趋势,分析相关系数血小板计数r=0.938(P<0.01),白细胞计数r=0.884(P<0.01)均呈显著的正相关。

图1 全血及PRP中的血小板计数

图2 全血及PRP中的白细胞计数
经计算得,全血和PRP中血小板浓度分别为(183.97±33.48)×109/L及(1009.91±219.43)×109/L,比较差异有统计学意义(t=16.981,P<0.01)。全 血和 PRP 中 白 细 胞 浓 度 分 别 为(6.22±1.48)×109/L和(19.31±7.40)×109/L,比较差异有统计学意义(t=8.272,P<0.01)。PRP 中血小板和白细胞浓度的变异系数分别为 21.73% 和38.32%(表1)。

表1 全血和PRP中血小板及白细胞计数的比较
计算 PRP 中血小板、白细胞的回收率和富集系数,富集系数=PRP 中血小板或白细胞浓度/全血中血小板或白细胞浓度,回收率 =PRP 中血小板或白细胞总数/全血中血小板或白细胞总数×100%。计算得PRP中血小板的富集系数为5.46±0.45,回收率为84.37±4.32;白细胞的富集系数为3.02±0.71,回收率为46.90±11.37。并且PRP 中白细胞的回收率和富集系数间显著相关(r=0.947,P<0.01),而PRP中血小板的回收率和富集系数间相关性较差(r=0.502,P>0.05),见表2。
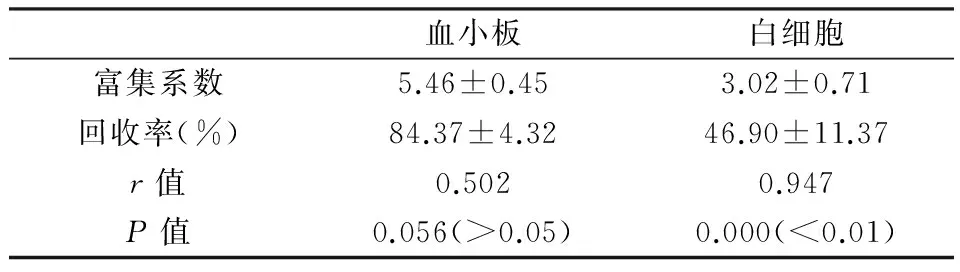
表2 PRP中血小板和白细胞富集系数及回收率的比较
2.2全血和PRP的细菌培养结果
细菌培养1周,所用培养结果均为阴性。
3讨论
自上世纪90年代富血小板血浆技术问世以来,富血小板血浆逐渐成为组织工程领域尤其是骨创伤缺损修复方面的研究热点[4],并在临床中的应用越来越广泛,同时也出现了多种富血小板血浆的制备方法。经典的制备方法有(1)Anitua[5]法 :160 g离心6 min一次离心法,(2)Landersberg[6]法: 两次均为200 g离心10 min的二次离心法;(3)Aghaloo[7]法:分两次离心,第一次215 g离心10 min,第2次863 g离心10 min等;李明等[8]指出当离心血量较大时,这些方法制备的PRP的血小板浓度并不理想,较大的血量需要较大的离心管直径及较高的离心力。对于PRP中血小板的有效浓度,Giusti等[9]发现人肌腱细胞培养中血小板浓度在(500-1000)×109/L之间刺激细胞的增殖、迁移及胶原合成的作用最为显著,当血小板浓度为2 000×109/L和3 000×109/L时,PRP的促细胞增殖作用明显减弱。同样Graziani等[10]体外研究发现,PRP制剂对成纤维细胞和成骨细胞的促增殖作用具有剂量依赖性;当血小板计数为(800-1000)×109/L之间时能够达到更好的促增殖作用。本实验采血量为40 ml,加入6 ml抗凝剂,其抗凝剂与全血的比例为1∶6.7,其血液被稀释而使全血及PRP中血小板、白细胞计数均偏低。本实验中血小板的富集系数与回收率的相关系数r=0.502,并不显著性相关(P>0.05),可能是由于制备的PRP较多(1∶6.7)导致PRP的富集系数相对较低而回收率较高造成的。但PRP中血小板浓度(1009.91±219.43)×109/L、富集系数(5.46±0.45)及PRP的量尚可满足临床需要。此实验采用二次离心法,两次均为660 g离心10 min,避免了离心力过大离心时间过长导致血小板活化及生长因子的过早释放。
白细胞中含有中性粒细胞,单核细胞和淋巴细胞,在机体的宿主防御中发挥着重要作用。中性粒细胞被病原体,毒素等激活后,生成具有高度杀菌活性的次氯酸和其它的活性氧衍生物,及其胞内的多种水解酶对病原体或异物具有消化作用;并且单核细胞的吞噬作用及淋巴细胞的免疫功能均对机体具有保护作用[11]。目前对于PRP中白细胞的含量及有无并没有明确的要求。Wasterlain等[12]表示理想的骨科PRP制备应该有高比率的血小板和白细胞,从而合成代谢大于分解代谢,以利于骨折的愈合。但也有报道称富白细胞PRP用于治疗跟腱炎可能会增加患者的局部疼痛[13]。本实验PRP中白细胞的浓度为(19.31±7.40)×109/L,富集系数为3.02±0.71,其在各种临床疾病中的作用还有待进一步的试验与研究。
本实验的优缺点分析(1)第1次离心后采用去除红细胞,第2次离心后去除上层的P-PRP的方法,减少了多次抽吸血小板及转移试管对血小板的刺激,从理论上降低了血小板的活化;(2)由于不同疾病、不同性别患者的红细胞压积的不同,第1次离心后去除红细胞的体积并不相同,本实验用20 ml的离心管吸取红细胞,最终使管底剩余约(1±0.3)ml的红细胞,保证了每次制备的PRP中血小板的数量及PRP的有效体积,并减少沉降在红细胞层的血小板的丢失,但同时使PRP中红细胞的量增加。(3)本实验为了尽可能的减少对患者的二次伤害,全血中加入抗凝剂的体积相对较大且制备的PRP的量也较大,这使得全血及PRP中血小板及白细胞的浓度均偏低。
参考文献:
[1]Dhillon MS,Behera P,Patel S,et al.Orthobiologics and platelet rich plasma[J].Indian J Orthop,2014,48(1):1.
[2]付维力,李棋,李箭.富血小板血浆制备技术及其组分的研究进展[J].中国修复重建外科杂志,2014,28(12):1560.
[3]吕敏.同种异体富血小板血浆标准化制备的研究[D].西安:第四军医大学,2013:1-67.
[4]康健,袁文.富血小板凝胶制备方法的比较与优选[J].中国组织工程研究,2014,18(3):476.
[5]Anitua E.Plasma rich in growth factors:preliminary results of use in the preparation of future sites for implants[J].Int J Oral Maxillofac Implants,1999,14:529.
[6]Landesberg R,Roy M,Glickman RS,et al.Quantification of Growth Factor Levels Using a Simplifed Method of Platelet-Rich Plasma Gel Preparation[J].J Oral Maxillofac Surg,2000,58:297.
[7]Aghaloo TL,Moy PK,Freymiller EG.Investigation of platelet-rich plasma in rabibitcranial defects:A pilot study[J].J Oral Maxillofac Surg,2002,60(10):1176.
[8]李明,张长青,袁霆,等.富血小板血浆制备套装的评估研究[J].中国修复重建外科杂志,2011,25(1):112.
[9]Giusti I,D’ Ascenzo S,Mancò A,et al.Platelet concentration in platelet-rich plasma affects tenocyte behavior in vitro[J].BioMed research international,2014.
[10]Graziani F,Ivanovski S,Cei S,et al.The in vitro effect of different PRP concentrations on osteoblasts and fibroblasts[J].Clinical oral implants research,2006,17(2):212.
[11]叶露露,单桂秋,马静,等.富血小板血浆抑菌作用的研究进展[J].中国输血杂志,2014,27(2):216.
[12]Wasterlain AS,Braun HJ,Dragoo JL.Contents and formulations of platelet-rich plasma[J].Operative Techniques in Orthopaedics,2012,22(1):33.
[13]Young A,McNaught CE.The physiology of wound healing[J].Surgery(Oxford),2011,29(10):475.
基金项目:吉林省卫计委项目(20152004)
*通讯作者
文章编号:1007-4287(2016)06-1008-03
作者简介:刘铁梅(1965-).女,博士,教授、主任医师,输血科主任,主要从事临床输血工作。
(收稿日期:2015-06-28)
