右美托咪定可能通过抑制TLR4通路对LPS诱导的脓毒症小鼠急性肺损伤起保护作用
2016-07-22刘海萍王东伟高骞皓晋学飞
刘海萍,郭 红*, 王东伟,高骞皓, 晋学飞
(1.佳木斯大学附属第一医院 麻醉科, 黑龙江 佳木斯154002;2.吉林大学中日联谊医院 泌尿外科, 吉林 长春130033)
右美托咪定可能通过抑制TLR4通路对LPS诱导的脓毒症小鼠急性肺损伤起保护作用
刘海萍1,郭红1*, 王东伟1,高骞皓1, 晋学飞2
(1.佳木斯大学附属第一医院 麻醉科, 黑龙江 佳木斯154002;2.吉林大学中日联谊医院 泌尿外科, 吉林 长春130033)
摘要:目的研究右美托咪定(Dex)对脂多糖(LPS)诱导的脓毒症(Sep)小鼠急性肺损伤(ALI)起保护作用的分子机制。方法将100只清洁级成年雄性BALB/c小鼠随机平均分为高浓度右美托咪定组(A组)、低浓度右美托咪定组(B组)、脓毒症组(C组)和空白对照组(D组)。A、B两组小鼠分别于建模前30 min经腹腔注射Dex 12.5 μg/kg和25 μg/kg ,A、B、C三组小鼠均用腹腔内注射LPS建立ALI模型,建模后0、12 h用Western blot法检测各组小鼠肺组织中TLR-4水平,用酶联免疫吸附法(ELISA)检测各组小鼠肺组织中MyD88、NF-κB和IL-6水平,并检测肺组织湿/干质量比(W/D)。结果建模后,A、B、C三组小鼠肺组织中MyD88、NF-κB和IL-6水平均随时间延长而提高,且均显著高于D组(P<0.05)。各个时间点A、B、C三组MyD88、NF-κB和IL-6水平存在显著差异,C组显著高于A组(P<0.05),A组显著高于B组(P<0.05)。结论TLR-4信号通路可能参与了脓毒症大鼠肺损伤过程,Dex可能通过抑制TLR-4通路来实现脓毒症大鼠的肺保护作用。
关键词:右美托咪定; 肺; 脓毒症; 炎症反应
(ChinJLabDiagn,2016,20:0887)
脓毒症(Sepsis)是机体对于感染所形成的超强的炎症反应,常发生于大手术术后、休克、烧伤等患者,其病死率较高[1]。肺组织在脓毒症中极易受损,形成急性肺损伤(Acute lung injury,ALI),患者出现呼吸窘迫,血氧进行性下降,是造成脓毒症患者死亡的主要原因。目前研究发现Toll样受体-4(TLR-4)信号传导通路在ALI中起到重要作用[2],通过阻断或抑制TLR-4信号传导通路成为预防和治疗ALI的新方向。右美托咪定(dexmedetomidine,Dex)是α2受体激动剂,且具有较高的选择性,临床上主要用于对手术患者围术期的镇静和镇痛。新近研究发现Dex具有器官保护作用[3],但机制尚不明了。此次研究拟通过观察Dex对ALI小鼠模型非组织中TLR4的影响,探讨Dex对ALI患者肺保护的机制。
1材料与方法
1.1实验动物与试剂由佳木斯大学实验动物中心[合格证号:scxk(黑)2013-001]提供的清洁级BALB/c雄性小鼠100只,体重20-24 g。盐酸右美托咪定注射液(Dex)购自江苏恩华药业股份有限公司;脂多糖(LPS)购自哈药集团三精加滨药业有限公司,来自于灵杆菌;Toll样受体4(TLR-4)、髓样分化因子88(MyD88)、核因子κB (NF-κB)和白细胞介素-6(IL-6)ELISA试剂盒均购自美国Abcam公司。采用随机数表法将100只小鼠分为4组:高浓度右美托咪定组(A组)、低浓度右美托咪定组(B组)、脓毒症组(C组)和空白对照组(D组),每组各25只。所有小鼠建模前均禁食12 h,饮水不限制。
1.2方法
1.2.1模型建立A、B组小鼠建模前30 min,经腹腔注入Dex 12.5 μg/kg和25 μg/kg。30 min后,将A、B、C三组小鼠经腹腔注射LPS,浓度为20 mg/kg,D组小鼠经腹腔注射生理盐水0.2 ml。建模小鼠出现呼吸细速、抱团取暖、口唇发绀、抓取时无力反抗等状态,表示建模成功。每组分别于建模后0、2、6、12小时,采用随机数表法选取5只小鼠断颈处死取右肺。将右肺上叶和中叶在生理盐水中制成组织匀浆,5 000 r/min离心20 min,取上层清液置于-80℃冰箱中保存。将建模后12 h处死的小鼠右肺下叶取出后立刻用电子天平称重,记为湿重,后置于70℃烘干箱中烘干72 h。
1.2.2观察指标将冻存的小鼠肺组织用1 ml裂解液裂解,4℃恒温,8 000r/min离心20 min,取上层清液0.5 ml,应用Western blot法检测TLR-4水平。TLR-4蛋白定量后,用10%浓度的聚丙烯胺凝胶对目标蛋白进行凝胶电泳,此次电泳选用β-actin为内参。电泳结束后,将凝胶转膜、封闭、加入一抗,在4℃环境中孵育12 h后加入二抗,37℃恒温孵育2 h后加入显色液显色,避光脱色至条带出现,终止显色。应用Quantity One软件对条带光密度值进行定量测定。此次研究以TLR-4/β-actin比值作为TLR-4的相对表达水平。用酶联免疫吸附法(ELISA)检测肺组织上清液中MyD88、NF-κB和IL-6水平。所有操作均严格按照相应说明书进行操作。将建模后12 h处死的小鼠右肺下叶标本烘干后再次用电子天平测量重量,记为干重,据此计算干湿比(W/D)。
1.2.3统计学方法所有数据均应用SPSS 14.0软件进行统计分析,计量资料均数比较采用单因素方差分析;组间比较采用LSD-t检验进行两两比较。P<0.05为差异具有统计学意义。
2结果
2.1各组肺组织中TLR-4表达情况建模后(0 h),四组小鼠肺组织中TLR-4水平无明显差异(P>0.05);建模12 h后,A、B、C三组小鼠肺组织中TLR-4水平显著升高,C组显著高于A、B、D组(P<0.05),A组显著高于B组(P<0.05)。见图1、2。
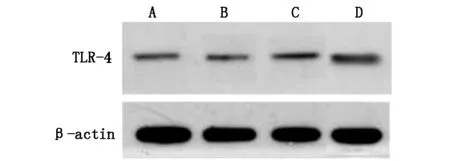
图1 建模后0 h
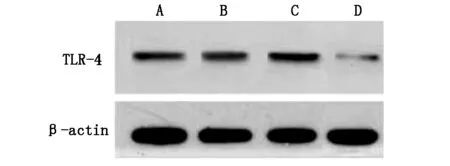
图2 建模12 h后
2.2各组肺组织中MyD88和NF-κB表达情况建模成功后(0 h),四组小鼠肺组织中MyD88和NF-κB水平无显著差异(P<0.05),建模2 h至12 h,A、B、C三组小鼠肺组织中MyD88和NF-κB水平均逐渐升高,且均显著高于D组(P<0.05),但组间存在显著差异(P<0.05),C组显著高于A组,A组显著高于B组。见表1。

表1 各组肺组织中MyD88和NF-κB表达情况
2.3各组肺组织中IL-6表达情况建模成功后(0 h),四组小鼠肺组织中IL-6水平无显著差异(P<0.05),建模2 h至12 h,A、B、C三组小鼠肺组织中IL-6水平均逐渐升高,且均显著高于D组(P<0.05),但组间存在显著差异(P<0.05),C组显著高于A组,A组显著高于B组。见表2。

表2 各组肺组织中IL-6表达情况(pg/ml)
2.4建模12 h各组小鼠肺组织W/D情况建模12 h后,D组小鼠W/D为(4.3±0.5),A组小鼠W/D为(4.8±0.9),B组小鼠W/D为(4.5±0.8),C组小鼠W/D为(6.7±1.2),C组显著高于另外三组(P<0.05)。
3讨论
脓毒症导致急性肺损伤的病理生理基础是大量炎症因子的释放,导致肺泡上皮细胞和毛细血管内皮细胞的损伤,致使肺组织严重水肿,氧合作用下降,血氧急性进行性降低,故抑制炎症反应,治疗急性肺损伤是降低脓毒症病死率的重要一环[4-6]。
龚小卫等人在研究中发现,脂多糖(LPS)注入小鼠腹腔后,LPS结合蛋白与之结合,继而激活Toll样受体4(TLR4)信号通路[7]。TLR-4是TLR家族跨膜受体蛋白的一员,是机体内非特异性免疫过程中重要的蛋白之一。目前研究发现,TLR-4主要在巨噬细胞、中性粒细胞等免疫细胞表面[8]。当外源性LPS突破机体物理屏障后,TLR-4识别LPS,并与之结合,进而释放大量炎性因子,这些炎性因子通过刺激中性粒细胞产生大量的活性氧簇,造成肺组织毛细血管内皮细胞的损伤,形成肺水肿,于健认为这可能是形成ALI的原因之一[9]。石计朋在一项动物实验中发现,ALI大鼠肺组织中IL-6和TNF-α水平显著升高[10]。而IL-6和TNF-α是ALI中启动炎症级联反应的起始因子。有研究证实[11,12],TLR-4可以通过激活MyD88非依赖型TRIL信号通路,激活TRL-4胞内尾状结构,使之与MyD88蛋白分子结构中的TLR受体结构域相结合,从而实现刺激信号的传导,启动蛋白酶级联反应。杨晶的研究结果发现,这个过程中,NF-κB结构中的IκB被磷酸化,并从NF-κB中解离,实现NF-κB的激活,从而促进致炎因子的大量释放[13]。
此次研究发现,Sep模型建立2 h后,A、B、C三组小鼠肺组织中TLR-4、MyD88、NF-κB和IL-6水平均显著升高,且显著高于D组;随着时间的延长,A、B、C三组TLR-4、MyD88、NF-κB和IL-6水平逐渐升高,这与蒋海弦的研究结果相似,提示TLR4通路可能参与了ALI的形成[14]。此次研究结果还发现,A、B两组小鼠肺组织中TLR-4、MyD88、NF-κB和IL-6水平在除建模0 h外各个时间点均显著低于C组,且B组显著低于A组。Dex在临床中主要用于围术期患者的镇静、镇痛,并可以通过激活突触前α2受体来抑制交感神经产生冲动,且对呼吸作用影响较小。近年来有研究发现右美托咪定具有抗炎作用,在脓毒症小鼠模型中可以保护肝、肺等器官[15]。此次研究结果证实,Dex对Sep小鼠有较明显的抗炎、减轻炎症导致的肺损伤的作用,且抗炎效果与浓度有关,25 μg/kg浓度的抗炎效果显著优于12.5 μg/kg浓度。这提示Dex可能抑制了Sep小鼠肺组织中TLR-4的表达,从而降低了MyD88和NF-κB的合成,同时下调了炎症肺组织中炎症因子的水平。
综上,TLR-4信号通路可能参与了脓毒症大鼠肺损伤过程,Dex可能通过抑制TLR-4通路来实现脓毒症大鼠的肺保护作用。
参考文献:
[1]姚咏明,盛志勇,林洪远,等.脓毒症定义及诊断的新认识[J].中国危重病急救医学,2004,16(6):321.
[2]齐眀禄,杨敬平,银雪,等.外周血中TLR4、TIRAP表达与脓毒症相关性研究[J].临床肺科杂志,2015,1:19.
[3]冷亚书,李龙云,胡宇博,等.右美托咪定在围术期镇痛作用的研究进展[J].中国实验诊断学,2014,9:1565.
[4]李丽娟,陈炜,古旭云,等.血浆PCT和CRP水平的动态变化对脓毒症严重程度的评估及其相关性研究[J].中国实验诊断学,2013,17(6):1010.
[5]张立华,张铁麟,杜金,等.姜黄素对脓毒症肺损伤患者血清NT-pro-BNP、IL-6、IL-10及肺功能影响研究[J].中国生化药物杂志,2015,7:89.
[6]林名瑞.脓毒症相关性肺损伤治疗进展[J].中国急救医学,2013,33(5):391.
[7]龚小卫,姜勇.TLR4在哺乳动物对脂多糖反应中的作用[J].生物化学与生物物理进展,2001,28(3):300.
[8]Guillot L,Medjane S,Le Barillec K,et al.Response of human pulmonary epithelial cells to lipopolysaccharide involves Toll-like receptor 4 (TLR4)-dependent signaling pathways: evidence for an intracellular compartmentalization of TLR4[J].The Journal of biological chemistry,2004,279(4):2712.
[9]于健,李睿,姚文瑜,等.右美托咪啶预处理对下肢缺血再灌注致肺损伤的保护作用[J].中华医学杂志,2014,44:3510.
[10]石计朋,黄丽密,钱燕,等.脂肪乳剂对脂多糖诱导的急性肺损伤中细胞因子IL-1β和IL-6的影响[J].临床儿科杂志,2014,3:250.
[11]杨国柱,周寅,吕兆瑛,等.TLR4通路关键蛋白MyD88在坏死性小肠结肠炎发病过程中的作用机制研究[J].中华小儿外科杂志,2015,36(2):113.
[12]Uto T,Akagi T,Yoshinaga K,et al.The induction of innate and adaptive immunity by biodegradable poly(gamma-glutamic acid) nanoparticles via a TLR4 and MyD88 signaling pathway.[J].Biomaterials,2011,32(22):5206.
[13]杨晶,李元建,胡长平,等.缺血预适应通过抑制TLR4/NF-KB信号通路保护大鼠心肌缺血再灌注损伤[J].中南大学学报(医学版),2011,36(10):972.
[14]蒋海弦,李天舒,顾国宝,等.外周血单核细胞TLR2、TLR4与急性胰腺炎肺损伤的关系[J].中国实验诊断学,2013,17(5):902.
[15]徐颖臻,王耀岐,宁巧庆,等.右美托咪定通过抑制JAK2/STAT3通路改善脂多糖诱导的小鼠急性肺损伤[J].临床麻醉学杂志,2015,31(11):1105.
*通讯作者
文章编号:1007-4287(2016)06-0887-04
中图分类号:R614
文献标识码:A
(收稿日期:2015-11-27)
Dexmedetomidine may inhibit the TLR4 pathway play a protective effect on the acute lung injury in sepsis mice induced by LPS
LIUHai-ping,GUOHong,WANGDong-wei,etal.
(DepartmentofAnesthesiology,theFirstAffiliatedHospitalofJiamusiUniversity,Jiamusi154002,China)
Abstract:ObjectiveStudy on the molecular mechanism of protective effect of dexmedetomidine on acute lung injury in sepsis mice induced by lipopolysaccharide.MethodsPut randomly 100 clean grade adult male BALB/c mice into high concentrations of dexmedetomidine group (group A),low concentrations of dexmedetomidine group (group B),sepsis sepsis group (Group C) and blank control group (Group D).A and B group of mice were injected DEX 12.5 mu g / kg and 25 g/kg before 30 min of modeling.A,B and C group of mice were intraperitoneal injection of LPS to establish the model of ALI.Detecting the level of TLR-4 in lung tissue of mice with Western blot after modeling 0 and 12 hours.Using enzyme linked immunosorbent method (ELISA) to detected MyD88,NF-κB and IL-6 levels in the lung tissue of the mice,and detection of lung tissue wet/dry weight ratio (W/D).ResultsAfter modeling,level of MyD88,NF-κB and IL-6 in A,B and C group were increaseing with time,and were significantly higher than D group (P<0.05).Level of MyD88,NF- three groups of NF-κB in C group were significantly higher than that of group A (P<0.05),and those in A group was significantly higher than that of group B (P<0.05).ConclusionTLR-4 signaling pathway may be involved in the process of lung injury in septic rats,Dex may inhibit the TLR-4 pathway to achieve lung protective effect in septic rats.
Key words:Dexmedetomidine;lung;sepsis;inflammatory reaction
