人激活素受体结合蛋白2与结肠癌相关性研究
2016-07-22李占东朱可彤包晓华刘飞舟龚秀玲杨海玲
李占东,李 皓,朱可彤,包晓华,李 琳,刘飞舟,龚秀玲,杨海玲
(1.吉林工程技术师范学院 食品工程学院,吉林 长春130052;2.中国人民解放军208医院,吉林 长春130062;3.吉林大学中日联谊医院,吉林 长春130033;4.长春长生生物科技股份有限公司,吉林 长春130103;5.上海紫江企业集团股份有限公司长春分公司,吉林 长春130033)
人激活素受体结合蛋白2与结肠癌相关性研究
李占东1,李皓1,朱可彤1,包晓华2,李琳3,刘飞舟4,龚秀玲5,杨海玲3
(1.吉林工程技术师范学院 食品工程学院,吉林 长春130052;2.中国人民解放军208医院,吉林 长春130062;3.吉林大学中日联谊医院,吉林 长春130033;4.长春长生生物科技股份有限公司,吉林 长春130103;5.上海紫江企业集团股份有限公司长春分公司,吉林 长春130033)
激活素是胞外信号蛋白TGF-超家族的成员。它具有多种调控功能,如细胞增殖和分化、细胞凋亡,代谢的动态平衡,免疫反应,创伤修复及各种内分泌功能[1,2]。激活素诱导胞内信号分子Smad蛋白磷酸化,Smad蛋白包括Ⅰ型和Ⅱ型受体。以往的研究表明,hARIP2可以通过与激活素Ⅱ型受体(ActRIIs)结合减弱激活素信号[3]。但是,hARIP2在结肠癌细胞中的表达分布尚不清楚。在本研究中我们发现,hARIP2能够促进结肠癌细胞的增值,hARIP2的表达量随着结肠肿瘤病理分级的升高而增强。而且,hARIP2的表达量与结肠癌肿瘤的体积、淋巴结转移呈正相关。这些结果表明,hARIP2可能是一种结肠肿瘤中负反馈调节因子。
1材料与方法
1.1实验材料
HCT8细胞、pcDNA3及构建好的pcDNA3-FLAG-hARIP2质粒为本课题组保存,随机收集(2014年)吉林大学病理学与病理生理学系I级结肠癌组织40例,Ⅱ级结肠癌组织28例,Ⅲ级结肠癌组织10例。所有病理组织均为首次诊断病例,未进行放疗、化疗及生物治疗等。
1.2抗体制备
合成hARIP2羧基端 50个氨基酸长度的小肽,将合成的小肽免疫新西兰大白兔,制备抗hARIP2多克隆抗体。通过琼脂糖凝胶蛋白A(Amersham Biosciences公司)对特异性抗血清进行纯化,并用于免疫组化分析。anti-GAPDH抗体购于Abcam公司(英国)。
1.3免疫印迹分析
将pcDNA3及构建好的pcDNA3-FLAG-hARIP2质粒载体用脂质体2000细胞试剂(Invitrogen公司,美国)转染结肠癌HCT8细胞。转染两天后,HCT8细胞在PBS溶液中洗涤三次,然后再放到裂解液中裂解(50 mM Tris- HCl(pH=7.5),150 mM 氯化钠,1 mM 氟化钠,1%NP-40,1 mMPMSF,2 μg/ml 亮肽素,和2 μg/ml 抑肽酶)。离心分离裂解液,用考马斯亮蓝蛋白质测定试剂(上海生工)测定每种上清液的蛋白质。通过SDS-PAGE电泳分离蛋白质,然后转到PVDF膜上。膜用抗-GAPDH和抗-hARIP2抗体孵育,再将孵育后的膜与辣根过氧化物酶标记的二抗孵育。用ECL (Piece Biotechnology公司,美国)化学发光法检测。
1.4细胞增殖分析
HCT8细胞被分别转染pcDNA3(对照组),pcDNA3-FLAG-hARIP2质粒载体,转染24 h后,细胞被接种到96孔板中,接种密度为1×104每孔,在含有10% FBS的DMEM培养基(Gibco)中分别培养。24、48、72和96 h。制备20 μl MTT储备溶液(5 mg/ml溶于 PBS,Sigma),然后将其加入到各孔中,并且进一步将板孵育4 h。孵育后,向每孔加入150 μl DMSO中,剧烈混合均匀,在37℃下孵育15 min后在570 nm处测定吸光度。
1.5hARIP2免疫组织化学染色
石蜡包埋结肠癌组织样本块进行切片,转到聚L-赖氨酸包被的载玻片上。脱石蜡后,在10 mM柠檬酸盐缓冲液的抗原表位测定非特异性的结合位点。切片在5%正常兔血清的PBS (pH 7.4)中孵育20 min。用PBS洗涤,切片组织加入抗hARIP2抗体,1∶500倍稀释,稀释液为的1% PBS溶液,4℃孵育12 h。用PBS充分洗涤后,加入生物素标记的二抗,并在室温孵育20 min。PBS洗涤,切片与过氧化物酶标记的抗生物素蛋白-生物素复合物在室温下孵育20 min。用DAB显色液显色。
1.6统计学分析
所有的体外实验至少重复3次,每个结果是3次独立实验的平均值。由t检验分析组之间的差异,P值小于0.05被认为统计学上具有显著性。
2结果
2.1HCT8细胞中hARIP2过表达的免疫印迹分析
为确定hARIP2对结肠癌细胞的作用,用转染pcDNA3-FLAG-hARIP2载体上调其表达。在HCT8细胞中,hARIP2的表达量增加。在其他结肠肿瘤细胞中也获得相似的结果(结果未示出)。这些结果表明,pcDNA3-FLAG-hARIP2载体使hARIP2在结肠癌细胞中的表达量上调;以合成小肽做为抗原制备的hARIP2多克隆抗体能够识别结肠癌细胞内天然hARIP2抗原决定簇(图1)。
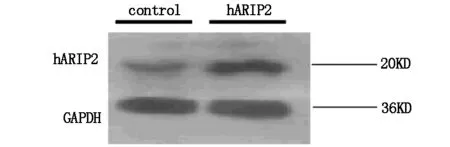
图1 HCT8细胞中hARIP2过表达的免疫印迹分析
pcDNA3-FLAG-hARIP2载体及阴性对照组(control )分别被转染HCT8细胞,每个样品都添加等量细胞裂解液,抗体选用抗GAPDH抗体和抗hARIP2抗体,通过免疫印迹进行分析。
2.2hARIP2对结肠癌细胞增殖的影响
用pcDNA3及pcDNA3-FLAG-hARIP2载体转染HCT8细胞,研究hARIP2在人结肠肿瘤细胞中的增殖的作用。采用MTT法测定转染有对照及hARIP2的HCT8细胞在体外的增殖。MTT实验均在24、48、72和96 h的条件下进行,在570 nm处测定吸光度,每个数据表示为平均值±SD,根据MTT实验绘制细胞增殖曲线。细胞增殖活性如图2所示,实验重复3次。MTT法检测的结果表明,过表达hARIP2增加细胞增殖。在其他的肿瘤细胞中也得到同样的结果。这些结果表明是hARIP2促进了人类结肠肿瘤细胞的增殖。

图2 体外实验验证hARIP2对HCT8 细胞增殖的作用
2.3hARIP2在不同病理分级的结肠癌组织中的表达
免疫组织化学染色实验结果发现,与对照相比,在40例Ⅰ级结肠癌组织(图3B)中为中强度至低强度染色;28例Ⅱ级结肠癌组织以及10例Ⅲ级结肠癌组织(图3C、3D)在结肠癌中检测到是高强度染色。实验结果显示随着结肠癌组织的病理分级的增高,hARIP2的表达量也相应增高。

图3免疫组化分析hARIP2在结肠癌组织中的表达情况。组织被染成棕黄色为阳性免疫反应,细胞核呈蓝色,A.阴性对照(未加一抗)。B.病理Ⅰ级组织。C.病理Ⅱ级组织。D.病理Ⅲ级组织。放大倍数是×20。
2.4hARIP2免疫强度的分析
统计表明,hARIP2在病理分级程度高的结肠癌组织(89.3%Ⅱ级结肠癌组织;100%Ⅲ级结肠癌组织;表1)中表达更强,比它在病理分级程度低的结肠癌组织(62.5%Ⅰ级结肠癌组织,表1)中表达更强。此外,我们的结果表明,hARIP2的表达与在淋巴结转移(表2),结肠癌肿瘤大小(表3)是呈正相关的。
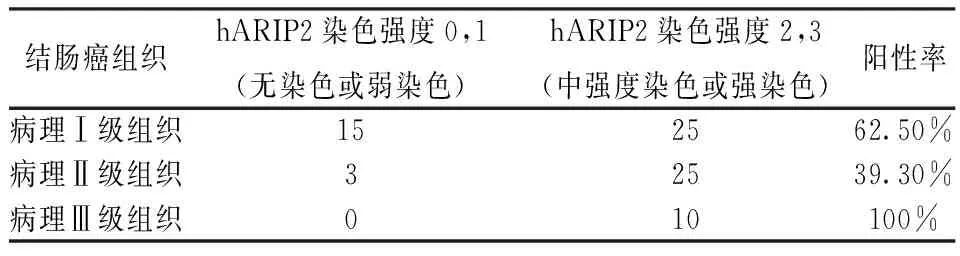
表1 hARIP2染色强度与结肠癌组织病理分级的关系

表2 hARIP2染色强度与结肠癌组织淋巴结状态的关系
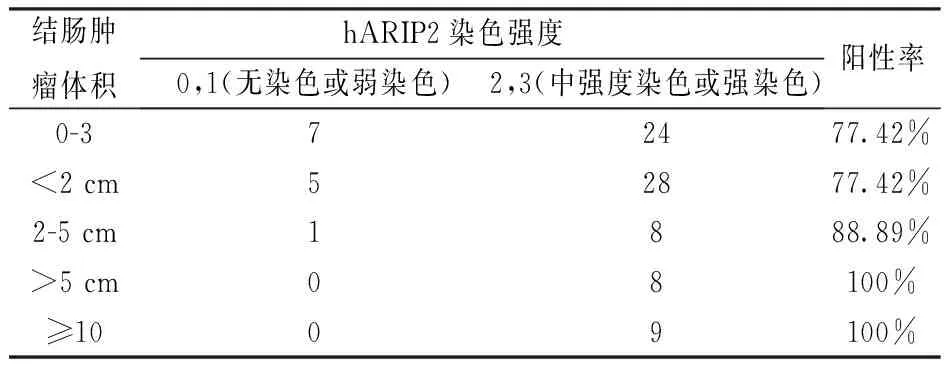
表3 hARIP2染色强度与结肠癌组织体积大小的关系
3讨论
结肠癌是胃肠道中常见的恶性肿瘤,在我国近20年以来其发病率逐年升高,以大城市更为明显,且出现结肠癌多于直肠癌的趋势,虽然最近诊断和治疗手段的进展挽救了许多早期肿瘤患者的生命,但晚期及转移患者的预后仍不理想。随着分子生物学技术的发展,多步骤、多阶段及多基因方面研究结肠癌的发生发展尤为重要。
激活素属于转化生长因子超家族成员中的一种多功能生长和分化因子,能抑制结肠癌细胞的增殖。激活素通过其I型和Ⅱ型丝氨酸-苏氨酸激酶受体介导产生不同的生物学功能。激活素直接与其Ⅱ型受体结合,导致募集、磷酸化I型受使其激活,一旦被激活,Ⅰ型受体结合并磷酸化Smad蛋白。这些转录后的Smad蛋白,将细胞内信号转运到细胞核内,进而调控靶基因的转录[4]。到目前为止,已知的ActRIIs的功能仅限于与配体结合,募集Ⅰ型受体和转磷酸化作用。激活素Ⅱ型受体包括两种亚型,即激活素Ⅱ型受体A和激活素Ⅱ型受体B,每一个亚型都由单独的基因编码。此外,还有两个ActRIIA的剪接突变体及五个ActRIIB的剪接突变体已被发现[5-7]。据推测,ActRIIs在激活素信号中起着重要的作用。
已有研究表明,激活素能够抑制多种类型肿瘤细胞的增殖[8]。且激活素与结肠癌密切相关。激活素信号转导成分已被确定为肿瘤抑制基因[9]。激活素信号成分的缺失或减少,使某些肿瘤变得更具有侵袭性,此外,激活素已被报道通过激活Smad蛋白抑制肿瘤细胞的生长。由于hARIP2可以增强ActRII的内吞作用,并通过Ral/RalBP1-depending的通路降低ActRIIA在细胞膜上的表达,并具有抑制激活素介导的信号转导的能力。因此,可以认为hARIP2可能参与结肠癌的功能调节。在本研究中,我们通过对不同结肠癌病理阶段进行免疫组化实验分析发现,hARIP2表达水平在不同病理分级的结肠癌组织中呈正相关,说明hARIP2与肿瘤的分化有着密切的联系。hARIP2对结肠肿瘤细胞增值的促进作用及hARIP2表达量与肿瘤体积及淋巴结转移呈正相关,说明hARIP2能促进肿瘤的发生发展。因此,我们推测hARIP2在结肠肿瘤形成过程中起着一定的作用。
参考文献:
[1]Bao YL,Tsuchida K,Liu B,et al.Synergistic activity of activin A and basic fibroblast growth factor on tyrosine hydroxylase expression through Smad3 and ERK1/ERK2 MAPK signaling pathways[J].J Endocrino,2005,184(3):493.
[2]Chen YG,Wang Q,Lin SL,et al.Activin Signaling and Its Role in Regulation of Cell Proliferation,Apoptosis,and Carcinogenesis[J].J Experimental Biology and Medicine,2006,231:534.
[3]Li ZD,Wu Y,Bao YL,et al.Identification and characterization of human ARIP2 and its relation to breast cancer[J].J Cyto,2009,2(46):251.
[4]Panopoulou E,Gillooly DJ,Wrana JL,et al.Early Endosomal Regulation of Smad-dependent Signaling in Endothelial Cells[J].J Biol Chem,2002,277(20):18046.
[5]Shoji H,Nakamura T,Van den Eijnden-van Raaij AJ,et al.Identification of a Novel Type Ⅱ Activin Receptor,Type IIA-N,Induced during the Neural Differentiation of Murine P19 Embryonal Carcinoma Cells[J].J Biochem Biophys Res Commun,1998,246:320.
[6]Ethier JF,Lussier JG,Silversides DW.Bovine activin receptor type IIB messenger ribonucleic acid displays alternative splicing involving a sequence homologous to Src-homology 3 domain binding sites[J].J Endocrinology,1997,138:2425.
[7]Shoji H,Tsuchida K,Kishi H,et al.Identification and Characterization of a PDZ Protein That Interacts with Activin Type Ⅱ Receptors[J].Journal of Biological Chemistry,2000,275(8):5485.
[8]Bauer J,Sporn J C,Cabral J,et al.Effects of Activin and TGFβ on p21 in Colon Cancer[J].J PLoS One,2012,7(6):e39381.
[9]Deacu E,Mori Y,Sato F,et al.Activin type Ⅱ receptor restoration in ACVR2-deficient colon cancer cells induces transforming growth factor-beta response pathway genes[J].J Cancer Res,2004,64:7690.
基金项目:吉林省科技厅科技发展计划项目资助(2012050);吉林省科技厅自然科学基金项目(20130101156JC)
文章编号:1007-4287(2016)06-0893-03
作者简介:李占东(1979-),男,讲师,博士,研究方向为肿瘤发生机制研究。
(收稿日期:2015-11-19)
