FXR蛋白在肝癌组织中的表达情况
2016-07-22孟祥宽陈玉丙
冯 虎,刘 念,孟祥宽,陈玉丙,王 欣
(吉林大学第二医院 1.放疗科;2.检验科,吉林 长春130041;3.吉林大学第一医院)
FXR蛋白在肝癌组织中的表达情况
冯虎1,刘念3,孟祥宽1,陈玉丙1,王欣2*
(吉林大学第二医院 1.放疗科;2.检验科,吉林 长春130041;3.吉林大学第一医院)
我国肝癌发病率居全球首位,患者在确诊后即使经过治疗,仅有19%的患者能存活一年,Yang[1]发现FXR基因敲出的27只大于15个月龄的小鼠全部自发肝脏肿瘤,而同月龄的17只野生鼠无肿瘤发生,首次证实了FXR与肝癌的发生有密切关系。同年Kim[2]报道了类似的结果,在12个月龄的FXR基因敲除小鼠肝脏中发现了腺瘤、肝细胞癌及肝胆管细胞癌,进一步证实了FXR的缺乏将导致小鼠肝脏肿瘤的发生。可见FXR缺失与肝癌发生具有密切关系,这与FXR对机体代谢稳态的网络调控密不可分。而FXR在人类肝癌组织中的表达情况仍罕见报道。为了解FXR在人肝癌组织及正常组织的表达情况,我们收集了6例术后的肝癌组织及周围正常组织标本,通过Western blot法检测FXR蛋白表达情况。
1材料与方法
1.1材料
1.1.1患者和肝脏样本选取2014-2015年间就诊于吉林大学第二医院肝胆外科的6例接受根治性肝叶切除术治疗的患者。其中,男性3例,女性3例,年龄小于50岁的3例,大于或等于50岁的3例。6例患者经病理确诊为肝细胞癌,其中IIA期3例,IIIA期3例。这些患者在手术前未进行任何局部或全身治疗。肿瘤样品从肿瘤的无坏死区取出,癌旁正常肝组织样品在肿瘤外3 cm处取得。所得样品立即放于-80℃液氮中保存备用。
1.1.2试剂:兔抗人FXR单克隆抗体(Abbiotec,购自深圳市豪地华拓生物科技有限公司)FITC Goat Anti-Rabbit IgG(HL)(货号ASO11,购自武汉爱博泰克生物科技有限公司)。
1.2方法
1.2.1Western blot分析分别取肝癌组织及癌旁正常组织约30 mg研磨后加200 μl裂解液进行裂解。用BCA蛋白定量试剂盒进行蛋白定量。各取100 μg在12% SDS—聚丙烯酰胺凝胶上跑电泳、转PVDF膜、用脱脂奶粉封闭、孵一抗(1∶1 000)、洗一抗、孵二抗(1∶1 000)、洗二抗,加ECL显色。1.2.2结果判定观察肝癌和癌旁组织中FXR蛋白表达的高低,并使用IMAGE J软件处理图像得到灰度值,并计算出目的蛋白与内参蛋白的灰度比值作为相对灰度值,以相对灰度值作为结果分析数据。
1.3统计学处理Excel表格收集数据,应用Shapiro-Wilk统计学方法对肝癌组织及癌旁组织两组的数据分别进行正态性检验。由于癌旁组织的Western结果分析得到相对灰度值这一组数据不符合正态分布,所以上述两组数据采用两配对样本的非参数检验的统计方法,分析肝癌和癌旁组织中FXR表达的差异,全部统计过程通过SPSS21.0实现。
2结果
2.1FXR蛋白在肝癌和癌旁组织中的表达通过Western blot法检测,我们发现FXR蛋白在肝细胞癌组织(T)中的表达量比癌旁组织(N)中的表达量低(见图1)。
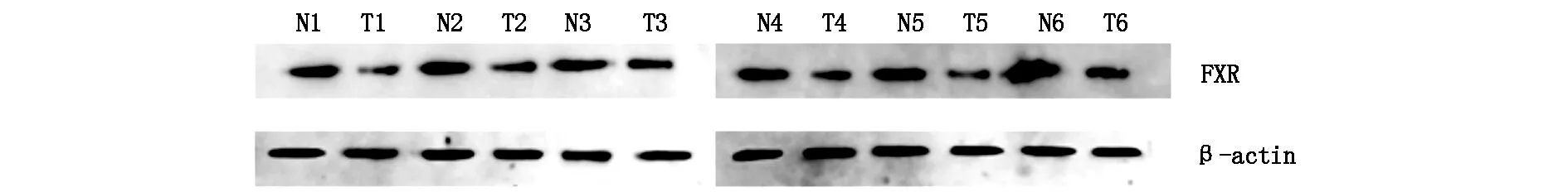
图1 6例HCC患者癌组织和癌旁组织样本FXR蛋白表达情况
2.2Western blot图像的相对灰度值分析使用IMAGE J软件对肝癌组织(T)和癌旁组织(N)的Western结果分析得到相对灰度值(见图2)。将6例患者的肝癌组织与癌旁组织Western结果分析得到相对灰度值分别进行正态性检验,结果显示:癌旁组织的Western结果分析得到相对灰度值这一组数据不符合正态分布,而肝癌组织所得到的数据符合正态分布(见表1)。故将6例患者的肝癌组织与癌旁组织组成配对资料,使用两配对样本的非参数检验的统计方法分析肝癌组织与癌旁组织FXR表达量的差异,差值有统计学意义(P=0.028),FXR在肝癌组织中的表达与癌旁组织相比显著降低(见表2)。
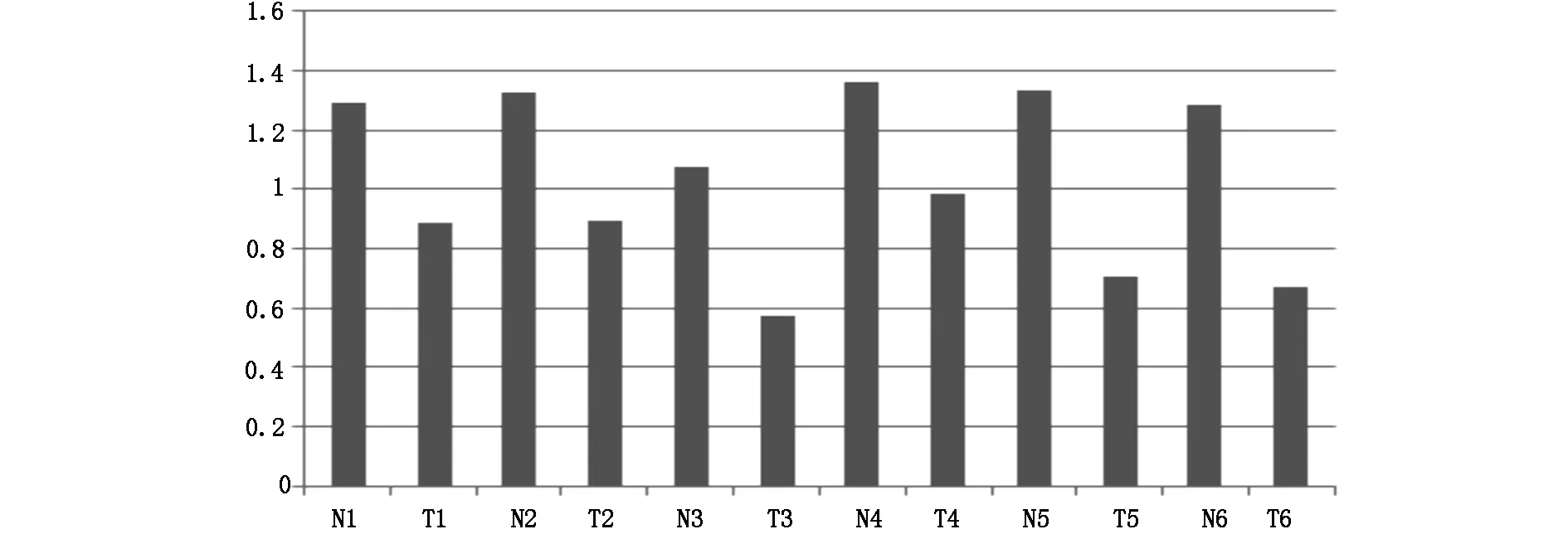
图2 用相对灰度值量化Western blot结果
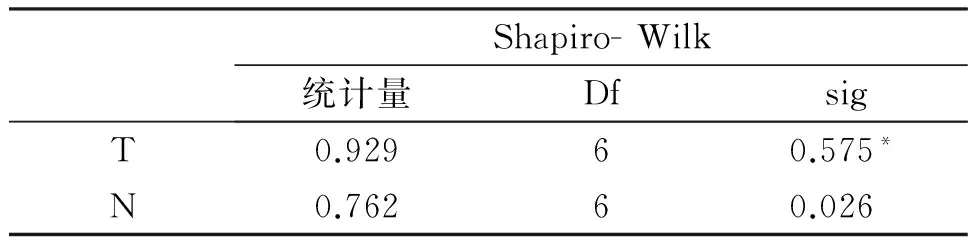
Shapiro-Wilk统计量DfsigT0.92960.575*N0.76260.026
注:*符合正态分布,P>0.05。

表2 肝癌组织与癌旁组织FXR表达量的两配对样本的非参数检验的结果
注:肝癌组织组数据符合正态分布,使用Mean±S表示;癌旁组织组的数据不符合正态分布,故使用median,Q表示。Mean :平均值;S: 标准差;median:中值;Q:四分位数间距。*:P<0.05,有统计学意义。
3讨论
FXR在生物体内非常普遍,是维持机体代谢稳态所需的物质。FXR可能通过以下方式发挥保肝作用:维持正常的胆汁酸、糖、脂代谢的动态平衡[3,4],促进肝细胞再生[5],通过抑制NF-κB-和STAT3-介导的信号通路反调节肝脏炎症[6],诱导的肿瘤抑制基因的表达并且抑制癌基因的转录[7]。因此,FXR活性的损失可能成为肝癌的发生和发展的一个重要的分子事件。本实验用Western blot法比较了6例术后的肝癌组织及周围正常组织标本FXR蛋白表达情况发现,FXR蛋白在癌组织的表达水平显著低于癌旁正常组织。
然而,肝癌的发展过程中FXR的表达下调的精确分子机制至今仍然不清楚。炎症可能为减少FXR的表达提供了一个微环境,Liu[8]在大多数肝细胞癌患者中升高的促炎细胞因子,如TNFα,IL-1β和IL-6,可能通过抑制FXR基因启动子降低FXR的表达。表观遗传沉默是FXR表达的减少的另一个重要因素。Zhang[9]证明了miR-421通过靶向肝细胞癌中FXR mRNA的3′UTR抑制FXR的转录。
因此,我们需要进一步研究证实FXR与其他转录因子、炎症因子以及激素之间的交互调控作用,阐明FXR与机体稳态调控网络的作用机制,进而揭示FXR与肿瘤细胞增值以及癌症发生、发展的关系,从而为肿瘤治疗新靶点的发现、新策略的制定提供坚实的科学研究基础。
参考文献:
[1]Yang F,Huang X,Yi T,et al.Spontaneous development of liver tumors in the absence of the bile acid receptor farnesoid X receptor[J].Cancer Res,2007,67(3):863.
[2]Kim I,Morimura K,Shah Y,et al.Spontaneous hepatocarcinogenesis in farnesoid X receptor-null mice[J].Carcinogenesis,2007,28(5):940.
[3]Inagaki T,Choi M,Moschetta A,et al.Fibroblast growth factor 15 functions as an enterohepatic signal to regulate bile acid homeostasis[J].Cell Metab,2005,2(4):217.
[4]Claudel T,Staels B,Kuipers F.The Farnesoid X receptor:a molecular link between bile acid and lipid and glucose metabolism[J].Arterioscler Thromb Vasc Biol,2005,25(10):2020.
[5]Huang W,Ma K,Zhang J,et al.Nuclear receptor-dependent bile acid signaling is required for normal liver regeneration[J].Science,2006,312(5771):233.
[6]Grivennikov SI,Karin M.Dangerous liaisons:STAT3 and NF-kappaB collaboration and crosstalk in cancer[J].Cytokine Growth Factor Rev,2010,21(1):11.
[7]Chen Y,Song X,Valanejad L,et al.Bile salt export pump is dysregulated with altered farnesoid X receptor isoform expression in patients with hepatocellular carcinoma[J].Hepatology,2013,57(4):1530.
[8]Liu N,Meng Z,Lou G,et al.Hepatocarcinogenesis in FXR-/- mice mimics human HCC progression that operates through HNF1alpha regulation of FXR expression[J].Mol Endocrinol,2012,26(5):775.
[9]Zhang Y,Gong W,Dai S,et al.Downregulation of human farnesoid X receptor by miR-421 promotes proliferation and migration of hepatocellular carcinoma cells[J].Mol Cancer Res,2012,10(4):516.
文章编号:1007-4287(2016)06-0999-03
基金项目:吉林省科技厅自然科学基金资助项目(编号:201215072)
*通讯作者
(收稿日期:2015-12-16)
