电位滴定法测定PA6中端氨基和端羧基含量的不确定度评定
2016-07-18周丽华
周丽华
(中国石化仪征化纤有限责任公司研究院,江苏仪征 211900)
分析测试
电位滴定法测定PA6中端氨基和端羧基含量的不确定度评定
周丽华
(中国石化仪征化纤有限责任公司研究院,江苏仪征211900)
摘要:通过电位滴定法测定PA6中端氨基和端羧基含量,分析并找出测定过程中影响不确定度的因素,并对各不确定度分量进行评定。结果表明:标准滴定溶液的浓度和消耗标准滴定溶液的体积所引入的不确定度对总不确定度贡献最大,其次是测量的重复性。
关键词:PA6电位滴定法端氨基不确定度
测量的目的是为了得到测量结果,但在很多场合下给出测量结果往往还不充分,任何测量都存在缺陷,测量结果都会或多或少地偏离被测量的真值,因此在给出测量结果的同时,还必须指出所测量结果的可靠程度。其中测量结果的不确定度被人们经常使用,测量结果的不确定度表征合理地赋予被测量之值的分散性[1],与测量结果相联系的参数。由于测量结果受很多因素的影响,因此测量不确定度由多个分量组成,对每个分量都要评定其标准不确定度。
本文通过对电位滴定法测定PA6中端氨基和端羧基含量,分析找出测定过程中影响不确定度主要因素来源,并对各不确定度分量进行量化计算,评定了PA6中端氨基和端羧基含量的不确定度。
1试验
1.1试剂
PA6切片,湖南岳化化工股份有限公司提供。
三氟乙醇,分析纯,百灵威科技有限公司制。
邻苯二甲酸氢钾,基准试剂,国家标准物质研究中心制。
无水碳酸钠,基准试剂,国家标准物质研究中心制。
水,蒸馏水,自制。
1.2仪器
全自动电位滴定仪,905型,瑞士万通造。
分析天平,精度0.1mg,XS104型,梅特勒造。
酸(碱)滴定管,A级,50mL。
电热鼓风干燥箱,302BN型,重庆永恒实验仪器厂。
1.3配制0.02mol/LHCL标准滴定溶液
(1)配制
量取200mL按GB/T601-2002[2]规定配制的浓度约为0.1mol/LHCL溶液,用蒸馏水稀释至1 000mL,摇匀。
(2)标定
称取约0.04g(精确至0.000 1g)于280 ℃烘至质量恒定的基准无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红混合指示液,用配制好的HCL溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。同时作空白试验。计算HCL溶液的浓度。
1.4配制0.02mol/LNaOH标准滴定溶液
(1)配制
按GB/T601-2002[2]规定配制的浓度约为0.1mol/LNaOH溶液,量取200mL,用蒸馏水稀释至1 000mL,摇匀。
(2)标定
称取约0.15g(精确至0.000 1g)于110 ℃烘至质量恒定的基准邻苯二甲酸氢钾,溶于50mL无CO2的水中,加2滴酚酞指示液(10g/L),用配制好的NaOH溶液滴定至溶液呈粉红色。同时作空白试验。计算NaOH溶液的浓度。
1.5实验方法
称取0.8g(精确至0.000 1g)PA6切片于100mL三角锥形瓶中,加30mL三氟乙醇-水(体积比88∶12)溶液,于60 ℃水浴振荡器上振荡至全溶。
开启905型全自动电位滴定仪,用0.02mol/LHCL滴定氨基,得到第一个电位突跃,然后用0.02mol/LNaOH溶液返滴定得到第二个电位突跃(中和过量的盐酸),继续滴定得到第三个电位突跃(中和端羧基的量)。
2不确定度评定
2.1建立端氨基测定的数学模型
PA6中 -NH2值按式(1)计算
(1)
式中X为PA6样品的-NH2值,mmol/kg;
V1为滴定氨基所消耗HCL标准溶液的体积(第一电位突跃点),mL;
P为基准无水Na2CO3的纯度;
m为称取基准无水Na2CO3质量,g;
V为滴定基准无水Na2CO3溶液消耗HCL标准溶液的体积,mL;
V0为滴定空白溶液消耗HCL体积,mL;
M为以(1/2Na2CO3)为基本单元的摩尔质量(52.99g/mol);
m1为称取PA6样品质量,g。
2.1.1PA6中-NH2值的测量不确定度主要来源
(1)测量重复性带来的不确定度;
(2)称量基准物量而使用电子天平带来的不确定度;
(3)基准无水Na2CO3的纯度P带来的不确定度;
(4)滴定氨基消耗HCL标准溶液的体积V1带来的不确定度;
(5)基准物摩尔质量带来的不确定度;
(6)称量PA6样品质量带来的不确定度;
(7)滴定基准物消耗HCL标准溶液的体积V带来的不确定度;
(8)滴定空白溶液消耗HCL标准溶液的体积V0带来的不确定度;
(9)标定重复性带来的不确定度。
2.1.2不确定度分量的评定
2.1.2.1测量的重复性引入的不确定度ur
按照实验方法,在相同的测定条件下,对PA6样品进行6次测定,测定结果见表1。
表1PA6中-NH2值测定结果

项目-NH2/(mmol·kg-1)CHCL/(mol·L-1)V1/mLV-V0()/mLm/gm1/g平均值46.150.019881.8639.870.04200.8000标准偏差s0.20450.00035////
以平均值作为实验结果,用对观测列进行统计分析的方法,来评定标准不确定度[3]。(A类评定)方法测量重复性的不确定度以标准偏差表示:
2.1.2.2称量基准物质量引入的不确定度um
称量读数的重复性,已包括在测量重复性中,不再评定。由于减量法称量是用同一台天平在几乎相同的测量点进行测量的,故天平的灵敏度对测量结果的影响可忽略不计。空气浮力对其影响也可忽略。
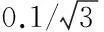
2.1.2.3基准无水Na2CO3的纯度P引入的不确定度up
基准无水Na2CO3的说明书上给出其纯度P(100±0.05)%,假设为矩形分布[3],则基准物纯度引入的标准不确定度为:
2.1.2.4消耗HCL标准溶液体积V1引入的不确定度u1
用HCL标准溶液滴定样品中氨基所消耗体积的不确定度来源有:滴定体积重复性、滴定管检定、环境温度和终点判断误差。
(1)滴定体积的重复性已包括在测量重复性中,不再评定。
(2)根据电位滴定仪的说明书,20mL交换单元滴定管的最大允许误差为0.15%,即±0.03mL,假设为三角分布[3],则滴定管引入的不确定度为:
(3)实验室的温度变化约为±3 ℃,查得水的膨胀系数为2.1×10-4℃,根据矩形分布[3],温度变化引入的不确定度为:
(4)电位滴定法是依据待测离子的活度与其电极电位间的关系,遵守能斯特方程,通过测量滴定过程中电池电动势的变化确定滴定终点的滴定分析方法。仪器自动判断终点[4],故不确定度可以忽略不计。
将上述不确定度分量合成得:
2.1.2.5基准物摩尔质量引入的不确定度uM
从2007年IUPAC元素周期表查得NaCO3各组成元素的相对原子质量及其不确定度,见表2。
表2各组成元素相对原子质量及其不确定度
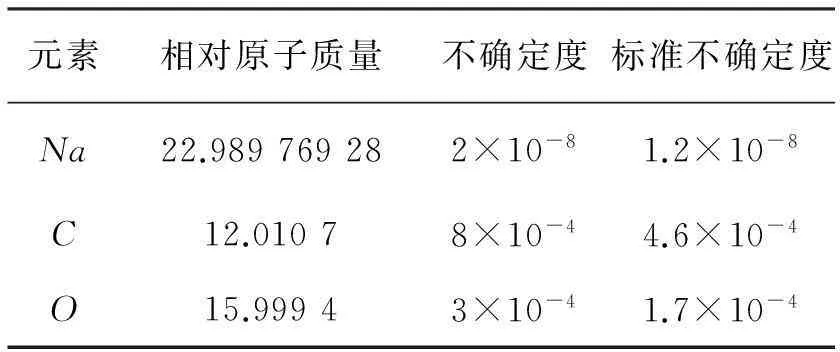
元素相对原子质量不确定度标准不确定度Na22.989769282×10-81.2×10-8C12.01078×10-44.6×10-4O15.99943×10-41.7×10-4

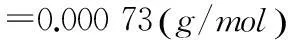
称量PA6样品质量引入的不确定度um1与um相同,即:
2.1.2.7滴定基准物所消耗HCL标准溶液的体积V引入的不确定度u2
用HCL标准溶液滴定基准物所消耗体积的不确定度来源有:滴定管检定、环境温度、人员读数和终点判断误差。
(1)滴定管校准引入的不确定度u21
滴定使用50mL碱式滴定管(A级),按照GB12805-91要求,其最大容量允差±0.05mL,假设为三角分布[3],则滴定体积校正引入的不确定度为:
(2)实验室温度变化对V和V0引入的不确定度u22
实验测得V0=0.02mL,相对于V来说非常小,故温度变化对V0引起的不确定度非常小,可忽略不计。按照2.1.2.4(3)进行分析得:温度变化对V引入的不确定度为:
u22=0.015(mL)
(3)人员读数引入的不确定度u23
50mL碱式滴定管的最小刻度单位为0.1mL,假设为三角分布[3],人员读数引入的不确定度为:
(4)终点判断误差引入的不确定度u24
标定HCL标准溶液时,滴定终点时的误差为0.01mL(1/4滴体积),假设为两点分布[3],则终点误差引入的不确定度为:
将上述不确定度分量合成得:
2.1.2.8滴定空白溶液所消耗HCL标准溶液的体积V0引入的不确定度u0
滴定空白消耗的HCL标准溶液体积一般为0.00~0.02mL,实验中测得V0=0.02mL,体积量很小,故由空白引入的不确定度可忽略不计。
2.1.2.9标定重复性引入的不确定度ur1
对标准滴定溶液进行8次标定,标准溶液浓度的平均值为0.019 88mol/L,标准偏差S为0.000 35mol/L,按照2.1.2.1得:
ur1=0.000 35(mol/L)
2.1.3合成标准不确定度
PA6中-NH2值测定结果的相对标准不确定度按照式(2)合成:
(2)
将上述数据代入(2)式:uX/X=0.019
2.2建立端羧基测定的数学模型
PA6中-COOH值按式(3)计算
(3)
式中Y为PA6样品的-COOH值,mmol/kg;
V3为滴定端羧基所消耗NaOH标准溶液的体积(第三电位突跃点),mL;
V2为中和过量HCL所消耗NaOH标准溶液的体积(第二电位突跃点),mL;
P为基准物KHC8H4O4的纯度;
m为称取基准KHC8H4O4质量,g;
V为滴定基准KHC8H4O4溶液消耗NaOH标准溶液的体积,mL;
V0为滴定空白溶液消耗NaOH标准溶液的体积,mL;
M为KHC8H4O4的摩尔质量(204.22g/mol);
m1为PA6质量,g。
2.2.1PA6中-COOH值的测量不确定度来源
(1)测量重复性带来的不确定度;
(2)称量基准物量而使用电子天平带来的不确定度;
(3)基准KHC8H4O4的纯度P带来的不确定度;
(4)滴定端羧基和过量HCL所消耗NaOH液的体积V3和V2带来的不确定度;
(5)基准物摩尔质量带来的不确定度;
(6)称量PA6样品质量带来的不确定度;
(7)滴定基准物所消耗NaOH标准溶液的体积V来的不确定度;
(8)滴定空白溶液所消耗NaOH标准溶液的体积V0的不确定度;
(9)标定重复性带来的不确定度。
2.2.2不确定度分量的评定
2.2.2.1测量的重复性引入的不确定度ur
按照实验方法,在相同的测定条件下,对PA6样品进行6次测定,测定结果见表3。
表3PA6中-COOH值测定结果
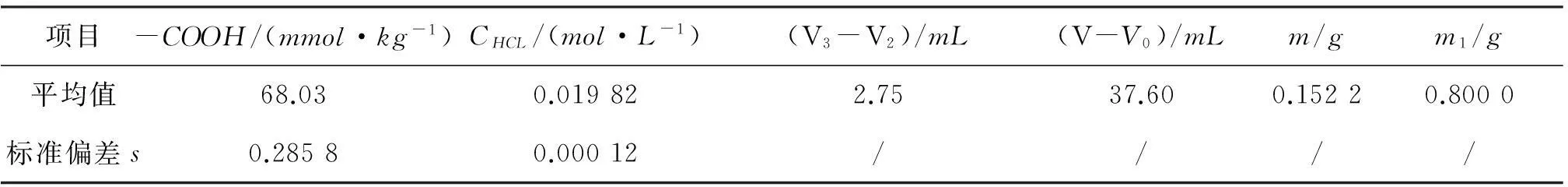
项目-COOH/(mmol·kg-1)CHCL/(mol·L-1)(V3-V2)/mL(V-V0)/mLm/gm1/g平均值68.030.019822.7537.600.15220.8000标准偏差s0.28580.00012////
按照2.1.2.1进行分析得:
ur=0.285(g)
2.2.2.2称量基准物质量引入的不确定度um
按照2.1.2.2进行分析得:
2.2.2.3基准KHC8H4O4的纯度P引入的不确定度up
基准KHC8H4O4的说明书上给出其纯度P(99.99±0.02)%,按照2.1.2.3进行分析得:
up=0.000 12
2.2.2.4消耗NaOH标准溶液的体积V3和V2引入的不确定度u1
按照2.1.2.4进行分析得:
(1)滴定体积的重复性已包括在测量重复性中,不再评定。
(2)根据电位滴定仪的说明书,10mL交换单元滴定管的最大允许误差为0.2%,即±0.02mL,则滴定管引入的不确定度为:
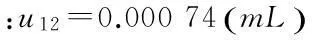
(4)仪器自动判断终点的不确定度可以忽略不计。
将上述不确定度分量合成得:
2.2.2.5基准物摩尔质量引入的不确定度uM
从2007年IUPAC元素周期表查得KHC8H4O4各组成元素的相对原子质量及其不确定度,见表4。
表4各组成元素相对原子质量及其不确定度
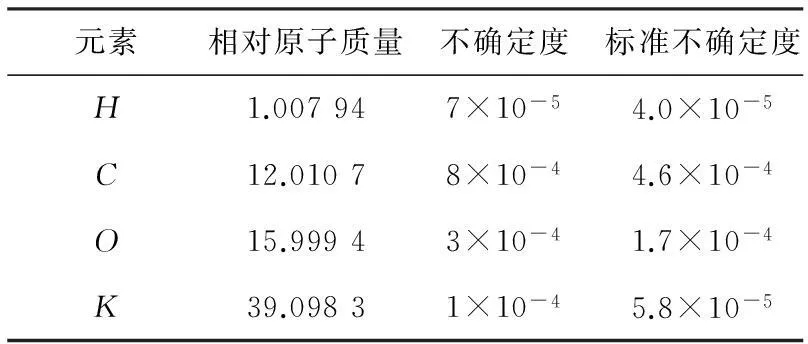
元素相对原子质量不确定度标准不确定度H1.007947×10-54.0×10-5C12.01078×10-44.6×10-4O15.99943×10-41.7×10-4K39.09831×10-45.8×10-5
按照2.1.2.5进行分析得:
2.2.2.6称量PA6样品质量引入的不确定度um1
称量PA6样品质量引入的不确定度
2.2.2.7滴定基准物所消耗NaOH标准溶液的体积V引入的不确定度u2
按照2.1.2.7进行分析得:
(1)滴定管校准引入的不确定度u21
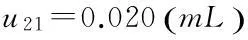
(2)实验室温度变化对V和V0引入的不确定度u22
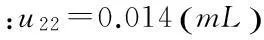
(3)人员读数引入的不确定度u23
(4)终点判断误差引入的不确定u24
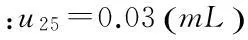
将上述不确定度分量合成得:
2.2.2.8滴定空白溶液所消耗NaOH标准溶液的体积V0引入的不确定度u0
滴定空白消耗的NaOH标准溶液体积一般为0.00~0.02mL,实验中测得V0=0.02mL,体积量很小,故由空白引入的不确定度可忽略不计。
2.2.2.9标定重复性引入的不确定度ur1
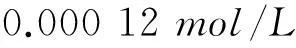
2.2.3合成标准不确定度
PA6中-COOH值测定结果的相对标准不确定度按照式(4)合成:
(4)
将上述数据代入(4)式:uY/Y=0.0081
2.3不确定度分量汇总
各不确定度分量汇总见表5。
表5参数的数值和相对标准不确定度表
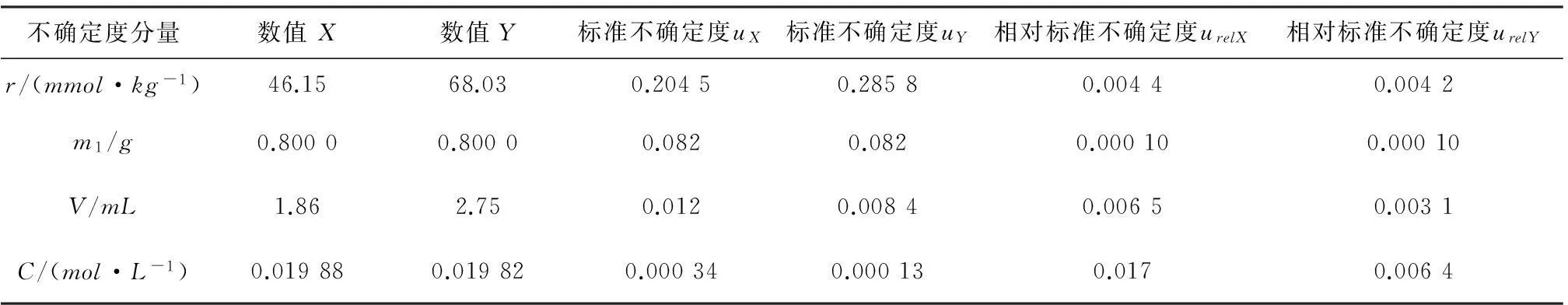
不确定度分量数值X数值Y标准不确定度uX标准不确定度uY相对标准不确定度urelX相对标准不确定度urelYr/(mmol·kg-1)46.1568.030.20450.28580.00440.0042m1/g0.80000.80000.0820.0820.000100.00010V/mL1.862.750.0120.00840.00650.0031C/(mol·L-1)0.019880.019820.000340.000130.0170.0064
从表中数据可以看,电位法测定PA6中端氨基和端羧基含量的不确定度评定过程中,标准滴定溶液的浓度和消耗的体积所引入的相对标准不确定度比较大,其次是测量重复性引入的相对标准不确定度。因此,在测试过程中应注意标准滴定溶液的配制与标定和消耗标准滴定体积对试验结果带来的影响。
3扩展不确定度
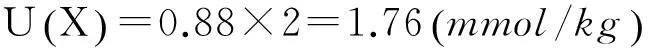
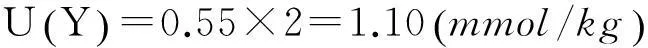
4结论
用电位滴定法测定PA6中端氨基和端羧基含量的过程中,测试结果的不确定度主要来源于标准滴定溶液的浓度、消耗标准滴定液的体积和测量的重复性。标准滴定溶液浓度引入的不确定度由称量误差、基准物纯度、滴定管检定、实验室温度、人员读数和终点判断误差等引起,消耗标准滴定溶液体积引入的不确定度由电位滴定仪上交换单元滴定管检定、实验室温度等引起。因此,在测试工作中,应注意标准滴定溶液浓度的标定和消耗标准滴定溶液体积的读取。
参考文献:
[1]全国法制计量管理计量技术委员会.JF1059.1-1999测量不确定度评定与表示[S].北京:中国标准出版社,1999.
[2]全国化学标准技术委员会化学试剂分会.GB/T601-2002化学试剂标准滴定溶液的制备[S].北京:中国标准出版社,2002.
[3]倪育才.实用测量不确定度评定-2版[M].北京:中国计量出版社,2007:72-76.
[4]孙黎峰.光度法测定PET中端羧基的不确定度评定[J].聚酯工业,2008,21(6):29-31.
[5]魏昊.化学分析中不确定度的评估指南[M].北京:中国计量出版社,2002:72.
Evaluation of the uncertainty of measuring the end amino and endcarboxylcontentinPA6bythemethodofpotentiometrictitration
ZhouLihua
(Research Institute of Sinopec Yizheng Chemical Fibre L.L.C., Yizheng Jiangsu 211900,China)
Abstract:Using the method of potentiometric titration to measure the end amino and the end carboxyl content in PA6,in order to analyze and identify the uncertainty factors affecting the determination process,and all uncertainty components were evaluated。The results showed that uncertainty arising from the concentration of standard titration solution and volume of consumption standard titration solution,which was the greatest contribution to the total uncertainty,the second was the repeatability of measurement。
Key words:PA6 ;potentiometric titration method;the end amino;uncertainty
收稿日期:2016-03-09
作者简介:周丽华(1985-),女,江苏淮安人,工程师,主要从事化学分析测试和研究工作。
中图分类号:O657.15
文献标识码:B
文章编号:1006-334X(2016)02-0056-06
