头孢呋辛酯的合成研究
2016-07-18曹卫凯
曹卫凯
(西安万隆制药股份有限公司,陕西西安 710119)
研究论文
头孢呋辛酯的合成研究
曹卫凯
(西安万隆制药股份有限公司,陕西西安710119)
摘要:利用7-氨基头孢烷酸(7-ACA)合成头孢呋辛酯,同时对合成过程及关键点进行优化。首先7-ACA在甲醇和水的混合溶剂中低温水解,生成D-7-ACA,不经分离,直接进行7-位酰化反应,经结晶分离干燥后得到关键中间体去氨甲酰基头孢呋辛酸(DCC),收率可达84.8%,再经过与氯磺酸异氰酸酯(CSI)反应完成C-3位的氨甲酰化改造,得到头孢呋辛酸的溶液,结晶分离干燥后,收率可达91.4%,最后与1-溴乙基乙酸酯缩合得到头孢呋辛酯,收率可达93.8%,总合计收率达72.7%。该工艺具有高收率、低成本、易操作等特点,极具有工业化生产价值。
关键词:头孢呋辛酸头孢呋辛酯合成工业化
头孢呋辛酯是头孢呋辛(API)的前体药物,属于半合成的第二代广谱头孢菌素类药物,是英国葛兰素史克(GSK)公司开发的头孢菌素类抗生素,本品抗菌谱广,对多种革兰氏阳性和革兰氏阴性细菌有效,同时对β-内酰胺酶稳定,由于其疗效确切,肾脏毒性低、副作用小[1-2],被广泛应用于对抗敏感菌引起的各类感染。其抗菌作用机制是通过结合细菌蛋白,抑制细菌细胞壁的合成,使细菌细胞壁破坏缺陷,菌体内物质外漏,致菌体死亡[3-5]。临床使用头孢呋辛酯主要用于治疗呼吸道及耳鼻喉、皮肤软组织及泌尿生殖系统的感染,同时对败血症、脑膜炎及骨关节感染也有很好的疗效。头孢呋辛酯己成为抗感染药物中的一线用药,同时为国家基本药物,自2009年9月21日开始施行《国家基本药物目录》以来,头孢呋辛酯一直被收录其中。
头孢呋辛酯的合成是经过将头孢呋辛酸的羧基进行成酯改造而得,一般都是直接与1-溴乙基乙酸酯直接反应,得到头孢呋辛酯[6],而头孢呋辛酸合成路线有多条,主要的工艺路线有以下几种:1)以7-ACA为起始物,溶解后,用甲氧亚胺基呋喃乙酰氯进行7位氨基酰化,之后3位水解,得到3-去氨甲酰基-头孢呋辛酸,再将3位羟甲基改造得到头孢呋辛酸[7-9];2)以7-ACA为起始物,水解得3-去乙酰基-7-氨基-头孢烷酸(D-7-ACA),然后将3位的羟甲基改造为氨甲酰氧甲基,再将7位氨基酰化引入侧链甲氧亚胺基呋喃乙酸铵盐(SMIA)得到头孢呋辛酸[10];3)以7-ACA为起始物,水解得D-7-ACA,先进行7位氨基的酰化将侧链引入,得到3-去氨甲酰基-头孢呋辛酸,再用氯磺酰异氰酸酯进行3位的羟甲基改造,同样可得头孢呋辛酸[11-17]。其中方法1,由于先进行7位氨基改造,这样使得在水解3位时,7位酰胺键也发生断裂,产生杂质D-7-ACA,使得最终产品纯度大大降低;方法2虽然先进行了3位酯键(R-CH2-O-COCH3)的水解,但之后直接进行3位羟甲基(R-CH2-OH)改造,得到氨甲酰氧甲基取代物(R-CH2-O-CONH2),这样会使得在进行7位氨基改造时,3位裸露的氨基同样会进行反应,产生3位氨基的酰化杂质(R-CH2-O-CONH-R1),R1为甲氧亚胺基呋喃乙酰。
为了制备高纯度的头孢呋辛酯,本研究以方法3为基础,同时对合成过程关键工艺参数进行优化,提高成品质量,同时将其收率大大提高,经过笔者优化后的头孢呋辛酯合成工艺收率,期望远高于已有的报道合成方法[6,9]。
1试验
1.1主要合成原料与试剂
7氨基头孢烷酸7-ACA,纯度≥98.5%,武汉楷伦;甲氧亚胺基呋喃乙酸铵盐SMIA,纯度≥99.0%,江苏清泉;氯磺酰异氰酸酯CSI,工业级,四平精细化工;1-溴乙基乙酸酯,工业级,四平精细化工。
三氯氧磷、DMF、甲醇、乙腈、乙酸乙酯、异丙醚均为分析纯,均为国药集团化学试剂有限公司制;碳酸氢钾,分析纯,为天津福晨化学试剂厂制;活性炭,徐州天正活性炭厂制。
1.2主要仪器设备
酸度计,梅特勒FE20K Plus型;低温循环泵,长城科工贸DLSB-30/-40型;自动水分测定仪,先驱威锋ZDJ-3S型;高效液相色谱仪,岛津LC-2010 CHT型。
1.3实验过程
具体合成工艺为:以7-ACA水解得到D-7-ACA,产物不经分离,直接在水相中与7位侧链酰氯进行混合相反应,制得3-去氨甲酰基-头孢呋辛酸(DCC),DCC经分离、干燥后与CSI反应,水解得到头孢呋辛酸溶液,之后进行结晶、过滤、干燥后可得头孢呋辛酸成品,将头孢呋辛酸溶解成盐,成盐后不经过分离,直接加入1-溴乙基乙酸酯成酯,经过萃取、脱色处理,之后用析晶溶剂析晶,最后过滤洗涤,减压干燥得到头孢呋辛酯成品,如图1所示。
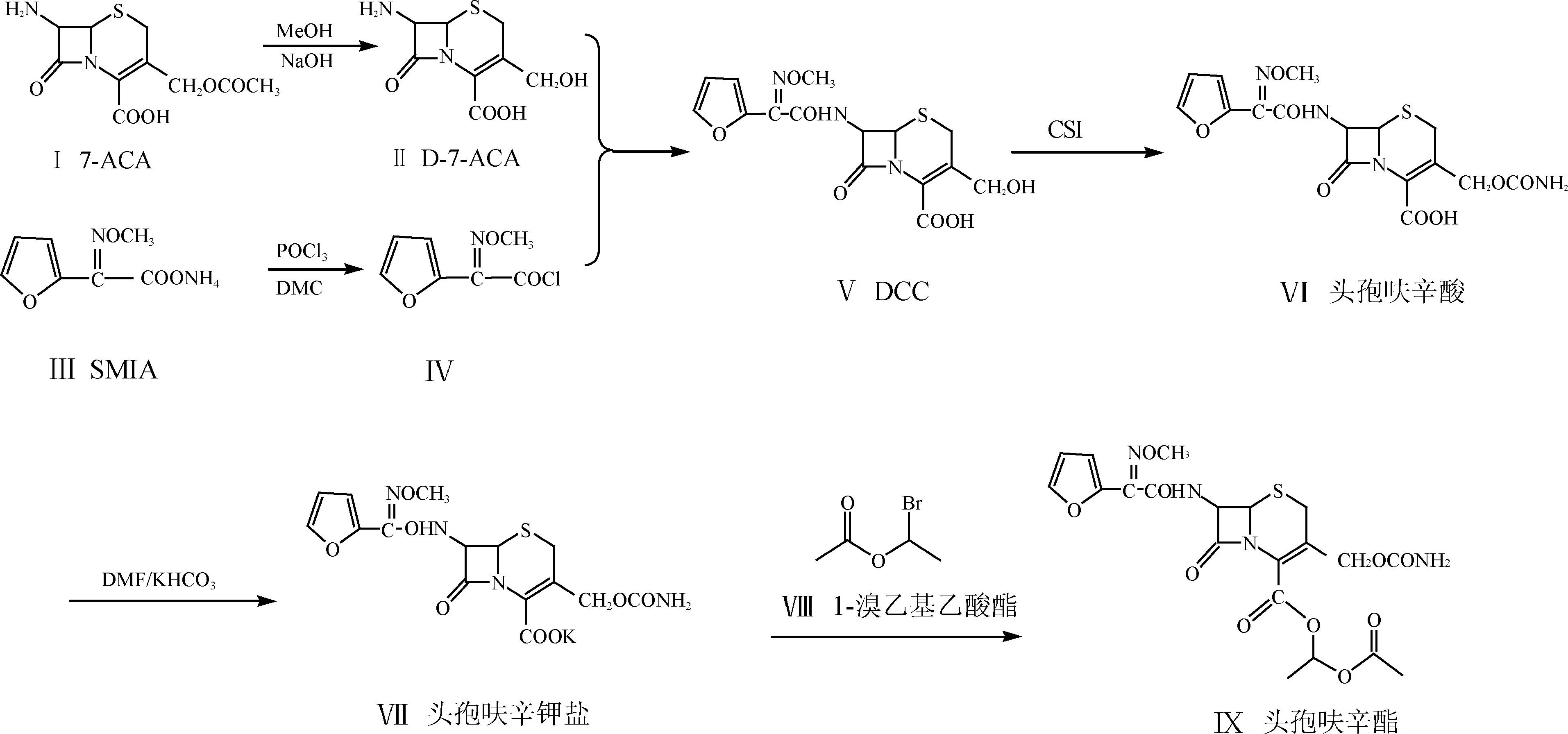
图1 头孢呋辛酯的合成路线
1.3.1甲氧亚胺基呋喃乙酰氯(Ⅳ)的合成
在250 mL三口反应瓶中加入DMF(30 g,0.41 mol)、DMAC(36 g,0.41 mol)和Ⅲ SMIA(17 g,0.091 mol),之后再加入DMC(40 mL),在搅拌下降温到-20 ℃,加入三氯氧磷(16.9 g,0.110 mol),控温-15~-10℃,反应120 min,得含Ⅳ反应液,降温至(-30±5)℃备用。
1.3.23-去氨甲酰基-头孢呋辛酸DCC(Ⅴ)的合成
在500 mL三口反应瓶中加入甲醇(120 mL)、水(80 mL)和Ⅰ7-ACA(24 g,0.088 mol),搅拌下降温至-35 ℃,滴加10%氢氧化钠(60 mL),搅拌30 min后,在25 min内滴加10%盐酸(20 mL),加入备用酰氯Ⅳ,反应30 min后,加入DMC(90 mL)进行洗涤,向水相中滴加10%盐酸,调pH到2.0,过滤,滤出固体用水洗涤,真空干燥得淡黄色粉末DCC(28.5 g,0.074 mol,收率84.8%,水分0.41%)
1.3.3头孢呋辛酸(Ⅵ)的合成
在500 mL三口瓶反应中加入乙腈(97 mL),启动搅拌降温到-30 ℃,加入中间体DCC(28.5 g,0.074 mol),控温至-30~-20 ℃,加入CSI(15 g,0.106 mol),保温-28~-23 ℃,反应80 min,加入水(40 mL),反应180 min,再向反应液中加入水(200 mL),控温15~25 ℃,滴加氨水,在45 min内,调节pH到5.6,加入DMC(20 mL)萃取分层,向水层中加入10%盐酸,控制搅拌转速,调pH到2.0,过滤,滤出固体用水洗涤,真空干燥得头孢呋辛酸(29 g,0.068 mol,水分0.26%,收率91.4%)。
1.3.4头孢呋辛酯(Ⅸ)的合成
在500 mL反应瓶中加入DMF 100 mL,控制料液温度25~30 ℃,快速搅拌下投入碳酸氢钾12 g,缓慢加入头孢呋辛酸(20 g,0.047 mol),控制料液温度25~35 ℃,搅拌60 min,反应完成后,控制料液温度-15~-10 ℃,然后快速将预冷至-15℃下的1-溴乙基乙酸酯Ⅷ(11.8 g,0.071 mol)加入到混合液中,该过程控温≤-10 ℃,控制料液温度-15~-10 ℃,继续搅拌反应30~40 min,将酯化反应液加入到冷却至5 ℃以下的乙酸乙酯600 mL与1.0%NaHSO3溶液200 mL混合溶液中,控制料液温度5~10 ℃,搅拌5 min,静置15 min,收集有机层,将预冷3.0%的盐酸溶液600 mL滴加到有机层中,搅拌5 min,静置30 min,收集水层,水层用乙酸乙酯200 mL洗涤,洗涤后的水层加入活性炭1.0 g,15~25 ℃搅拌脱色30 min,过滤,控制料液温度0~10 ℃,搅拌下加入冷二氯甲烷400 mL,控制料液温度0~10 ℃,用5%的氨水调节溶液的PH 8.0~8.5,静置20 min,收集有机层,有机层用2.0%的NaCl溶液500 mL洗涤,硫酸钠干燥有机层,减压浓缩至总体积的30%,控制料液温度0~10 ℃,将冷异丙醚500 mL在30 min内加入到浓缩液中,缓慢搅拌养晶,得头孢呋辛酯的混悬液,过滤,用异丙醚适量洗涤,抽干,得头孢呋辛酯湿品,40 ℃下真空干燥,得头孢呋辛酯Ⅸ(22.5 g,0.044 mol),收率93.8%,水分:0.52%,产品纯度为99.4%(HPLC),1H-NMR(DMSO-d6)δ:9.70(m,1H),7.82(d,1H,J=1.78 MHz),6.90(m,1 H,J=5.33 MHz),6.62(m,1 H,J=1.78 MHz),6.55(m,1 H,J=1.78 MHz,J=3.52 MHz),5.82~6.76(br,2H),5.50(m,1H),5.32(m,1H),4.70(m,2H),3.95(s,3H),3.60~3.82(m, 2H),2.06(d,3H),1.52(m,3H,J=5.72 MHz).
1.4质量分析
该实验过程合成所得头孢呋辛酯成品纯度高,尤其在最后头孢呋辛酯合成步骤,增加了相转移过程,使目标产物先从有机相中转移到水相中,再从水相转移到有机相中,每一次转移都用相应溶剂进行洗涤,最后再在有机相中通过析晶溶剂将其析出,这样能使反应产生杂质有效被除掉,最终通过相转移萃取洗涤结晶出来的产品纯度比直接析晶出来产品纯度高,具体参数见下表1。
表1相转移反应对头孢呋辛酯质量的影响

指标项目未增加相转移增加相转移收率,%93.993.8HPLC纯度,%97.899.4δ-3异构体杂质,%1.90.2杂质个数(含未知)/个135
1.5计算
各个步骤收率计算方法如下,
1) DCC摩尔收率计算方法,以起始投料物7-ACA计:

其中YDCC为DCC的摩尔收率,nDCC为DCC的摩尔数,mDCC为DCC实际产出量,MDCC为DCC分子量、n7-ACA为投料物7-ACA的摩尔数,M7-ACA为7-ACA分子量、m7-ACA为7-ACA实际投料量g。
2) 头孢呋辛酸摩尔收率计算方法,以投料物DCC计:

其中Y头孢呋辛酸为头孢呋辛酸的摩尔收率,n头孢呋辛酸为头孢呋辛酸的摩尔数,m头孢呋辛酸为头孢呋辛酸实际产出量,M头孢呋辛酸为头孢呋辛酸分子量。
3) 头孢呋辛酯摩尔收率计算方法,以投料物头孢呋辛酸计:

其中Y头孢呋辛酯为头孢呋辛酯的摩尔收率,n头孢呋辛酯为头孢呋辛酯的摩尔数,m头孢呋辛酯为头孢呋辛酯实际产出量,M头孢呋辛酯为头孢呋辛酯分子量。
以起始物料7-ACA计,头孢呋辛酯总的摩尔收率为以上三步收率之积。
2结果与讨论
2.1酰氯化试剂三氯氧磷的用量对收率的影响
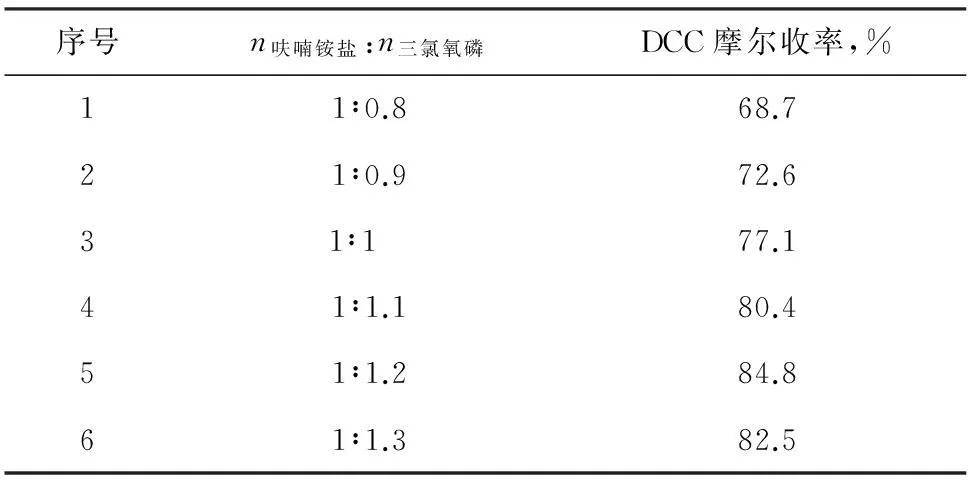
表2为酰氯化试剂三氯氧磷的用量对DCC收率的影响
表2三氯氧磷用量对反应收率的影响
序号n呋喃铵盐:n三氯氧磷DCC摩尔收率,%11∶0.868.721∶0.972.631∶1 77.141∶1.180.451∶1.284.861∶1.382.5
由表2可知,呋喃铵盐与三氯氧磷配比为1∶1.2时,最为适宜,当三氯氧磷用量少时反应不完全,收率低;随着三氯氧磷的增多,收率变化很小,同时由于三氯氧磷投入量太大会造成过量的三氯氧磷对环境造成严重危害及生产三废难处理等问题,故三氯氧磷量优选呋喃铵盐的1.2倍。
2.2DCC制备过程中盐酸加料时间对收率的影响
表3为DCC制备过程中盐酸加料时间对DCC反应收率的影响。
表3盐酸加料时间对反应收率的影响

序号加料时间/minDCC摩尔收率,%14580.123582.232584.841581.45580.3
由表3可知,加料时间为25 min时,最为适宜。对于盐酸加料时间缩短时,呋辛酸的收率变高,但当再要缩短时间时,就会适得其反,头孢呋辛酸的收率会大大降低,这是由于在酸性条件下D-7-ACA的羧基可与其3位的羟基缩合形成内酯(杂质产生反应式见下图2),导致中间体DCC纯度降低,而使最终成品的收率降低。
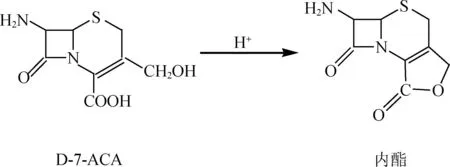
图2 杂质形成机理
2.3呋辛酸缩合时反应温度对DCC收率影响
在其他条件不变的情况下,只改变缩合反应温度,考察温度对反应收率的影响,具体见表4。
表4头孢呋辛酸缩合反应温度对收率的影响

序号缩合温度/℃反应时间/minDCC摩尔收率,%1-13~-88063.22-18~-138085.13-23~-188089.54-28~-238091.45-33~-288088.2
由表4可见,实验4较为理想,在此情况下,头孢呋辛酸的收率较高,实验1由于反应温度太高,反应产生杂质太多,最终导致产品收率大幅下降;对于实验5,由于反应温度太低,在固定的时间内反应率较低,但在该温度下,笔者通过延长反应时间进行考察,发现随着时间的延长,其中相关杂质显著提高,同时由于温度的进一步降低,制冷成本将大幅上升,考虑到最终成品质量及成本问题,该反应优选反应温度-28~-23 ℃。
2.4侧链1-溴乙基乙酸酯加入后缩合反应温度对收率影响
在其他条件不变的情况下,只改变侧链1-溴乙基乙酸酯加入后缩合反应温度(头孢呋辛酯缩合反应温度),观察对头孢呋辛酯反应收率的影响,见表5所示。
表5头孢呋辛酯缩合反应温度对收率的影响
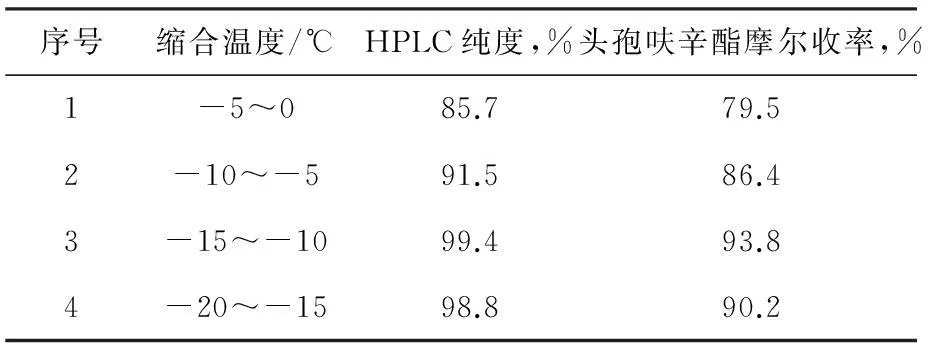
序号缩合温度/℃HPLC纯度,%头孢呋辛酯摩尔收率,%1-5~085.779.52-10~-591.586.43-15~-1099.493.84-20~-1598.890.2
由表5可见,实验3较为理想,在此情况下,头孢呋辛酯的收率较高,实验1和2由于反应温度较高,形成大量杂质,一般生成的杂质主要为δ-3异构体(产生机理见下图3),使得头孢呋辛酯纯度降低的同时收率也大大降低,实验4反应温度太低,虽然不会导致反应过程产生大量杂质,但这样会使得反应不完全,会残留少量原料,使得纯度降低,同时,反应温度太低,在生产上能耗很大,故考虑到最终的质量、成本以及收率,优选实验3,即头孢呋辛酯缩合反应温度选择-15~-10 ℃。
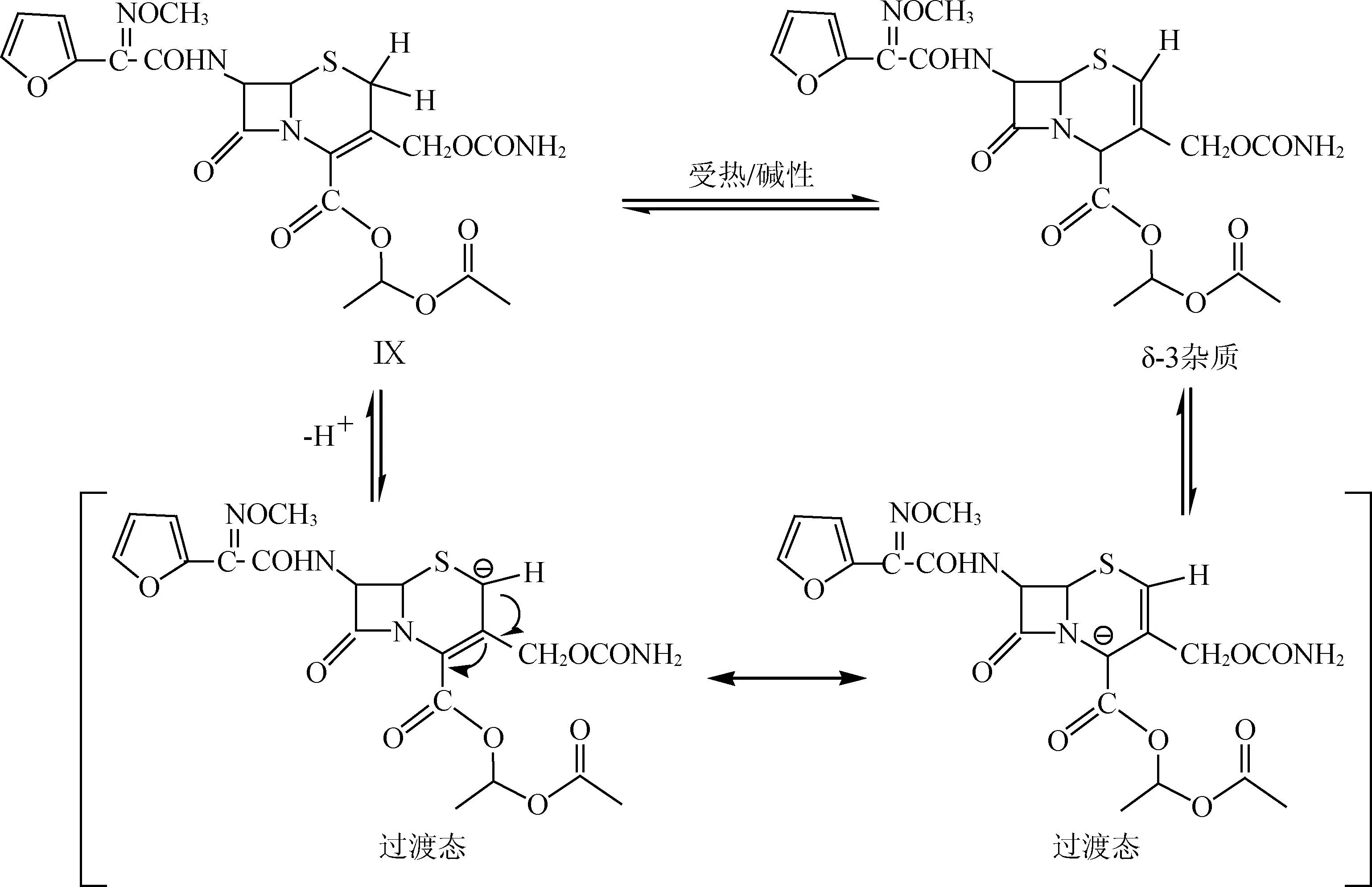
图3δ-3杂质形成机理
3结论
本研究顺利地合成了头孢呋辛酯,首先,对酰氯化试剂三氯氧磷的用量进行了优化,该过程兼顾降低生产成本和对环境的保护理念,最终得出最优投料量,即nSMIA∶nPOCl3为1∶1.2;其次,对DCC中间体制备过程中盐酸滴加时间进行优化,该步骤十分关键,盐酸滴加时间在影响质量的同时也会影响到产品收率,经过大量实验最终得出最优滴加时间25 min;再次,对中间体呋辛酸缩合反应时温度进行了优化,得最优反应温度-28~-23 ℃;最后,对头孢呋辛酯的缩合反应温度进行优化,确定头孢呋辛酯缩合反应温度在-15~-10 ℃。
通过对头孢呋辛酯合成过程的关键点和参数进行了优化,使得中间体Ⅴ、头孢呋辛酸(Ⅵ)和头孢呋辛酯成品Ⅸ的收率分别为84.8%、91.4%和93.8%,总收率高达72.7%,该反应具有收率高、成本低、操作容易和环境友好等特点,并具有工业化生产价值。
参考文献:
[1]钟宇眉.头孢呋辛酯片治疗寻常痤疮45例疗效观察[J].中国麻风皮肤病杂志,2011,27(8):592-592.
[2]王久伶,于沛涛,涂银萍,等.依替米星联合头孢呋辛酯治疗14~18岁社区获得性肺炎临床分析[J].临床肺科杂志,2013,18(8):1376-1377.
[3]刘跃建,于云芝,李小惠,等.注射用头孢呋辛酯临床研究[J].中国抗生素杂志,2002,27(12):734-737.
[4]王荣耕.具有较好市场前景的头孢类抗生素-头孢呋辛酯[J].精细化工原料及中间体,2003,(11):15-18.
[5]薛亮.头孢类抗生素及中间体发展浅析[J].精细化工原料及中间体,2007,(3):27-29.
[6]张军立,白鹏.头孢呋辛酯合成方法研究[J].河北工业科技,2006,23(6):328-329.
[7]Bunnel C A.Process for preparing acid halides:US,5084568[P].1992-01-28.
[8]Tsuji T,Okada T.Hydroxymethyl cephem compounds and their preparation:EP,0204517A2[P].1987-09-23.
[9]李爱军,周雪琴,刘东志.头孢呋辛钠合成工艺优化[J].天津大学学报,2007,40(11):1342-1345.
[10] Siviero E,Cabri W,Terrassan D M.Process for the preparation of β-lactam derivatives:US,6458558[P].2002-10-01.
[11] Deshpande P B,Deshpande P N,Khadangale B P,et al.Process for the preparation of cef -uroxime sodium:US,20040092735[P].2004-03-13.
[12] Kremminger P.Intermediates in cephalosporin production:US,20030171577[P].2003-09-11.
[13] Cabri W,Siviero E,Darverlo P L,et al.Process for the synthesis of β-lactam derivatives: US,6642378[P].2003-11-04.
[14] Tyagi O D,Yadav G C,Handa V K.Process for the preparation of highly pure crystalline (R,S)-cefuroxime axetil:US,6833452[P].2004-12-21.
[15] 王建军,张鹏.一种合成头孢呋辛酸的方法:中国,104072516A[P].2014-06-18.
[16] 魏青杰,刘东,曹卫凯,等.头孢呋辛酸、头孢呋辛酯生产新技术开法[EB/OL].河北省科学技术研究成果公报第四号,河北省科学技术厅,2012,87-88.http://www.hebstd.gov.cn/banshi/tongzhi/kejiting/content_79190.htm
[17] 曹卫凯.头孢呋辛酸的合成研究[J].化工与医药工程,2016,37(2):35-38.
Optimization of synthesis technology of cefuroxime axetil
Cao Weikai
(Xi’anWanlongPharmaceuticalCo.Ltd.,Xi’anShaanxi710119,China)
Abstract:On the synthesis of cefuroxime axetil from 7-aminocephalosporin acid(7-ACA),the synthetic process and critical points were optimized. Firstly,the 7-ACA was hydrolyzed in the low temperature mixture of methanol and water to obtain D-7-ACA,without separation,the acylation reaction was carried out at location C-7 site directly. After crystallization,separation and drying,the crirical intermediate DCC was obtained with the yield of 84.8%. Then through the reaction with chlorosulfonyl isocyanate(CSI),the formamyl transformation at location C-3 had been completed and the solution of cefuroxime acid was obtained. After crystallization,separation and drying,the output yield could reached 91.4%. At last,through the condensation with 1-bromoethyl acetate, the cefuroxime axetil was obtained,with the yield of 93.8%,and the total yield was 72.7%,This process had the characteristics of high yield, low cost, easy to operate, and extremely had the industrial production value.
Key words:cefuroxime acid; cefuroxime axetil; synthesis; industrialization
收稿日期:2016-05-20
作者简介:曹卫凯(1987-),陕西渭南人,执业药师,主要从事药物合成和精细化工领域的研究。
中图分类号:TQ465
文献标识码:A
文章编号:1006-334X(2016)02-0004-05
