程序升温汽化-气相色谱-三重四极杆串联质谱法(PTV-GC-MS/MS)同时测定小麦中的109种农药残留
2016-07-16赵振宇吴建霞汪地强高川川楼小华贵州茅台酒股份有限公司技术中心贵州仁怀56450贵州省烟草质量监督检测站贵州贵阳55005
袁 河,赵振宇,吴建霞,王 垄,聂 叶,汪地强,王 莉,高川川,楼小华(.贵州茅台酒股份有限公司技术中心,贵州仁怀56450;.贵州省烟草质量监督检测站,贵州贵阳55005)
程序升温汽化-气相色谱-三重四极杆串联质谱法(PTV-GC-MS/MS)同时测定小麦中的109种农药残留
袁河1,赵振宇1,吴建霞1,王垄1,聂叶1,汪地强1,王莉1,高川川2,楼小华2
(1.贵州茅台酒股份有限公司技术中心,贵州仁怀564501;2.贵州省烟草质量监督检测站,贵州贵阳550025)
摘要:建立了一种同时测定小麦中109种农药残留(121个组分)的程序升温汽化-气相色谱-三重四极杆串联质谱(PTV-GC-MS/MS)检测方法。小麦样品经QuEChERS技术快速提取与净化,PTV进样后在毛细管柱TR-pesticideII上分离,以保留时间窗口和特征SRM(选择性反应监测)离子对定性、峰面积定量。结果表明:(1)109种农药在小麦中的检出限(LOD)为0.6~10.6 μg/kg,定量限(LOQ)为2.1~35.5 μg/kg;(2)在1~950 μg/L范围内,线性相关系数为0.9956~1.0000;(3)在小麦样品中添加浓度在7.3~620 μg/kg之间时,平均回收率在66.6%~118.2%之间,RSD为1.0%~18.0%;(4)该方法对农药品种覆盖面广、前处理简单快速、节省溶剂,一次进样可分析109种农药,准确、灵敏。
关键词:程序升温汽化-气相色谱-三重四极杆串联质谱;小麦;农药残留
优先数字出版时间:2016-04-01;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160401.1352.007.html。
小麦是世界上最早的栽培作物之一,富含淀粉、蛋白质、脂肪、矿物质、维生素A及维生素C等,在地球上分布很广,遍布世界各大洲,自北极圈到非洲和美洲的南端,总种植面积约2亿公顷[1]。在我国,小麦不仅是一种重要的主食原料,也是酿造白酒的主要原料,在白酒风格形成和呈香呈味上起着重要作用。小麦在生产、储运过程中,为了保证粮食产量和储藏,农药的使用难以避免。目前,欧盟、美国和日本颁布了有关于小麦的多项农药残留限量标准并不断更新。2014年3月,农业部与国家卫生计生委联合发布的最新食品安全国家标准《食品中农药最大残留限量》(GB 2763—2014[2]),在该标准中,关于小麦的农残限量指标有134项,在GB 2763—2012[3]的基础上增加了42项。从GB 2763—2005[4]到GB 2763—2014,小麦中所涉及的农药种类增加的同时,其限量也在不断降低,传统的GC和GC-MS分析手段已无法满足部分农药越来越低的限量要求。因此,建立一种前处理简便、灵敏度高、一次进样能同时分析多种农药残留的分析方法,应用于白酒企业监控酿酒原料小麦的质量极为必要。
随着分析技术的不断发展,传统的一种方法一种残留的检测技术逐步被多种、多类农残的高通量残留分析技术所取代,分析仪器也从单一的气相色谱(GC),发展到气相色谱-质谱联用(GC/MS),以及气相色谱-串联质谱联用(GC-MS/MS),甚至全二维气相色谱-飞行时间质谱(GC×GC-TOF-MS)[5-11]。用气相色谱法(GC)测定农药时,通过保留时间定性,易产生假阳性且基质干扰严重;气相色谱-质谱法(GC-MS)通过保留时间结合特征离子碎片定性,优于气相色谱(GC),但由于样品基质产生的离子碎片会对某些农药产生干扰,所以在定性方面尚存在不足,定量灵敏度也不够要求;气相色谱-串联质谱法(GC-MS/MS)采用SRM(选择反应监测)数据采集模式,采取“保留时间+定性定量离子对+丰度比”三重定性方式,可避免样品基质的串扰而出现的假阳性,使定性定量结果更加可靠,已逐渐被广泛应用[12-19],但在酿酒原料的农药残留分析上仍不多见。本研究试图建立QuECh-ERS法处理样品,同时测定小麦中109种农药残留(121个组分)的气相色谱-三重四极杆串联质谱分析方法,为酿酒原料安全性的监控和评价提供技术支撑。
1材料与方法
1.1材料
小麦:优质小麦。
仪器:Thermo Scientific Trace GC Ultra-TSQ Quantum XLS气相色谱-三重四极杆串联质谱联用仪(美国ThermoFisher Scientific公司);Talboys/Standard Multi-Tube Vortexer漩涡振荡器(美国Talboys公司);HITACHI CR22G III高速离心机(日本日立公司)。
试剂:乙腈、甲苯(色谱纯,美国TEDIA试剂公司);艾科浦超纯水系统(艾科浦国际有限公司);QuEChERS试剂包1(4 g无水硫酸镁,1 g氯化钠,1 g柠檬酸钠和0.5 g柠檬酸氢二钠)、QuEChERS试剂包2(900 mg无水Mg-SO4+150 mg C18 E+150 mg乙二胺-N-丙基硅烷,PSA)(美国Agilent公司);0.22μm有机相滤膜(美国Agilent公司);109种农药标准物质及内标磷酸三苯酯(AccuStandard公司)。
标准溶液配制:用甲苯配制浓度在14.0~33.4 mg/L的混合标准液和20 mg/L内标磷酸三苯酯(TPP)工作液,存于-18℃冰箱中备用。
1.2样品前处理
1.2.1小麦样品制备
按照粮食抽样标准GB 5491—1985[20]取代表性小麦样品约100 g,用粉碎机粉碎,过40目筛,混匀装入洁净的密封袋,避光低温保存。
1.2.2提取
称取5 g粉末样品于50mL具盖离心试管中(精确至0.001 g),加入8mL超纯水,混匀后静置30min,加入10mL乙腈和200μL TPP内标工作液,以2000r/min漩涡振荡5min,-18℃冷冻10min,取出后加入QuEChERS试剂包1,立即手持摇匀,2000r/min漩涡振荡5min,再以6000r/min离心5min。
1.2.3净化
吸取1.2.2上清液3mL于装有QuEChERS试剂包2的15mL离心管中,立即手持摇匀,以2000r/min漩涡振荡5min,6500r/min离心5min,吸取净化液约1.0mL,过0.22μm有机相滤膜后进GC-MS/MS分析,内标法定量。
1.3实验条件
1.3.1色谱条件
进样体积:1μL;进样模式:PTV不分流进样;Surge压力:150 kPa(1min);进样口初始温度:90℃,进样后以10℃/s快速升至280℃;毛细管柱:TR-Pesticide II[(50%苯基)甲基聚硅氧烷,30m×0.25 mm×0.25μm+5m× 0.25μm Guard +5m(预柱)];载气:He,纯度≥99.999%;载气流速:1.2mL/min;色谱柱升温程序:90℃保持5min,然后以25℃/min升至180℃,保持15min,再以5℃/min升至280℃,保持4.5min;色谱-质谱接口温度:290℃。
1.3.2质谱条件
离子源温度:250℃;发射电流:50 μA;离子源:封闭式EI源;碰撞气压力:1.2 mTorr(Ar);溶剂延迟时间:7.0min;扫描模式:MRM(多反应离子监测),采用“EZ-Method”设定方法,“Start time”设定为目标化合物扫描时间起点,为“目标化合物保留时间RT-0.75min”,在“End time”设定为目标化合物扫描时间终点,为“目标化合物保留时间RT+0.75min”。各农药的定性离子对、定量离子对、碰撞能及保留时间见表1。
2结果与讨论
2.1样品的提取
由于所分析的农药种类较多,极性差异大,农药与小麦中的脂类物质结合及紧密,因而对提取条件要求较高。乙腈是一种极性覆盖范围较广的提取溶剂,且对小麦样品中的蜡质、色素、糖类溶解较少。因此,选择乙腈作为本实验的提取溶剂。由于小麦样品含水较少,农药与样品结合紧密,在前处理过程中将样品粉碎,并加入一定量的水润湿以使细胞充分膨胀,使乙腈渗入组织与目标物充分接触,从而提高萃取效率。加入柠檬酸钠和柠檬酸氢二钠缓冲盐,将pH值调节到适当范围,使大部分遇酸或遇碱不稳定的农药保持稳定从而提高回收率。通过使用比无水硫酸钠脱水能力更强的无水硫酸镁除去提取液中的水分,促使农药进入有机相;-18℃冷冻一段时间,防止无水硫酸镁在除水时放热导致温度过高而影响热不稳定的农药。
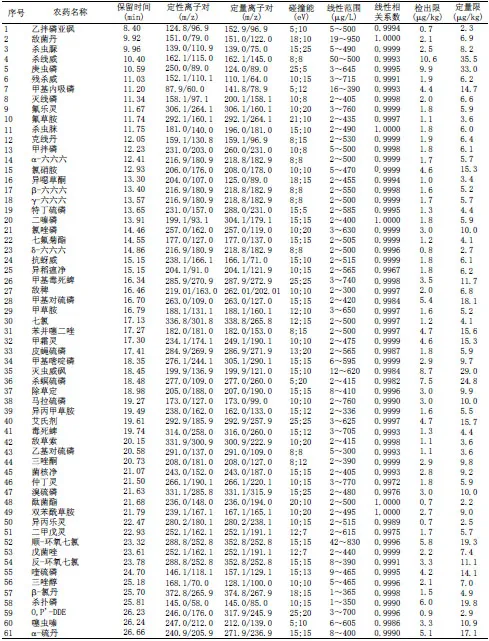
表1多反应监测模式下109种(121个组分)农药的保留时间、监测离子对、碰撞能、线性范围、线性相关系数、检出限、定量限
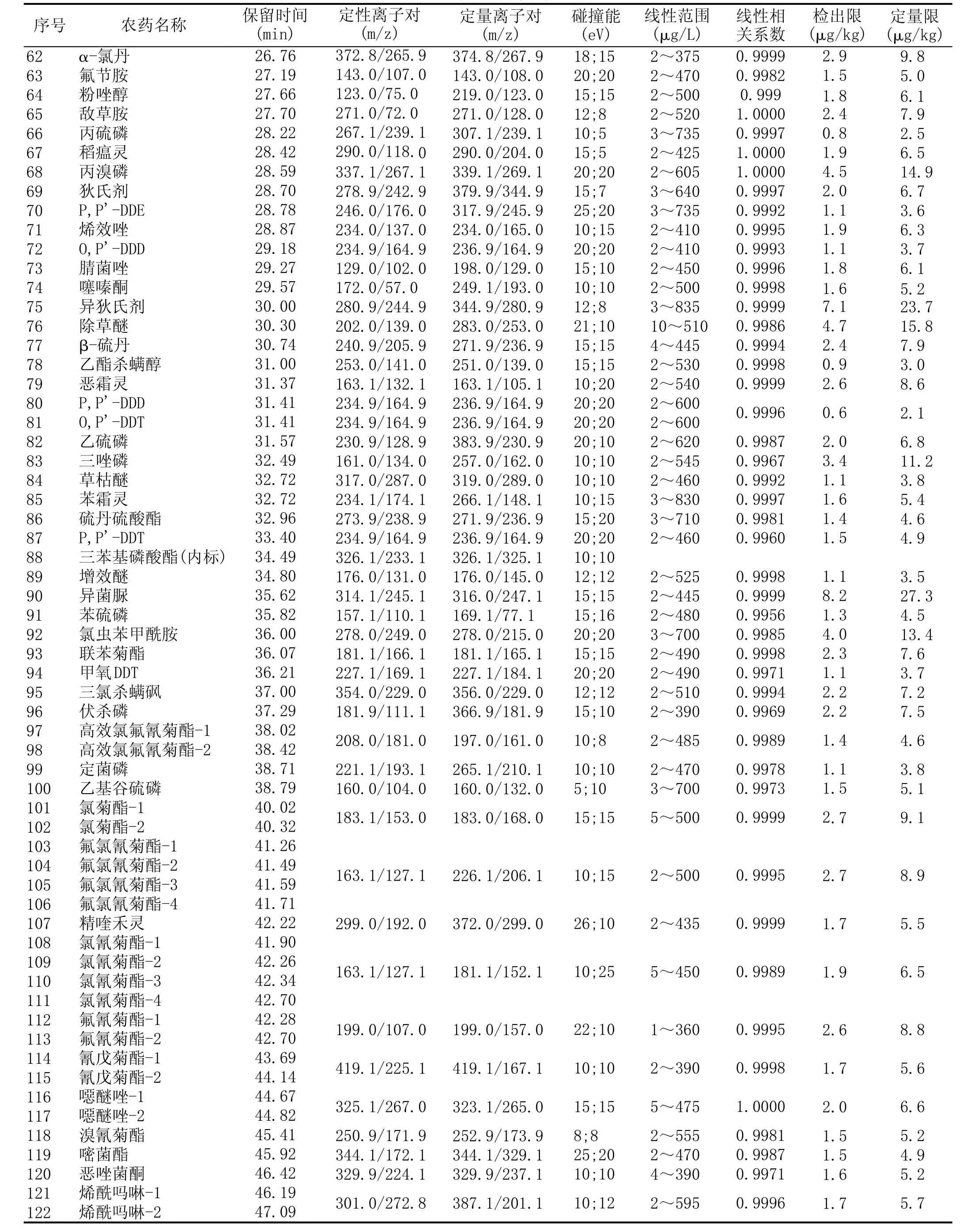
续表1多反应监测模式下109种(121个组分)农药的保留时间、监测离子对、碰撞能、线性范围、线性相关系数、检出限、定量限
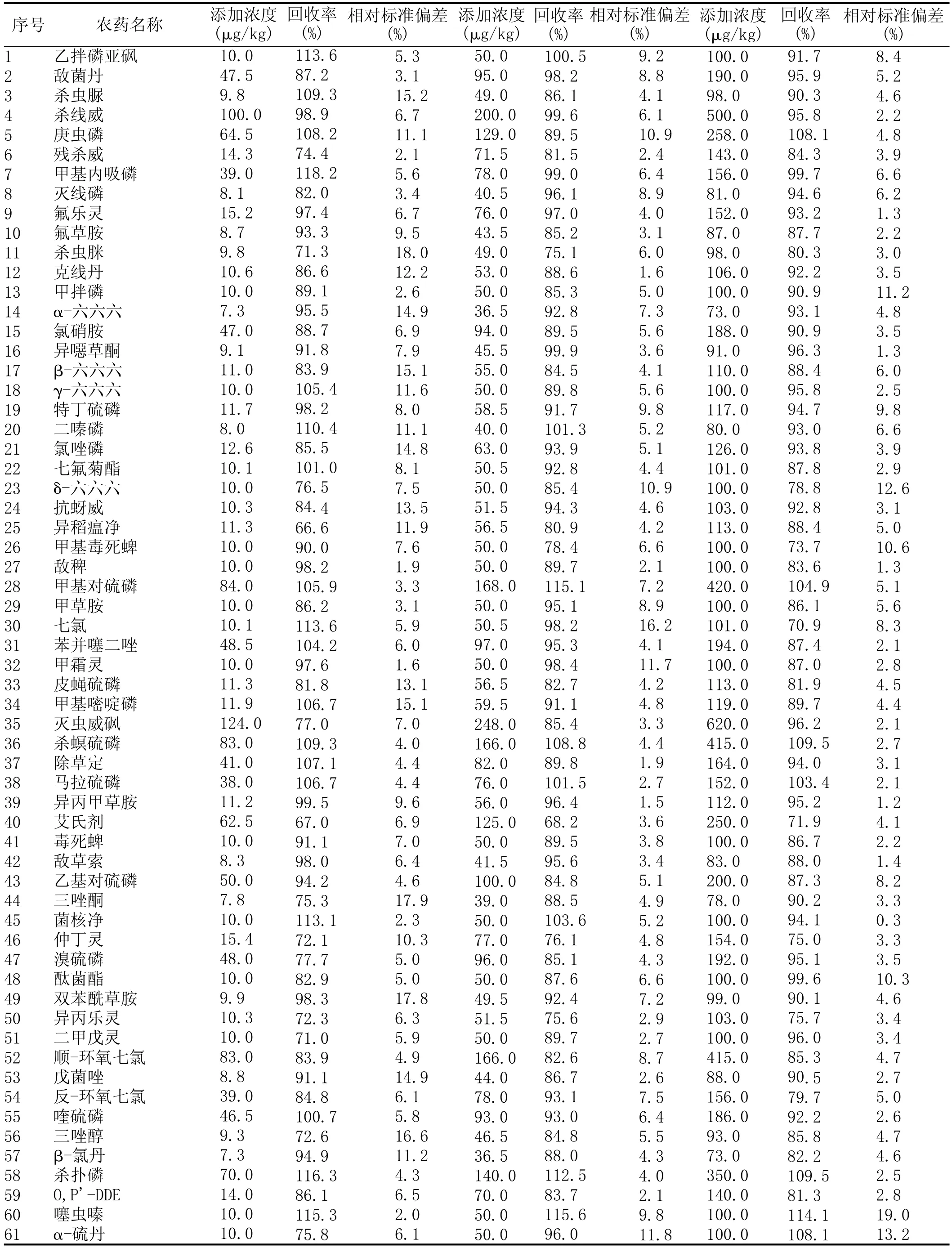
表2 109种农药(121个组分)在小麦中3个添加水平的平均回收率和相对标准偏差(n=6)
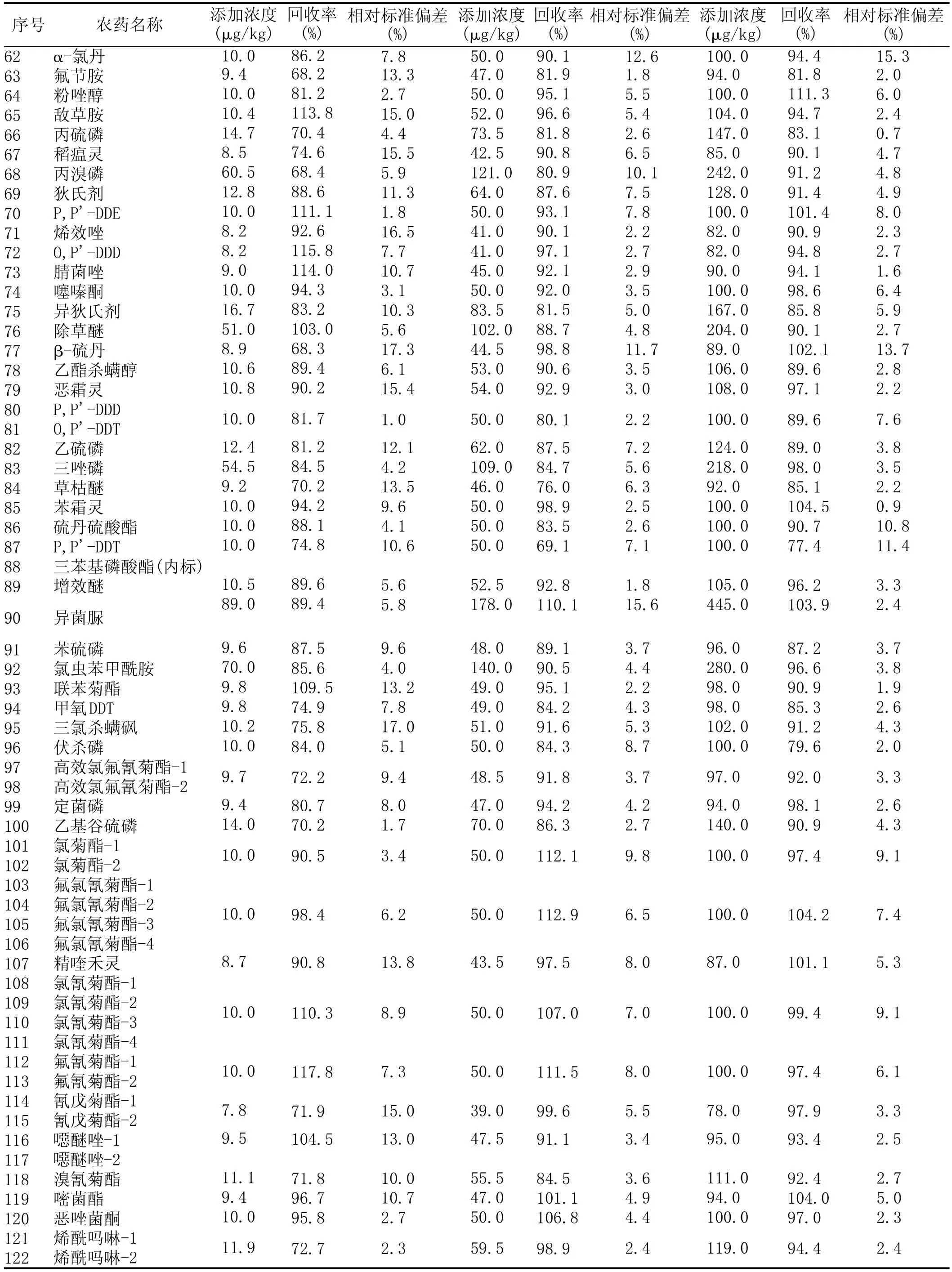
续表2 109种农药(121个组分)在小麦中3个添加水平的平均回收率和相对标准偏差(n=6)
2.2样品的净化
QuEChERS方法净化的实质是利用分散固相萃取材料吸附提取液中的杂质而达到样品净化的目的。常用的分散固相萃取材料有C18、石墨化炭黑、PSA和无水硫酸镁等,在实际应用中根据基质特性和所分析目标物的种类选择分散固相萃取材料的种类和用量,并以净化效果和回收率作为评价标准。本实验采用含有900 mg无水硫酸镁、150 mg C18E和150 mg乙二胺-N-丙基硅烷(PSA)的QuEChERS试剂包对样品提取液进行净化。其中C18的作用是吸附样品中的脂类物质和一些非极性的干扰物;PSA用于去除样品中极性基质成分如脂肪酸、亲脂性色素和糖类等杂质;无水硫酸镁用于除去有机层中的微量水分,避免水分直接进入色谱柱。
2.3SRM质谱参数的优化
目标物SRM参数的优化包括母离子、子离子和碰撞能量。首先,对质量浓度为1~3 mg/L的各单独标准品母液在30~600m/z之间进行全扫描,获得保留时间和一级质谱图(109种农药混标的全扫描色谱图见图1),从一级质谱图中选择丰度较高、质荷比较大、特征性强的离子作为母离子,在5 eV、10 eV、15 eV、20 eV、25 eV、30 eV、35 eV碰撞能条件进行子离子扫描,得到二级质谱图,选择丰度较高、质荷比较大、特征性强的离子作为子离子,并记录对应的碰撞能量,再在记录的碰撞能量附近缩小能级,做二次能量优化得到最佳碰撞能量。部分农药的离子对和碰撞能量还可以从Thermo Fisher公司农残库(SRM Transitions)中检索或查询相关文献而得。扫描时间窗口一般设置为“保留时间±0.75min”,少数农药如氯氰菊酯和氟氰菊酯因其同分异构体的存在分别出现4个和2个相连的色谱峰(图2所示),其出峰时间窗口相对较宽,因此设置其扫描时间窗口为“保留时间±1.25min”,确保目标化合物在设定的扫描时间窗口出峰,同时能容忍目标化合物的保留时间在一定程度上的偏移。109种农药(121个组分)的离子对、碰撞能、保留时间等参数见表2,在SRM模式下采集的色谱图见图3。
在分析中,有的农药保留时间重合,但质谱的高通量可克服这一不足,实现准确的定量分析。图2所示氯氰菊酯(离子对181.1→152.1)与氟氰菊酯(离子对199.0→ 157.0)、图4所示抗蚜威(离子对238.1→166.1)与异稻瘟净(离子对204.1→121.9)两组目标物同时出峰,但各目标物SRM离子对不同,从而实现准确定量分析。另外,在此方法的色谱分析条件下,P,P'-DDD与O,P'-DDT的出峰时间均为第31.41min,SRM离子对均为(234.9→164.9)与(236.9→164.9),定量时以P,P'-DDD与O,PDDT的含量的总和计,在GB 2763—2014、欧盟和日本肯定列表的限量标准中均是以其几种异构体的总量计,在实际应用中不影响对样品是否合格的判断。
2.4线性关系和方法检出限、定量限
用不含待测目标物的小麦样品按照1.2所述进行前处理,操作时不加内标,处理后所得溶液为小麦基质溶液,用适量小麦基质溶液、混合农药标准溶液及内标工作液,配制成含有等量内标的浓度在1~950 μg/L之间7个浓度点,以目标物与内标的峰面积比值作为纵坐标,目标物的浓度作为横坐标,作图得到线性范围和线性相关系数;以每种农药信噪比S/N≥3时的添加浓度确认检出限(LOD),以S/N≥10时的添加浓度确认定量限(LOQ)。结果显示,在相应的质量浓度范围内,各目标物与内标的峰面积比值与其质量浓度均呈良好的线性关系,相关系数在0.9956~1.0000之间,其中有78种农药的相关系数在0.999~1.0000之间,方法的检出限LOD在0.6~10.6 μg/kg之间,定量限LOQ在2.1~35.5 μg/kg之间,有84种农药的定量限在10 μg/kg或以下,在各农药的线性范围、线性相关系数、LOD和LOQ见表1。
2.5方法的回收率与精密度
分别在空白小麦样品中添加高中低3个水平的109种农药标准品,添加浓度在7.3~620 μg/kg之间,每个水平做3个平行样品,同时做溶剂空白和样品空白对照,按1.2所述方式处理后进仪器分析,每个水平重复测定6次。各农药的具体添加浓度、平均回收率和相对标准偏差见表2。各农药的平均回收率在66.6%~118.2%之间,相对标准偏差在1.0%~18.0%之间,说明本方法有良好的回收率和精密度,满足多种农残的分析要求。
2.6样品测定
应用本方法对30份从某市场采购的小麦样品进行109种农药残留测定,其中1份检出马拉硫磷,其含量为12.96 μg/kg,其余未检出。
3 结论
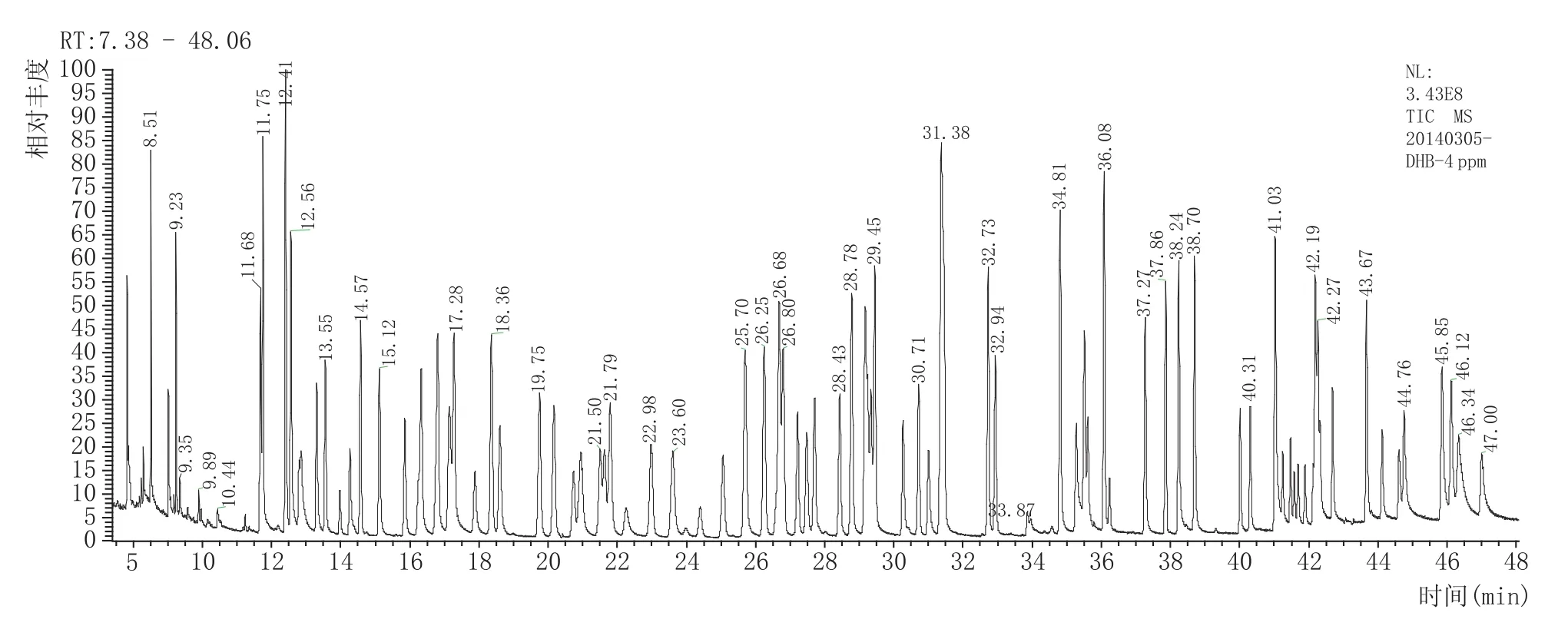
图1 109种农药(121个组分)全扫描总离子流图
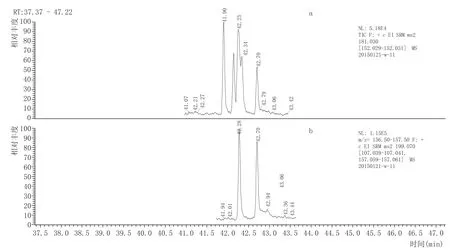
图2氯氰菊酯(a)和氟氰菊酯(b)SRM色谱图
建立了基于QuEChERS前处理技术的气相色谱-三重四级杆串联质谱法分析小麦中的109种农药残留。该方法具有对农药品种覆盖面广、前处理简单快速、节省溶剂、一次进样实现多种农药组分分析等特点,适用于酿酒原料小麦中多种农药残留的快速确认和定量检测,能在企业原料进厂时的质量监控中发挥积极作用。
参考文献:
[1]曹亚萍.小麦的起源、进化与中国小麦遗传资源[J].小麦研究,2008,29(3):1-10.
[2]国家卫生和计划生育委员会.食品中农药最大残留限量:GB 2763—2014[S].北京:中国标准出版社,2014.
[3]Abhilash P C,Singh V,Singh N.Simplified determination of combined residues of lindane and other HCH isomers in vegetables,fruits,wheat,pulses and medicinal plants by matrix solid-phase dispersion(MSPD)followed by GC-ECD[J].Food Chemistry,2009,113(1):267-271.
[4]许秀丽,李礼,丁罡斗,等.大米中13种有机磷农药的固相萃取结合大体积进样/气相色谱-质谱法快速分析[J].分析测试学报,2008,27(3):30-33.
[5]赵祥梅,董英,王和生,等.QuEChERS-气-质联用法检测大米中12种农药残留物[J].中国食品学报,2010,10(2):214-220.
[6]Kolberg D I.,Prestes O D,Adaime M B,et al.Development of a fast multi-residue method for the determination of pesticides in dry samples(wheat grains,flour and bran)using QuEChERS based method and GC-MS[J].Food Chemistry,2011,125(4):1436-1442.
[7]陈其勇,葛宝坤,韩红芳,等.粮谷中11种二硝基苯胺类除草剂残留量的气相色谱-串联质谱法测定[J].分析测试学报,2011,30(5):573-576.
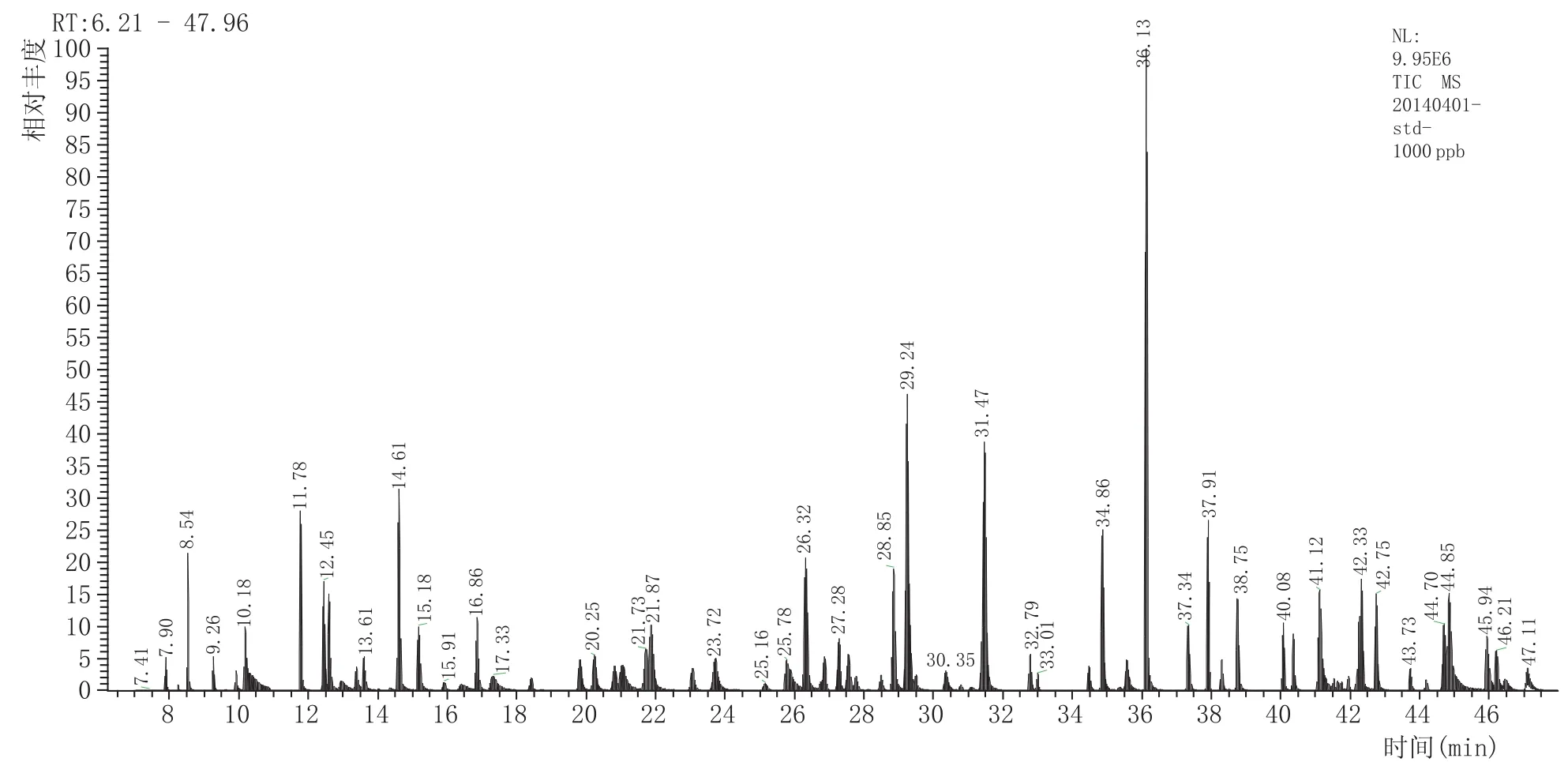
图3 109种农药(121个组分)选择性反应监测总离子流图(小麦基质中)
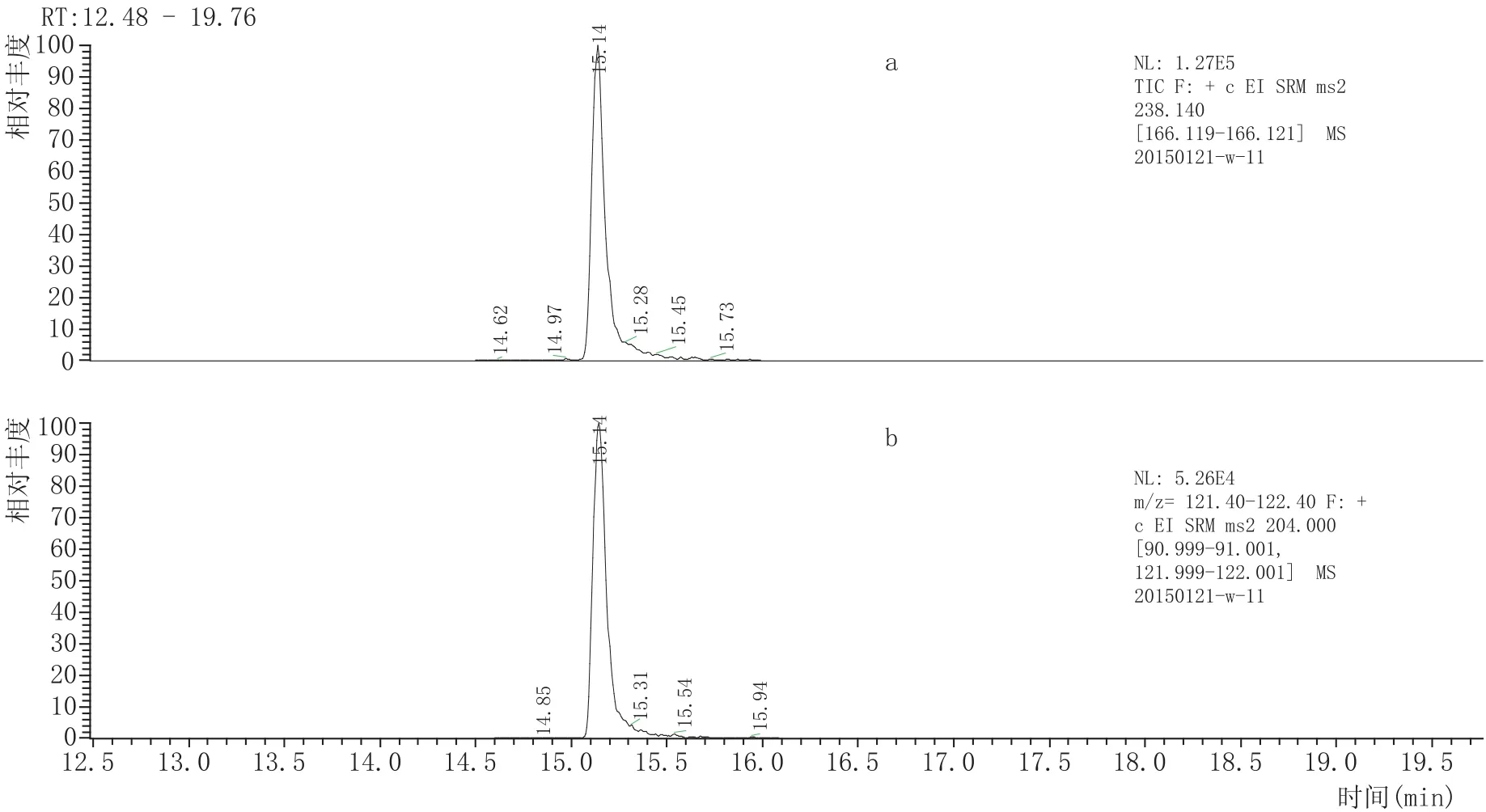
图4抗蚜威(a)与异稻瘟净(b)SRM色谱图
[8]马智玲,赵文,李凌云,等.气相色谱-三重四极杆串联质谱法快速测定蔬菜水果中129种农药的残留量[J].色谱,2013,31(3):228-239.
[9]姜俊,李培武,谢立华,等.固相萃取-全二维气相色谱/飞行时间质谱同步快速检测蔬菜中64种农药残留[J].分析化学,2011,39(1):72-76.
[10]杨芳,李蓉,卢俊文,等.GC-MS/MS法检测果蔬中50种农药残留[J].现代预防医学,2013,40(24):4569-4573.
[11]楼小华,高川川,朱文静,等.PTV-GC-MS/MS同时测定烟草中202种农药残留[J].烟草科技,2013(8):45-57.
[12]程志,张蓉,刘韦华,等.气相色谱-串联质谱法快速筛查测定中药材中144种农药残留[J].色谱,2014,32(1):57-68.
[13]马君刚,丁春瑞,张莹.GC-MS/MS法测定白酒中邻苯二甲酸酯类化合物[J].食品工业,2014,35(5):224-227.
[14]莫李桂,马盛韬,李会茹,等.气相色谱三重四极杆串联质谱法检测土壤中氯代多环芳烃和溴代多环芳烃[J]分析化学,2013,41(12):1825-1830.
[15]姜玲玲,徐宜宏,隋颖,等.气相色谱串联质谱(GC-MS/MS)检测羊毛纤维中31种农药[J].现代农药,2013,12(5):30-34.
[16]卢业举,舒勇,赵成仕.气相色谱-串联质谱法测定食品中的三聚氰胺[J].色谱,2008,26(6):749-751.
[17]吴惠勤,张春华,黄晓兰,等.气相色谱-串联质谱法同时检测尿液中15种有毒生物碱[J].分析检测学报,2013,32(9):1031-1037.
[18]全国粮油标准化技术委员会.粮食、油料检验扦样、分样法:GB 5491—1985[S].北京:中国标准出版社,1986.
Simultaneous Determination of 109 Pesticide Residues in Wheat by PTV-GC-MS/MS
YUAN He1,ZHAO Zhenyu1,WU Jianxia1,WANG Long1,NIE Ye1,WANG Diqiang1,WANG Li1,GAO Chuanchuan2and LOU Xiaohua2
(1.Technology Center of Maotai Distillery Co.Ltd.,Renhuai,Guizhou 564501;2.Guizhou Tobacco Quality Supervision & Test Station,Guiyang,Guizhou 550025,China)
Abstract:A method had been developed for simultaneous determination of 109 pesticides(121 components)in wheat by programmed temperature vaporizer gas chromatography with tandem mass spectrometry(PTV-GC-MS/MS).The pesticide residues in wheat sample were extracted rapidly and purified with QuEChERS technique,then separated on TR-pesticide II capillary chromatographic column after PTV sampling.Qualitative and quantitative analysis was conducted by retention time window and SRM(selective reaction monitoring)ion pairs with peak area respectively.The result showed that:(1)The limits of detection(LODs)of 109 pesticides were ranged from 0.6 to 10.6 μg/kg,and the limits of quantification(LOQs)of the tested pesticides were between 2.1 and 35.5 μg/kg.(2)In the linear range between 1 μg/L and 950 μg/L of each pesticide,the linear correlation coefficients were between 0.9956 and 1.0000.(3)At the spiked levels of 7.3 to 620 μg/kg in the wheat extract,the average recoveries ranged from 66.6%to 118.2%and the relative standard deviations(RSDs)were between 1.0%and 18.0%.(4)The method covered a wide range of pesticides with the advantages of simple and rapid pretreatment,saving solvent and capable of analyzing 109 pesticides accurately and sensitively by a single sample injection.
Key words:PTV-GC-MS/MS;wheat;pesticide residue
中图分类号:TS261.2;TS261.7;S512.1;TQ450.2
文献标识码:A
文章编号:1001-9286(2016)06-0120-09
DOI:10.13746/j.njkj.2016052
基金项目:国家科技支撑计划项目(2011BAC06B12);“863计划”项目(2013AA102108);贵州省重大科技专项合作项目(黔科合重大专项字(2013)6009号)。
收稿日期:2016-02-23
作者简介:袁河(1987-),男,助理工程师,从事白酒食品安全研究工作,E-mail:maotaiyuanhe@163.com。
通讯作者:王莉(1972-),女,研究员,国家级白酒评酒委员,长期从事白酒酿造研究及质量管理工作,E-mail:moutai2@163.com;楼小华(1963-),男,高级工程师,从事烟草质量安全检测研究工作,E-mai:louxh6311@sina.com。
