一株窖泥己酸菌株的多相鉴定及产酸研究
2016-07-15薛正楷泸州职业技术学院白酒学院四川泸州646005泸州市生物医学工程研究所四川泸州646005同济大学理学院化学系上海200016
薛正楷,薛 原(1.泸州职业技术学院白酒学院,四川泸州646005;2.泸州市生物医学工程研究所,四川泸州646005;.同济大学理学院化学系,上海200016)
一株窖泥己酸菌株的多相鉴定及产酸研究
薛正楷1,2,薛原3
(1.泸州职业技术学院白酒学院,四川泸州646005;2.泸州市生物医学工程研究所,四川泸州646005;3.同济大学理学院化学系,上海200016)
摘要:采用常规形态、生理生化指标,并结合16s RNA基因序列分析进行多相鉴定方法及气相色谱分析技术,对分离自泸州老窖180年窖池的1株产己酸菌株(K-2)进行分类鉴定和代谢产物分析,结果表明,K-2菌株能利用D-葡萄糖、甘露醇、菊糖、L-阿拉伯糖、D-蔗糖等多种碳源,具有脲酶、七叶灵和明胶酶水解活性;K-2菌株16s RNA基因序列(1346bp)与Clostridium celerecrescens一致率为99%,Strain K-2 16s RNA基因序列在系统进化树中位于Clostridium属分支,与Clostridium celerecrescens序列相似性最近,本研究将其鉴定为梭菌属(GenusI Clostridium)中的Clostridium celerecrescens菌株,该菌株有高效的产己酸(547.26 mg/100mL)和丁酸能力(382.45 mg/100mL)能力,但几乎不产己酸乙酯和丁酸乙酯。此研究为国内外首次报道从浓香型白酒窖池窖泥中分离出Clostridium celerecrescens菌株,且具有高效的产己酸特性。
关键词:窖泥;己酸菌;浓香型白酒;多相鉴定
优先数字出版时间:2016-04-25;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160425.1613.020.html。
目前,中国白酒分为12种香型,其中浓香型白酒最受青睐,其年总产量占中国白酒年产量的70%。据分析,浓香型白酒风味物质多达近674种,定量检测成分有近342种,关键风味物质为乙酸乙酯、丁酸乙酯、乳酸乙酯、己酸乙酯、乙酸、丁酸和己酸,其中己酸乙酯为主体香(Core fragrance),其含量的多少及其在关键风味物质中的比例,决定着浓香型白酒风格的典型性及品质[1-4]。
己酸乙酯的产生源于浓香型白酒泥窖发酵糟醅过程中己酸与乙醇在生香酵母、细菌和霉菌的复杂过程。乙醇是发酵过程的最丰富产物,己酸乙酯产量的高低,取决于糟醅中己酸浓度的高低,因此,选育高效产己酸菌菌株,成为浓香型白酒科研单位及企业提高浓香型白酒品质的重要课题[1,5-7]。
浓香型白酒的酿造采用的是传统固态天然发酵工艺,泥窖是其特有的发酵容器,其中的窖泥是酿酒微生物菌群栖息繁衍的场所,经过长期高酸度、高酒精度和长期密闭发酵等酿酒环境的筛选和驯化,窖泥中逐渐富集了大量具有产酸生香的微生物,主要是厌氧的甲烷菌、己酸菌、乳酸菌、硫酸盐还原菌、硝酸盐还原菌等,泥窖连续使用的时间越长,富集的产酸生香微生物,尤其是己酸菌越多,其生产的浓香型白酒的品质也越高,这也是古谚语“千年老窖万年糟,酒好全凭窖池老”的科学机理[8-11]。
本研究拟通过对窖泥微生物的分离、纯化、鉴定及产酸代谢分析,为浓香型白酒企业白酒生产提供高产菌种和科学研究提供优良的出发菌。
1材料与方法
1.1材料
1.1.1窖泥
取自泸州老窖集团万宾酒业有限公司180年窖池窖底。
1.1.2培养基
富集培养基:醋酸钠0.5%,硫酸镁0.02%,硫酸铵0.05%,酵母膏0.1%,磷酸氢二钾0.04%,pH 6.8~7.0,121℃灭菌20min,接种前单独加入2%除菌的无水乙醇。
强化梭菌琼脂:牛肉粉0.5%,胰酪蛋白胨0.5%,酵母粉0.015%,葡萄糖0.025%,可溶性淀粉0.005%,氯化钠0.025%,醋酸钠0.015%,L-半胱氨酸盐酸盐0.0025%,琼脂6.25%,加热搅拌溶解于1000mL蒸馏水中,分装,121℃高压灭菌15min,备用。
发酵培养基:醋酸钠0.5%,酵母膏0.1%,碳酸钙0.5%,1∶3糟醅浸出液50%,无菌无水乙醇20mL(接种前单独加入),pH7.0~7.2,121℃高压灭菌15min,备用。
1.1.3试剂
快速DNA提取扩增套装(KG201)、Universal DNA纯化回收试剂盒(DP214)、DNAMakrer(DL2000)均购自天根生化科技有限公司;Taq酶、PCR10×buffe、dNTP均购自TaKaRa公司;正己酸、正丁酸、己酸乙酯、丁酸乙酯标准物质购自天津市精细化工研究所;无水乙醇(色谱纯)购自成都科龙化学试剂厂。细菌16S rDNA通用引物:27F,5'- AGAGTTTGATCCTGGCTCAG- 3';1541R,5'-AAGGAGGTGATCCACCC-3',由上海生工生物工程有限公司提供。气相色谱法高纯度氮气、空气及氢气购自泸州天一气体有限公司。
1.2实验方法
1.2.1初筛
称取窖泥1 g,加入含有100mL无菌水的三角瓶中,以180r/min振荡30min,在85℃水浴锅内水浴10min,无菌条件下吸取1mL稀释液加入装有20mL富集培养基的厌氧瓶中,在35℃、0.06 MP真空培养箱中培养7d。
1.2.2分离纯化
挑选出产气早、气泡多的厌氧瓶于85℃水浴10min,待冷却后,采用平皿稀释法分离,将己酸菌液依次稀释到10-1~10-6,然后取最后3个稀释度的己酸菌液各50 L加入50℃强化梭菌培养基中进行混合培养,置于35℃、0.06 MP真空培养箱中培养3d,观察菌落形态。
1.2.3复筛
挑取菌落呈乳黄色、生长速度快、直径较大的菌落分离纯化菌株于装满发酵培养基的厌氧培养瓶中,置于35℃、0.06 MP真空培养箱中培养10d。
1.2.4发酵液的预处理
取发酵液460μL加入2%丁酸乙酯、己酸乙酯、丁酸和己酸标准物质溶液各10μL,超声处理10min,调pH2.0,1000r/min离心10min,取上清液200μL进行色谱分析;弃上清液,菌体中加入460μL生理盐水,振荡混匀后进行细菌计数。
1.2.5发酵液色谱分析
色谱柱:AT.LZP-930白酒专用色谱柱(25m×0.32mm,0.25μm)。
色谱条件:氢火焰离子检测器,柱温采取程序升温,初始温度为65℃,保持5min,然后以3.5℃/min的速率升温,升至150℃时保持0min;进样器温度为200℃,检测器温度为200℃,载气(高纯氮气)流速,1.0mL/min,分流比37∶1,进样量为1μL。
产物浓度的计算:采用白酒分析方法GB/T 10345—2007提供的方法进行,每个样品重复3次,取3次平均值作为样品浓度。
1.2.6发酵液细菌计数
取细菌计数板对发酵10d单克隆菌液,在100倍油镜下计数完100方格后总数除100,得到每格的平均值,乘稀释度,除1/4000计算得到的数字为每立方毫米的细菌数,每个样品重复3次,取3次平均值作为细菌浓度。
1.2.7高效发酵己酸菌的鉴定
本研究对产己酸菌采用形态学特征、生理生化指标及16S rRNA比对分析进行分类学鉴定。
1.2.7.1形态学观察
将在梭菌强化培养基中培养3d,菌株置于100倍油镜下观察其菌体特征。
1.2.7.2生理生化鉴定
细菌主要生理生化鉴定,参考东秀珠等《常见细菌鉴定手册》进行试验[12]。
1.2.7.3分离菌株的分子生物学鉴定
菌株总DNA的提取:挑高效产己酸鉴定的单菌落菌体于34℃真空培养箱中培养7d发酵液,按天根生化科技有限公司的快速DNA提取扩增套装(KG201)使用说明书提取菌株总DNA。
PCR扩增及测序:以高效发酵菌株总DNA为模板,采用16s DNA通用引物进行16s RNA基因PCR扩增,反应体系:10ng DNA模板,1×Taq reaction buffer,引物各4 pmol,4 μmol dNTP,0.5单位Taq酶(Ferments),总体积10μL。反应程序为:94℃预变性5min,94℃变性1min,52℃复性1min,72℃延伸90s,30个循环后72℃延伸10min,PCR产物进行1%琼脂电泳。在PCR产物纯化操作按天根公司Universal DNA纯化回收试剂盒提供的使用说明书进行,纯化产物送上海生物工程公司测序。
测序结果分析及分子进化树构建:测序结果用Chromas软件参照正反序列图谱人工校对后,采用NCBI数据库BLAST工具进行比对,获得已知近缘种的相似性。采用CLUSTALW对高效菌株及其若干近缘种16S rRNA基因序列进行多序列比对,并采用MEGA5.0软件,按邻位连接法进行1000次的相似度重复计算,构建高效产己酸菌株与邻近物种的16S rDNA序系统发育树。
1.2.8数据处理
数据采用SPSS17软件包和excel进行。
2结果与分析
2.1单菌落发酵产物色谱分析
按1.2.5节的色谱条件对培养基和发酵15d的单菌落发酵液进行气相色谱检测,内标和产物色谱图见图1。
从图1可知,无论是培养基和15d发酵后培养液内物质均不干扰气相色谱对内标物质和发酵产物的检测,各个检测成分的出峰时间分别是:乙酸正戊酯(A)的出峰时间为3.7min左右,乙酸(B)的出峰时间为7.7min左右,丁酸乙酯(C)的出峰时间为9.4min左右,丁酸(D)的出峰时间为15.4min左右,己酸乙酯(E)的出峰时间为18min左右,2-乙基丁酸(F)的出峰时间为21min左右,己酸(G)的出峰时间为24min左右。
对代谢产物采用1.2.5节的色谱条件获得内标及产物峰面积,用GB/T 10345—2007提供的计算公式进行代谢产物的计算:f=(A1/A2)×(d2/d1),X1=f×(A3/A4)×I。式中:f为校正因子,A1为待测产物的标准物质峰面积,A2为待测内标物质峰面积,d1为待测产物的浓度,d2为内标物质的浓度,X1为己酸浓度(mg/100mL),A3为待检测产物的峰面积,A4为内标物质的峰面积,I为内标物质浓度(mg/100mL)。其结果见表1。
将K-2产物浓度数据,采用spss软件包中成对数据T检验(paired-samples T test)对发酵0d和15d产物进行比较,从T检验结果可知:(1)K-2菌株的代谢产物丁酸乙酯和己酸乙酯浓度,在发酵0d和15d时,发酵液均无显著差异(P=0.2,0.19>0.05),表明K-2均不能产2种酯,发酵液中的2种酯浓度可认为是培养基中乙醇与丁酸、己酸自然化合的产物;(2)K-2菌株的代谢产物丁酸浓度,在0d和15d时的发酵液中,表现为差异极其显著(P=0.004<0.01),表明K-2能高效产丁酸;其己酸浓度,在0d和15d时的发酵液中,表现极为显著差异(P=0.001<0.01),表明该菌株有极高效的产己酸能力;(3)比较K-2菌株0d和15d时的发酵液中丁酸和己酸浓度,0d发酵液中的丁酸与己酸浓度之间不显著(P=0.059>0.05)15d发酵液中的丁酸与己酸浓度之间差异极其显著(P= 0.002<0.01),表明,K-2菌株产己酸能力超过产丁酸能力,丁酸是己酸生产过程中的中间产物。
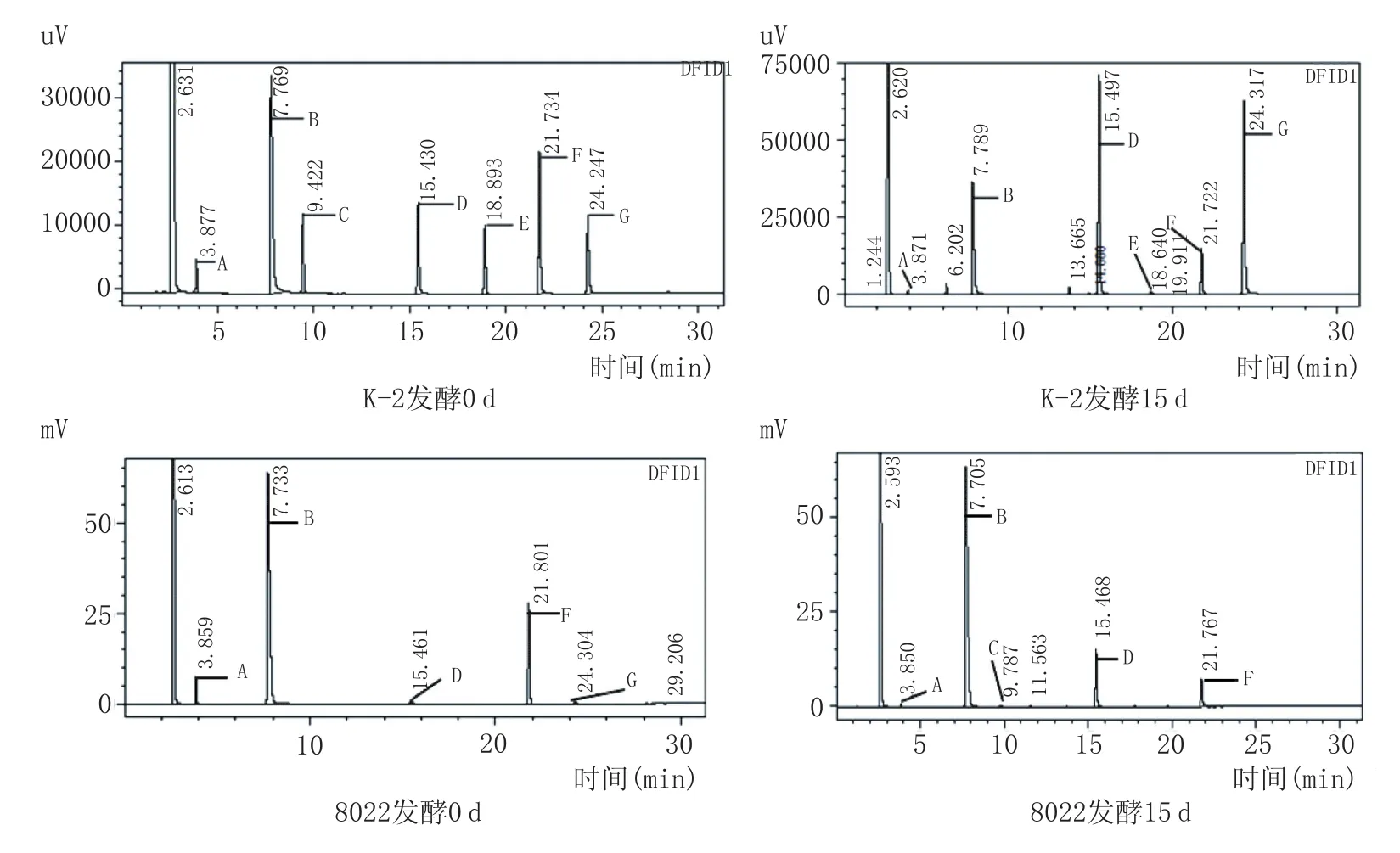
图1 K-2菌株气相色谱图
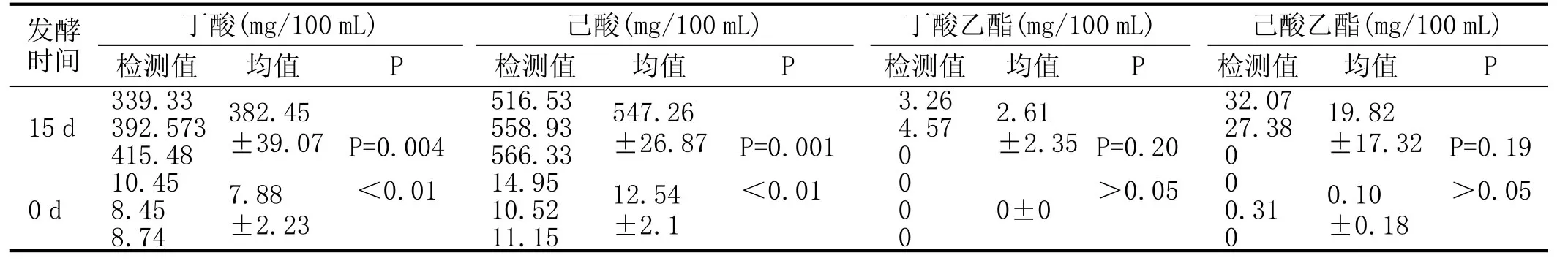
表1 K-2菌株发酵培养基的代谢产物气相色谱检测结果
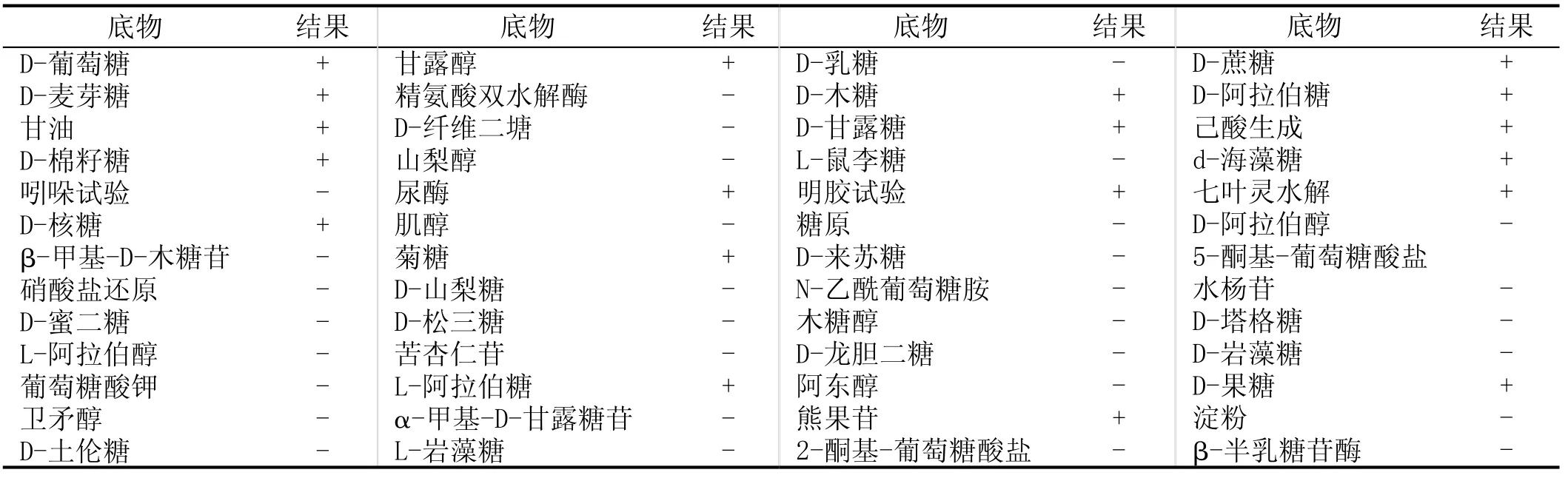
表2 K-2菌株生理生化鉴定试验结果
总之,本试验数据分析表明,K-2菌株具有高效的产丁酸和己酸能力,且产己酸能力超过产丁酸能力,几乎不产己酸乙酯和丁酸乙酯。
2.2形态学观察
在强化梭菌琼脂培养基上,37℃培养3d,菌体杆状,革兰氏阳性,0.6×(2.5~4.5)µm,单个或链状排列菌落呈白色,近透明的液滴状,圆形,有光泽(图2)。
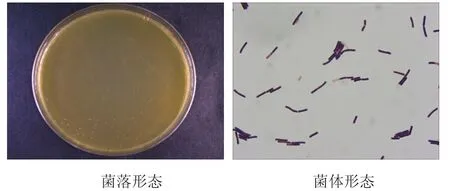
图2菌株K-2菌落和菌体形态
2.3采用法国梅里埃芽孢杆菌鉴定系统生理生化鉴定
K-2菌株生理生化鉴定试验结果见表2。
从表2可知,K-2菌株与梭菌属(Clostridium)在C源同化及水解酶活性方面基本一致,K-2菌株应属于梭菌属(Clostridium),为属水平鉴定结果。
2.416S rDNA序列鉴定及进化分析
将K-2菌株总DNA经16S rDNA基因引物进行PCR扩增,扩增产物纯化后进行测序,将K-2菌株16S rDNA序列(1346 bp)测序结果,采用NCBI数据库中blast工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)在Genebank进行比对,结果表明,在NCBI基因数据库中,K-2菌株与Clostridium celerecrescens 16S rDNA序列相似度最高,一致性(Identifity)高达99%,表明K-2菌株极有可能是Clostridium celerecrescens。
采用MEGA5.0软件,按邻位连接法进行1000次的相似度重复计算,构建K-2菌株与相关物种的16S rDNA序列系统发育树,见图3。
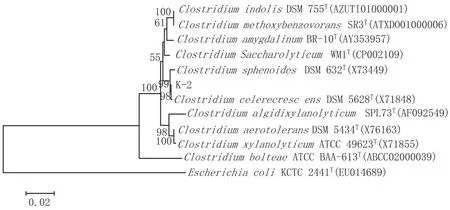
图3菌株K-2与邻近物种的系统发育树
从图3可知,K-2菌株与与Clostridium celerecre-scens DSM 5628T位于同一分枝上,Bootstrap支持率为98%,该结果表明K-2为Clostridium celerecrescens。
3 讨论
己酸菌(hexanoic acid bacteria or caproic acid bacteria)是一大类产次级代谢产物己酸微生物的总称,其模式菌株为Closlridium Kluyveri(strain ATCC 8527 / DSM 555 / NCIMB 10680),该菌株最初由H.A.BARKER在1936年从淤泥中分离,1942年被命名为克氏梭菌(Clostridium Kuyveri),其在分类上属于厚壁菌门(Phylum Firmicutes),芽孢杆菌纲(class Bacilli)、芽孢杆菌目(order Bacillales)、芽孢杆菌科(Bacillaceae)、梭菌属(Clostridium)[13,14]。目前发现的产己酸的菌株还包括同为梭菌属的Clotridium scatologenes、Clostridium sp.BS-1,以及其他属的Rhodospirillum rubrum、Eubacterium limosum、Megasphaera elsdenii、Bacillus Megaterium、Bacillus fusiformis等[15-20]。
为了提高浓香型白酒的品质,自20世纪60年代以来,越来越多的己酸菌(Clostridium kluyveri)菌株从浓香型白酒窖泥中分离出来,目前在中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)的己酸菌菌株共有30株,其中CICC8022(内蒙30#)研究得最为充分。该菌株的形态、生理、发酵条件及生产性能均得以分析,但其分类地位有待深入研究[21,22]。
本研究从泸州老窖集团万宾酒业公司180年老窖池中分离出产己酸菌株,其形态、生理特征与Clostridium kluyveri基本一致[13],将其产酸能力与其他菌株相比,结果见表3。
由表3可知,本研究获得的己酸菌,其产酸能力明显高于吴衍庸、张彬、苗子健和赵辉等[5,20,23,24]从窖泥中分离获得的菌株,Byoung Seung Jeon等分离自淤泥的Clostridium sp.BS-1和菌株Megasphaera elsdenii NCIMB 702410[19,25],但低于内蒙30#[27],远低于分离自牛胃的C.kluyveri 3231B菌株[26],可见,本研究鉴定的产己酸Clostridium celerecrescens菌株,在从窖泥分离出的产己酸菌中,属于高产型。
为了获得K-2菌株的系统分类特征,本研究采用形态、生理生化及分子生物学相结合的多相鉴定技术,对K-2菌株分类鉴定,结果表明,本研究分离的K-2菌株,属于厚壁菌门(Phylum BXIII Firmicutes),梭菌纲(ClassI clostridia)、梭菌菌目(OrderI clostridiales)、梭菌科(FamilyIclostidiaceae)、梭菌属(GenusI Clostridium),Clostridium celerecrescens菌株[28]。
梭菌属(GenusI Clostridium)是一类厌氧、杆状、形成内生孢子的革兰氏阳性菌,主要分布于土壤、水体沉积物、厌氧人体或底物组织等富含有机物的环境中;其营养体及其分泌的胞外酶具有广阔的利用或降解底物,包括工业、农业或市政废弃物(包括CO2、CO、H2等废气)、天然和人造有机毒物等简单或复杂的含碳化合物,且无降解底物或产物抑制的耐受现象,其多样化的代谢途径赋予其生产丁酸、乙酸、乳酸、己酸、丁醇、丙酮、乙醇、气体物质(CO2、H2等)、恶臭化合物(如甲酚等)、异丁酸、吲哚、吲哚酸、乙酸苯酯、戊酸、异戊酸以及抗生素Closthiomide等极其多样化的产物,因此,梭菌属是一类极具环保或工农业生产及生物工程应用价值的微生物[29]。目前,该属共有220余菌株,该属中的Clostridium kluyveri是最著名的产己酸菌株[13-15],国内从浓香型白酒窖泥中分离出的产己酸几乎均被鉴定为Clostridium kluyveri;其他产己酸菌还包括Clostridium scatologenes、Clostridium sp.BS-1、Clostridium difficile[30]、Clostridium scatologenes[31]、Clostridium butyricum[32]等,本研究获得的Clostridium celerecrescens为严格厌氧、杆状的革兰氏阳性菌,该菌于1989年由Palop et al首次从富含纤维素的产甲烷培养基中分离并命名[33],该菌广泛用于利用纤维质生物质生产氢气、乙醇和有机酸工艺;电燃料、用于调味剂的桂皮酸衍生物;还原FeIII铁矿石引起环境酸化作用和金属的腐蚀,也是引起人与动物组织感染的病原微生物,分布于淤泥、感染的人和动物组织、废弃的铁矿和铁质物品表面等环境[34-37]。
本研究在采用常规形态学、生理生化鉴定方法结合16s RNA基因序列分析,国内外首次从浓香型白酒窖池窖泥中分离得到Clostridium celerecrescens菌株,并确定其具有高效产己酸(547.26 mg/100mL)和丁酸能力(382.45 mg/100mL)能力,为该菌株在浓香型白酒生产和科研中的应用,提供了理论和实践依据。

表3几株产己酸菌株的产酸性能比较
参考文献:
[1]Chen Y,Li F,Guo J,et al.Enhanced ethyl caproate production of Chinese liquor yeast by overexpressing EHT1 with deleted FAA1[J].Journal of industrial microbiology & biotechnology,2014,41(3):563-572.
[2]季克良,郭坤亮,朱书奎,等.全二维气相色谱/飞行时间质谱用于白酒微量成分的分析[J].酿酒科技,2007(3):100-102.
[3]Zheng J,Liang R,Wu C D,et al.Discrimination of different kinds of Luzhou-flavor raw liquors based on their volatile features[J].Food Research International,2014,56:77-84.
[4]Xiao Z B,Yu D,Niu YW,et al.Characterization of aroma compounds of Chinese famous liquors by gas chromatographymass spectrometry and flash GC electronic-nose[J].J Chromatogr,2014,945-946:92-100.
[5]张彬,庄名扬,武金,等.酿酒微生物太空育种及在生产中的应用研究(I)己酸菌太空育种及在生产中的应用[J].酿酒,2014,41(5):35-38.
[6]谢国排.己酸菌培养方法及其主要关联产物生成[J].酿酒科技,2011(3):63-64.
[7]崔海灏,崔靖靖.十里香老窖泥中己酸菌的分离纯化及扩大培养和应用的研究[J].酿酒,2014,41(1):39-41.
[8]Tao Y,Li J,Rui J,et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Applied and Environmental Microbiology,2014,80(7):2254-2260.
[9]Liang H,Li W,Luo Q,et al.Analysis of the bacterial community in aged and aging pit mud of Chinese Luzhouflavour liquor by combined PCR-DGGE and quantitative PCR assay[J].Journal of the Science of Food and Agriculture,2015,95(13):2729-2735.
[10]Ding X F,Wu C D,Zhang L Q,et al.Characterization of eubacterial and archaeal community diversity in the pit mud of Chinese Luzhou-flavor liquor by nested PCR-DGGE[J].World Journal of Microbiology and Biotechnology,2014,30 (2):605-612.
[11]王明跃,张文学,王海英,等.不同窖龄窖泥古菌的系统发育多样性分析[J].应用与环境生物学报,2012,18(6):1043-1048.
[12]东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:教育科学出版社,2001.
[13]Barker HA,Taha S M.Clostridium kluyverii,an organism concerned in the formation of caproic acid from ethyl alcohol [J].Journal of bacteriology,1942,43(3):347.
[14]Garrity G M,Bell JA,Lilburn T G.Bergey’s Manual of Systematic Bacteriology[M].2nd ed.Springer,2005.
[15]Holdeman LV,Cato E P,Moore W E C.Anaerobe laboratory manual[M].4th ed.Blacksburg: Virginia Polytechnic Institute and State University,1977.
[16]Kohlmiller Jr E F,Gest H.Acomparative study of the light and dark fermentations of organic acids by Rhodospirillum rubrum[J].Journal of Bacteriology,1951,61(3):269.
[17]Genthner B R,Davis C L,Bryant M P.Features of rumen and sewage sludge strains of Eubacterium limosum,a methanoland H2-CO2-utilizing species[J].Applied and Environmental Microbiology,1981,42(1):12-19.
[18]Marounek M,Fliegrova K,Bartos S.Metabolism and some characteristics of ruminal strains of Megasphaera elsdenii[J].Applied and Environmental Microbiology,1989,55(6):1570-1573.
[19]Jeon B S,Kim B C,Um Y,et al.Production of hexanoic acid from D-galactitol by a newly isolated Clostridium sp.BS-1 [J].Applied Microbiology and Biotechnology,2010,88(5):1161-1167.
[20]赵辉,敞毅,王葳,等.浓香型白酒高产己酸兼性厌氧细菌分离鉴定[J].食品科学,2012,33(5):177-182.
[21]沈怡方.关于己酸菌的培养及其应用[J].酿酒科技,1998(4):15-23.
[22]周恒刚.80年代前己酸菌及窖泥培养的回顾[J].酿酒科技,1997(4):17-22.
[23]吴衍庸.泸型梭菌己酸发酵应用的理论与实践[J].酿酒科技,2007(11):131-135.
[24]苗子健,王兴初,刘晓宁.窖泥中己酸菌的分离纯化及产酸性能研究[J].酿酒科技,2012(11):27.
[25]Choi K,Jeon B S,Kim B C,et al.In situ biphasic extractive fermentation for hexanoic acid production from sucrose by Megasphaera elsdenii NCIMB 702410[J].Applied Biochemistry and Biotechnology,2013,171(5):1094-1107.
[26]Weimer P J,Stevenson D M.Isolation,characterization,and quantification of Clostridium kluyveri from the bovine rumen [J].Applied Microbiology and Biotechnology,2012,94(2):461-466.
[27]罗维,武志敏.北方地区浓香型白酒生产工艺研究[J].酿酒科技,2002(4):47-49.
[28]Garrity G M,Bell JA,Lilburn T G.Taxonomic Outline of the Prokaryotes Bergey’s Mannual of Systematic Bacteriology [M].2nd ed.Springer,2004.
[29]Tracy B P,Jones S W,Fast AG,et al.Clostridia: the importance of their exceptionalsubstrate and metabolitediversity for biofuel and biorefineryapplications[J].Curr Opin Biotechnol,2012,23(3):364-81.
[30]Madan E,Slifkin M.Stool caproic acid for screening of Clostridium difficile[J].Am J Clin Pathol,1988,89(4):525-527.
[31]Kridelbaugh D,Doerner K C.Development of a defined medium for Clostridium scatologenes ATCC 25775[J].LettAppl Microbiol,2009,48:426-432.
[32]Butel M J,Rimbault A,Khelifa N,et al.Formation of 2-hydroxy-4-methylpentanoic acid from L-leucine by Clostridium butyricum[J].FEMS Microbiol Lett,1995,132:171-176.
[33]Palop M L,Valles S,Pinaga F,et al.Isolation and characterization of an anaerobic,cellulolytic bacterium,Clostridium celerecrescens sp.nov.[J].Int J Syst Evol Microbiol,2010,39:68-71.
[34]Bouvet P,K'Ouas G,Le Coustumier A,et al.Clostridium celerecrescens,often misidentified as“Clostridium clostridioforme group,”is involved in rare human infection cases[J].Diagnostic Microbiology and Infectious Disease,2012,74(3):299-302.
[35]Honkalas V S,Dabir AP,Arora P,et al.Draft genome sequence of Clostridium celerecrescens 152B isolated from sub-seafloor methane hydrate deposits[J].Marine Genomics,2015,21:23-24.
[36]Mischnik A,Zimmermann S,Bekeredjian-Ding I,et al.Relapse of posttraumatic osteomyelitis due to Clostridium celerecrescens[J].Infection,2011,39(5):491-494.
[37]Monroy OA,Gayosso M J,Ordaz N R,et al.Corrosion of API XL 52 steel in presence of Clostridium celerecrescens[J].Materials and Corrosion,2011,62(9):878-883.
Polyphasic Identification of a Hexanoic Acid Bacteria Strain from the Pit Mud and Study on Its Acid Producing Ability
XUE Zhengkai1,2and XUE Yuan3
(1.School of Liquor-making Engineering,Luzhou Vocational and Technical College,Luzhou,Sichuan 646005;2.Institute of Biomedical Engineering,Luzhou,Sichuan 646005;3.Chemistry Department of Science School,Tongji University,Shanghai 200016,China)
Abstract:Polyphasic identification of a combination of morphological observation,physiological & biochemical indexes,16s RNA gene sequencing analysis was adopted to identify a hexanoic-acid-producing bacteria strain K-2(isolated from the mud of 180-year-old pit).Then the metabolites of this strain were analyzed by GC.The results showed that,K-2 could utilize various carbon sources including D-glucose,mannitol,inulin,L-arabinose,D-sucrose and it had hydrolysis activities of urease,esculin and gelatin.16s RNA gene sequence(1346 bp)of strain K-2 showed the identity of 99%to Clostridium celerecrescens by NCBI blast,and phylogenetic analysis based on 16S rRNA gene sequence positioned K-2 in the Clostridium branch,thus we identified it to be Clostridium celerecrescens.Besides,K-2 demonstrated a highly-efficient capability of producing hexanoic acid(547.26 mg/100mL)and butyric acid(382.45 mg/100mL),but it hardly produced ethyl caproate and ethyl butyrate.This study was the first report at home and abroad on a hexanoic-acid-producing Clostridium celerecrescens strain isolated from Nongxiang Baijiu pit mud.
Key words:pit mud;hexanoic acid bacteria;Nongxiang Baijiu;polyphasic identification
中图分类号:TS262.3;TS261.4;TS261.1
文献标识码:A
文章编号:1001-9286(2016)06-0065-07
DOI:10.13746/j.njkj.2015089
基金项目:四川省科技支撑计划项目(NO.2014FZ0018);四川省教育厅理工重点项目;泸州市科技局重点项目(NO.2013-S-44(4/8)。
收稿日期:2015-03-10
作者简介:薛正楷(1968-),男,重庆永川人,博士,副教授,泸州市生物医学工程研究所所长,研究方向:分子代谢与工程;E-mail:zk.xue988@163.com。
