辛伐他汀对食管癌细胞放疗敏感性的影响
2016-07-14金迎迎马红兵孙晓力
金迎迎,卫 阳,王 力,何 赟,贾 辉,马红兵,孙晓力
(西安交通大学第二附属医院:1. 肿瘤科;2. 科研中心实验室;3. 普外科,陕西西安 710004)
◇临床研究◇
辛伐他汀对食管癌细胞放疗敏感性的影响
金迎迎1,卫阳2,王力1,何赟1,贾辉1,马红兵1,孙晓力3
(西安交通大学第二附属医院:1. 肿瘤科;2. 科研中心实验室;3. 普外科,陕西西安710004)
摘要:目的观察辛伐他汀对食管癌细胞放疗敏感性的影响。方法应用间断照射的方法诱导食管癌细胞EC9706的放射抗拒细胞R-resistant;Cell Counting Kit-8检测辛伐他汀联合放疗对食管癌细胞EC9706及其放射抗拒细胞R-resistant增殖的影响;集落形成实验检测辛伐他汀对食管癌细胞EC9706及其放射抗拒细胞R-resistant的放疗敏感性的影响。结果成功诱导出食管癌细胞EC9706的放射抗拒细胞R-resistant,Cell Counting Kit-8实验及集落形成实验结果都显示辛伐他汀可以增强食管癌细胞EC9706及其放射抗拒细胞R-resistant对放疗的敏感性。结论辛伐他汀可以增强食管癌细胞的放疗敏感性。
关键词:辛伐他汀;食管癌;放疗抗拒;增敏
食管癌(esophageal cancer, EC)是世界上最常见的恶性肿瘤之一,国际癌症研究中心(IARC)全球癌症统计报告显示[1]:2012年食管癌发病人数为45.58万人,我国为25万,发病占全世界人数一半以上。放射治疗是EC三大治疗手段之一。然而,单纯放疗治疗局部晚期食管癌的疗效并不理想。美国肿瘤放射治疗协作组(RTOG)85-01临床试验,患者接受64 Gy(2 Gy/d)常规放疗,结果显示单纯放疗的患者都在3年内死亡,而放化疗联用组的患者的5年生存期也仅为26%[2]。虽然放疗设备和方法不断改进,但EC疗效并无明显改善。目前,调强放射治疗(intensity modulated radiation therapy, IMRT)技术已成为放疗的主流,但也仅是在照射范围和剂量方面更加精确,减少心肺等危及器官毒性上有一定的优势,对EC疗效并无明显提高[3]。众多研究表明,癌细胞经过射线反复照射后放射敏感性能发生改变,只有放射抗拒细胞能够在射线作用下继续增殖,放疗后残留的这些肿瘤细胞不仅放射抗拒性增强,而且更具侵袭性、容易发生淋巴结转移和远处转移。因此,放疗抗拒是制约EC疗效的瓶颈[4]。
他汀类药物包括洛伐他汀、辛伐他汀、阿托伐他汀和普伐他汀等。该类药物通过竞争性抑制肝脏合成胆固醇的限速酶3-羟-3-甲基戊二酰辅酶A (HMG-CoA)还原酶的活性,减少肝内胆固醇合成,该类药目前被广泛用于预防和治疗心脑血管疾病。近年来,大量细胞模型和临床观察显示他汀类药物对癌症具有一定的抑制作用,特别是在结肠癌、乳腺癌、前列腺癌、肺癌、胶质瘤等肿瘤中显示出较好的效果[5-12]。多个临床试验的结果显示他汀类药物对食管癌不仅有预防作用,还有治疗效果,而关于他汀类药物增强食管癌细胞对放疗的敏感性,以及逆转食管癌细胞的放射抗拒性也鲜有研究[13-14]。本研究首次显示辛伐他汀可以增强食管癌放射抗拒细胞对放疗的敏感性,将为临床上放疗抗拒食管癌的治疗提供新的思路。
1材料与方法
1.1主要试剂细胞培养试剂RPMI 1640培养基、小牛血清购自美国GIBCO公司;细胞生长曲线测定CCK-8试剂盒购自日本Dojindo公司,辛伐他汀结晶紫染液购自碧云天生物技术公司。
1.2细胞培养食管癌细胞系EC9706为本研究室保存,37 ℃、50 mL/L CO2条件下培养。建立放射抗拒食管癌细胞株: 将培养的细胞在室温下用直线加速器6MV-X射线(2100EX,Varian)满射野照射细胞,照射剂量为2、4、6、8、10 Gy,吸收剂量率为300 cGy/min,射距100 cm,培养板下放置一个“水箱”和培养板上覆盖1.5 cm厚的组织胶补偿块,经计算机定位确保高能X线均匀、准确地照射到细胞,照射后继续培养并观察细胞生长和死亡情况,确定亚致死剂量的放射线。在亚致死剂量确定后,食管癌细胞接受5次亚致死剂量放射线照射:食管癌细胞用亚致死剂量放射线照射后立即放回培养箱中继续孵育,直至存活细胞形成克隆,收集照射后存活的克隆细胞作为第一代亚克隆细胞;如此反复照射5次,直到第五代亚克隆细胞产生,定义第五代存活的亚克隆细胞作为放射抗拒的食管癌细胞,并命名。相同步骤处理但未照射的食管癌细胞作为放射敏感的食管癌细胞。
1.3细胞增殖将待放射处理后的细胞以每孔2 000个细胞接种于96孔培养板中,并同时联合辛伐他汀处理,培养72 h,每天在同一时间取出3孔按照CC K-8试剂盒要求检测。Micro-ELISA仪读取光密度,检测波长为450 nm,绘制细胞生长曲线,此实验重复3次。
1.4集落形成集落形成实验测定单个细胞的增殖能力,是判断细胞对放射敏感性的金标准,计算存活分数。将放疗联合辛伐他汀处理的EC9706细胞接种到培养皿中培养1周后,PBS洗3次,多聚甲醛固定后,结晶紫染色,实验重复3次。对照组选取完全空白组和DMSO对照组(由于本研究用的DMS溶解的辛伐他汀,故DMSO组设对照组)。
1.5统计学方法细胞存活率随着放射剂量的变化用半对数线图进行描述,用一般线性模型进行两条半对数曲线的比较;不同组别的细胞集落数用误差条图进行描述,直条的高度表示均数,误差线表示1个标准差。经检验,不同组间细胞集落数具有方差齐性,组间集落数的比较用单因素方差分析,LSD法进行两两比较。用 Microsoft Excel和SPSS20.0统计软件进行统计图的绘制和统计分析,P<0.05认为差异有统计学意义。
2结果
2.1辛伐他汀增强食管癌细胞对放疗的敏感性本研究比较了几种常见的食管癌细胞对放疗的敏感性,结果显示EC9706对放疗最为敏感,进一步的研究显示辛伐他汀可以增强食管癌细胞EC9706对放疗的敏感性。单独加入辛伐他汀可以抑制细胞的存活率(图1)。随着放射剂量的增加,加入辛伐他汀组的食管癌细胞EC9706存活率相对于完全空白组呈现明显的下降,集落形成实验结果也显示辛伐他汀和放疗有协同抗肿瘤的作用,联合组相对于单独放疗组和辛伐他汀组集落的数量呈现明显的减少(P<0.001,图2)。

图1辛伐他汀联合放疗对食管癌细胞EC9706存活率的影响
Fig.1 The effect of simvastatin combined with radiotherapy on the survival rate of esophageal squamous cell carcinoma EC9706
2.2食管癌放射抗拒细胞的成功诱导本研究通过间断照射的方法成功诱导出食管癌细胞EC9706的放射抗拒细胞R-resistant,相对于亲代细胞,放射抗拒细胞R-resistant对放疗的敏感性呈现明显的降低(F=17.637,P<0.05,图3)。

图2集落形成实验验证辛伐他汀和放疗在食管癌细胞EC9706中的协同抗肿瘤作用
Fig.2 The colony formation assay indicated that simvastatin could sensitize esophageal squamous cell carcinoma to irradiation
A:集落形成实验的代表图;B:数据统计图。单因素方差分析结果为F=574.105,P<0.001;LSD多重比较中与Simvastatin+6 Gy组比较,***P<0.001。
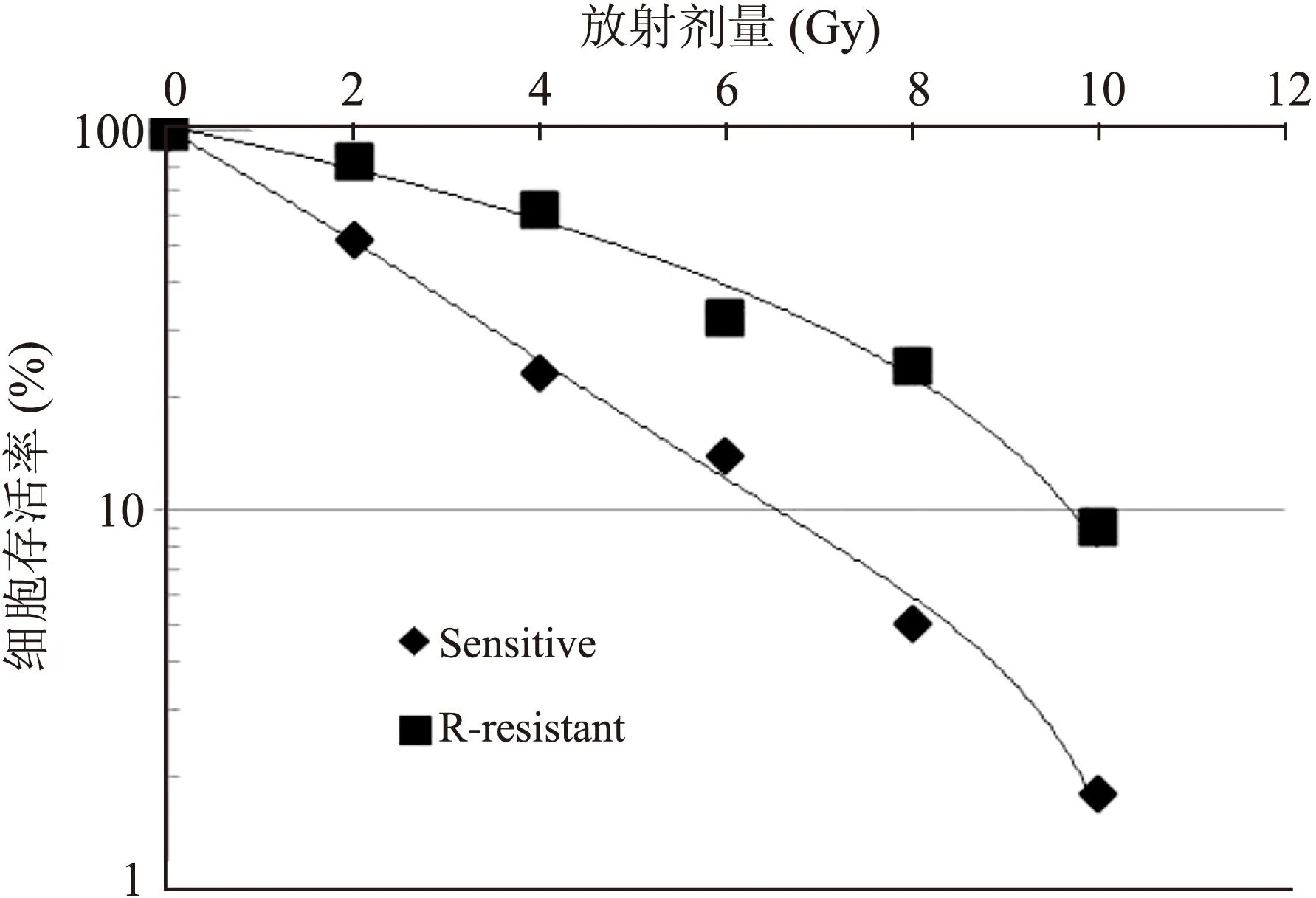
图3食管癌细胞EC9706及其放射抗拒细胞对放疗的敏感性
Fig.3 The radiosensitivity of esophageal squamous cell carcinoma EC9706 and the radioresistant cell R-resistant
2.3辛伐他汀增强食管癌放射抗拒细胞对放疗的敏感性CCK8的结果显示,相对于单独放疗组来说,联合组对肿瘤放射抗拒细胞具有明显的抑制效果(图4);而集落形成实验的结果也显示联合组相对单独放疗组和辛伐他汀组可以明显增强放射抗拒细胞R-resistant对放疗的敏感性(P<0.001,图5)。

图4辛伐他汀联合放疗对食管癌放射抗拒细胞EC9706(R-resistant)存活率的影响
Fig.4 The effect of simvastatin combined with radiotherapy on the survival rate of radioresistant EC9706 (R-resistant)

图5集落形成实验显示辛伐他汀可以增强食管癌放射抗拒细胞对放疗的敏感性
Fig.5 The colony formation assay indicated that simvastatin could sensitize the radioresistance of esophageal squamous cell carcinoma to irradiation
A:集落形成实验的代表图;B数据统计图。单因素方差分析结果为F=105.576,P<0.001;LSD多重比较中与Simvastatin+6 Gy组比较,**P<0.01,***P<0.001。
3讨论
食管癌以综合治疗为主要手段,放疗是食管癌的三大治疗手段之一,而放射抗拒则是制约EC放疗疗效的瓶颈。虽然放疗设备和方法不断改进,但单纯放疗治疗局部晚期EC的疗效并无明显改善。因此,提高食管癌细胞对放疗的敏感性的研究显得尤为重要,放疗增敏药物的研究也随之成为一个热点问题。对于新的放疗增敏药物的研究因为其对机体的毒性不明成为研究的难点。他汀类药物目前广泛用于预防和治疗心脑血管疾病,并且展现出良好的安全性。近年来,大量的研究显示他汀类药物在多种肿瘤治疗中呈现出对肿瘤细胞较好的抑制效果[5-12]。
近年来,大量细胞模型和临床观察显示他汀类药物对癌症具有一定的抑制作用。深入研究表明,他汀类药物具有抑制肿瘤细胞增殖、诱导细胞凋亡及抑制血管生成等作用[6]。关于他汀类药物增强放射抗拒细胞对放疗的敏感性的机制目前已有部分进展。MILLER等[15]的研究显示Ras参与了骨肉瘤的放射抗拒,而洛伐他汀则可以通过抑制甲羟戊酸途径抑制Ras蛋白的翻译后修饰,抑制其和细胞膜的作用,继而促进Ras转化的骨肉瘤对放疗的敏感性。有报道显示Rac1介导的内皮细胞对放疗的响应可以促进肿瘤细胞的转移,而他汀类药物则可以通过抑制Rac1的翻译后修饰来降低其活性,继而抑制肿瘤转移[16]。在肺癌细胞A549中的研究显示,洛伐他汀可以增强肺癌细胞对放疗的敏感性,其机制可能通过抑制Akt和激活AMPK通路来诱导细胞的凋亡实现的[9]。而目前关于他汀类药物是否可以增强食管癌细胞对放疗的敏感性则鲜有研究[13-14]。
本研究主要以放射敏感的食管癌细胞EC9706为研究对象,研究结果显示,加入辛伐他汀后随着放射剂量的增加,细胞EC9706的存活率降低。集落形成实验显示,辛伐他汀联合放疗相对于单独放疗组和辛伐他汀组集落的数量呈现明显的减少(P<0.001)。因此,本研究结果显示辛伐他汀可以增强亲代食管癌细胞对放疗的敏感性。另一方面,本研究通过间断照射的方法成功诱导出食管癌细胞EC9706的放射抗拒细胞R-resistant,进一步的研究显示,辛伐他汀联合放疗与单独放疗组相比,放射抗拒细胞R-resistant的存活率明显降低,具有明显的肿瘤抑制效果;集落形成实验的结果也显示联合组相对单独放疗组和辛伐他汀组,集落的数量呈现明显的减少(P<0.01)。由此说明辛伐他汀可以明显增强放射抗拒细胞R-resistant对放疗的敏感性,可逆转R-resistant的放射抗拒。
辛伐他汀作为预防和治疗心脑血管疾病方面的一种老药,在临床上显示出良好的安全性,未见明显不良反应,将其作为EC放疗的增敏药物,具有安全应用于临床的基础。因此,“老药新用”作为放疗增敏药物的辛伐他汀具备良好的安全性优势。辛伐他汀对EC放疗敏感性的具体的作用机制尚不明确,笔者正在开展更进一步的深入研究。本研究将为食管癌的临床放疗增敏,尤其是放射抗拒的食管癌患者的治疗提供新的治疗策略。
参考文献:
[1] TORRE LA, BRAY F, SIEGEL RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108.
[2] COOPER JS, GUO MD, HERSKOVIC A, et al. Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG85-01)[J]. JAMA, 1999, 281(17):1623-1627.
[3] CHANDRA A, GUERRERO TM, LIU HH, et al. Feasibility of using intensity-modulated radiotherapy to improve lung sparing in treatment planning for distal esophageal cancer[J]. Radiother Oncol, 2005, 77(3):247-253.
[4] NGUYEN GH, MURPH MM, CHANG JY. Cancer stem cell radioresistance and enrichment: Where frontline radiation therapy may fail in lung and esophageal cancers[J]. Cancers (Basel), 2011, 3(1):1232-1252.
[5] KELVIN KW, AMIT M, LILLIAN L. The statins as anticancer agents[J]. Clin Cancer Res, 2003, 9(1):10-19.
[6] FRITZ G, HENNINGER C, HUELSENBECK J. Potential use of HMG-CoA reductase inhibitors (statins) as radioprotective agents[J]. Br Med Bull, 2011, 97(1):17-26.
[7] AGARWAL B, HALMOS B, ALEKSANDER S, et al. Mechanism of lovastatin induced apotosis in intestinal epithelial cells[J]. Carcinogenesis, 2002, 23(3):521-528.
[8] FARINA HG, BUBLIK DR, ALONSO DF, et al. Lovastatin alters cytoskleton organization and inhibits experimental metastasis of mammary carcinoma cell[J]. Clin Exp Metastasis, 2002, 19(6):551-559.
[9] SANLI T, LIU C, RASHID A, et al. Lovastatin sensitizes lung cancer cells to ionizing radiation: modulation of molecular pathways of radioresistance and tumor suppression[J]. J Thorac Oncol, 2011, 6(3):439-450.
[10] LACERDA L, REDDY JP, LIU D, et al. Simvastatin radiosensitizes differentiated and stem-like breast cancer cell lines and is associated with improved local control in inflammatory breast cancer patients treated with postmastectomy radiation[J]. Stem Cells Transl Med, 2014, 3(7):849-856.
[11] LARNER J, JANE J, LAWS E, et al. A phase Ⅰ, Ⅱ trial of lovastatin for anaplastic astrocytoma and glioblastoma multiforme[J]. Am J Clin Oncol, 1998, 21(6):579-583.
[12] HOLLER V, BUARD V, GAUGLER MH, et al. Pravastatin limits radiation-induced vascular dysfunction in the skin[J]. J Invest Dermatol, 2009, 129(5):1280-1291.
[13] AZOULAY L, SUISSA S. Immortal person-time bias in relation to the use of nonsteroidal anti-inflammatory drugs and statins in the prevention of esophageal cancer in patients with Barrett's esophagus[J]. Gastroenterology, 2012, 142(5):e20-21.
[14] ALEXANDRE L, CLARK AB, BHUTTA HY, et al. Statin use is associated with reduced risk of histologic subtypes of esophageal cancer: a nested case-control analysis[J]. Gastroenterology, 2014, 146(3):661-668.
[15] MILLER AC, KARIKO K, MYERS CE, et al. Increased radioresistance of EJras-transformed human osteosarcoma cells and its modulation bylovastatin, an inhibitor of p21ras isoprenylation[J]. Int J Cancer, 1993, 53(2):302-307.
[16] HAMALUKIC M, HUELSENBECK J, SCHAD A, et al. Rac1-regulated endothelial radiation response stimulates extravasation and metastasis that can be blocked by HMG-CoA reductase inhibitors[J]. PLoS One, 2011, 6(10):e26413.
(编辑韩维栋)
收稿日期:2015-11-02修回日期:2016-03-12
通讯作者:孙晓力. E-mail: 2697782835@qq.com
中图分类号:R735.1
文献标志码:A
DOI:10.7652/jdyxb201604019
Simvastatin enhances the radiosensitivity of esophageal squamous cell carcinoma
JIN Ying-ying1, WEI Yang2, WANG Li1, HE Yun1,JIA Hui1, MA Hong-bing1, SUN Xiao-li3
(1. Department of Oncology, 2. Scientific Research Center, 3. Department of General Surgery,the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004, China)
ABSTRACT:ObjectiveTo study the effect of simvastatin on the radiosensitivity of esophageal squamous cell carcinoma. MethodsInterrupted radiation was used to induce the radioresistance EC9706, named R-resistant cell. The effect of simvastatin on the proliferation and radiosensitivity of EC9706 and R-resistant cells were examined by Cell Counting Kit-8 assay and colony formation assay, respectively. ResultsThe radioresistance EC9706, named R-resistant, was induced successfully. The results of Counting Kit-8 assay and colony formation assay indicated that simvastatin could sensitize EC9706 and the radioresistance of R-resistant to irradiation. ConclusionSimvastatin can sensitize esophageal squamous cell carcinoma to irradiation.
KEY WORDS:simvastatin; esophageal squamous cell carcinoma; radioresistance; sensitization
优先出版:http://www.cnki.net/kcms/detail/61.1399.r.20160615.1047.020.html(2016-06-15)
