ADSCs与HUVECs体外共培养促进HUVECs增殖及成血管化作用
2016-07-14焦自钊薛武军田晓辉
焦自钊,薛武军,田晓辉,李 杨,郑 瑾
(西安交通大学第一附属医院肾脏病医院肾移植科,陕西西安 710061)
◇基础研究◇
ADSCs与HUVECs体外共培养促进HUVECs增殖及成血管化作用
焦自钊,薛武军,田晓辉,李杨,郑瑾
(西安交通大学第一附属医院肾脏病医院肾移植科,陕西西安710061)
摘要:目的为制备血管化胰岛,分离、培养脂肪来源干细胞(adipose derived stem cells, ADSCs),观察细胞共培养条件下,ADSCs对人脐静脉内皮细胞(human umbilical vein endothelial cell, HUVECs)增殖及成血管化功能的促进作用并探讨其机制。方法采用胶原酶消化法分别原代培养获得ADSCs与HUVECs,细胞形态学、免疫荧光或多向诱导分化鉴定,建立HUVECs与ADSCs接触式及间接共培养体系,设立HUVECs单独培养为对照组,比较两组成血管化功能、HUVECs增殖状况及上清液血管内皮生长因子(vascular endothelial growth factor, VEGF)、碱性成纤维生长因子(basic fibroblast growth factor, b-FGF)浓度。结果通过原代培养成功获得ADSCs与HUVECs;第3代ADSCs呈均一的长梭形纤维细胞样形态,免疫荧光检测见CD44/CD49d(+)、CD31/CD34(-),并具有多向分化功能;第2代HUVECs免疫荧光检测示vWF/CD31(+)。于Matrigel内接触式共培养4 h,ADSCs+HUVECs组血管密度高于HUVECs组;间接共培养时,HUVECs生长曲线于ADSCs+HUVECs组上移,在对数生长期的第3、4、5天,ADSCs+HUVECs组HUVECs计数为(4.52±0.31)×104、(7.18±0.45)×104、(8.23±0.36)×104,大于单独HUVECs组的(2.71±0.25)×104、(4.87±0.26)×104、(6.86±0.33)×104(P<0.01);ADSCs+HUVECs组HUVECs群体倍增时间为(1.36±0.23)d,短于单独HUVECs组的(1.62±0.31)d。四甲基噻唑蓝(methylthiazol tetraztlium, MTT)法测定HUVECs的A值培养第1、3、5、7天的ADSCs+HUVECs组高于单独HUVECs组(P<0.01)。培养第3、7、13天时ADSCs+HUVECs组上清液VEGF、b-FGF浓度均高于HUVECs组(P<0.01)。结论ADSCs与HUVECs共培养时,ADSCs可能通过分泌或增加HUVECs分泌VEGF、b-FGF等细胞因子,进而促进HUVECs增殖及成血管化。
关键词:共培养;脂肪来源干细胞;人脐静脉内皮细胞;细胞增殖;成血管化
胰岛移植是治疗Ⅰ型糖尿病的有效手段,但在胰岛分离纯化过程中破坏了其内部的微循环系统,以致移植后早期大量的移植胰岛因缺血、缺氧而凋亡、死亡,胰岛功能受损[1-2]。再建移植胰岛的微循环已成为胰岛移植迫切需要解决的问题之一。研究报道,骨髓等间充质干细胞可通过旁分泌血管内皮生长因子(vascular endothelial growth factor, VEGF)、成纤维生长因子(fibroblast growth factor, FGF)、表皮生长因子、转化生长因子、胰岛素样生长因子等促进内皮细胞增殖及血管形成[3-6]。因此,我们将分离、培养的脂肪来源干细胞(adipose derived stem cells, ADSCs)及人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs),研究在体外共培养条件下,ADSCs对HUVECs增殖及成血管化功能的促进作用并探讨其机制,为以后制备血管化胰岛鉴定基础。
1材料与方法
1.1材料脂肪组织来自因疤痕修复需行腹部取皮术患者的腹部皮下脂肪组织(西安交通大学第一附属医院整形外科提供),无系统性感染、糖尿病及相关疾病,年龄18~42岁;脐带组织来自健康孕妇足月妊娠经剖腹产娩出的新生儿脐带组织(西安交通大学第一附属医院产科提供);取标本前经医院伦理委员会及患者同意。
倒置式显微镜及VANOX型荧光显微镜(日本Olympus公司);5100型细胞培养箱(美国NAPCC公司);ELISA试剂盒(VEGF、b-FGF)及抗人CD31、CD34、CD49d、vWF抗体,FITC或PE标记的二抗(美国Sigma公司);胶原酶Ⅰ、胶原酶Ⅱ、胎牛血清、DMEM-F12培养基、RPMI-1640培养基 (美国Gibco公司产);Matrigel、锥虫蓝、MTT(上海伟进生物科技有限公司)。
1.2ADSCs的分离、培养及多向诱导分化鉴定无菌条件下取脂肪组织10 g,超净台内剪除筋膜和血管,PBS液冲洗除去血液和组织碎片;剪碎脂肪组织至大小约1 mm3,0.1 g/L的胶原酶Ⅰ溶液,于37 ℃水浴震荡消化60 min;1 000 r/min离心5 min,弃去上层油脂、脂肪组织以及上清;DMEM-F12培养基重悬,75 μm不锈钢筛网过滤,再次1 000 r/min离心5 min;弃去上清,DMEM-F12完全培养基(含100 mL/L胎牛血清,100 U/L青霉素,100 μg/L链霉素 )重悬细胞,调整细胞种植密度,以5×104个有核细胞/cm2密度接种25 mL细胞培养瓶中。37 ℃、饱和湿度、50 mL/L CO2培养箱中培养,视细胞生长状况每2~3 d换液1次。倒置显微镜下观察,当细胞达到80%~90%融合时,2.5 g/L胰酶+0.2 g/L EDTA消化传代。
ADSCs体外多向诱导分化鉴定:取P3代生长均一的ADSCs,分别向脂肪细胞、成骨细胞体外定向诱导分化。
①ADSCs向脂肪细胞诱导分化:取P3代生长均一的ADSCs以5×104/孔接种至6孔板,DMEM-F12完全培养基孵育至80%融合,换成成脂诱导培养液(DMEM-F12培养基+100 mL/L胎牛血清+0.5 mmol/L IBMX+1 μmol/L地塞米松+10 μmol/L胰岛素+200 μmol/L吲哚美辛+100 U/L青霉素+100 μg/L链霉素)诱导。DMEM-F12完全培养基为阴性对照。每3 d更换培养液1次,倒置相差显微镜观察细胞形态变化,并油红O染色定性观察体外诱导分化的结果。
油红O染色定性:取5 g/L油红O储存液,按储存液∶蒸馏水=3∶2的比例稀释并过滤,制成油红O染色剂。染色时,细胞弃去原培养液,PBS漂洗1遍,40 g/L多聚甲醛在4 ℃条件下固定1 h,700 mL/L异丙醇清洗1遍,加1.5 mL油红O染色剂室温下20 min,600 mL/L异丙醇洗去多余的染料,PBS漂洗,倒置相差显微镜下观察细胞内脂滴形成。
②ADSCs向成骨细胞诱导分化:取P3代生长均一的ADSCs以5×104/孔接种至6孔板,DMEM-F12完全培养基孵育至80%融合,换成成骨诱导培养液(DMEM-F12培养基+100 mL/L胎牛血清+10 mmoL/L VitD3+37.5 mg/L VitC+2.16 g/L β2磷酸甘油+100 U/L青霉素+100 μg/L链霉素)诱导。倒置相差显微镜下观察细胞形态变化并茜素红染色鉴定。
茜素红染色:成骨诱导14 d的,蒸馏水冲洗,750 mL/L乙醇固定20~30 min,蒸馏水冲洗后加入20 g/L茜素红10~20 min,镜下观察。
1.3ADSCs表型的免疫荧光检测酸化处理的普通盖玻片消毒后放入24孔培养板,将P3代的ADSCs悬液接种于盖玻片上,37 ℃、饱和湿度、50 mL/L CO2培养箱继续培养。待细胞均匀铺满孔底,吸出培养液,用PBS冲洗盖玻片,根据ADSCs的表面抗原谱免疫荧光法检测ADSCs的CD31、CD34、CD44、CD49d相关抗原。
取出玻片后置入湿盒中,PBS冲洗,3 min×2次;40 g/L多聚甲醛室温固定30 min,PBS冲洗3 min×2次;内源性过氧化物酶阻断剂10 min,PBS冲洗3 min×2次;10 g/L TritonX-100 2 min,PBS冲洗3 min×2次;分别加兔抗人CD31、CD34、CD44、CD49d IgG一抗,4 ℃过夜,PBS冲洗5 min×3次;加Cyc3或FITC-羊抗兔IgG荧光二抗,室温下避光2 h,PBS冲洗5 min×3次;甘油封片,指甲油封片周,即刻在荧光显微镜下观察。
1.4HUVECs的分离、培养及鉴定超净台内修齐两断面,找出脐静脉,用PBS液将血迹完全冲洗干净;从冲洗的针头中注入1 g/L的胶原酶Ⅱ使其充盈后止血钳钳夹两端,置于37 ℃培养箱中孵育15 min,间断轻轻按摩静脉使其消化更充分;消化完毕后收集脐静脉内的消化液,然后注入含100 mL/L胎牛血清的RPMI-1640培养基再次冲洗管腔;将消化液与冲洗液一并收集于离心管,1 000 r/min,离心5 min,弃上清;调整细胞种植密度,以5×104个细胞/cm2密度接种于预先用10 g/L明胶铺被的25 mL细胞培养瓶中,RPMI-1640完全培养基(含200 mL/L胎牛血清、20 ng/L hVECF121、L-谷氪酰胺2 mmol/L、青霉素100 U/mL、链霉素100 μg/mL),37 ℃、饱和湿度、50 mL/L CO2培养箱中培养。视细胞生长状况每2~3 d 换液1次,内皮细胞达70%~80%汇合融合时用2.5 g/L胰酶+0.2 g/L EDTA消化传代。
用兔抗人CD31、VWF IgG一抗及相应二抗对HUVECs进行免疫荧光鉴定,方法同ADSCs免疫荧光鉴定。
1.5ADSCs和HUVECs直接共培养取ADSCs与HUVECs,RPMI1640完全培养基调整细胞密度为1×105/mL,于6孔板每孔内各加入1 mL ADSCs与HUVECs细胞悬液,使ADSCs与HUVECs比例为1∶1,RPMI-1640完全培养基(含200 mL/L胎牛血清、青霉素100 U/mL、链霉素100 μg/mL),37 ℃、50 mL/L CO2培养箱内培养,每2~3 d换液。倒置相差显微镜下观察细胞共培养大体形态。
ADSCs和HUVECs在Matrigel中直接共培养:将Matrigel置于4 ℃过夜融解,每孔100 μL加入24孔板后37 ℃孵育1~2 h成胶;取ADSCs与HUVECs,分别消化,用RPMI-1640完全培养基调整细胞密度为1×105/mL;设立ADSCs和HUVECs共培养组及HUVECs单独培养组,共培养组每孔内各加入1 mL ADSCs与HUVECs细胞悬液,使ADSCs与HUVECs比例为1∶1,单独培养组各加入1 mL HUVECs,用培养基补至2 mL(实验过程冰上操作);37 ℃、50 mL/L CO2培养箱内培养,倒置显微镜下观察细胞形态及各孔血管形成情况。
1.6ADSCs和HUVECs间接共培养取ADSCs按1×104/mL密度接种在Transwell 24孔双层培养板的上层,将HUVECs接种于下层培养板中,接种密度1×104/mL,在双层24孔板的每孔中加入RPMI-1640完全培养基2 mL,上下各1 mL,每2 d换液1次,分别收集第3、7、13天上清液100 μL,按ELISA试剂盒说明检测上清液VEGF、b-FGF等细胞因子浓度,设单独HUVECs培养组对照组。倒置相差显微镜下观察细胞形态变化。每2 d取3孔2.5 g/L胰酶消化,锥虫蓝染色计数。共计数8 d。绘制各组HUVECs细胞生长曲线,计算细胞群体倍增时间。
取ADSCs按1×104/mL密度接种于Transwell 96孔双层培养板的上层,将HUVECs接种于下层培养板中,接种密度1×104/mL,RPMI-1640完全培养基200 μL,上下各100 μL,使ADSCs与HUVECs比例为1∶1,每2 d换液1次;HUVECs组只于下层培养板中加入100 μL HUVECs细胞悬液,用培养基补至200 μL;培养1、3、5、7 d后,取出Transwell 96孔双层培养板的上层,下层培养板中保留培养液100 μL,每孔分别加入5 g/L的MTT 10 μL,继续培养4 h;然后吸掉上清,每孔加入150 μL二甲基亚砜,置摇床上低速振荡5 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光度(A值)。
2结果
2.1ADSCs的培养与鉴定倒置相差显微镜下ADSCs细胞呈贴壁生长,原代培养至14 d的细胞达约80%融合,细胞呈梭形、多角形、圆形等多种形态;传至P3代时细胞生长良好,呈漩涡状或辐射状生长,均一的长梭形纤维细胞样形态,与文献报道的间充质细胞形态相符(图1)。
ADSCs向脂肪细胞诱导分化后3 d,镜下可见小部分细胞胞质内出现少量高折光性的细小脂滴,并逐渐聚集;分化诱导后6 d,部分细胞形态发生明显改变,从长梭形类成纤维细胞外观逐渐变圆,并且开始出现充满脂滴的细胞,油红O染色阳性,未加成脂诱
导剂的阴性对照组则为梭形细胞形态(图1)。向成骨细胞诱导分化3~4 d,细胞形态开始改变,由长梭形变为扁圆形,细胞核变圆,细胞体积增大,长轴缩短,细胞外基质有少量钙盐沉积,随着诱导时间的延长,钙盐沉积增加;成骨诱导14 d,茜素红染色提示细胞外基质大量钙盐沉积,未加成骨诱导剂的阴性对照组则为梭形细胞形态(图1)。经CD31、CD34、CD44、CD49d表面抗原荧光染色后,镜下可见CD31、CD34呈阴性反应,CD44、CD49d呈阳性反应,符合文献报道的ADSCs表面抗原谱(图2)。
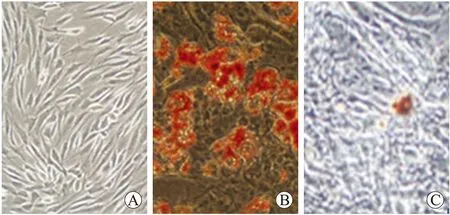
图1脂肪干细胞培养及多向诱导分化
Fig.1 The culture and multi-directional differentiation of ADSCs (×100)
A:P3代细胞形态呈均一长梭形,呈旋涡状生长;B:ADSCs成脂诱导6 d,油红O染色阳性;C:ADSCs成骨诱导14 d,茜素红染色阳性。
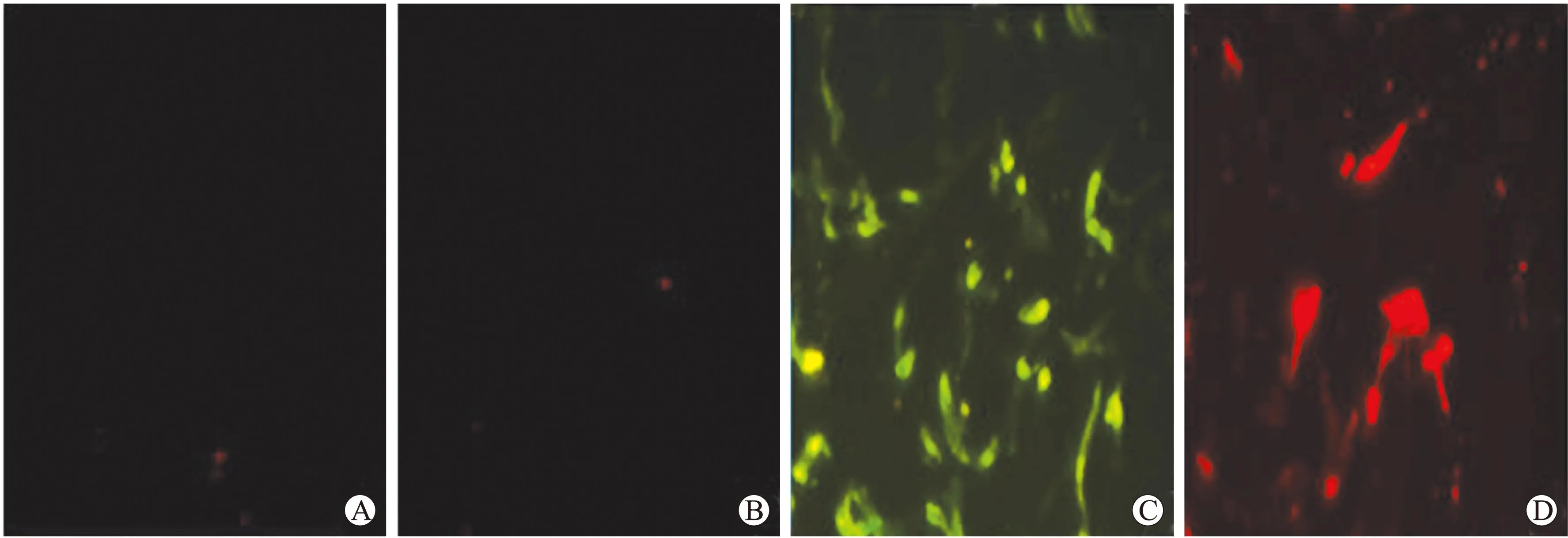
图2ADSCs细胞的免疫荧光鉴定
Fig.2 Immunofluorescence test of surface antigens on ADSCs (×100)
A、B:ADSCs的CD31、CD34免疫荧光鉴定呈阴性反应;C:CD44加FITC-羊抗兔IgG荧光二抗呈阳性反应;D:CD49d加Cyc3-羊抗兔IgG荧光二抗呈阳性反应。
2.2HUVECs的培养与鉴定相差倒置显微镜下观察,HUVECs贴壁单层生长,呈短梭状或铺路石样镶嵌排列,细胞为扁平多角形,边界清楚,胞质丰富,胞核清晰可见,为圆形或椭圆形。原代培养细胞,于接种后2 h开始贴壁生长,传代细胞约0.5 h后即开始贴壁生长;原代细胞5~7 d可达70%~80%汇合融合,传代细胞生长旺盛,约3 d可长满瓶底。HUVECs的CD31、vWF血管内皮细胞相关抗原检测呈阳性反应,细胞呈铺路石样镶嵌排列,证实培养的细胞为血管内皮细胞(图3)。
2.3ADSCs和HUVECs共培养倒置显微镜下可见,在直接接触培养条件下,ADSCs和HUVECs呈相容性贴壁生长,细胞形态未发生明显变化,相邻细胞贴靠交织生长。HUVECs接种于Matrigel内2 h后可见HUVECs毛刺状突起,4 h后可见毛刺状突起呈小官状相互衔接,说明HUVECs在Matrigel内有血管形成功能。ADSCs和HUVECs共培养组血管密度比单纯HUVECs组密度更高(图4)。
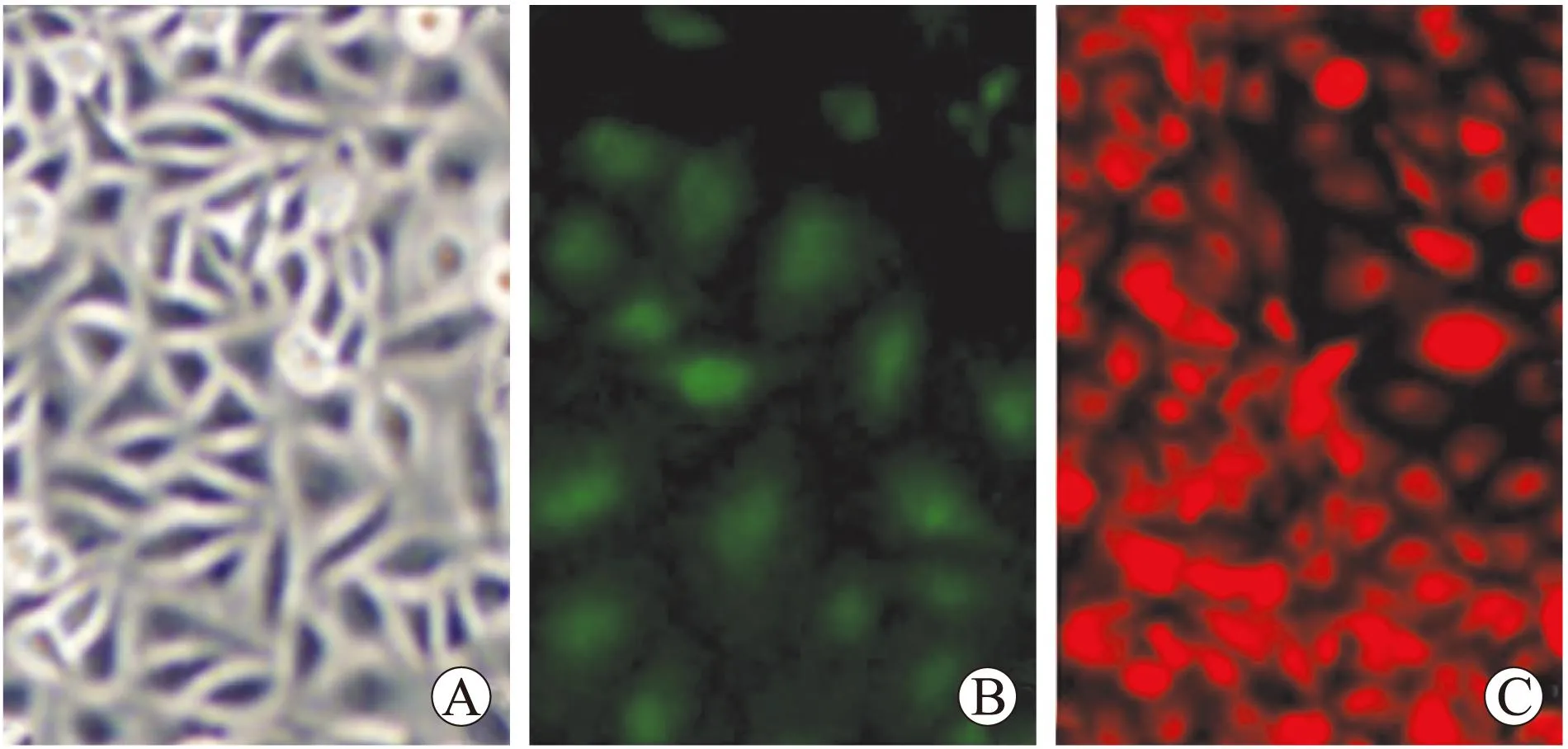
图3HUVECs培养及免疫荧光鉴定
Fig.3 The culture and immunofluorescence test of HUVECs (×100)
A:HUVECs贴壁生长,扁平多角形,呈短梭状或铺路石样镶嵌排列;B:CD31加FITC-羊抗兔IgG荧光二抗呈阳性反应;C:vWF加PE-羊抗兔IgG荧光二抗呈阳性反应。

图4ADSCs+HUVECs共培养
Fig.4 The co-culture of ADSCs and HUVECs (×200)A:ADSCs+HUVECs直接共培养;B:ADSCs+HUVECs组于Matrigel内共培养4 h;C:HUVECs组于Matrigel内培养4 h。
间接共培养时,ADSCs+HUVECs组、HUVECs组培养8 d绘制HUVECs细胞生长曲线可见,在ADSCs+HUVECs组曲线上移,2组均在第2天进入对数生长期,持续时间持续均为3 d。在对数生长期第3、4、5天HUVECs细胞计数,ADSCs+HUVECs组分别为(4.52±0.31)×104、(7.18±0.45)×104、(8.23±0.36)×104,大于HUVECs组的(2.71±0.25)×104、(4.87±0.26)×104、(6.86±0.33)×104(P<0.01);ADSCs+HUVECs组、HUVECs组,根据公式DT=T×Lg2/(LgNt-LgNo)计算HUVECs细胞群体倍增时间分别为(1.36±0.23)d、(1.62±0.31)d(DT:倍增时间;T:培养时间;Nt:对数生长期终点细胞计数;No:首次细胞计数)(图5A)。
间接共培养第3、7、13天时,ADSCs+HUVECs组上清液VEGF、b-FGF质量浓度分别为(33.45±6.78)pg/L、(38.75±5.67)pg/L、(35.42±6.34)pg/L,(19.78±3.27)pg/L、(21.34±4.13)pg/L、(17.26±2.89)pg/L;单独HUVECs组上清液VEGF、b-FGF质量浓度分别为(5.34±0.98)pg/L、(5.61±1.12)pg/L、(5.75±1.03)pg/L,(2.31±0.42)pg/L、(2.45±0.17)pg/L、(2.17±0.21)pg/L,ADSCs+HUVECs组均高于单独HUVECs组(P<0.01,图5B、5C)。
共培养后第1、3、5、7天,MTT法检测HUVECs细胞增值能力,结果显示,ADSCs+HUVECs组HUVECs的A值分别为0.16±0.04、0.32±0.05、0.51±0.08、0.29±0.03,显著高于HUVECs组的0.11±0.03、0.28±0.07、0.24±0.05、0.14±0.04,差异有统计学意义(P<0.01);ADSCs+HUVECs组的HUVECs的A值第5天达高峰后下降,HUVECs组的A值第3天达高峰后下降(图5D)。
3讨论
近年来,促进冠心病、脑血栓形成等缺血性疾病的缺血器官血管再建问题已成为临床医学面临的重大课题。同时,组织工程中的微循环再建问题亦受到人们的广泛关注,如胰岛移植中,普遍认为移植胰岛的存活很大程度上取决于其早期血管化的程度和速度。血管再生(angiogenesis)是指从已存在于血管网的内皮细胞分化而形成新的血管。血管生长过程受酸性和碱性成纤维细胞生长因子(aFGF and bFGF)、表皮生长因子、血小板源性生长因子、胰岛素样生长因子及血管内皮生长因子(VEGF)等多种生长因子的调节。其中VEGF是血管内皮细胞特异性的生长因子,具有显著促进新生血管形成的功能[7-8]。骨髓等间充质干细胞可通过旁分泌产生VEGF、FGF、表皮生长因子、转化生长因子、胰岛素样生长因子等多种促内皮细胞增殖及血管再生的细胞因子,从而改善胰岛血管再生的微环境[3-6]。
脂肪干细胞(ADSCs)是从脂肪组织中分离得到的一群多能间充质干细胞,相对于骨髓干细胞(BMSCs),具有取材方便、对供体损伤小、来源充足、扩增迅速、可自体移植等优点;而在细胞分泌、稳定生长能力、分化能力方面二者无明显差别,是胰岛、骨组织工程中良好的种子细胞[9-14]。本实验中我们成功分离、培养了人脂肪干细胞(ADSCs),细胞形态学、免疫荧光及多向分化功能鉴定符合间充质干细胞特性,和人脐静脉内皮细胞(HUVECs)间接共培养时ELISA检测见共培养组上清液VEGF、b-FGF浓度明显高于HUVECs单独培养组,从而证实ADSCs细胞和其他间充质干细胞一样,亦存在VEGF、FGF等多种促血管再生细胞因子的分泌功能。
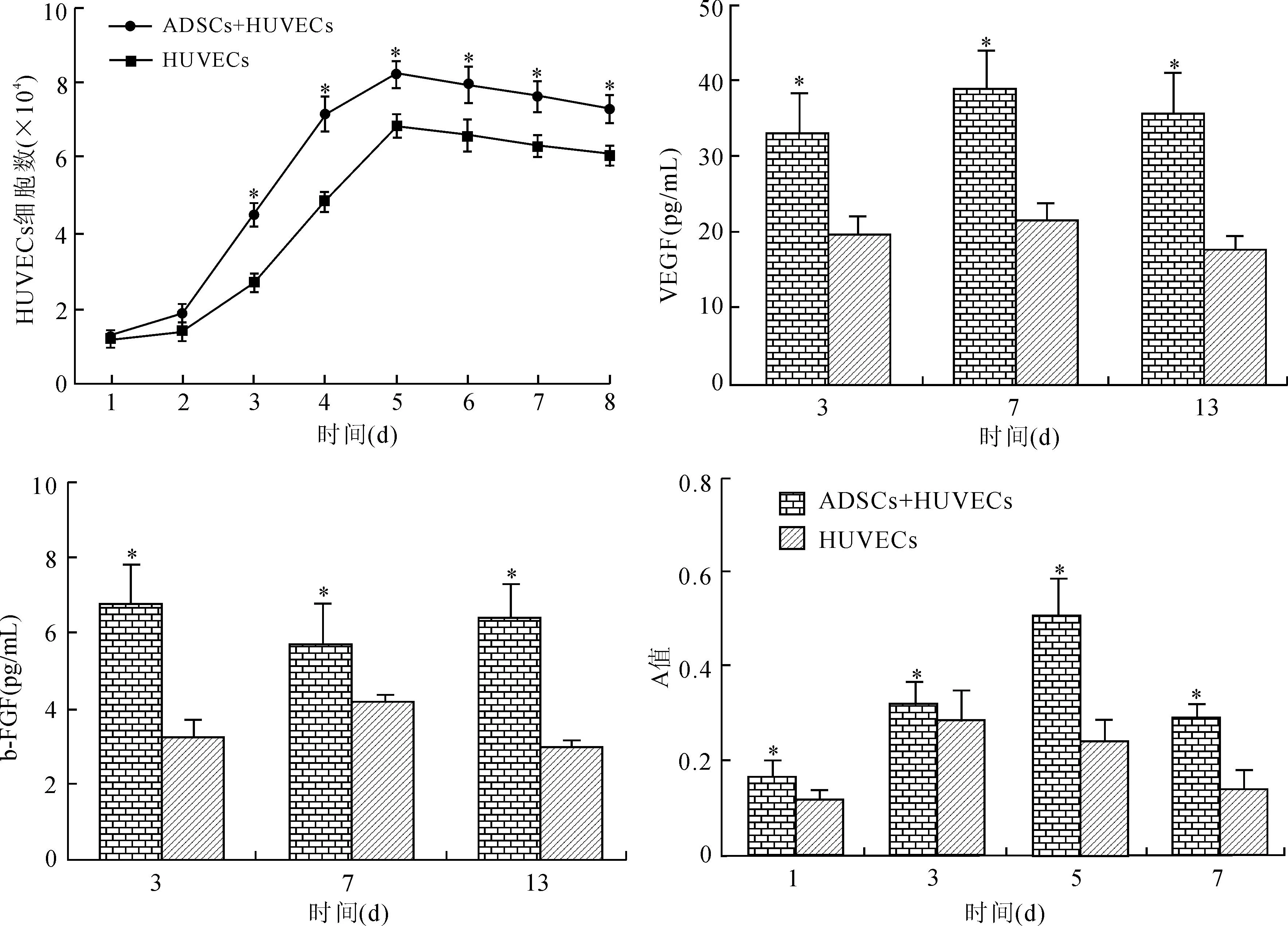
图5HUVECs细胞生长曲线、上清液VEGF、b-FGF质量浓度及HUVECs A值的比较
Fig.5 The growth curve of HUVECs, the concentration of VEGF and b-FGF in the supernatant, and A value of HUVECs
与HUVECs组比较,*P<0.01。
目前,组织工程促进内皮细胞血管化的方法主要为添加VEGF等生长因子、转染VEGF基因等,但由于存在VEGF等生长因子半衰期短、作用部位不确定及转染病毒的安全性问题,限制了以上方法的应用[15-16]。脂肪干细胞(ADSCs)等间充质干细胞因除具有VEGF、FGF等多种促血管再生细胞因子的分泌功能外,还具有低免疫源性,可自体、异体移植及通过旁分泌作用局部等优点,因此成为组织工程中促进内皮细胞血管化的良好方法之一[17-18]。BHANG等[19]研究ADSCs细胞体内注射给下肢缺血大鼠时发现,ADSCs细胞具有向缺血区域归巢的作用,能够促使缺血下肢的血管密度增高,血流量增加,并证实这种促进血管形成的功能是通过ADSCs细胞旁分泌VEGF、FGF等多种促进血管再生的细胞因子实现的。
本研究中我们发现,体外直接接触培养条件下,ADSCs和HUVECs呈相容性、相邻细胞贴靠交织生长;于Matrigel内接触式共培养时见ADSCs+HUVECs组血管密度高于HUVECs组,证实了ADSCs具有促进HUVECs成血管化的功能。细胞生长曲线、细胞群体倍增时间及四甲基噻唑蓝(methylthiazol tetraztlium, MTT)法测定的A值均是细胞增殖行为的客观指标,细胞生长曲线可全面反映细胞的增殖能力,细胞群体倍增时间可反映细胞的分裂能力,但不能反映增殖细胞的活性,而MTT法测定的A值则对细胞活性的反映更准确[20-21]。因此,综合采用以上3种方法检测细胞的增殖生长能力。在本实验中,间接共培养时的HUVECs生长曲线示ADSCs+HUVECs组曲线上移,HUVECs计数于ADSCs+HUVECs组大于单独HUVECs组,HUVECs细胞群体倍增时间于ADSCs+HUVECs组短于单独HUVECs组;MTT法测定显示,ADSCs+HUVECs组HUVECs的A值高于HUVECs组。说明ADSCs具有促HUVECs的细胞增殖作用,并且共培养组上清液VEGF、b-FGF浓度明显高于HUVECs单独培养组,证明ADSCs的促进血管内皮细胞增殖作用可能是通过其分泌的或其促进HUVECs分泌的VEGF、b-FGF等生长因子实现的。
综上所述,本研究证实了ADSCs与HUVECs共培养时,ADSCs可通过分泌或促进HUVECs分泌VEGF、b-FGF等细胞因子促进HUVECs增殖及成血管化。本实验不仅为以后血管化胰岛的制备鉴定了良好的实验基础,而且亦为细胞治疗的临床转化研究提供了一定的理论基础。
参考文献:
[1] EMAMAULLEE JA, SHAPIRO AM. Factors influencing the loss of beta-cell mass in islet transplantation[J]. Cell Transplant, 2007, 16(1):1-8.
[2] SCHRIMPE-RUTLEDGE AC, FONTES G, GRITSENKO MA, et al. Discovery of novel glucose-regulated proteins in isolated human pancreatic islets using LC-MS/MS-based proteomics[J]. J Proteome Res, 2012, 11 (7):3520-3532.
[3] WANG JL, CUI WG, YE JH, et al. A cellular delivery system fabricated with autologous BMSCs and collagen scaffold enhances angiogenesis and perfusion in ischemic hind limb[J]. J Biomed Mater Res Part A, 2012, 100A (6):1438-1447.
[4] ZHANG Q, ZHAO YH. Therapeutic angiogenesis after ischemic stroke: Chinese medicines, bone marrow stromal cells (BMSCs) and their combinational treatment[J]. Am J Chin Med, 2014, 42(1):61-77.
[5] KUCHROO P, DAVE V, VIJAYAN A, et al. Paracrine factors secreted by umbilical cord-derived mesenchymal stem cells induce angiogenesisinvitroby a VEGF-independent pathway[J]. Stem Cells Dev, 2015, 24(4):437-450.
[6] LU F, ZHAO X, WU J, et al. MSCs transfected with hepatocyte growth factor or vascular endothelial growth factor improve cardiac function in the infarcted porcine heart by increasing angiogenesis and reducing fibrosis[J]. Int J Cardiol, 2013, 167(6):2524-2532.
[7] HANAHAN D, FOLKMAN J. Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis[J]. Cell, 1996, 86(3):353-364.
[8] RISAU W. Mechanisms of angiogenesis[J]. Nature, 1997, 386(6626):671-674.
[9] DAO LT, PARK EY, HWANG OK, et al. Differentiation potential and profile of nuclear receptor expression during expanded culture of human adipose tissue-derived stem cells reveals PPARgamma as an important regulator of Oct4 expression[J]. Stem Cells Dev, 2014, 23(1):24-33.
[10] AHN HH, LEE IW, LEE HB, et al. Cellular behavior of human adipose-derived stem cells on wettable gradient polyethylene surfaces[J]. Int J Mol Sci, 2014, 15(2):2075-2086.
[11] SHENG L, YANG M, LIANG Y, et al. Adipose tissue-derived stem cells (ADSCs) transplantation promotes regeneration of expanded skin using a tissue expansion model[J]. Wound Repair Regen, 2013, 21(5):746-754.
[12] LIU B, CUI L, LIU GP, et al. Tissue-engineering bone with ADSCs and coral scaffold for repairing of cranial bone defect in canine[J]. Zhonghua Zheng Xing Wai Ke Za Zhi, 2009, 25(3):204-208.
[13] STERODIMAS A, DE FARIA J, NICARETTA B, et al. Tissue engineering with adipose-derived stem cells (ADSCs): current and future applications[J]. J Plast Reconstr Aesthet Surg, 2010, 63(11):1886-1892.
[14] 姜丽丽,刘天庆,宋克东,等. 脂肪干细胞生长特性研究[J]. 高校化工工程学报,2014,28(2):275-281.
[15] BAI Y, YIN G, HUANG Z, et al. Localized delivery of growth factors for angiogenesis and bone formation in tissue engineering[J]. Int Immunopharmacol, 2013, 16(2):214-223.
[16] LANGER R. Biomaterials and biotechnology: from the discovery of the first angiogenesis inhibitors to the development of controlled drug delivery systems and the foundation of tissue engineering[J]. J Biomed Mater Res A, 2013, 101(9):2449-2455.
[17] BOCELLI-TYNDALL C, BRACCI L, SPAGNOLI G, et al. Bone marrow mesenchymal stromal cells (BM-MSCs) from healthy donors and auto-immune disease patients reduce the proliferation of autologous- and allogeneic-stimulated lymphocytesinvitro[J]. Rheumatology (Oxford), 2007, 46(3):403-408.
[18] KEAN TJ, LIN P, CAPLAN AI, et al. MSCs: Delivery routes and engraftment, cell-targeting strategies, and immune modulation[J]. Stem Cells Int, 2013, 2013:732742.
[19] BHANG SH, LEE S, SHIN JY, et al. Efficacious and clinically relevant conditioned medium of human adipose-derived stem cells for therapeutic angiogenesis[J]. Mol Ther, 2014, 22(4):862-872.
[20] MOZES E, HUNYA A, POSA A, et al. A novel method for the rapid determination of beta-amyloid toxicity on acute hippocampal slices using MTT and LDH assays[J]. Brain Res Bull, 2012, 87(6):521-525.
[21] WANG H, WANG F, TAO X, et al. Ammonia-containing dimethyl sulfoxide: an improved solvent for the dissolution of formazan crystals in the 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT) assay[J]. Anal Biochem, 2012, 421(1):324-326.
(编辑卓选鹏)
收稿日期:2016-03-04修回日期:2016-04-07
基金项目:高等学校博士学科点专项科研基金(No.20110201110048)、国家自然科学基金(No.81400677)、中央高校基本科研业务费专项资金资助(No.08143014)
通讯作者:薛武军. E-mail: xwujun@126.com.
中图分类号:R318.1
文献标志码:A
DOI:10.7652/jdyxb201604006
ADSCs promotes the proliferation and vascularization of HUVECs when co-cultured in vitro
JIAO Zi-zhao, XUE Wu-jun, TIAN Xiao-hui, LI Yang, ZHENG Jin
(Department of Renal Transplantation, Hospital of Nephropathy,the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
ABSTRACT:ObjectiveFor preparation of vascularized islets, to isolate and culture human adipose derived stem cells, investigate the role of adipose derived stem cells (ADSCs) in promoting the proliferation and vascularization of human umbilical vein endothelial cells (HUVECs) co-cultured in vitro, and explore its mechanism. MethodsADSCs and HUVECs were isolated by collagenase digestion method, then cultured, and identified by morphology, immunofluorescence or multi-directional differentiation. The co-culture system of ADSCs and HUVECs was established, HUVECs cultured alone were set up for control group. The proliferation, vascularization and concentration of vascular endothelial growth factor (VEGF) and basic fibroblast growth factor (b-FGF)in the supernatant were compared between the two groups. ResultsThe third generational ADSCs had uniform long spindle fiberous morphology and multi-directional differentiational function. Immunofluorescence test of surface antigens on ADSCs revealed CD44/CD49d(+), CD31/CD34(-), on HUVECs CD31/vWF(+). High vascular density was found when co-cultured in Matrigel of ADSCs and HUVECs than alone of HUVECs. Growth curve shown at days 3, 4 and 5 of the logarithmic phase, HUVECs count in co-culture group of ADSCs and HUVECs was (4.52±0.31)×104, (7.18±0.45)×104, and (8.23±0.36)×104 under indirect co-culture condition, while that in individual HUVECs group was (2.71±0.25)×104, (4.87±0.26)×104, and (6.86±0.33)×104 (P<0.01). Population doubling time of HUVECs was shorter in co-culture group than in individual group. Also, the OD value of HUVECs was higher in co-culture group than in individual group when cultured at days 1, 3, 5 and 7 (P<0.01). When cultured at days 3, 7 and 13, the concentration of VEGF and b-FGF in the supernatant was higher in co-culture group than in individual group (P<0.01). ConclusionADSCs can promote the proliferation and vascularization of HUVECs in vitro co-culture conditions by secreting or increasing the HUVECs secretion of VEGF and b-FGF.
KEY WORDS:co-culture; adipose derived stem cell; human umbilical vein endothelial cell; cell proliferation; vascularization
Supported by the Specialized Research Fund for the Doctoral Program of Higher Education (No.20110201110048), the National Natural Science Foundation of China (No.81400677), and the Central University Special Funding for Basic Scientific Research Expenses (No.08143014)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160615.0857.008.html(2016-06-15)
