CYP1A1与PPAR-γ在猪肺炎支原体感染炎性反应调控中的作用关系
2016-07-13赵为民任守文周艳红李惠侠方晓敏
徐 杰,赵为民,任守文,赵 芳,周艳红,李惠侠,方晓敏*
(1.南京农业大学动物科技学院,南京 210095;2.江苏省农业科学院畜牧研究所动物品种改良和繁育重点实验室,南京 210014)
CYP1A1与PPAR-γ在猪肺炎支原体感染炎性反应调控中的作用关系
徐杰1,2,赵为民2,任守文2,赵芳2,周艳红1,2,李惠侠1*,方晓敏2*
(1.南京农业大学动物科技学院,南京 210095;2.江苏省农业科学院畜牧研究所动物品种改良和繁育重点实验室,南京 210014)
摘要:为研究猪CYP1A1基因表达变化对肺炎支原体感染的影响,探讨CYP1A1与过氧化物酶体增殖物激活受体-γ(PPAR-γ)在肺炎支原体感染炎性反应过程中的作用关系,通过基因克隆及真核表达载体构建,获得猪CYP1A1基因全长编码序列真核载体,借助细胞转染和抗性筛选技术获取稳定表达CYP1A1基因的猪肺泡巨噬细胞系,构建猪肺炎支原体细胞感染实验模型,分析炎症反应前后CYP1A1与PPAR-γ间的表达变化关系。结果显示:在肺炎支原体感染PAM细胞的炎性反应过程中,PPAR-γ与CYP1A1表达呈明显的正相关,并参与炎症调控,揭示猪肺炎支原体感染过程中CYP1A1基因可通过调控PPAR-γ发挥抑炎作用。
关键词:猪;CYP1A1;PPAR-γ;支原体肺炎;炎症反应
细胞色素酶P450(CYP 450)是一组结构功能相关的超家族基因编码酶系,主要参与机体外源性有害物质、内源活性物质及摄入药物的生物化学转化[1]。其亚家族成员CYP1A1主要编码产物为芳香羟化酶,代谢底物为多环芳烃、芳香胺等[2]。作为前致癌物质代谢活化的主要功能酶,CYP1A1在癌症病变及肿瘤发生过程中的作用机制备受关注。近年来,在肿瘤恶化及相关疾病的临床研究中发现P450酶在很多炎症疾病发病过程中具有一定的活性变化,引起药物代谢率的改变[3-4]。E.Paszti-Gere等[5]通过构建肝肠体外模型发现LPS应激构成的肝细胞炎症反应引起细胞色素酶P450家族的显著差异表达,其中包括CYP1A1的下调;本团队在前期研究中也发现,猪支原体肺炎感染猪与健康猪之间CYP1A1基因表达水平存在显著差异,暗示CYP1A1可能通过某种调控途径参与肺炎支原体感染炎症反应过程。
过氧化物酶体增殖物激活受体-γ(PPAR-γ)是由配体激活的核转录因子[6-7],目前研究已表明它与炎症反应有较为密切的联系,具有显著的抑炎作用[8-10]。而且,PPAR-γ在细胞色素酶的介导途径中也发挥一定作用,是细胞色素酶的五种诱导活化因子之一[11]。有研究发现芳香化酶敲除小鼠肝组织PPAR表达水平发生了变化,猜想PPAR与细胞色素酶的表达有关[12],但PPAR-γ涉及的核内调控机制复杂,在人、家禽方面的调控机制并未得到深入的研究,本课题在前期研究中也发现PPAR-γ与CYP1A1表达水平具有一定相关性。为探讨CYP1A1在猪肺炎支原体感染炎症反应过程中的作用及分子途径,作者通过构建稳定表达CYP1A1的细胞系以及猪肺炎支原体细胞感染模型,监测并分析炎症反应前后CYP1A1与PPAR-γ间的表达变化关系,为进一步揭示猪支原体肺炎发生的分子机制提供依据。
1材料与方法
1.1材料
梅山猪,由上海梅山猪保种场提供;猪肺泡巨噬细胞3D4/21(PAM)及猪肺炎支原体(Mhp)由江苏省农业科学院兽医研究所提供;真核载体构建相关试剂盒、单克隆抗体及基因工程酶系分别来自上海英骏公司、(大连)宝生物公司;细胞培养耗材及细胞转染试剂分别来自南京维森特生物公司及上海前尘生物公司。
1.2方法
1.2.1CYP1A1基因克隆猪屠宰取肝组织样,提取总RNA,2.2%甲醛变性凝胶电泳和紫外分光光度仪检测RNA纯度及浓度,反转录合成cDNA。以GenBank中猪CYP1A1基因cDNA序列(NCBI Reference Sequence:NM_214412.1)为模板设计引物(表1),以反转录cDNA为模板,PrimerSTAR高保真酶扩增CYP1A1基因,目的片段长度1 572 bp;PCR反应条件:94 ℃预变性2 min;98 ℃ 10 s,60 ℃ 5 s,72 ℃ 1.5 min,30个循环;72 ℃ 7 min,20 ℃保持,扩增结束后产物以1% 的琼脂糖凝胶电泳检测。
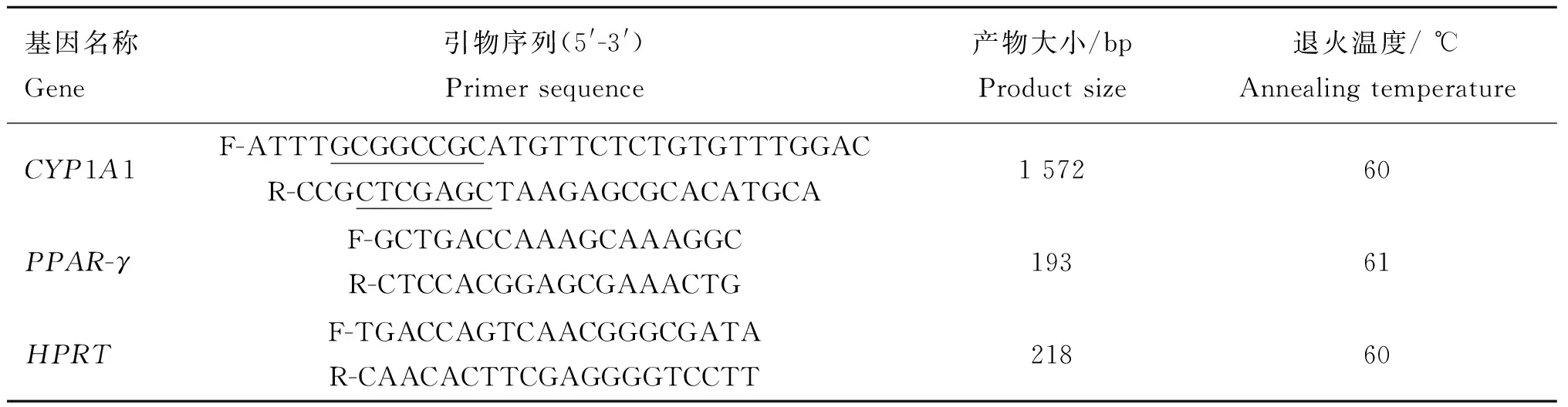
表1 相关基因引物设计及扩增信息
划线部分为酶切位点保护碱基
The underlined bases are designed to protect the restriction site
1.2.2真核表达载体构建目的片段回收纯化后,使用Taq酶加A尾(PrimerSTAR高保真酶扩增后为平末端),经与pMD-18-T载体连接,构建PMD-18-T-CYP1A1克隆载体,转化DH5α大肠杆菌感受态细胞,挑取阳性克隆摇菌12 h,菌液PCR鉴定并测序。小量提取pMD-18-T-CYP1A1重组质粒与pcDNA3.1/zeo(+)载体质粒,XhoⅠ、NotⅠ双酶切鉴定并回收片段,T4酶连接CYP1A1基因片段与酶切后的pcDNA3.1/zeo(+)载体片段,转化DH5α大肠杆菌感受态细胞,挑取阳性克隆摇菌12 h,小量提取质粒酶切验证,菌液PCR验证并测序鉴定,无内毒素大量提取质粒。
1.2.3CYP1A1过表达细胞系的建立制备100、150、200、250、300 μg·mL-1的Zeocin筛选培养液,分别培养PAM,选取10~14 d将PAM完全杀死的浓度为Zeocin筛选浓度。将正常PAM接种于六孔板并培养至贴壁程度达到80%,用转染试剂LipofectmineTM2000分别将pcDNA3.1/zeo(+)-CYP1A1质粒、pcDNA3.1/zeo(+)质粒以每孔2.5 μL转染入PAM,用RPMI1640完全培养液培养24 h,Zeocin筛选培养液继续培养至细胞大量死亡,并有抗性克隆出现时,减半浓度维持培养,将抗性克隆逐渐筛选并扩大培养,至传代稳定后RT-PCR,Western blot检验CYP1A1基因表达,构建成功的CYP1A1过表达PAM细胞系备用。
1.2.4Mhp感染PAM及PPAR-γ表达监测分别用Mhp菌液感染贴壁程度达到80%的CYP1A1过表达PAM(记为过表达组)、pcDNA3.1/zeo(+)载体转染细胞(记为空载组),正常PAM(记为正常组),每孔500 mL Mhp菌液和1 000 mL无双抗RPMI1640培养液。感染后0、4、12、24、48 h时收集细胞,提取细胞总RNA并反转录,猪肺炎支原体P36基因PCR扩增鉴定感染效果;以HPRT基因为内参,RT-PCR监测各组细胞PPAR-γ表达变化,相关引物及扩增信息如表1。相对定量2-ΔΔCt法计算目标基因表达水平,SPSS软件统计分析,并进行独立样本t检验,P<0.05和P<0.01表示统计学差异。
2结果
2.1CYP1A1基因克隆及真核载体构建
PCR扩增产物1%琼脂糖凝胶电泳检测结果如图1A,目的片段浓度高、特异性好,可用作后续试验。菌液PCR电泳结果如图1B,阳性克隆条带清晰,特异性好,经与GenBank中CYP1A1序列测序比对,相似性达99%。菌液提取质粒后双酶切电泳结果显示,重组质粒经酶切后形成两条带,一条为目的条带(1 572 bp),一条为pMD18-T载体条带(2.9 kb),如图1C。
连接后的真核载体质粒pcDNA3.1(+)/zeo-CYP1A1经NotⅠ、XhoⅠ双酶切鉴定,电泳结果如图2:双酶切后出现两条带,一条为CYP1A1(1 572 bp),一条为pcDNA3.1(+)/zeo载体条带;分别单酶切后形成一条带。菌液测序结果与之前测序结果基本一致,证明CYP1A1与pcDNA3.1(+)/zeo连接正确。
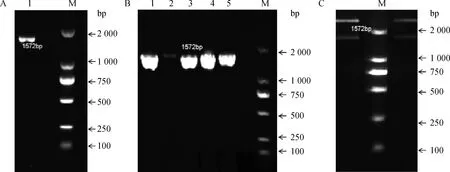
A.CYP1A1基因RT-PCR扩增结果,1泳道为成功扩增的CYP1A1条带;B.重组pMD18-T-CYP1A1菌液PCR鉴定示例;C.重组质粒双酶切后电泳示例,M.DNA相对分子质量标准,Marker左右两侧条带均为重组质粒双酶切后条带A.RT-PCR result of porcine CYP1A1 gene,land 1 is the amplified products of CYP1A1 band;B.PCR identification of recombinant pMD18-T-CYP1A1 vector;C.Double digestion result of recombinant plasmid,M.DNA marker,both sides of the Marker are band of double digestion result of recombinant plasmid图1 目的基因扩增及克隆载体构建鉴定Fig.1 RT-PCR result of porcine CYP1A1 gene and identification of recombinant cloning vector
2.2CYP1A1过表达细胞系的建立
PAM经过不同浓度的Zeocin筛选培养液处理后均开始大量死亡,其中Zeocin含量在250 μg·mL-1条件下,PAM细胞于14 d全部死亡,故确定最佳Zeocin筛选质量浓度为250 μg·mL-1,该质量浓度用于后续抗性克隆的筛选。
抗性克隆细胞筛选、收集并提取DNA 后,RT-PCR检测到了CYP1A1的表达(图3 A),且过表达组亮度明显高于正常组;Western blot法检测结果(图3B)也表明:重组细胞系的CYP1A1基因相对表达量明显高于正常细胞和空载转染细胞,灰度差异较为明显,说明重组基因成功整合到PAM细胞。
2.3Mhp感染PAM及PPAR-γ表达监测
肺炎支原体感染后,各处理组细胞随时间推移大量死亡,但形态无明显变化(图4),间接说明Mhp感染活性较好。针对Mhp感染的P36鉴定琼脂糖电泳显示:各处理组细胞均检测到427 bp的P36基因表达,条带亮,浓度高(图5),表明Mhp对PAM感染成功。

A.重组细胞系RT-PCR检测结果,泳道1为重组细胞PCR扩增片段(过表达),泳道2为正常细胞PCR扩增片段,M为DNA相对分子质量标准;B.Western blot灰度值效果图,1、2组为空载转染细胞,3组为正常细胞,4~6组为重组质粒转染细胞A.The identification result of recombinant cell lines by RT-PCR,1 land is the amplified PCR products of recombinant cell (over-expression),2 land is the amplified PCR products of normal group,M is the DNA marker;B.The picture of grey level of Western blot,1-2 is the blank transfection of cell group,3 is the normal cell group,4-6 is the recombinant plasmid transfection of cell group图3 转染效果的鉴定Fig.3 The identification of transfection efficiency
图4 Mhp感染后不同时间点细胞变化Fig.4 Cells changes at different times after Mhp stimulation
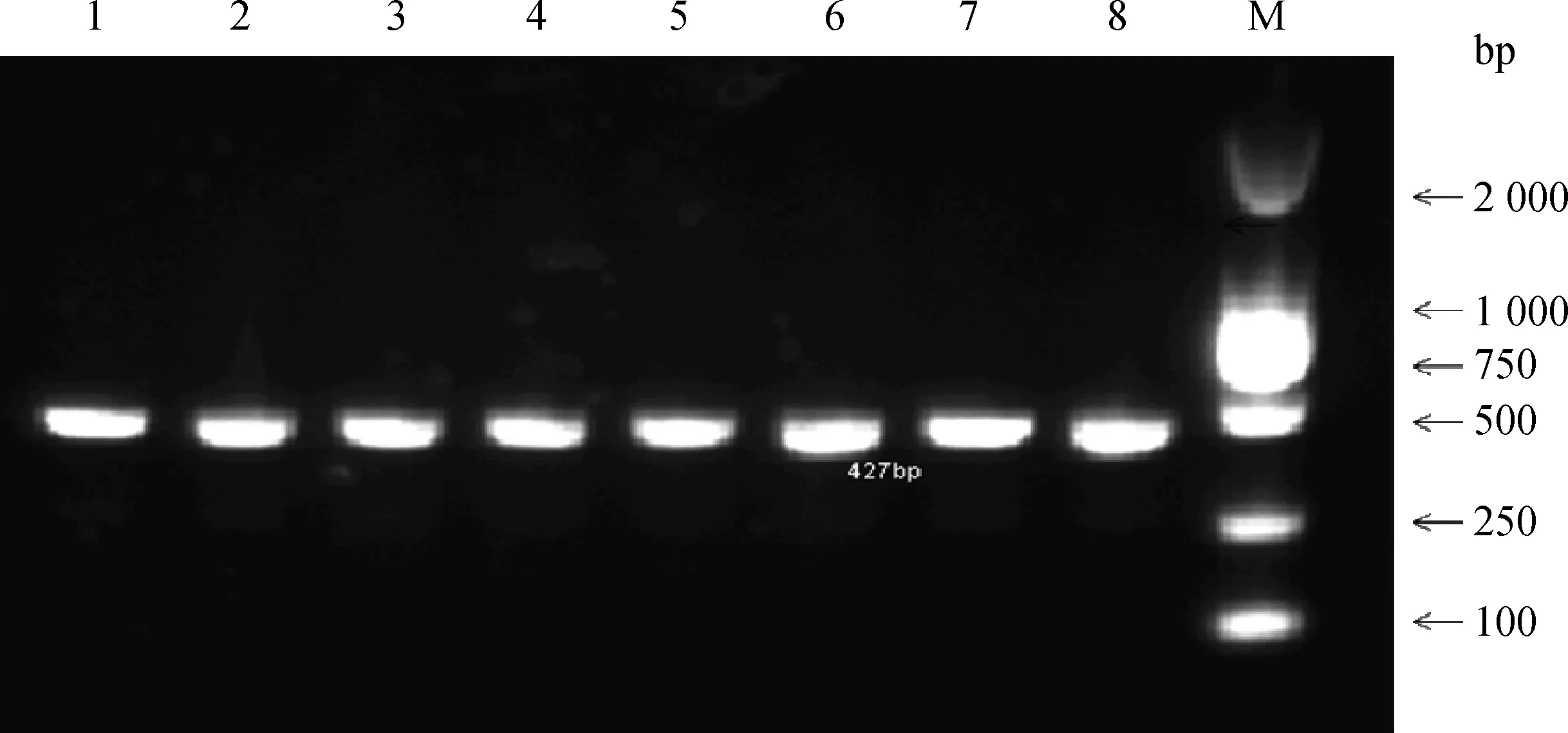
1~4.感染后4、12、24、48 h收集的正常组细胞;5~8.感染后4、12、24、48 h收集的过表达组细胞;M.DNA相对分子质量标准1-4.The collection of normal cell group at 4,12,24,48 h after infection;5-8.The collection of over-expression cell group at 4,12,24,48 h after infection;M.DNA marker图5 Mhp感染PAM细胞效果的PCR鉴定Fig.5 PCR identification of PAM cell after Mhp infection
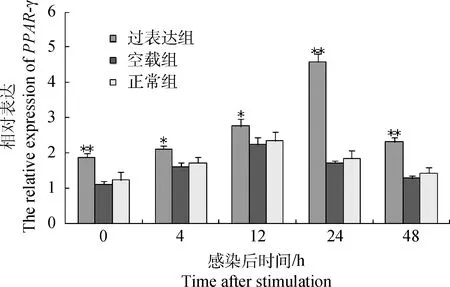
与对照组相比,*.差异显著(0.01 各组细胞感染Mhp后PPAR-γ表达监测显示:与未感染细胞相比,过表达组、空载组、正常组PPAR-γ表达量均出现显著上调,但不同时间点各组细胞PPAR-γ表达水平存在显著差异(图6),且在感染过程中上调时间先后也存在显著差异,其中,过表达组细胞(24 h)较空载组、正常组细胞(12 h)出现极显著上调的时间晚,在感染0~48 h的时间段内,过表达组细胞PPAR-γ的表达量均显著高于空载组和正常组(P<0.05),其中0、24、48 h表现为差异极显著(P<0.01),表明CYP1A1与PPAR-γ的表达量呈正相关。在炎症反应过程中,PPAR-γ的表达水平出现显著变化,表明PPAR-γ参与了炎症调控,过表达组、空载组及正常组PPAR-γ上调敏感度及峰值水平有显著差异,表明炎症程度可能不同。 3讨论 运用真核载体转染技术定向改变目标基因的表达水平是现代分子生物学研究的常用方法。作者参考刘旺根[13]的真核载体构建方案,根据猪CYP1A1基因的酶切位点及真核载体pcDNA3.1/zeo(+)的多克隆位点,选用了合适的限制性内切酶XhoⅠ、NotⅠ完成了载体与目的基因的连接,在PCR扩增方案上,提前添加酶切位点,形成特异性的黏性末端以保证CYP1A1基因的定向克隆,避免了反序连接而导致目的基因表达受阻。本试验选用的猪肺泡巨噬细胞3D4/21细胞是猪病毒学和免疫学常用的细胞,该细胞由PSV3neo质粒转染而获得传代能力,本身携带新霉素(neo)抗性基因和SV40大T抗原,故选用博来霉素(Zeocin)作为抗性克隆筛选实际,以携带Zeocin抗性的pcDNA3.1/zeo(+)作为真核载体成功构建了CYP1A1过表达细胞系。 PPAR-γ核内信号转导与炎症反应有着直接和间接的联系,它能够与配体复合物竞争性结合CBP和p300等核内转录辅助因子,形成对NF-κB等炎症活化因子的抑制作用[14-16],也能通过蛋白质之间的相互作用抑制T淋巴细胞在炎症过程中的活化,其中包括对NFAT等途径的抑制作用[16],NF-κB、NFAT等炎症活化因子调控着单核细胞和巨噬细胞等免疫细胞分泌相关炎性细胞因子并在靶组织发挥作用[17-18]。本试验通过构建猪肺炎支原体体外感染实验模型,在转录水平对PPAR-γ在不同CYP1A1表达水平情况下的表达量进行了分析,结果表明CYP1A1的表达能够影响PPAR-γ的表达,而PPAR-γ的表达又抑制了炎症反应,因此推测在炎症反应过程中,CYP1A1对PPAR-γ表达水平的影响会间接对炎症反应构成调控。但也不排除CYP1A1通过上游通路AhR(芳香烃受体)途径影响炎症活化因子MAPK等的活化[19-20],使它们在细胞内的活化水平发生变化,并通过核内的竞争性调节间接调控PPAR-γ的表达。由于涉及的信号通路较为复杂,且相关介导途径的信号级联、反馈机制尚不清楚,具体的调控机制还有待研究。 通过构建猪肺炎支原体细胞感染实验模型,作者推测在猪肺炎支原体感染过程中CYP1A1基因可能通过调控PPAR-γ来发挥抑炎作用。 作为机体药物代谢功能酶,细胞色素P450酶在炎症过程中的活性变化会直接影响到炎症程度、炎症临床用药的代谢率、毒性、安全性及临床诊断效果,因此研究细胞色素P450酶活性与炎症之间的关系,能为控制炎症临床反应及治疗提供一定的科学启示,也能够揭示细胞色素酶在炎症反应过程的活性变化导致底物的代谢异常从而诱导其他疾病的机制,深入分析疾病与疾病之间的关联。 参考文献(References): [1]胡之璧,贺丽虹,赵淑娟.细胞色素P450研究进展[J].江苏中医药,2006,27(10):81-84. HU Z B,HE L H,ZHAO S J.Research progress of cytochrome P450[J].JiangsuJournalofTraditionalChineseMedicine,2006,27(10):81-84.(in Chinese) [2]徐彬,杨忠英,樊洪忠,等.细胞色素P450与药物代谢性相互作用[J].山西医药杂志,2015,44(12):1376-1380. XU B,YANG Z Y,FAN H Z,et al.Interaction effects of Cytochrome P450 and drug metabolism[J].ShanxiMedicalJournal,2015,44(12):1376-1380.(in Chinese) [3]MORGAN E T.Impact of infectious and inflammatory disease on cytochrome P450-mediated drug metabolism and pharmacokinetics[J].ClinPharmacolTher,2009,85(4):434-438. [4]RENTON K W.Alteration of drug biotransformation and elimination during infection and inflammation[J].PharmacolTher,2001,92(2-3):147-163. [5]PASZTI-GERE E,MATIS G,FARKAS O,et al.The effects of intestinal LPS exposure on inflammatory responses in a porcine enterohepatic co-culture system[J].Inflammation,2014,37(1):247-260. [6]ISSEMANN I,GREEN S.Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators[J].Nature,1990,347(6294):645-650. [7]ADAMS M,REGINATO M J,SHAO D,et al.Transcriptional activation by peroxisome proliferator-activated receptor γ is inhibited by phosphorylation at a consensus mitogen-activated protein kinase site[J].JBiolChem,1997,272(8):5128-5132. [8]ZHU Y,KAN L,QI C,et al.Isolation and characterization of peroxisome proliferator-activated receptor (PPAR) interacting protein (PRIP) as a coactivator for PPAR[J].JBiolChem,2000,275(18):13510-13516. [9]JIANG C,TING A T,SEED B.PPAR-γ agonists inhibit production of monocyte inflammatory cytokines[J].Nature,1998,391(6662):82-86. [10]WANG N,VERNA L,CHEN N G,et al.Constitutive activation of peroxisome proliferator-activated receptor-γ suppresses pro-inflammatory adhesion molecules in human vascular endothelial cells[J].JBiolChem,2002,277(37):34176-34181. [11]王延军.细胞色素P450表达的诱导机制及其筛选方法的研究进展[J].内蒙古医学杂志,2008,40(3):332-334. WANG Y J.Research progress of induction mechanism and screening method of the expression of cytochrome P450[J].InnerMongoliaMedicalJournal,2008,40(3):332-334.(in Chinese) [12]宋汉香,王淑秋,吕少春,等.芳香化酶基因敲除小鼠肝组织PPARα表达及与肝脂肪变性的关系[J].中国老年学杂志,2012,32(13):2766-2769. SONG H X,WANG S Q,LV S Q,et al.Relationship between the expression of PPARα in liver tissue which is Aromatase knockout and liver steatosis[J].ChineseJournalofGerontology,2012,32(13):2766-2769.(in Chinese) [13]刘旺根.雌激素受体-α 36过表达对人乳腺癌细胞MCF-7生物学行为的影响[D].郑州:郑州大学,2012. LIU W G.The Effect of estrogen receptor alpha 36 overexpression on biological behaviors of human breast cancer cell MCF-7[D].Zhengzhou:Zhengzhou University,2012.(in Chinese) [14]BLANQUART C,BARBIER O,FRUCHART J C,et al.Peroxisome proliferator-activated receptors:regulation of transcriptional activities and roles in inflammation[J].JSteroidBiochemMolBiol,2003,85(2-5):267-273. [15]LIANG Y,ZHOU Y,SHEN P.NF-kappaB and its regulation on the immune system[J].CellMolImmunol,2004,1(5):343-350. [16]STRAUS D S,PASCUAL G,LI M,et al.15-Deoxy-Δ12,14-prostaglandin J2 inhibits multiple steps in the NF-κB signaling pathway[J].ProcNatlAcadSciUSA,2000,97(9):4844-4849. [17]RASMUSSEN M K,IVERSEN L,JOHANSEN C,et al.IL-8 and p53 are inversely regulated through JNK,p38 and NF-κB p65 in HepG2 cells during an inflammatory response[J].InflammRes,2008,57(7):329-339.[18]曾锦章.细胞信号传导与转录因子AP-1活性的调节[J].国外医学遗传学分册,1999,22(4):191-194. ZENG J Z.Regulation of the activity of cell signaling transcription factor-AP-1[J].SectionofGeneticsForeignMedicalSciences,1999,22(4):191-194.(in Chinese) [20]SHIBAZAKI M,TAKEUCHI T,AHMED S,et al.Suppression by p38 MAP kinase inhibitors (pyridinyl imidazole compounds) of Ah receptor target gene activation by 2,3,7,8-tetrachlorodibenzo-p-dioxin and the possible mechanism[J].JBiolChem,2004,279(5):3869-3876. (编辑白永平) Interaction Effect ofCYP1A1 andPPAR-γin the Regulation of Inflammation of Mycoplasma Pneumonia in Swine XU Jie1,2,ZHAO Wei-min2,REN Shou-wen2,ZHAO Fang2,ZHOU Yan-hong1,2,LI Hui-xia1*,FANG Xiao-min2* (1.CollegeofAnimalScienceandTechnolgy,NanjingAgricultureUniversity,Nanjing210095,China;2.TheKeyLaboratoryofAnimalBreedImprovementandReproduction,InstituteofAnimalScience,JiangsuAcademyofAgricultureSciences,Nanjing210014,China) Abstract:In order to study the effect ofCYP1A1 expression change inMycoplasmahyopneuminiaeinfection and to investigate the association betweenCYP1A1 and peroxisome proliferator-activated receptors associated-γ (PPAR-γ),we obtained the full-length coding sequence ofCYP1A1 by means of cloning and eukaryotic expression vector construction method,established PAMs cell lines that stably expressedCYP1A1 by method of cell-transfection and resistance screening techniques,constructed cell experimental model infection withMycoplasmahyopneuminiaeand analyzed the relationship of the expression level ofPPAR-γandCYP1A1.The results show that the expression level ofPPAR-γis positively correlated withCYP1A1 and is involved in the regulation of inflammation,which suggest thatCYP1A1 may play a role in suppressing inflammation by regulatingPPAR-γ. Key words:pig;CYP1A1;PPAR-γ;mycoplasma pneumonia;inflammatory doi:10.11843/j.issn.0366-6964.2016.03.021 收稿日期:2015-05-15 基金项目:国家自然科学基金项目(31301953);国家生猪现代产业技术体系项目(CARS-36);江苏省自然科学基金项目(BK20131332);江苏省农业科技自主创新基金项目[CX(14)5033] 作者简介:徐杰(1990-),男,湖北黄冈人,硕士生,主要从事动物遗传育种与繁殖研究,Tel:025-84391941,E-mail:940872282@qq.com *通信作者:方晓敏,副研究员,主要从事猪抗病育种方面的科研及技术推广工作,E-mail:fxmw2000@163.com;李惠侠,副教授,主要从事家畜遗传育种与繁殖研究,E-mail:lihuixia@njau.edu.cn 中图分类号:S852.62 文献标志码:A 文章编号:0366-6964(2016)03-0574-07
