兔肝细胞中与RHDV VP60 P2亚区相互作用蛋白质的筛选和初步鉴定
2016-07-13宋艳华范志宇魏后军仇汝龙
李 腾,姜 平,王 芳*,宋艳华,胡 波,范志宇,魏后军,仇汝龙,刘 星
(1.南京农业大学动物医学院,南京 210095;2.江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,国家兽用生物制品工程技术研究中心,南京 210014)
兔肝细胞中与RHDV VP60 P2亚区相互作用蛋白质的筛选和初步鉴定
李腾1,2,姜平1*,王芳1,2*,宋艳华2,胡波2,范志宇2,魏后军2,仇汝龙2,刘星2
(1.南京农业大学动物医学院,南京 210095;2.江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,国家兽用生物制品工程技术研究中心,南京 210014)
摘要:兔出血症病毒(RHDV)衣壳蛋白VP60 P2亚区在病毒感染宿主细胞过程中可能起重要作用,为找寻RHDV靶细胞——兔肝细胞中与P2亚区相互作用的蛋白质,以原核表达的P2蛋白为诱饵蛋白质,通过免疫共沉淀试验(Co-IP)结合质谱分析筛选与之有相互作用的肝细胞蛋白质。经分析选取层黏连蛋白受体(LamR)蛋白做进一步研究。提取兔肝细胞总RNA,反转录扩增LamR基因,将其插入pGEX-6p-1载体,经IPTG诱导表达,获得GST-LamR融合蛋白,并通过GST pull-down试验验证LamR蛋白与P2蛋白的结合。结果显示,以P2蛋白为诱饵蛋白质,免疫共沉淀试验结合质谱分析共筛选到26个与P2存在相互作用的肝细胞蛋白质,其中LamR蛋白是多种病毒的受体。通过原核表达系统表达了LamR蛋白,经pull-down试验验证了LamR蛋白与P2蛋白有直接的相互作用。本研究证实兔肝细胞LamR蛋白与RHDV VP60 P2蛋白的相互作用,为深入研究RHDV的感染过程、揭示RHDV的致病机制提供了线索。
关键词:兔出血症病毒(RHDV);VP60 P2亚区;免疫共沉淀;层黏连蛋白受体(LamR)
兔出血症(rabbit hemorrhagic disease,RHD)是由兔出血症病毒(rabbit hemorrhagic disease virus,RHDV)引起的兔的一种急性、败血性、高度接触传染性、致死性疾病,是兔的一种毁灭性传染病。RHDV属杯状病毒科兔病毒属,无囊膜,为20面体对称结构。病毒衣壳由180个VP60蛋白形成的90个二聚体组装而成。VP60蛋白是RHDV的主要结构蛋白,包含形成病毒衣壳内壳的S区和在衣壳外表面形成刺突结构的P区。P区变异性较高,与病毒的抗原性相关,是宿主抗体识别的主要区域并在病毒粒子吸附宿主细胞及随后的感染致病过程中起重要作用[1-3]。该区又可进一步划分为P1亚区和P2亚区。P2亚区位于病毒衣壳表面,具有突出的β桶核心结构,推测P2区在病毒整个感染过程中起关键作用。此外,P2区还包含7个loop环,其loop区与其他杯状病毒有显著不同,这可能是病毒感染宿主特异性的主要决定因素[4]。因此,本研究选用P2亚区蛋白作为诱饵蛋白质,以RHDV的主要靶器官兔肝作为研究对象,通过Co-IP法钓取兔肝细胞中与P2相互作用的蛋白质,以期为研究RHDV的致病机制提供线索。
1材料与方法
1.1载体、蛋白质、菌株及细胞
感受态细胞E.coliDH5α、BL21购自北京全式金生物技术有限公司;供体质粒pET-32a(+)、pGEX-6p-1及真核表达的VP60蛋白[5]、pET-32a(+)表达的重组IFN-γ蛋白均由本实验室保存。
1.2试剂
Platinum®Pfx高保真DNA 聚合酶(50 U·μL-1)购自Invitrogen公司;抗GST标签单抗抗体购自北京全式金生物技术有限公司;抗LamR山羊多抗购自Santa Cruz公司;识别VP60-P2区的单克隆抗体1B8由本实验室制备;柱式DNA质粒OUT试剂盒购自北京天恩泽基因科技有限公司;HiTrapTMProtein G HP纯化柱试剂盒、His TrapTMHP 纯化柱购自GE公司;Pierce®交联IP试剂盒购自Thermo Fisher Scientific公司;GST-resin纯化树脂购自上海点创生物科技有限公司;其他试剂均为国产分析纯级。
1.3P2亚区基因的克隆
根据GenBank数据库RHDV皖阜株基因序列(FJ794180,RHDVa型),以pMD19-T-VP60为模板,应用Primer 5.0软件设计P2亚区基因引物(表1)扩增RHDVVP60 P2亚区基因。
1.4pET-32a-P2重组载体的构建
用琼脂糖凝胶DNA回收试剂盒回收P2亚区基因扩增产物。pET-32a(+)供体质粒及目的基因扩增产物经EcoRⅠ和XhoⅠ 37 ℃双酶切3 h,用T4 DNA Ligase 4 ℃连接12 h,将连接产物转化DH5α感受态大肠杆菌,经质粒提取和双酶切鉴定后,阳性克隆送上海华津生物科技有限公司测序,测序正确的克隆提取质粒,最终获得重组质粒,命名为pET-32a-P2。
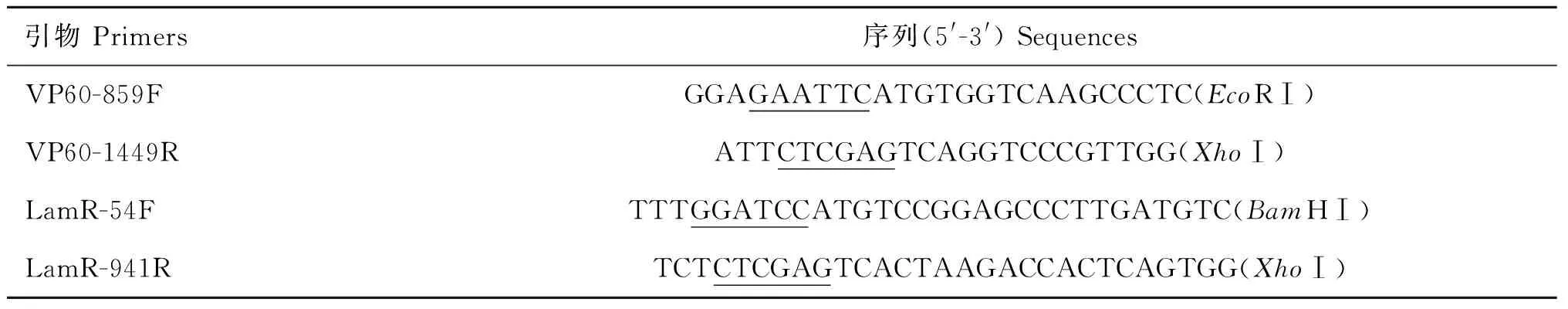
表1 引物序列
下划线为内切酶位置
The underlined letters show the restriction endonuclease sites
1.5P2重组蛋白质的表达、纯化及鉴定
经测序正确的重组质粒转入BL 21大肠杆菌,以1 mmol·L-1的IPTG 37 ℃诱导表达5 h,离心收集菌体并重悬至原体积的1/5,经超声波破碎后收集含可溶性表达蛋白质的上清。使用His TrapTMHP 纯化柱试剂盒,按照说明对P2重组蛋白质进行纯化。SDS-PAGE和Western blotting鉴定P2蛋白的表达及纯化效果。
1.6肝细胞全蛋白质的制备
采用胶原酶灌注法分离肝细胞[6]。IP裂解液重悬细胞,4 ℃摇床上孵育10 min以裂解肝细胞,13 000 g离心10 min,去除细胞碎片,取上清备用。超微量核酸蛋白质分析仪测定蛋白质浓度。
1.7间接免疫荧光鉴定P2蛋白与兔肝细胞的结合
分离正常兔肝细胞,PBS洗涤两次后,稀释至5×106个·mL-1,铺覆0.1 mg·mL-1多聚L-赖氨酸包被的细胞板。用含0.1% TritonX100的2%多聚甲醛固定液4 ℃固定肝细胞30 min,PBS洗涤两次,加入纯化的P2蛋白,4 ℃孵育过夜。PBS洗涤三次,加入5~10 μg·mL-11B8单抗200 μL·孔-1,37 ℃孵育1 h。洗涤,加入FITC标记的羊抗鼠IgG,37 ℃ 1 h。PBS洗涤三次,倒置荧光显微镜下观察试验结果。同时设置阳性对照(VP60蛋白)和阴性对照(重组IFN-γ蛋白)。
1.8Co-IP筛选与P2蛋白相互作用的兔肝细胞蛋白
根据Pierce交联IP试剂盒使用说明书,P2蛋白、肝细胞蛋白质分别经对照琼脂糖树脂预处理,去除与琼脂糖非特异性结合的蛋白质后,备用。将识别P2区的单克隆抗体1B8结合到protein A/G 琼脂糖上,经洗涤后,再将诱饵蛋白质P2与之共孵育,洗涤去除未结合的蛋白质。最后将肝细胞蛋白质与结合有1B8和P2的protein A/G琼脂糖共孵育,4 ℃摇床过夜。低pH洗脱液洗脱蛋白质,并进行SDS-PAGE电泳分析。同时,设置对照A只加入1B8和P2蛋白,用以鉴定抗体和诱饵蛋白质上样时结合到琼脂糖上的非特异蛋白;设置对照B以重组IFN-γ蛋白替代P2诱饵蛋白质做阴性对照,以鉴别肝细胞蛋白质与琼脂糖或1B8抗体的非特异结合蛋白。
1.9质谱鉴定
分别从SDS-PAGE凝胶上切取整个泳道的蛋白质,去除诱饵蛋白质和抗体重轻链条带后,送杭州景杰生物科技有限公司进行LC-MS/MS质谱分析。筛出质谱结果中试验组与对照组间的差异蛋白质,并通过GO分析注释差异蛋白质的分子功能和生物进程。通过文献查阅最终选择laminin receptor(LamR)进行后期验证。
1.10LamR基因扩增
以兔肝细胞提取的总RNA反转录得到的cDNA为模板,根据GenBank数据库中 LamR(LOC100354806)的CDS序列设计引物(表1)扩增LamR基因。
1.11pGEX-6p-1-LamR重组表达载体的构建
方法同“1.4”,以pGEX-6p-1为载体,构建pGEX-6p-1-LamR重组质粒,并进行双酶切和测序鉴定。
1.12GST-LamR重组蛋白质的表达及鉴定
方法同“1.5”,SDS-PAGE及Western blotting鉴定LamR蛋白的表达。
1.13P2蛋白与GST-LamR蛋白的体外pull-down试验
将GST-LamR或GST(阴性对照)结合到Glutathione树脂上,再与P2蛋白共孵育,4 ℃ 2 h。还原性谷胱甘肽GSH洗脱并进行SDS-PAGE和Western blotting分析。设置空白对照不加GST蛋白,P2蛋白直接与Glutathione树脂共孵育。
2结果
2.1pET-32a-P2重组表达载体的构建
以pMD19-T-VP60为模板,PCR扩增P2亚区基因,获得591 bp与预期大小相符的目的片段(图1)。双酶切鉴定重组质粒pET-32a-P2,结果与预期一致(图2)。测序结果与基因序列完全一致。

M.DL2000 DNA相对分子质量标准; 1.P2亚区基因PCR产物M.2 000 bp ladder;1.The PCR product of P2 subdomain gene图1 P2亚区基因扩增结果Fig.1 The amplified results of P2 gene
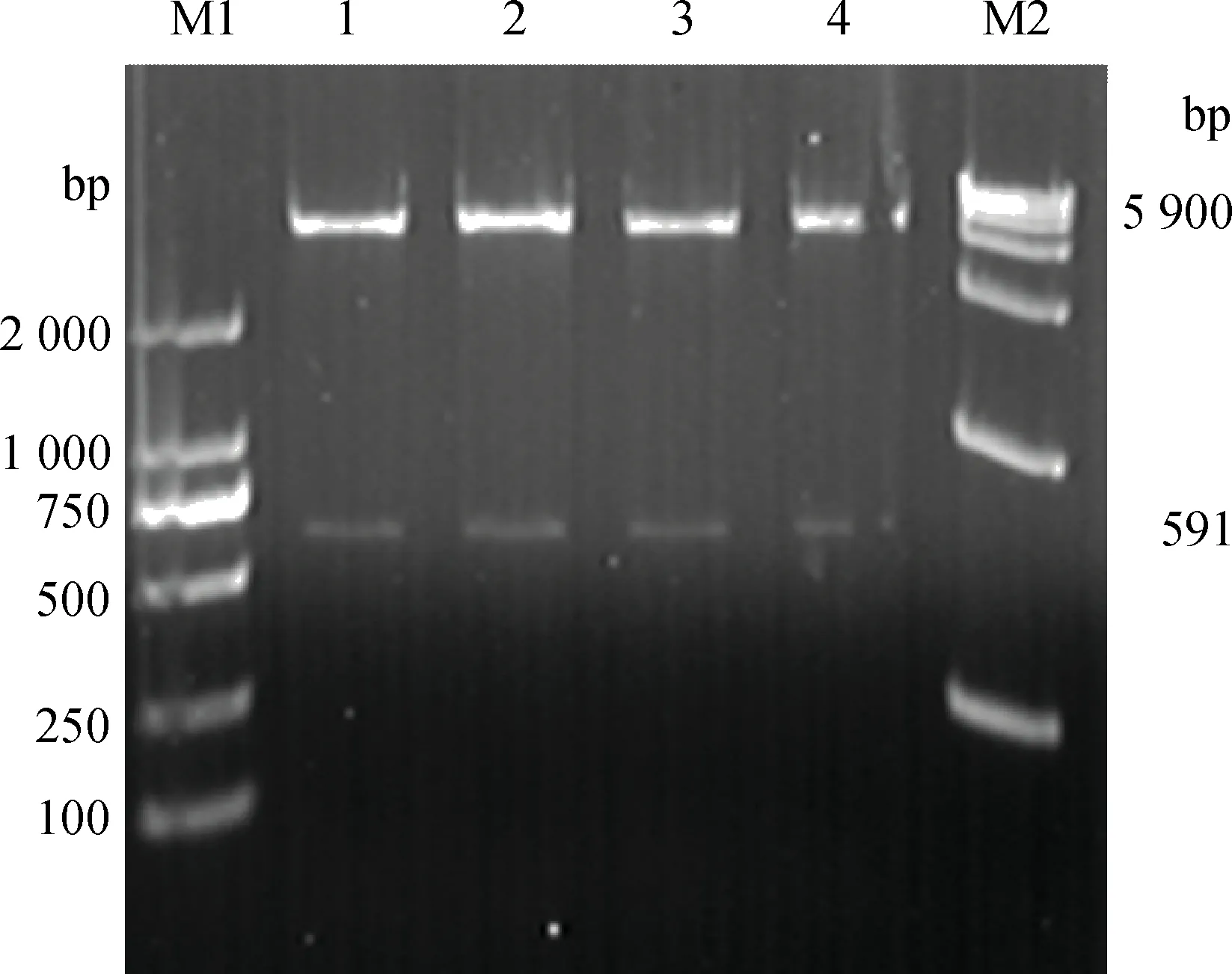
M1.DL2000 DNA相对分子质量标准;1~4.重组质粒pET-32a-P2双酶切产物;M2.DL15000 DNA相对分子质量标准M1.2 000 bp ladder;1-4.Digestion products of pET-32a-P2 by enzymes;M2.15 000 bp ladder图2 重组质粒pET-32a-P2的酶切鉴定Fig.2 Enzyme digestion of recombinant plasmid pET-32a-P2
2.2P2重组蛋白质表达、纯化及鉴定
pET-32a-P2重组表达载体转化BL21感受态细胞,IPTG诱导表达,超声裂解,离心分离上清和沉淀。SDS-PAGE电泳结果表明,约40 ku处有特异性条带,与预期大小一致;经HisTrap亲和柱纯化后,蛋白质杂带减少,浓度变大(图3)。Western blotting 鉴定表达的融合蛋白质,结果显示在40 ku处有特异性条带。
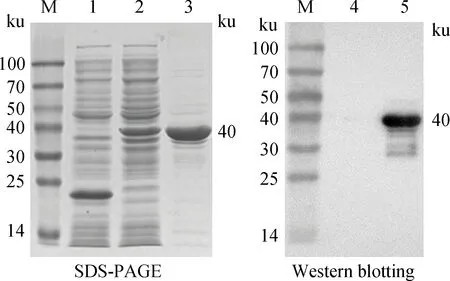
M.蛋白质相对分子质量标准;1、4.pET-32a(+)空载体表达蛋白质;2、5.重组表达的P2蛋白(未纯化);3.纯化的P2蛋白M.Protein marker;1,4.Protein expressed by pET-32a(+); 2,5.Recombined P2 protein(unpurified);3.Purified P2 protein图3 重组蛋白P2的SDS-PAGE和Western blotting鉴定Fig.3 SDS-PAGE and Western blotting analysis of the recombinant P2 protein
2.3P2与肝细胞结合的IFA鉴定
用纯化的P2蛋白与兔正常肝细胞共孵育,识别P2的单克隆抗体1B8和羊抗鼠FITC荧光二抗检测P2蛋白与兔肝细胞的结合。结果显示P2蛋白能与兔肝细胞发生较强的特异性吸附作用,有特异性绿色荧光,且强于阳性对照组(VP60),而阴性对照组(重组IFN-γ)肝细胞无绿色荧光(图4)。

A.P2蛋白;B.VP60阳性对照;C.重组IFN-γ阴性对照;D.阴性对照(明场图)A.P2 protein;B.Positive control (VP60);C.Negative control (IFN-γ);D.Negative control (bright)图4 P2与肝细胞结合的IFA鉴定Fig.4 Detection the binding of P2 to liver cells by IFA
2.4Co-IP筛选与P2蛋白相互作用的兔肝细胞蛋白质
以pET-32a(+)表达的P2蛋白为诱饵蛋白质,利用Co-IP法钓取与之互作的兔肝细胞蛋白质。SDS-PAGE结果表明,与对照组相比,试验组有多条肉眼可见的差异条带,如箭头所指(图5)。
2.5质谱分析
分别切下试验组、对照A、对照B 整个泳道条带,去除1B8抗体条带和P2诱饵蛋白质条带后,分别做LC-MS/MS质谱分析。去除与对照组重复的蛋白质、可信度低的蛋白质(Unique Peptides<2)及未鉴定蛋白质,共筛出26个差异蛋白质,并通过GO分析注释各蛋白质的分子功能和生物进程(表2)。从分子功能上看,大部分蛋白质为binding蛋白质和具有酶活性的蛋白质。binding蛋白质包括嘌呤核苷酸binding、金属离子binding、RNA binding、DNA binding、辅因子binding、ATP binding蛋白质。酶活性蛋白质包括具有脱氢酶、氧化酶、转移酶、磷酸化酶、裂解酶、连接酶等活性的蛋白质。还有小部分蛋白质为核糖体结构成分。从生物进程上来看,这些蛋白质多参与蛋白质的翻译、修饰、组装过程以及血红素、胆固醇等物质的代谢过程,还有部分蛋白质参与细胞凋亡、有氧呼吸及脂质、胆固醇的平衡过程。

表2 质谱分析结果
(转下页)(Continued on the next page)
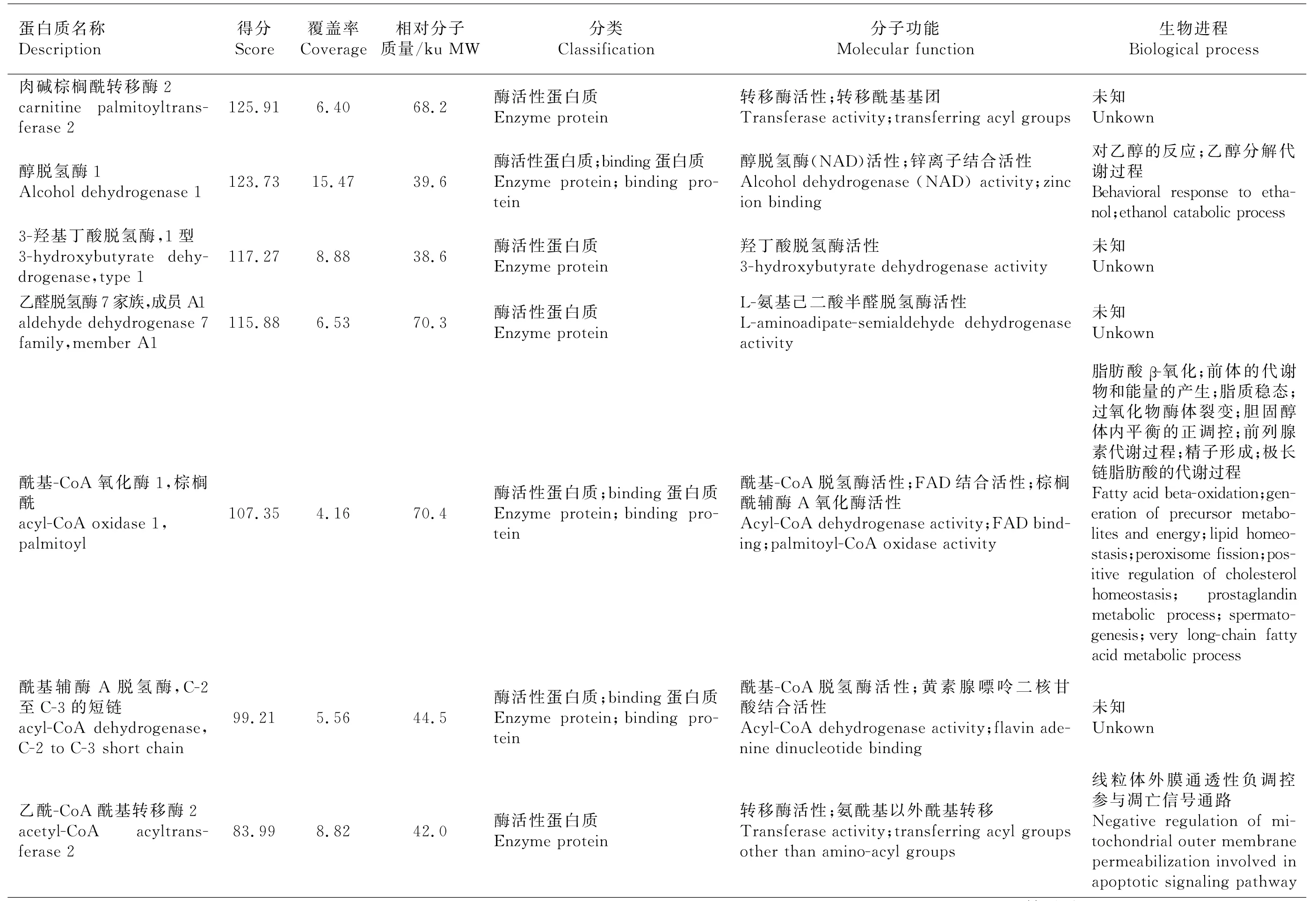
表2(续)Table 2(continued)
(转下页)(Continued on the next page)
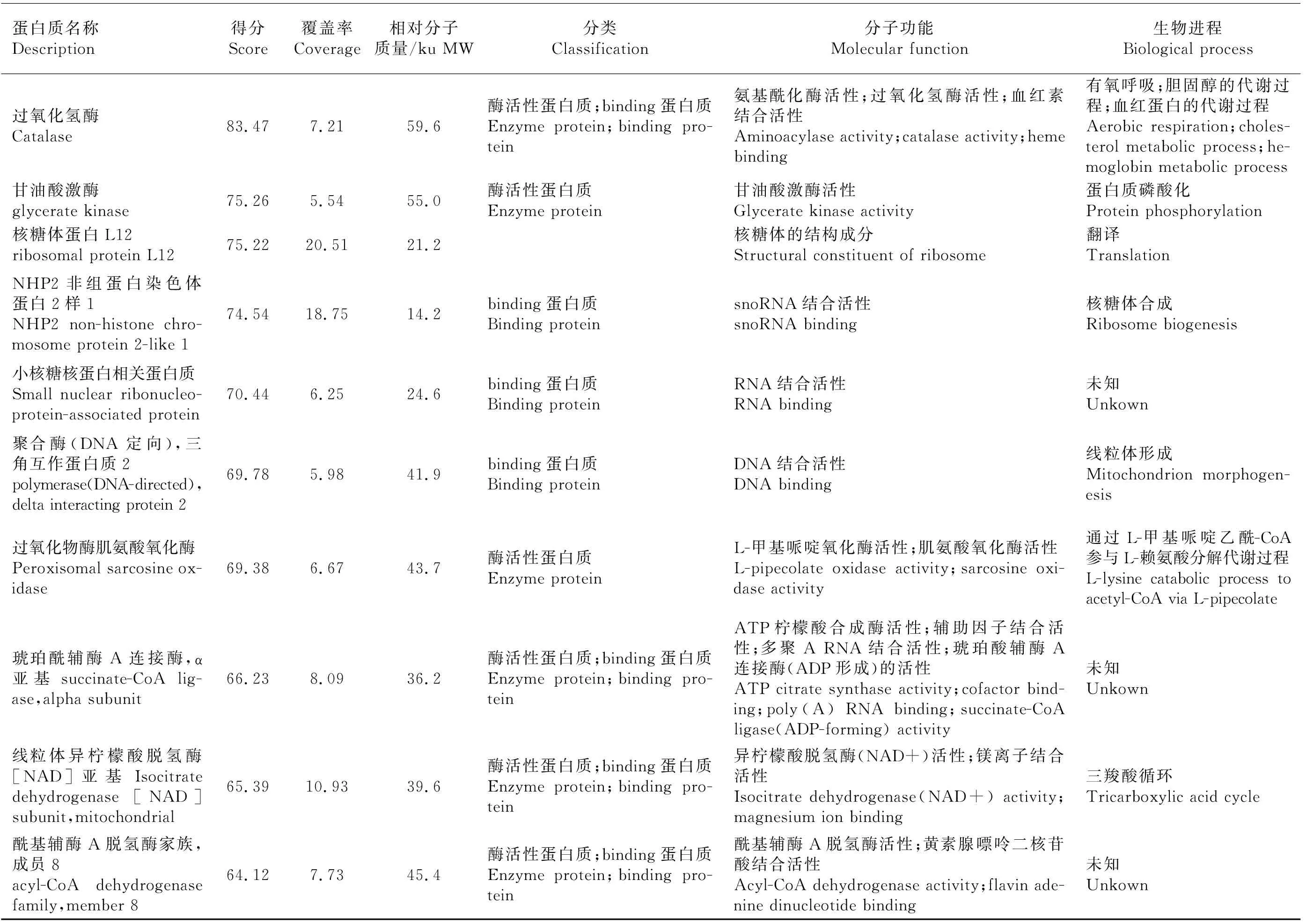
表2(续)Table 2(continued)
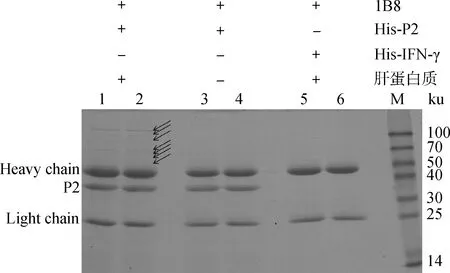
1、2.试验组样品;3、4.对照A样品; 5、6.对照B样品1,2.The experimental sample;3,4.Control A sample;5,6.Control B sample图5 Co-IP筛选与P2蛋白相互作用的兔肝细胞蛋白Fig.5 Detection of P2-interacting proteins in rabbit liver cells by Co-IP
通过文献查阅,选择laminin receptor(LamR)蛋白进行后期验证。
2.6pGEX-6p-1-LamR重组表达载体的构建
以兔肝组织总RNA反转录得到的cDNA为模板,PCR扩增LamR基因,获得888 bp与预期大小相符的目的片段(图6),重组质粒pGEX-6p-1-LamR双酶切鉴定正确(图7),测序结果显示克隆的LamR碱基序列与NCBI兔LamR(LOC100354806)碱基序列相似性为98%,氨基酸序列相似性为97.3%。

M.DL2000 DNA相对分子质量标准;1.LamR基因RT-PCR产物M.2 000 bp DNA ladder;1.The product of LamR by RT-PCR图6 LamR基因扩增结果Fig.6 The amplified results of LamR gene
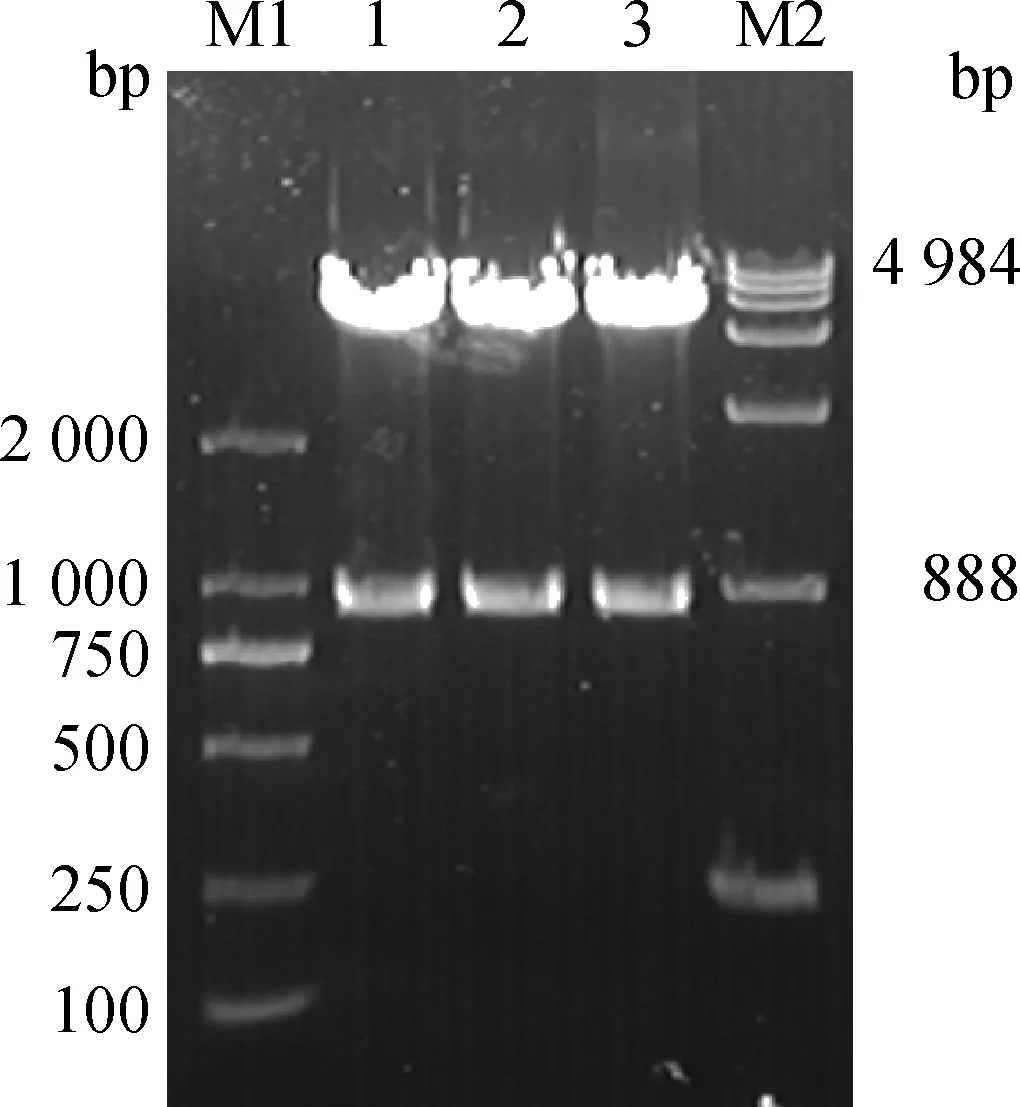
M1.DL2000 DNA相对分子质量标准;1~3.重组质粒pGEX-6p-1-LamR双酶切产物;M2.DL15000 DNA相对分子质量标准M1.2 000 bp DNA ladder;1-3.Digestion products of pGEX-6p-1-LamR by enzyme;M2.15 000 bp ladder图7 重组质粒pGEX-6p-1-LamR的酶切鉴定Fig.7 Enzyme digestion of recombinant plasmid pGEX-6p-1-LamR
2.7LamR重组蛋白质表达鉴定
pGEX-6p-1-LamR重组质粒转化BL21感受态细胞,经IPTG诱导表达,SDS-PAGE和Western blotting分析显示在60 ku处有GST-LamR特异性条带,与预期相符(图8)。
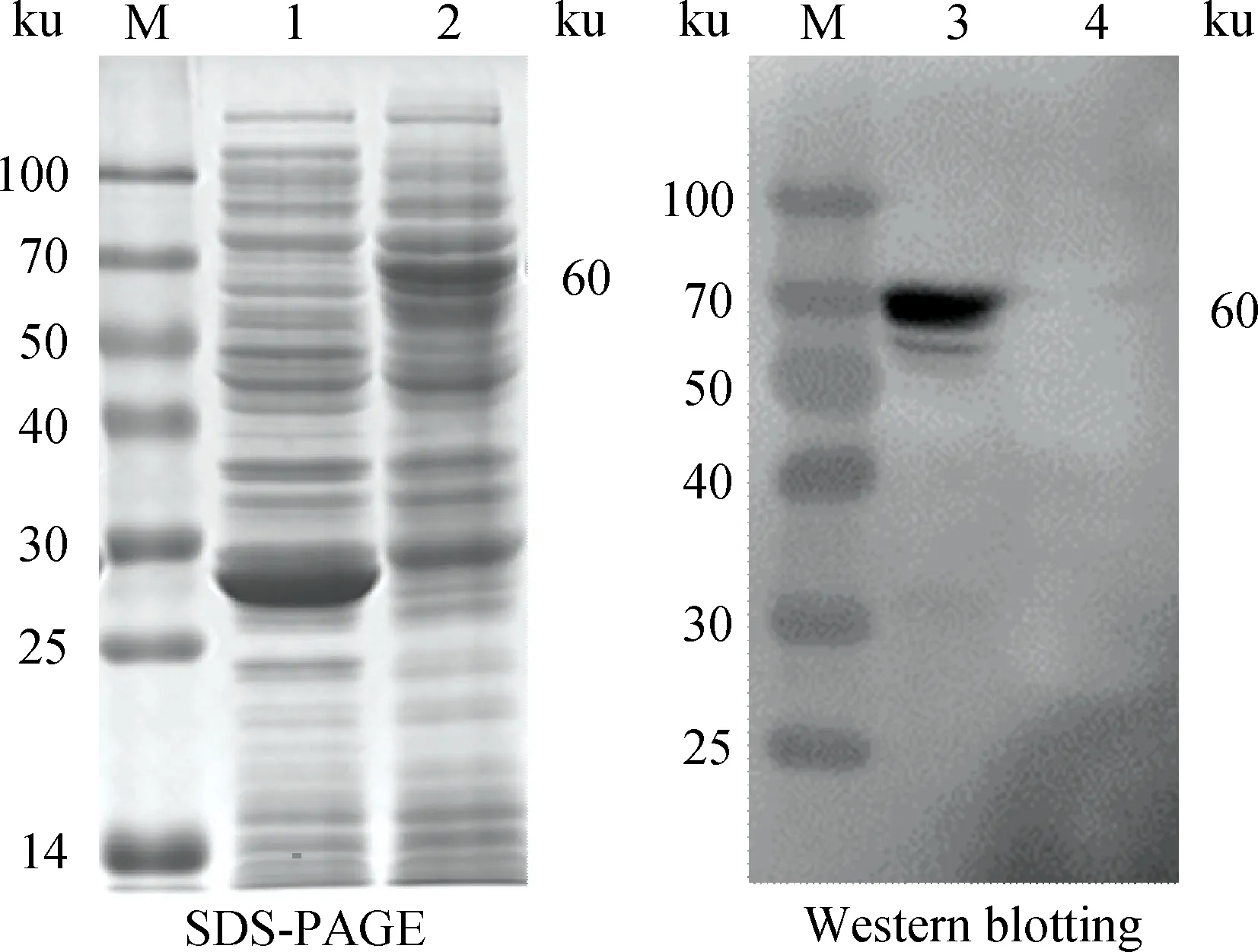
M.蛋白质相对分子质量标准;1、4.pGEX-6p-1空载体诱导表达蛋白质;2、3.重组表达的GST-LamR蛋白质M.Protein marker;1,4.Protein expressed by pGEX-6p-1;2,3.Recombined GST-LamR protein图8 融合蛋白质GST-LamR的SDS-PAGE和Western blotting鉴定Fig.8 SDS-PAGE and Western blotting analysis of GST-LamR fusion protein
2.8P2蛋白与GST-LamR蛋白的体外pull-down试验
为验证LamR与P2是否存在直接相互作用,分别以GST-LamR和GST(阴性对照)为诱饵蛋白质,进行体外GST-pulldown试验并进行Western blotting分析。结果显示试验组有P2蛋白特异性条带,而阴性对照和空白对照无条带(图9)。
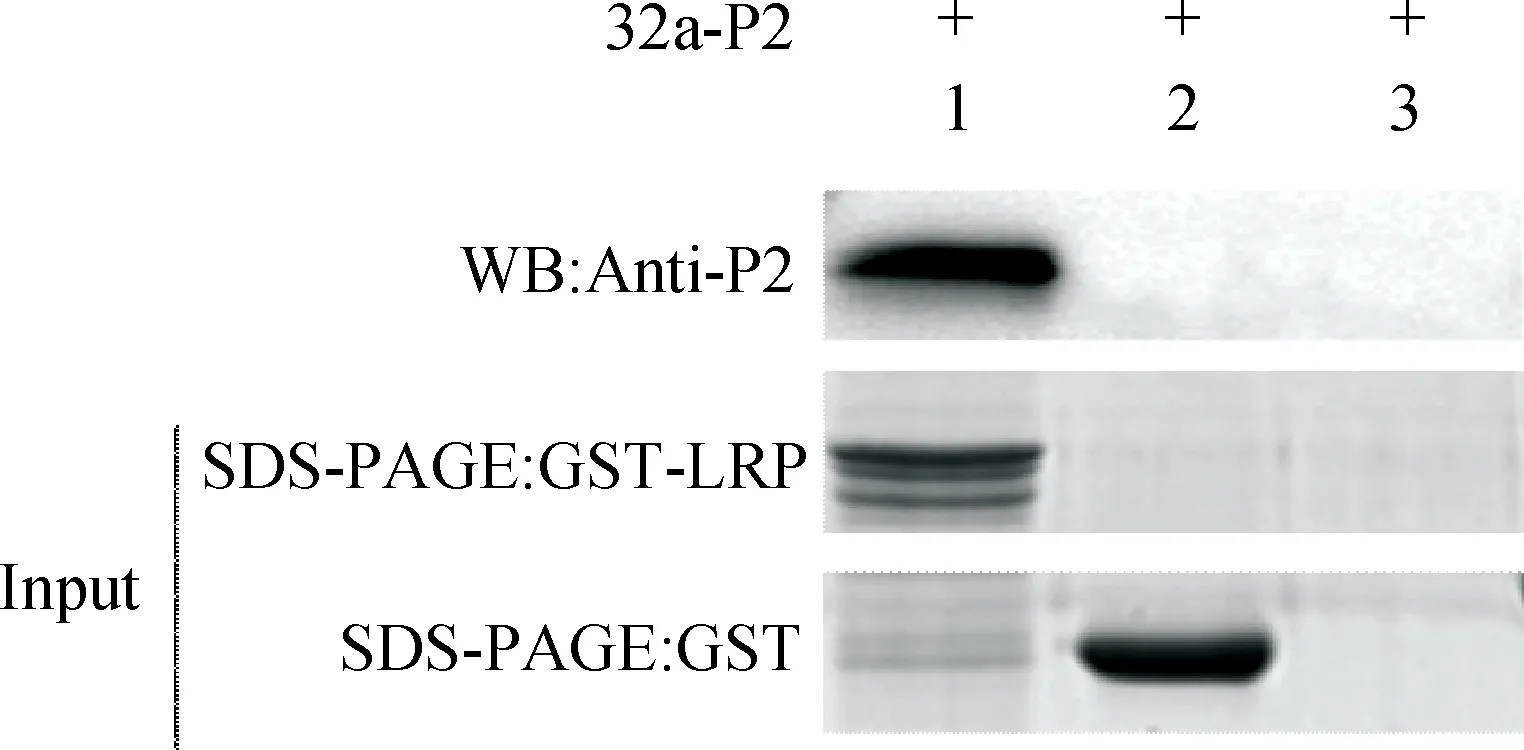
1.试验组(GST-LamR);2.阴性对照(GST);3.空白对照1.Treatment(GST-LamR);2.Negative control(GST);3.Blank control图9 P2蛋白与LamR蛋白相互作用的体外pull-down验证Fig.9 Pull-down analysis of P2 interacts with LamR in vitro
3讨论
RHDV衣壳蛋白VP60 P区包括P1亚区(238—286、450—466、484—579 aa)和P2亚区(287—449、467—483 aa),其中P2亚区包含7个高变区,推测与受体的结合相关[4]。M.Tan等研究发现诺如病毒(NVs)P2亚区是受体HBGAs结合的关键区域[7],R.Chen等也发现杯状病毒P2亚区与受体识别,宿主特异性和免疫逃避有关[8]。而NVs和RHDV具有相同受体(HBGAs)[9-10]和相似的病毒作用机制。且两种病毒的衣壳蛋白P2亚区均位于病毒衣壳的最突出区域,最有可能在病毒入侵宿主的过程中率先与宿主细胞接触并在病毒感染致病过程中发挥重要作用。由此推测RHDV P2亚区可能在病毒感染整个过程中均发挥关键作用。本研究构建了P2融合蛋白质,免疫荧光试验显示,表达的P2蛋白与肝细胞存在显著的结合,这表明以P2为诱饵蛋白质钓取的宿主蛋白质可能在病毒结合、侵染和致病过程中具有重要作用。
兔肝是RHDV感染的主要靶器官之一,RHDV能引起兔肝细胞程序性死亡,从而导致严重的急性肝炎症状[11-12],以兔肝作为研究RHDV P2互作蛋白质的研究对象具有代表性。试验通过Co-IP法共筛选出兔肝细胞中26个与P2亚区相互作用的蛋白质,GO分析分子功能显示,这些蛋白质多属于binding蛋白质和具有酶活性的蛋白质;生物进程显示,这些蛋白质涉及生理调节、细胞代谢、细胞生长增殖及凋亡等过程。推测RHDV感染肝细胞时,可能通过P2与这些蛋白质的互作,改变肝细胞的正常代谢,致使机体产生一系列的应答反应。
LamR是以二聚体形式存在的跨膜蛋白质,又称67 ku层黏连蛋白受体,是由37 ku的前体经翻译后加工形成[13]。LamR被认为是多种病原的受体。E.V.Protopopova等[14]使用独特型抗体发现LamR是蜱传脑炎病毒的细胞受体。K.S.Wang等[15]发现LamR是新培斯病毒进入BHK-21的功能受体。蚊源LamR蛋白被认为是委内瑞拉马脑炎病毒[16]和登革病毒[17-20]的假定受体。在哺乳动物细胞上,LamR又被认为是朊病毒的细胞受体[21-22]。J.Chen等[23]研究发现LamR是经典猪瘟病毒的细胞吸附受体。李茂中通过双向电泳结合质谱分析对RHDV感染兔和未感染兔肝组织中的差异蛋白质进行分析,也发现LamR是其中的差异蛋白质之一[24],这与本试验结果一致,但是他们没有对LamR与RHDV的相互作用进行进一步研究。因此本研究选择LamR蛋白,对其与P2蛋白的体外结合进行了进一步验证,证实了两者在体外确实存在直接的相互作用,但LamR蛋白在病毒入侵宿主的过程中究竟起到怎样的作用还有待进一步验证。
4结论
通过Co-IP的方法,以P2为诱饵蛋白质,以RHDV感染的靶器官兔肝为研究对象,结合质谱鉴定共筛选到了26个蛋白质。经分析选取LamR蛋白进行进一步研究。利用GST pull-down试验验证了P2与LamR蛋白存在直接的相互作用,为RHDV致病机制的研究提供了线索。
参考文献(References):
[1]KINNEAR M,LINDE C C.Capsid gene divergence in rabbit hemorrhagic disease virus[J].JGenVirol,2010,91(Pt 1):174-181.
[2]ESTEVES P J,ABRANTES J,CARNEIRO M,et al.Detection of positive selection in the major capsid protein VP60 of the rabbit haemorrhagic disease virus(RHDV)[J].VirusRes,2008,137(2):253-256.
[3]ROHAYEM J,BERGMANN M,GEBHARDT J,et al.Antiviral strategies to control calicivirus infections[J].AntiviralRes,2010,87(2):162-178.
[4]WANG X,XU F,LIU J,et al.Atomic model of rabbit hemorrhagic disease virus by cryo-electron microscopy and crystallography[J].PLoSPathog,2013,9(1):e1003132.
[5]王芳,胡波,任雪枫,等.兔出血症病毒衣壳蛋白在昆虫细胞中的表达及对家兔的免疫保护效果[J].畜牧兽医学报,2008,39(10):1382-1387.
WAGN F,HU B,REN X F,et al.Expression of the capsid protein of rabbit haemorrhagic disease virus in insect cells and its protective efficacy to rabbits[J].ActaVeterinariaetZootechnicaSinica,2008,39(10):1382-1387.(in Chinese)
[6]弗雷谢尼 R I.动物细胞培养—基本技术指南[M].章静波,徐存拴,等译.5版.北京:科学出版社,2008:521-522.
R IAN FRESHNEY.Culture of animal cells:a manual of basic technique[M].ZHAGN J B,XU C S,translated.5ed.Beijing:Science Press,2008:521-522.(in Chinese)
[7]TAN M,HUANG P,MELLER J,et al.Mutations within the P2 domain of norovirus capsid affect binding to human histo-blood group antigens:evidence for a binding pocket[J].JVirol,2003,77(23):12562-12571.
[8]CHEN R,NEILL J D,NOEL J S,et al.Inter- and intragenus structural variations in caliciviruses and their functional implications[J].JVirol,2004,78(12):6469-6479.
[9]ABRANTES J,VAN DER LOO W,LE PENDU J,et al.Rabbit haemorrhagic disease(RHD) and rabbit haemorrhagic disease virus(RHDV):a review[J].VetRes,2012,43:12.
[10]NYSTRÖM K,LE GALL-RECULÉ G,GRASSI P,et al.Histo-blood group antigens act as attachment factors of rabbit hemorrhagic disease virus infection in a virus strain-dependent manner[J].PLoSPathog,2011,7(8):e1002188.
[11]ALONSO C,OVIEDO J M,MARTN-ALONSO J M,et al.Programmed cell death in the pathogenesis of rabbit hemorrhagic disease[J].ArchVirol,1998,143(2):321-332.
[12]PARK J H,LEE Y S,ITAKURA C.Pathogenesis of acute necrotic hepatitis in rabbit hemorrhagic disease[J].LabAnimSci,1995,45(4):445-449.
[13]MALINOFF H L,WICHA M S.Isolation of a cell surface receptor protein for laminin from murine fibrosarcoma cells[J].JCellBiol,1983,96(5):1475-1479.
[14]PROTOPOPOVA E V,KONAVALOVA S N,LOKTEV V B.Isolation of a cellular receptor for tick-borne encephalitis virus using anti-idiotypic antibodies[J].VoprVirusol,1997,42(6):264-268.
[15]WANG K S,KUHN R J,STRAUSS E G,et al.High-affinity laminin receptor is a receptor for Sindbis virus in mammalian cells[J].JVirol,1992,66(8):4992-5001.
[16]LUDWIG G V,KONDIG J P,SMITH J F.A putative receptor for Venezuelan equine encephalitis virus from mosquito cells[J].JVirol,1996,70(8):5592-5599.
[17]UPANAN S,KUADKITKAN A,SMITH D R.Identification of dengue virus binding proteins using affinity chromatography[J].JVirolMethods,2008,151(2):325-328.
[18]GAUCZYNSKI S,NIKLES D,EL-GOGO S,et al.The 37-kDa/67-kDa laminin receptor acts as a receptor for infectious prions and is inhibited by polysulfated glycanes[J].JInfectDis,2006,194(5):702-709.
[19]TIO P H,JONG W W,CARDOSA M J.Two dimensional VOPBA reveals laminin receptor(LAMR1) interaction with dengue virus serotypes 1,2 and 3[J].VirolJ,2005,2:25.
[20]THEPPARIT C,SMITH D R.Serotype-specific entry of dengue virus into liver cells:identification of the 37-kilodalton/67-kilodalton high-affinity laminin receptor as a dengue virus serotype 1 receptor[J].JVirol,2004,78(22):12647-12656.
[21]SAKOONWATANYOO P,BOONSANAY V,SMITH D R.Growth and production of the dengue virus in C6/36 cells and identification of a laminin-binding protein as a candidate serotype 3 and 4 receptor protein[J].Intervirology,2006,49(3):161-172.
[22]GAUCZYNSKI S,PEYRIN J M,HAIK S,et al.The 37-kDa/67-kDa laminin receptor acts as the cell-surface receptor for the cellular prion protein[J].EMBOJ,2001,20(21):5863-5875.
[23]CHEN J,HE W R,SHEN L,et al.The laminin receptor is a cellular attachment receptor for classical Swine Fever virus[J].JVirol,2015,89(9):4894-4906.
[24]李茂中.人工感染兔出血症病毒兔肝脏的蛋白质组学分析[D].北京:中国农业科学院,2012.
LI M Z.Proteomics analysis of rabbit liver after infection by rabbit hemorrhagic disease virus[D].Beijing:Chinese Academy of Agricultural Sciences,2012.(in Chinese)
(编辑白永平)
Screening and Identification of RHDV VP60 P2 Domain Interacting Proteins in Rabbit Liver Cells
LI Teng1,2,JIANG Ping1*,WANG Fang1,2*,SONG Yan-hua2,HU Bo2,FAN Zhi-yu2,WEI Hou-jun2,QIU Ru-long2,LIU Xing2
(1.KeyLaboratoryofAnimalDiseasesDiagnosticandImmunology,CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China;2.KeyLaboratoryofVeterinaryBiologicalEngineeringandTechnologyofMinistryofAgriculture,NationalCenterforEngineeringResearchofVeterinaryBio-products,InstituteofVeterinaryMedicine,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China)
Abstract:According to reports,VP60 P2 subdomain of RHDV may play an important role in the viral infection. In this study,we used co-immunoprecipitation(Co-IP) with RHDV VP60 P2 expressed inE.colias bait protein and mass spectrometry analysis to screen the RHDV interacting hepatocellular proteins.Laminin receptor (LamR),as receptors of many other viruses,was identified and verified as potential interacting partner of P2.LamRgene was amplified by RT-PCR from rabbit liver cells.The recombinant LamR protein was expressed inE.coliand used in GST pull-down to verify the interaction of LamR and P2.Here we screened 26 proteins as potential P2 interacting proteins.After verification,the protein LamR could interact with P2 directly.We found that RHDV VP60 P2 interacted with LamR which would contributed to further study of the infectious process and pathogenesis of RHDV.
Key words:rabbit hemorrhagic disease virus (RHDV);VP60 P2 subdomain;co-immunoprecipitation; laminin receptor (LamR)
doi:10.11843/j.issn.0366-6964.2016.03.018
收稿日期:2015-08-21
基金项目:现代农业产业技术体系建设兔体系病毒病预防与控制岗位(CARS-44-C-1); 国家自然科学基金(31502073)
作者简介:李腾(1990-),女,湖南邵东人,硕士生,主要从事家畜传染病学研究,Tel:025-84390337,E-mail: 2013107045@njau.edu.cn *通信作者:姜平,教授, E-mail:jiangp@njau.edu.cn;王芳,研究员,E-mail:rwangfang@126.com
中图分类号:S855.3;S852.659.6
文献标志码:A
文章编号:0366-6964(2016)03-0549-10
