金英黄归汤对LPS介导乳腺上皮细胞TLR4信号通路中相关因子的影响
2016-07-13李中改张小艺周送桂王玉坤
李 欣,李中改,张小艺,周送桂,王玉坤,冯 将,易 琼,王 鲁*
(1.贵州大学 贵州省生化工程中心,贵阳 550025;2.贵州大学 动物科学学院,贵阳 550025;3.贵州大学 药学院,贵阳 550025)
金英黄归汤对LPS介导乳腺上皮细胞TLR4信号通路中相关因子的影响
李欣1,2,李中改1,2,张小艺1,2,周送桂1,3,王玉坤1,2,冯将1,2,易琼1,王鲁1*
(1.贵州大学 贵州省生化工程中心,贵阳 550025;2.贵州大学 动物科学学院,贵阳 550025;3.贵州大学 药学院,贵阳 550025)
摘要:为了评价金英黄归汤抗LPS致炎的作用机制,作者采用ELISA法检测金英黄归汤对细胞分泌细胞因子TNF-α、IL-8的影响,采用qPCR法研究药物对TLR4通路中IL-1受体相关激酶-1(IRAK-1)、肿瘤坏死因子受体6(TRAF-6)、转化生长因子激活激酶(TAK-1)、NF-κB诱导激酶(NIK)、抑制性NF-κB(IκB) mRNA的转录影响。结果显示,金英黄归汤低剂量组(39.1 μg·mL-1)、中剂量组(391 μg·mL-1)、高剂量组(3 910 μg·mL-1)能显著(P<0.05)或极显著(P<0.01)减少LPS介导的TNF-α和IL-8分泌;能显著(P<0.05)或极显著(P<0.01)减少LPS介导的IRAK-1、TRAF-6、TAK-1、IκB、NIKmRNA的转录。结果提示,金英黄归汤通过抑制小鼠MECs 的TLR4/NF-κB信号通路中IRAK-1/TRAF-6/TAK-1/NIK途径的活化来控制炎性因子的释放而发挥抗炎作用,而不是通过IRAK-1/TRAF-6/TAK-1/IκB途径实现的,这可能是金英黄归汤的抗炎机制。
关键词:金英黄归汤;LPS;乳腺上皮细胞;TLR4信号;mRNA转录
在免疫细胞研究中Toll样受体(TLRs)能启动和调节机体炎症和免疫反应[1],且TLR4是TLRs家族中研究最多的一种,它在脂多糖(LPS)介导的TLR4的途径中有激活髓样分化因子88(MyD88)、IL-1受体相关激酶-1(IRAK-1)、肿瘤坏死因子受体相关因子6(TRAF-6)、NF-κB抑制酶(IκB) 或NF-κB诱导激酶(NIK)相关因子参与信号的传导[2],最终使NF-κB转移至核内启动相关基因的转录,细胞分泌前炎症因子TNF-α、IL-1、IL-8、IL-6等。前期研究发现小鼠MECs细胞膜上存在TLR2和TLR4受体,TLR4是小鼠MECs上LPS介导细胞因子TNF-α、IL-8分泌的主要受体[3]。
近年来有大量研究报道中药复方、中药提取物及中药有效成分对TLR4/NF-κB信号通路具有调节作用,并用以探讨中药对相关疾病治疗的分子基础[4-6]。前期研究发现金英黄归汤具有良好的抗炎作用[7],对金黄色葡萄球菌所致乳房炎家兔血清及乳汁中IL-6和TNF-α的分泌也有显著的抑制作用[8]。在此基础上,本试验以LPS刺激小鼠MECs,研究金英黄归汤对TLR4/NF-κB信号通路的IRAK-1、TRAF-6、TAK-1、IκB、NIKmRNA转录的影响,旨在研究金英黄归汤的抗炎机制。
1材料与方法
1.1实验动物
SPF级3月龄的妊娠中期昆明小白鼠,体重35 g±5 g,购自解放军第三军医大学实验动物中心[动物许可证号:SCXK(渝) 2012-0003],在贵州大学贵州省生化工程中心SPF级动物实验室[动物许可证号:SYXK(黔) 2013-0001]饲养。
1.2主要药物
金英黄归汤中金银花、蒲公英、连翘、大黄、黄芪、当归、瓜萎、芙蓉花8味中药,购于贵阳市同济堂药店(中药GMP认证号:黔J0190),按文献[8]制备成生药浓度为1 g·mL-1,0.22 μm滤膜过滤除菌。4 ℃保存备用。
1.3主要试剂
DMEM/F12培养基、胎牛血清,Thermo scientific公司;小鼠表皮生长因子,SAB公司;胰岛素、霍乱毒素CT、L-谷氨酰胺、LPS,Sigma公司;Ⅰ型胶原酶和Ⅱ型胶原酶,Solarbio公司;Trypsin-EDTA,Invitrogen公司;Mouse TNF-α and IL-8 ELISA试剂盒,IBL公司。TIANScript cDNA第一链合成试剂盒,北京TIANGEN生物技术有限公司;动物组织/细胞RNA提取试剂盒,2×EsTaq MasterMix,北京康为世纪生物科技有限公司;Power SYBR Green PCR Master Mix,AB公司;注射用青霉素钠和硫酸链霉素,华北制药股份有限公司;氢化可的松,天津药业焦作有限公司;无水乙醇、氯仿、甲醛、异丙醇,均为国产化学纯试剂。
1.4主要实验仪器
ThermoFisher 8000储水型CO2细胞培养箱,Thermo公司;MultiskanGo型全波段酶标仪,Thermo公司;qTOWER实时荧光定量RT-PCR仪,德国jena公司;T100 Thermal Cycler温度梯度PCR仪,GelDoc XR+凝胶成像系统,BIO-RAD公司。
1.5金英黄归汤对LPS介导小鼠MECs分泌IL-8和TNF-α的影响
参照文献方法[3]制备小鼠MECs,将500 μL 5×104·mL-1的细胞悬液加入24孔板中,在37 ℃,5%CO2培养箱中培养,及时换液,当MECs生长融合成单层细胞时,随机分为5组:空白对照组、LPS刺激组、金英黄归汤低剂量组、金英黄归汤中剂量组、金英黄归汤高剂量组。各组分别以下列方法干预:空白对照组:只加MECs培养液500 μL。LPS刺激组:含有10 μg·mL-1LPS(终质量浓度)MECs培养液500 μL。金英黄归汤低剂量组:加入含有10 μg·mL-1LPS+39.1 μg·mL-1(终质量浓度)金英黄归汤的MECs培养液500 μL。金英黄归汤中剂量组:加入含有10 μg·mL-1LPS+391 μg·mL-1(终质量浓度)金英黄归汤的MECs培养液500 μL,金英黄归汤高剂量组:加入含有10 μg·mL-1LPS+3 910 μg·mL-1(终质量浓度)金英黄归汤的MECs培养液500 μL。在37 ℃,5%CO2培养箱中培养24 h后收集细胞。取每孔上清液,按照ELISA试剂盒说明书方法分别测定其IL-8和TNF-α的分泌量。
1.6金英黄归汤对LPS介导小鼠MECs中IRAK-1、TRAF-6、TAK-1、NIK、IκBmRNA转录的影响
按上述方法制备细胞及给药,在37 ℃,5%CO2培养箱中培养24 h后收集细胞。使用动物组织/细胞RNA提取试剂盒提取各组细胞的RNA,并检测其纯度与浓度,检测合格后,尽快用TIANScript cDNA第一链合成试剂盒将提取的RNA逆转录,并于-80 ℃保存备用。IRAK-1、TRAF-6、TAK-1、NIK、IκB基因序列从GenBank获得,使用Primer 5.0设计引物(表1),由上海生工合成。以GAPDH为内参基因,采用梯度PCR技术检测各基因的最佳退火温度(表1)。
10 μL反应体系中,加入5 μL SYBR Green,2 μL模板cDNA,0.8 μL引物,用无RNase的水补充体积至10 μL。然后进行PCR反应和荧光测定。荧光定量RT-PCR反应程序:95 ℃预热5 min;95 ℃变性30 s,退火温度(表1)30 s,72 ℃延伸30 s,自变性开始三步为一个循环,共设40个循环;72 ℃延伸2 min,使产物延伸完全。反应结束后自50 ℃至95 ℃绘制熔解曲线。测定结果用2-ΔΔCt的方法计算得到各组mRNA的转录量。
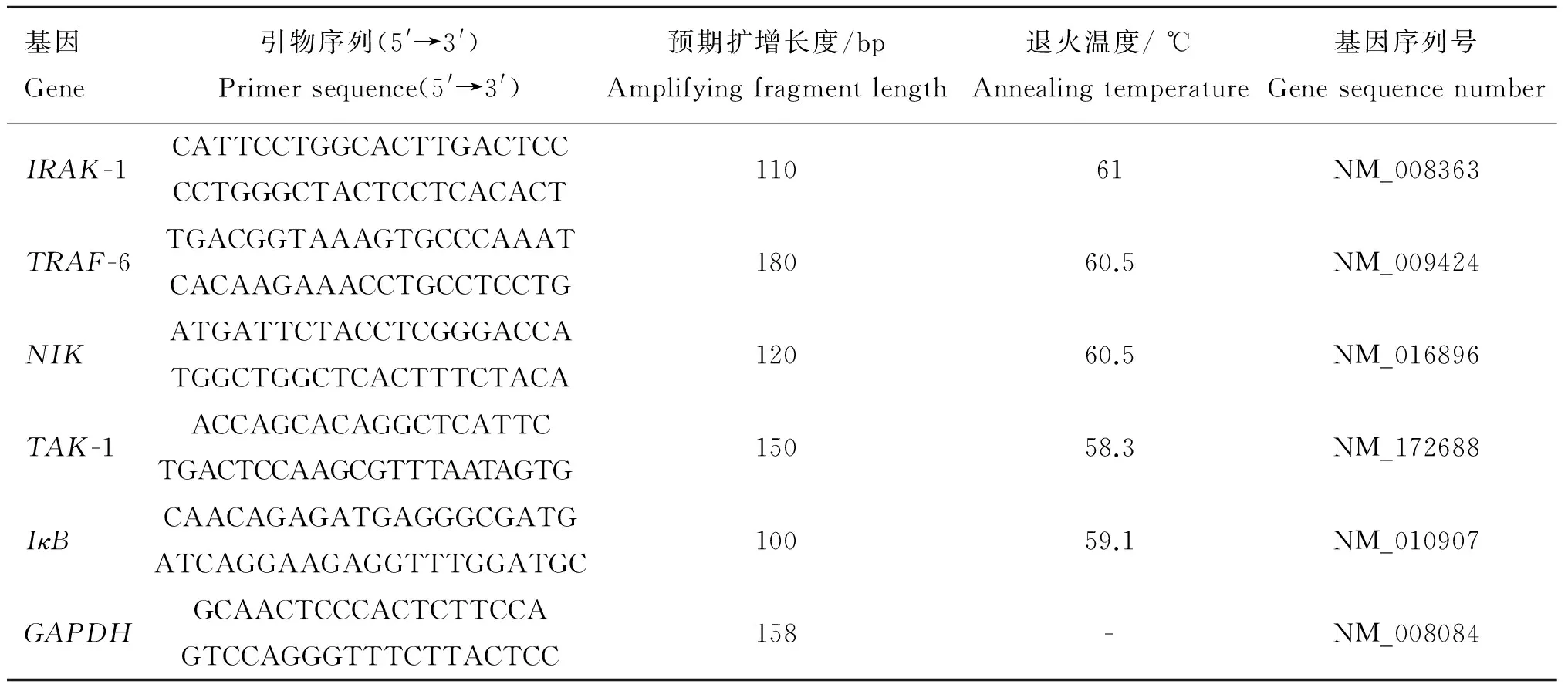
表1 qPCR 的引物序列及退火温度
1.7统计学处理
2结果
2.1金英黄归汤对LPS介导小鼠MECs分泌IL-8和TNF-α的影响
试验结果显示,与空白组相比,LPS刺激组的IL-8分泌量极显著升高(P<0.01),金英黄归汤低、中、高剂量组IL-8的分泌量差异不显著(P>0.05);与LPS刺激组比较,金英黄归汤低、中、高剂量组IL-8的分泌量分别显著(P<0.05)或极显著(P<0.01)降低,且细胞分泌IL-8的分泌量与中药浓度呈一定的量效关系,随着中药浓度的增加而减少,并回到空白组水平,结果见图1。

**.与空白组相比,P<0.01; #,##.与LPS组相比,P<0.05,P<0.01。下同**.Compared with control,P<0.01; #,##. Compared with LPS,P<0.05,P<0.01.The same as below图1 金英黄归汤对MECs分泌IL-8的影响Fig.1 Influence of JYT on IL-8 of MECs culture supernatants
试验结果显示,与空白组相比,LPS刺激组TNF-α的分泌量显著升高(P<0.05),金英黄归汤低、中、高剂量组TNF-α的分泌量差异不显著(P>0.05);与LPS刺激组比较,金英黄归汤低、中、高剂量组TNF-α的分泌量则分别极显著(P<0.01)或显著(P<0.05)降低,且也回到空白组水平,结果见图2。
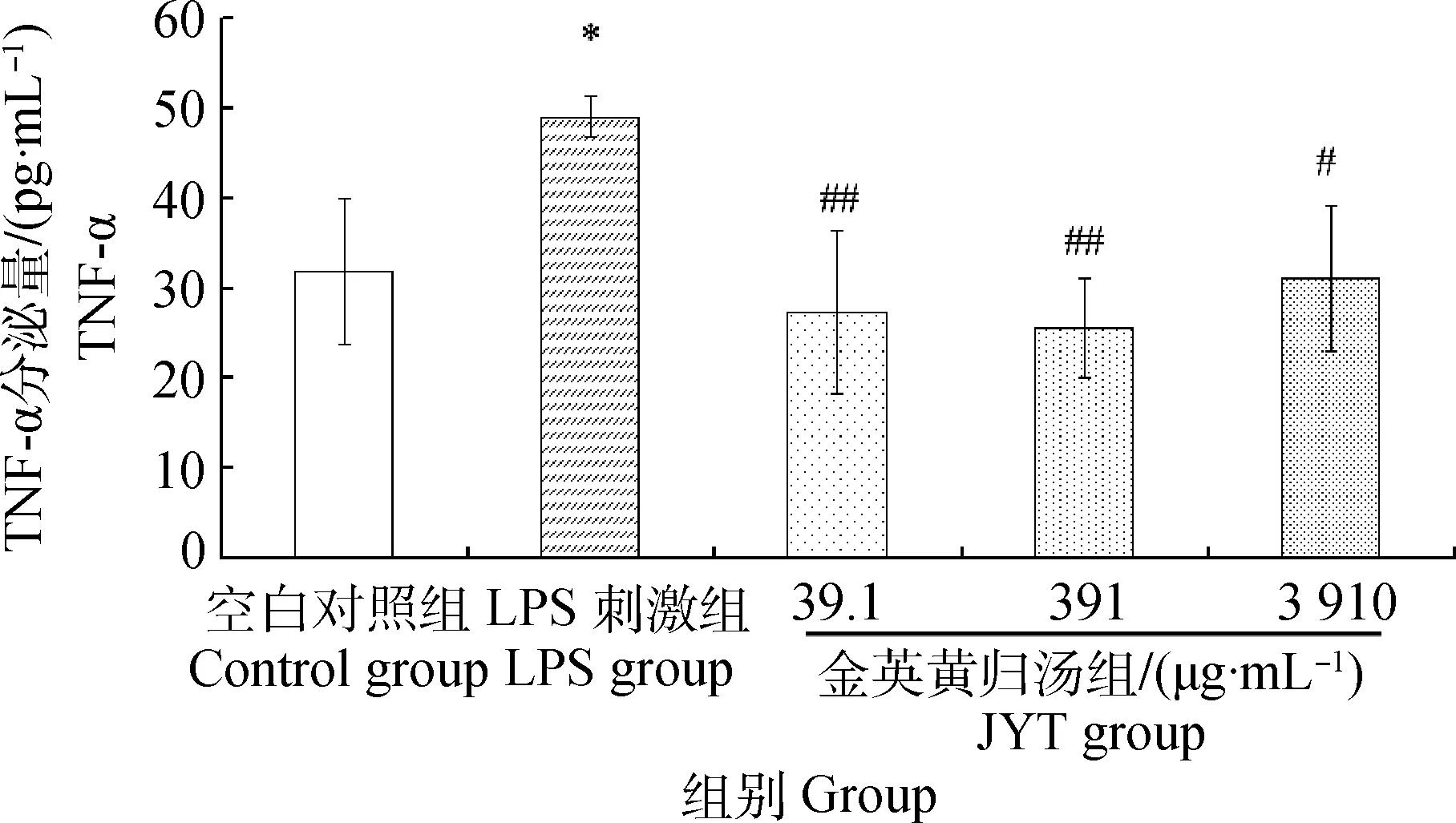
图2 金英黄归汤对MECs分泌TNF-α的影响Fig.2 Influence of JYT on TNF-α of MECs culture supernatants
2.2金英黄归汤对LPS导致小鼠MECs中IRAK-1 mRNA转录的影响
与空白组相比,LPS刺激组IRAK-1 mRNA转录量极显著上升(P<0.01),金英黄归汤低剂量组的转录量也显著上升(P<0.05),但金英黄归汤中、高剂量组的转录量下降,且差异不显著(P>0.05);与LPS刺激组相比,金英黄归汤各剂量组均极显著下调IRAK-1的转录(P<0.01),IRAK-1 mRNA的转录量与中药浓度呈一定的量效关系,随着中药浓度的增加而减少,且回到空白组水平,结果见图3。
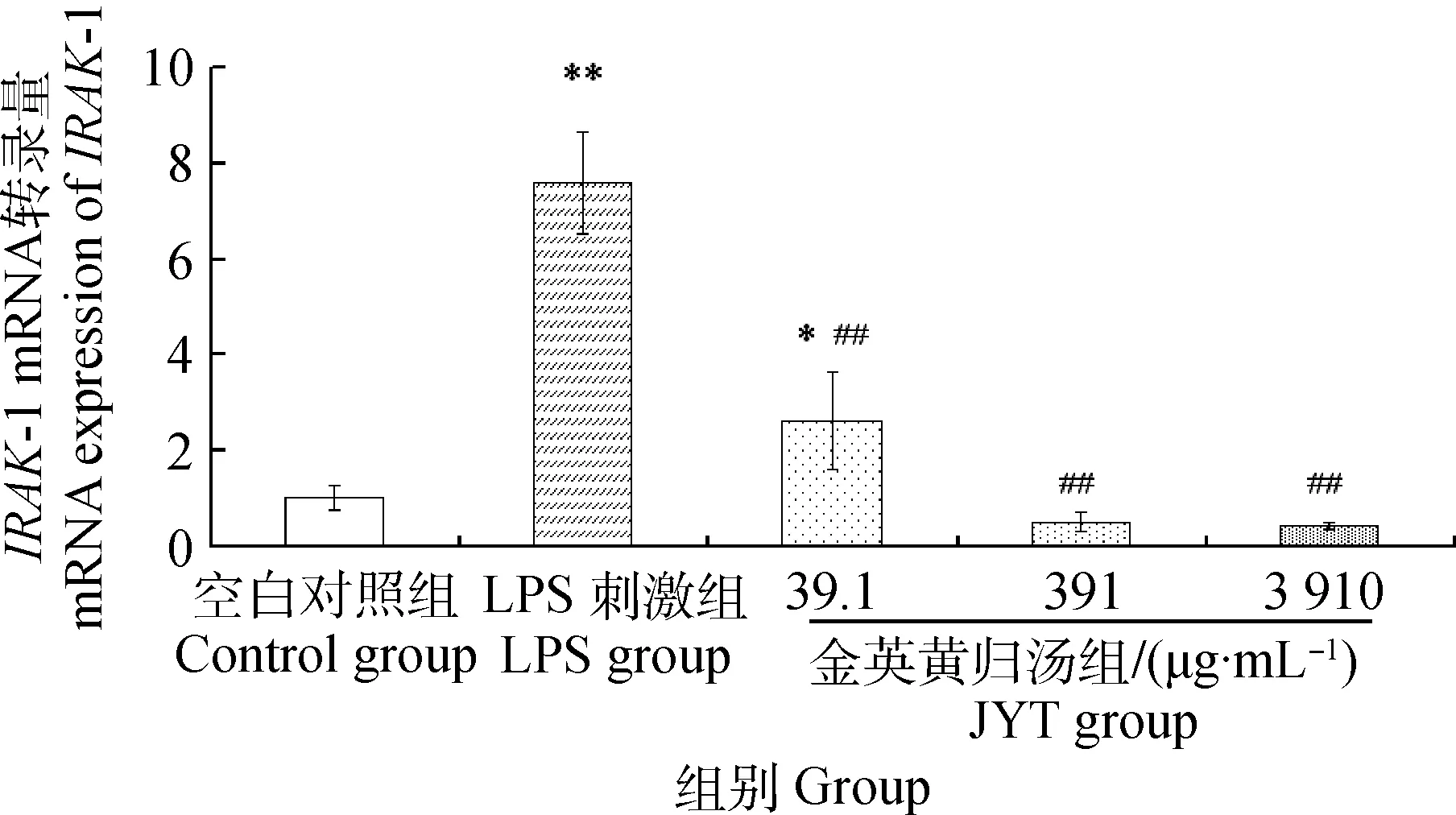
图3 金英黄归汤对MECs IRAK-1 mRNA转录的影响Fig.3 Influence of JYT on IRAK-1 mRNA expression in MECs
2.3金英黄归汤对LPS导致小鼠MECs中TRAF-6 mRNA转录的影响
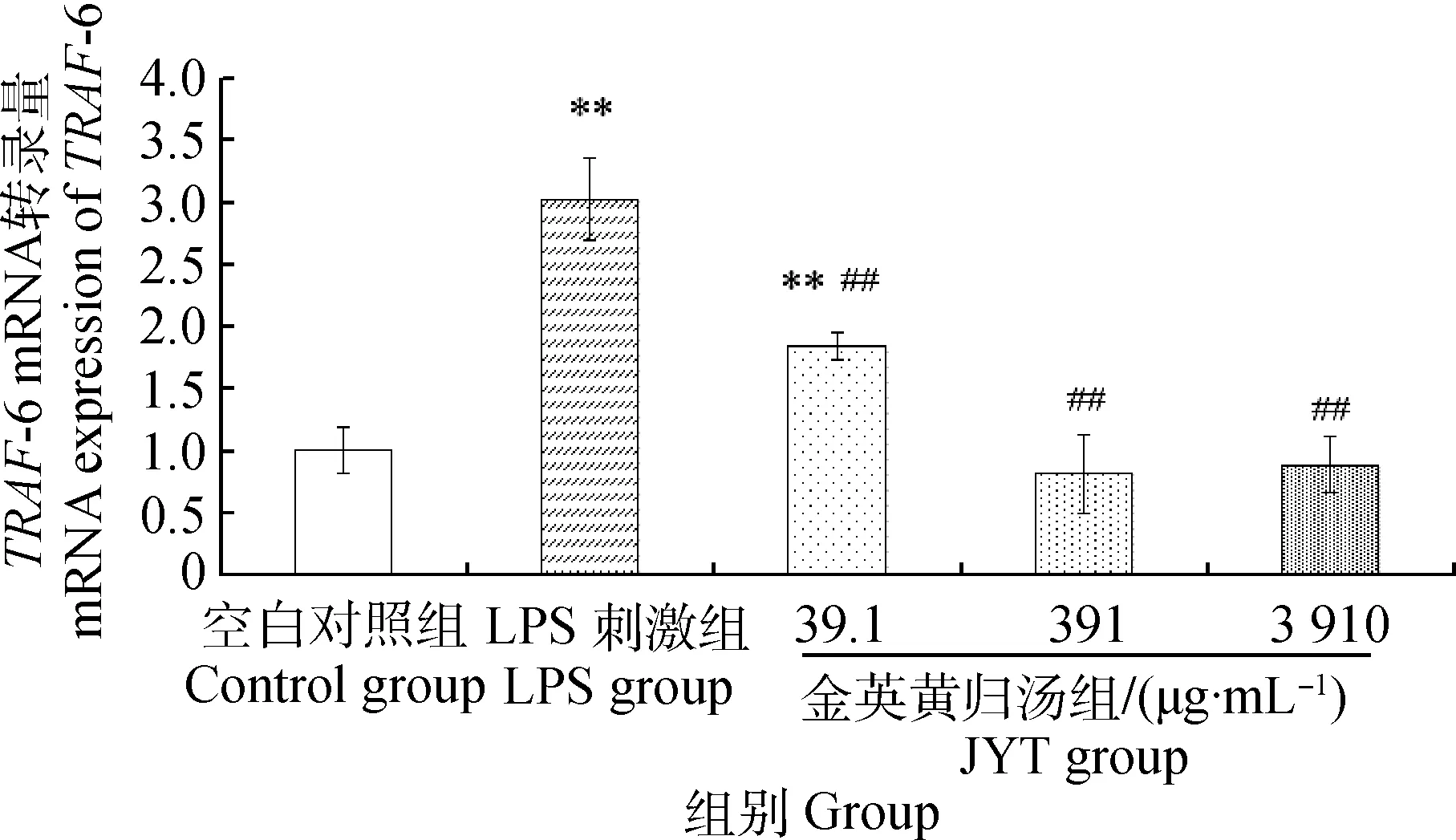
图4 金英黄归汤对MECs TRAF-6 mRNA转录的影响Fig.4 Influence of JYT on TRAF-6 mRNA expression in MECs
与空白组相比,LPS刺激组TRAF-6 mRNA转录量极显著上升(P<0.01),金英黄归汤低浓度组的转录量也极显著上升(P<0.01),但金英黄归汤中、高浓度组的转录量差异不显著(P>0.05);与LPS刺激组相比,金英黄归汤各剂量组均极显著下调TRAF-6的转录(P<0.01),TRAF-6 mRNA的转录量与中药浓度呈一定的量效关系,随着中药浓度的增加而减少,且回到空白组水平,结果见图4。
2.4金英黄归汤对LPS导致小鼠MECs中TAK-1 mRNA转录的影响
与空白组相比,LPS刺激组TAK-1 mRNA转录量极显著上升(P<0.01),金英黄归汤低剂量组的转录量差异不显著(P>0.05),但金英黄归汤中、高浓度组的转录量极显著下调(P<0.01);与LPS刺激组相比,金英黄归汤各剂量组均极显著的下调TAK-1的转录(P<0.01),TAK-1 mRNA的转录量与中药浓度呈一定的量效关系,结果见图5。
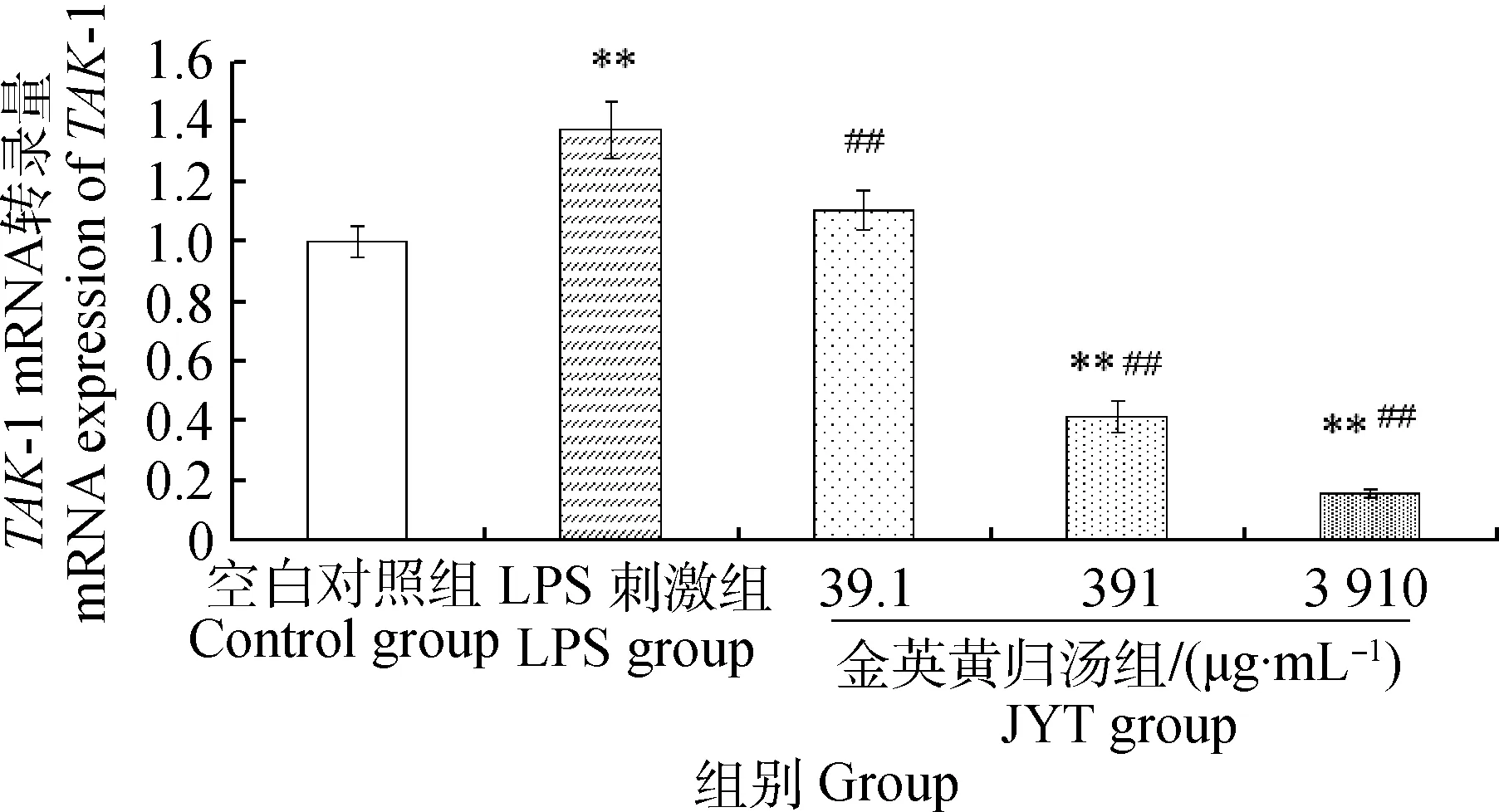
图5 金英黄归汤对MECs TAK-1 mRNA转录的影响Fig.5 Influence of JYT on TAK-1 mRNA expression in MECs
2.5金英黄归汤对LPS导致小鼠MECs中NIKmRNA转录的影响
与空白组相比,LPS刺激组NIKmRNA转录量极显著上升(P<0.01),金英黄归汤低剂量组的转录量也极显著上升(P<0.01),但金英黄归汤中、高浓度组的转录量显著(P<0.05)或极显著(P<0.01)下调;与LPS刺激组相比,金英黄归汤低浓度组则极显著上调NIK的转录(P<0.01),而中、高浓度组均极显著下调NIK的转录(P<0.01)。NIKmRNA的转录量与中药浓度呈一定的量效关系,结果见图6。
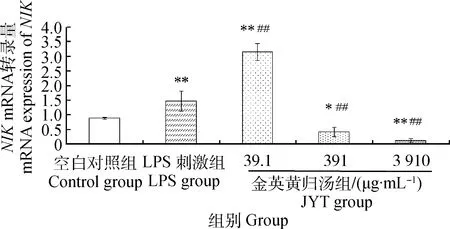
图6 金英黄归汤对MECs NIK mRNA转录的影响Fig.6 Influence of JYT on NIK mRNA expression in MECs
2.6金英黄归汤对LPS导致小鼠MECs中IκBmRNA转录的影响
与空白组相比,LPS刺激组、金英黄归汤各浓度组IκBmRNA转录呈极显著下调(P<0.01),与LPS刺激组相比,金英黄归汤各浓度组均显著或极显著的下调IκB的转录(P<0.05,P<0.01)。结果详见图7。
3讨论
MECs在病原微生物侵入乳腺时,能分泌细胞调节因子,如IL-1β、IL-6、IL-8和TNF-α[9-10],这些活性成分对乳腺炎的发生与病程发展起重要作用,它们能趋化中性粒细胞进入乳腺感染区,抵抗病原菌的感染[11],这对疾病的控制是有利的,但细胞受致炎因子刺激,机体过度活化后影响了其正常的功能,从这角度来说对机体是不利的,所以减少致炎因子所致细胞因子分泌更具有科学意义。本试验结果进一步证实了LPS可以导致小鼠MECs分泌IL-8和TNF-α[3],更重要的是发现适宜浓度的金英黄归汤可抑制LPS所致小鼠MECs分泌IL-8和/或TNF-α,这为金英黄归汤对抗LPS的生物活性提供了数据,为进一步研究金英黄归汤在LPS导致信号通路的研究打下基础。
LPS是TLR4的天然配体,在免疫细胞上的TLR4接受LPS刺激后,将信号转到细胞内,可激活MyD88依赖和非依赖的TLR4信号通路[2],MyD88依赖途径是MyD88和MyD88样接头蛋白(MAL)聚集到TLR4形成受体复合体。IRAK-1和IRAK-4与该受体复合物结合后,引起IRAK-1的磷酸化,使其从受体复合体上解离,并结合活化TAK-1结合蛋白1(TAB1)和TAB2以及TRAF-6并使其活化。活化的TRAF-6激活NF-κB转移至核内启动相关基因的转录最终细胞分泌前炎症因子TNF-α、IL-1、IL-8、IL-6等。前期研究发现金英黄归汤能降低LPS刺激小鼠MECs后TLR4、MyD88的mRNA的转录[12]。为了进一步研究金英黄归汤对TLR4信号通路中从MyD88之后起至NF-κB段相关因子的影响,设计了本试验。试验结果显示,LPS刺激小鼠MECs后,IRAK-1、TRAF-6、TAK-1、NIK都极显著的升高,IκB极显著的降低,说明小鼠MECs的TLR4信号传导与免疫细胞的信号传导途径是一致的,这为TLR4信号通路的研究增加了MECs的研究数据。结果还显示,金英黄归汤能降低LPS刺激小鼠MECs后IRAK-1、TRAF-6、TAK-1、NIK的mRNA的转录,这说明金英黄归汤抑制LPS所致小鼠MECs分泌IL-8和/或TNF-α的机制之一可能是抑制TLR4信号通路中IRAK-1、TRAF-6、TAK-1、NIK的转录。
NF-κB激活的经典途径是抑制IκB而实现,NF-κB激活的非经典途径通过NIK实现的[13]。试验结果证实了LPS能导致小鼠MECs的IκB的mRNA转录极显著下降,NIK的mRNA转录极显著上升,这可推断LPS是通过IκB途径和或NIK途径活化NF-κB。试验结果发现金英黄归汤能显著促进LPS介导小鼠MECs的IκB的mRNA转录下降,极显著抑制的NIKmRNA转录上升,我们推测金英黄归汤可能是从NIK途径而不是从IκB途径减少NF-κB活化,最终降低细胞分泌细胞因子。NF-κB是核转录因子,由于影响其活性及活化有多条途径,金英黄归汤对NF-κB活性及活化如何有待进一步深入研究。
4结论
MECs在病原微生物侵入乳腺时,能分泌细胞调节因子,如IL-1β、IL-6、IL-8和TNF-α,这对乳腺炎的发生与病程发展起重要作用,中药复方金英黄归汤可抑制LPS所致小鼠MECs分泌IL-8和/或TNF-α,其机制是抑制LPS介导的TLR4信号通路中IRAK-1、TRAF-6、TAK-1、NIK的mRNA转录。并可能从NIK途径而不是从IκB途径减少NF-κB活化,最终降低细胞分泌细胞因子。
参考文献(References):
[1]HIGGS R,CORMICAN P,CAHALANE S, et al.Induction of a novel chicken Toll-like receptor following Salmonella enterica serovar Typhimurium infection[J].InfectImmun,2006,74(3):1692-1698.
[2]KAWAI T,AKIRA S.Toll-like receptor downstream signaling[J].ArthritisResTher,2005,7(1):12-19.
[3]HE C L,YI Q,LI Y F, et al.Toll-like receptor-4,but not toll-like receptor-2 mediates secretion of tumour necrosis factor α and interleukin-8 in lipopolysaccharide-stimulated mouse mammary epithelial cells[J].BulletinoftheVeterinaryInstituteinPulawy,2013,57(3):393-397.
[4]ZHU H,ZHANG Y,HU X,et al.The effects of high-dose qinggan huoxue recipe on acute liver failure induced by d-galactosamine in rats[J].EvidBasedComplementAlternatMed,2013,2013:905715.
[5]LI H L,CHEN H I,LI H, et al.Regulatory effects of emodin on NF-kappaB activation and inflammatory cytokine expression in RAW 264.7 macrophages[J].IntJMolMed,2005,16(1):41-47.
[6]SINTARA K,THONG-NGAM D,PATUMRAIJ S,et al.Curcumin suppresses gastric NF-κB activation and macromolecular leakage in Helicobacter pylori-infected rats[J].WorldJGastroenterol,2010,16(32):4039-4046.
[7]覃英克,郭庆,肖纯刚,等.8个中药组方抗炎活性的筛选[J].黑龙江畜牧兽医,2011(11):126-127.
TAN Y K,GUO Q,XIAO C G,et al.Screening of eight Chinese medicine prescription in anti-inflammatory activity[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2011(11):126-127.(in Chinese)
[8]WANG L U,HE C L,HE B K, et al.Effects of Jin-Ying-Tang onStaphylococcusaureus-induced mastitis in rabbit[J].ImmunopharmacolImmunotoxicol,2012,34(5):786-793.
[9]PAREEK R,WELLNITZ O,VAN DORP R,et al.Immunorelevant gene expression in LPS-challenged bovine mammary epithelial cells[J].JApplGenet,2005,46(2):171-177.
[10]WELLNITZ O,KERR D E.Cryopreserved bovine mammary cells to model epithelial response to infection[J].VetImmunolImmunopathol,2004,101(3-4):191-202.
[11]PAAPE M,MEHRZAD J,ZHAO X,et al.Defense of the bovine mammary gland by polymorphonuclear neutrophil leukocytes[J].JMammaryGlandBiolNeoplasia,2002,7(2):109-121.
[12]李圆方.“金英黄归汤”对小鼠乳腺上皮TLR4信号转导的影响[D].贵州:贵州大学,2013.
LI Y F.Regulated effects of Jin-Ying-Huang-Gui decoction on the TLR4 signaling of mouse mammary epithelial cellsinvitro[D].Guizhou:Guizhou University,2013.(in Chinese)
[13]SUN S C.The noncanonical NF-κB pathway[J].ImmunolRev,2012,246(1):125-140.
(编辑白永平)
Effects of Jin-Ying-Tang on Correlated Molecules of Toll-like Receptor 4 Signaling of LPS-Induced Mouse Mammary Epithelial Cellsinvitro
LI Xin1,2,LI Zhong-gai1,2,ZHANG Xiao-yi1,2,ZHOU Song-gui1,3,WANG Yu-kun1,2,FENG Jiang1,2,YI Qiong1,WANG Lu1*
(1.BiochemistryEngineeringCenterofGuizhouProvince,GuizhouUniversity,Guiyang550025,China;2.CollegeofAnimalScience,GuizhouUniversity,Guiyang550025,China;3.CollegeofPharmacy,GuizhouUniversity,Guiyang550025,China)
Abstract:The study was conducted to investigate the effects of Jin-Ying-Tang (JYT) on correlated molecules of TLR4/NF-κB signaling of LPS-stimulated mouse mammary epithelial cells(MECs)invitroand explore its underlying molecular mechanisms.ELISA was performed to detect changes of the content of IL-8 and TNF-α in the culture supernatants.The mRNA transcription of TLR4-NF-κB signaling molecules such as IL-1 receptor-associated kinase-1(IRAK-1),tumour necrosis factor receptor associated factor 6(TRAF-6),Transforming Growth Factor activated kinase 1(TAK-1),NF-κB inducing kinase(NIK),Inhibitor of κB(IκB) were determined by qRT-PCR.The results showed that JYT could significantly decrease the expression of IL-8 and TNF-α in LPS-stimulated MECs(P<0.05,P<0.01);what’s more,JYT could down-regulate the expression ofIRAK-1,TRAF-6,TAK-1,IκB,NIKmRNA activated by LPS(P<0.05,P<0.01).It is concluded that JYT attenuates LPS-induced inflammatory response in MECs by inhibiting the activitation of IRAK-1/TRAF-6/TAK-1/NIK pathway,but not of IRAK-1/TRAF-6/TAK-1/IκB pathway.
Key words:Jin-Ying-Tang;LPS;mammary epithelial cells;TLR4/NF-κB signaling;mRNA expression
doi:10.11843/j.issn.0366-6964.2016.03.026
收稿日期:2015-08-12
基金项目:国家自然科学基金项目(31260618;31470128);北京农学院兽医学(中医药)北京市重点实验室开放课题
作者简介:李欣(1991-),男,吉林通化人,硕士生,主要从事中药药理学研究,E-mail:690079602@qq.com *通信作者:王鲁(1970-),教授,博士,主要从事中兽医学及中药药理学研究,E-mail:wanglu7007@163.com
中图分类号:S853.9
文献标志码:A
文章编号:0366-6964(2016)03-0609-06
