黄土区金盏菊幼苗根部细胞壁对Pb/Cd复合胁迫响应的FTIR和Raman光谱
2016-07-12范春辉高雅琳
范春辉,高雅琳,杜 波
陕西科技大学环境科学与工程学院,陕西 西安 710021
黄土区金盏菊幼苗根部细胞壁对Pb/Cd复合胁迫响应的FTIR和Raman光谱
范春辉,高雅琳,杜 波
陕西科技大学环境科学与工程学院,陕西 西安 710021

细胞壁; 红外光谱; 拉曼光谱; Pb/Cd胁迫; 金盏菊; 黄土
引 言
植物修复法是重金属污染场地修复的有效途径,具有成本低廉、适用性广、环境扰动少等特点和经济技术上的双重优势,目前已成为全球污染场地修复的主流技术之一[1]。植物对土壤重金属的修复净化主要通过螯合固定、平衡调控、胞内分隔等途径实现; 近些年,植物对土壤重金属胁迫响应途径和应答机制方面的研究日益引起学者们的广泛关注和兴趣[2]。
植物细胞壁是由果胶、纤维素、蛋白质等组成的复杂结构,也是物质转运与信息传递的关键介质通道。植物根部细胞壁是土壤重金属离子跨膜进入植物体的首要屏障,其对重金属胁迫的响应信号能够直接干扰植物代谢过程,进而影响重金属解毒效果和植物修复目标的实现[3-4]。对于植物细胞壁与重金属胁迫间的分子效应,国内外学者做了大量研究工作。比如,Vuletic[5]发现重金属可以抑制植物的正常生长发育,Cu/Cd胁迫易导致细胞壁过氧化物酶 (POD) 活性增加; Konno[6]认为剑叶舌叶藓能够将过量的Cu积累于其原丝体细胞壁中,证实了细胞壁果胶在Cu解毒方面的重要作用。但鉴于植物修复效能的时空差异性和细胞壁微观属性的不确定性,仍有必要深度发掘细胞壁对重金属逆境胁迫的响应信号。
光谱技术为解析植物修复过程机制提供了新手段和新思路,傅里叶变换红外光谱(FTIR)和拉曼光谱(Raman)就是其中两类[7]。这两种方法都能有效识别物质分子的化学键和官能团信息,且检测结果互为补充和验证,有望从量子化学层面提供大量直接证据。前期笔者验证了金盏菊对黄土区Pb/Cd复合污染修复的有效性和高效性,本研究主要分析Pb/Cd复合胁迫对金盏菊幼苗根部细胞壁的影响,探讨细胞壁官能团性质及对Pb/Cd胁迫的应答信号,以期为后续研究提供参考和借鉴。
1 实验部分
1.1 仪器和试剂
高速冷冻离心机(HC-3018R, 安徽中科中佳),超纯水机(UPHW-I-90T, 四川优普),扫描电镜(Q45, FEI),X射线荧光光谱仪(Axios PW4400, PANalytical),X射线衍射仪(D/Max2200PC, RIGAKU),红外光谱仪(VECTOR-22, BRUKER),拉曼光谱仪(INVIA, RENISHAW)。实验用水为超纯水,KBr为光谱纯,Pb(NO3)2和CdCl2等化学试剂均为优级纯。
1.2 方法
1.2.1 金盏菊幼苗培养
黄土样品取自陕西科技大学教学区南侧树林-草坪植被带。向土样中喷洒Pb(NO3)2和CdCl2溶液,充分搅拌使黄土润湿并混合均匀,配制模拟Pb/Cd复合污染黄土,其中Pb/Cd浓度分别为1 000和30 mg·kg-1,黄土老化时间为120 d。空白实验所用土样为未经Pb/Cd染毒的黄土原样。
采用盆栽土培实验获得合适的金盏菊幼苗。盆栽容器为45 cm×20 cm×15 cm的矩形塑料盆,每盆装有黄土原样(无Pb/Cd胁迫)或模拟污染黄土(Pb/Cd复合胁迫)(6.0±0.1)kg; 依次向黄土中均匀施加尿素、磷酸二氢钠和氯化钾,三种底肥添加量分别为0.4,0.2和0.3 g·kg-1黄土。金盏菊播种时间为2015年3月14日,置于室外天然光照条件下培养,定期以超纯水浇灌,维持黄土含水量为田间持水量的70%。从播种之日起,经过30 d的培养收获金盏菊幼苗。
1.2.2 金盏菊幼苗根部细胞壁提取
将冰冻的金盏菊根部在研钵中研磨至粉末状,之后转移到离心管中,加入75%冰乙醇浸没混匀,冰浴20 min后离心(10 000 r·min-1, 15 min); 去上清液后加入冰丙酮提取,冰浴20 min后离心(10 000 r·min-1, 15 min); 去上清液后加入甲醇∶氯仿(1∶1, 体积比)提取,冰浴20 min后离心 (10 000 r·min-1, 15 min); 去上清液后加入甲醇提取,冰浴20 min后离心(10 000 r·min-1, 15 min); 去上清液后冷冻干燥,得到的固体产物即为金盏菊幼苗根部细胞壁,保存备用。提取过程的试剂用量均为10 mL·g-1(以根鲜重计)。
1.3 分析方法和质量控制
将细胞壁样品喷金后装入样品盒,观察Pb/Cd复合胁迫对其表面形貌的影响。X射线衍射分析采用CuKα射线,步宽(相对于2θ)0.02°,管压/管流为40 kV/30 mA; 使用MDI Jade 5.0分峰,将无定形区散射和各晶面衍射峰分开。红外光谱测试采用KBr压片法,扫描范围4 000~400 cm-1,分辨率2 cm-1,扫描累加次数32次,样品与KBr质量比约为1∶100。拉曼光谱扫描范围3 200~100 cm-1,曝光时间10 s,激光功率1%,累加次数1次,测试温度25 ℃。玻璃器皿使用前均经10% HNO3浸泡24 h,超纯水洗净后备用。所得数据采用Origin 6.0软件处理和绘图。
2 结果与讨论
2.1 SEM
Pb/Cd复合胁迫对金盏菊幼苗根部细胞壁表观形貌的影响见图1。天然生长状态下,金盏菊根部细胞壁[图1(a)]较为完整,舒展度和连续性较好,壁厚均匀规则,可见细胞壁表面微孔道及少量附属物; 局部放大显示细胞壁表层具有多样化的堆叠排列方式,略呈层片状堆积态,具有较清晰的表面轮廓。Pb/Cd复合胁迫[图1(b)]导致细胞壁褶皱增多,表面光亮,但细胞壁整体趋于弯曲萎缩,偶现裂隙或断裂带; 尤其明显的是,在细胞壁表面零散分布若干絮状或深色固体颗粒。通常认为,细胞壁是重金属离子跨膜进入细胞质的首要屏障,对于土壤/植物界面的重金属离子具有较强的吸附固定作用[8]。本研究中细胞壁表面出现的深色附着颗粒可能与经氧化还原作用后形成的Pb/Cd沉淀有关。

图1 Pb/Cd复合胁迫对黄土区金盏菊幼苗
Fig.1 SEM micrographs of cell wall fromCalendulaofficinalisseedlings roots under lead and cadmium stress in loess
2.2 XRF
采用X射线荧光光谱仪分析Pb/Cd复合胁迫对金盏菊幼苗根部细胞壁元素组成的影响,结果见表1。Pb/Cd复合胁迫对细胞壁元素种类影响很小(Al,Fe和Cu除外),但胁迫过程导致细胞壁Pb/Cd含量从0.003 1%和0.002 6%分别升高到0.534 9%和0.212 0%。推测胁迫前细胞壁Pb/Cd组分可能与黄土原样中天然源Pb/Cd存在相关,而胁迫后Pb/Cd含量的增加则证实了细胞壁对于外源Pb/Cd的强烈吸持作用。尽管XRF定量分析的精准性还有待验证,但其定性分析结果仍能一定程度上揭示细胞壁对Pb/Cd胁迫的响应效应。
表1 Pb/Cd复合胁迫对黄土区金盏菊幼苗根部细胞壁元素种类和含量的影响
Table 1 Element types and contents of cell wall fromCalendulaofficinalisseedlings roots under lead and cadmium stress in loess

ElementContent/%WithoutleadandcadmiumstressWithleadandcadmiumstressPb0 00310 5349Cd0 00260 2120Na0 02080 0215Mg0 19750 1863Al0 0038N DSi0 56250 5238P2 56932 6497S0 59920 6034Cl0 01440 0116K0 30360 2825Ca0 82070 7728FeN D0 0025Mn0 01060 0085Cu0 0096N DZn0 00390 0046
2.3 XRD
金盏菊幼苗根部细胞壁对Pb/Cd复合胁迫响应的XRD图谱如图2所示。Pb/Cd胁迫对细胞壁XRD结果影响不大,在2θ[图2(a)]为21.52°出现的衍射信号为纤维素Ⅱ特征峰。Pb/Cd胁迫后,在2θ[图2(b)]为23.86°,26.84°和28.04°等处新出现衍射峰(或原有峰强增加); 经与标准卡片比对,鉴定为Cd盐晶体(CdS等)特征峰[9]。此外,XRD图谱中的若干馒头峰同样为Pb盐、Cd盐及其络合物的不同晶面弱峰,但其结晶度普遍较低,基本处于无定形和晶体之间。这表明金盏菊幼苗根部细胞壁表面没有形成明显的Pb或Cd结晶体,暗示了Pb或Cd可能以络合态形式存在于细胞壁表面。
2.4 FTIR


图2 黄土区金盏菊幼苗根部细胞壁对Pb/Cd胁迫响应的XRD图谱
(a): 无铅/镉胁迫; (b): 有铅/镉胁迫
Fig.2 X-ray diffraction pattern of cell wall fromCalendulaofficinalisseedlings roots under lead and cadmium stress in loess
(a): Without lead and cadmium stress; (b): With lead and cadmium stress

图3 黄土区金盏菊幼苗根部细胞壁对Pb/Cd胁迫响应的FTIR图谱
(a): 无铅/镉胁迫; (b): 有铅/镉胁迫
Fig.3 FTIR spectra of cell wall fromCalendulaofficinalisseedlings roots under lead and cadmium stress in loess
(a): Without lead and cadmium stress; (b): With lead and cadmium stress
2.5 Raman
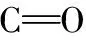

图4 黄土区金盏菊幼苗根部细胞壁对Pb/Cd胁迫响应的Raman图谱
(a): 无铅/镉胁迫; (b): 有铅/镉胁迫
Fig.4 Raman spectra of cell wall fromCalendulaofficinalisseedlings roots under lead and cadmium stress in loess
(a): Without lead and cadmium stress; (b): With lead and cadmium stress

3 结 论
(1)Pb/Cd胁迫导致金盏菊幼苗根部细胞壁弯曲萎缩、褶皱增多,细胞壁表面出现零散点状沉积物颗粒。XRF结果证实细胞壁Pb/Cd含量显著升高,但XRD图谱并没有发现Pb/Cd典型结晶峰。
(2)FTIR图谱中—OH吸收峰波数为3 416 cm-1,表明Pb/Cd离子与—OH存在配位结合效应; 1 701和1 593 cm-1的波峰分别移动到1 736和1 618 cm-1,说明Pb/Cd胁迫改变了细胞壁蛋白质结构属性。Raman光谱中2 960 cm-1特征峰差异暗示Pb/Cd胁迫可能改变了细胞壁纤维素分子排列方向。

致谢: 感谢陕西科技大学环境科学与工程学院分析测试中心朱超博士对扫描电镜操作的技术支持。
[1] Ali H, Khan E, Sajad M A. Chemosphere, 2013, 91: 869.
[2] Ullah A, Heng S, Munis M F H, et al. Environmental and Experimental Botany, 2015, 117: 28.
[3] Brady D, Duncan J R. Enzyme and Microbial Technology, 1994, 16: 633.
[4] Fernández R, Fernández-Fuego D, Bertrand A, et al. Plant Physiology and Biochemistry, 2014, 78: 63.
[5] Vuletic M, Hadzi-Taskovic S V, Markovic K, et al. Plant Biology, 2014, 16: 88.
[6] Konno H, Nakashima S, Katoh K. Journal of Plant Physiology, 2010, 167: 358.
[7] Akyuz T, Akyuz S, Gulec A. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 149: 744.
[8] Nishizono H, Ichikawa H, Suziki S, et al. Plant and Soil, 1987, 101: 15.
[9] Rodríguez P, Munoz-Aguirre N, San-Martin M E, et al. Applied Surface Science, 2008, 255: 740.
[10] Fadavi G, Mohammadifar M A, Zargarran A, et al. Carbohydrate Polymers, 2014, 101: 1074.
[11] Iqbal M, Saeed A, Zafar S I. Journal of Hazardous Materials, 2009, 164: 161.
[12] Wilson C J, Apiyo D, Wittung-Stafshede P. Quarterly Reviews of Biophysics, 2004, 37: 285.
[13] Richter S, Müssig J, Gierlinger N. Planta, 2011, 233: 763.
[14] Edwards H G M, Farwell D W, Webster D. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 1997, 53: 2383.
[15] Himmelsbach D S, Akin D E. Journal of Agricultural and Food Chemistry, 1998, 46: 991.
[16] Martinez-Sanz M, Gidley M J, Gilbert E P. Carbohydrate Polymers, 2015, 125: 120.
(Received Jun. 2, 2015; accepted Oct. 12, 2015)
Response of FTIR and Raman Spectra on Cell Wall ofCalendulaOfficinalisSeedlings Roots to the Co-Contamination Stress of Lead and Cadmium in Loess
FAN Chun-hui, GAO Ya-lin, DU Bo
School of Environmental Science & Engineering, Shaanxi University of Science & Technology, Xi’an 710021, China

Cell wall; Fourier transform infrared spectra; Raman spectra; Lead/cadmium stress;Calendulaofficinalis; Loess
2015-06-02,
2015-10-12
国家自然科学基金项目(21407103), 中国博士后科学基金项目(2012M511968)和陕西科技大学科研基金项目 (2014xhbz-06)资助
范春辉, 1982年生, 陕西科技大学环境科学与工程学院学院讲师 e-mail: fanchunhui@sust.edu.cn
O657.3
A
10.3964/j.issn.1000-0593(2016)07-2076-06
