微波超声协同提取金盏菊皂苷工艺及其抗氧化性研究
2021-11-17只德贤覃海波李建颖
只德贤,覃海波,李建颖
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,国家级食品与药品实验教学示范中心,天津 300134)
金盏菊又名大金盏花、金盏花、山金菊等,为菊科植物金盏菊(Calendula officinalis L.)的干燥全草。其性寒、味苦,具有清热解毒、凉血调经的作用。金盏菊原产于欧洲南部和埃及,现在世界各地均有分布,资源极其丰富,在我国亦有大量栽培。金盏菊应用广泛,不仅可用于化学工业、化妆品行业,还可用于食品和医药行业。金盏菊早期用于治疗静脉曲张,外用治疗褥疮等皮肤病[1]。现代研究表明金盏菊不仅具有良好的抗氧化[2]、抗炎[3]、抗菌活性[4],还具有降血糖[5]、保护肠黏膜[6]的作用。金盏菊提取物对皮肤有美白、保湿作用,能够延缓皮肤老化[7]。MIGUEL等[8]研究显示,金盏菊提取物对4种肿瘤细胞具有明显的抑制作用;JADOON等[9]的研究表明含有金盏菊提取物的药膏可减轻紫外线对皮肤造成的伤害;PREETHI等[10]研究显示,金盏菊提取物对C57BL/6小鼠B16F-10黑色素瘤细胞的转移有抑制作用。对金盏菊化学成分的研究表明[11],它富含黄酮类、挥发油、皂苷类、色素类等多种有效成分,同时还含有碳水化合物、脂类、蛋白质、维生素、可溶性糖类等多种营养成分。近年来对金盏菊化学成分的研究多集中在色素、挥发油和黄酮类成分[12-13],对其皂苷类成分的提取方法研究较少,且对金盏菊活性的研究多集中在金盏菊提取物的活性研究,对金盏菊皂苷类成分的活性研究较少。
微波辅助提取法具有加速细胞破壁、提高提取效率、节约溶剂等优点,且设备简易、选择性高,目前广泛应用于黄酮类、多糖类、色素类等成分的提取[14-15]。超声波辅助提取技术是利用超声波的强振动使细胞破壁并充分进入到溶剂中,可以有效地缩短提取时间,提高提取效率,目前已广泛应用于大多数天然产物的活性成分的提取[16]。
本文采用响应面法对微波超声协同提取金盏菊皂苷的工艺进行优化,并对其体外抗氧化活性进行初步研究,以期为更好地开发利用金盏菊资源提供理论依据。
1 材料与方法
1.1 材料与仪器
金盏菊:安国市旭芳中药材经营有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼(DPPH):美国Sigma公司;2,4,6-三吡啶基三嗪 [2,4,6-Tris(2-pyridyl)-s-triazine,TPTZ]:上海阿拉丁生化科技股份有限公司;齐墩果酸标准品:上海源叶生物科技有限公司;香草醛:北京索莱宝科技有限公司;甲醇、乙醇、冰醋酸、浓硫酸(分析纯):天津鑫桥化工贸易有限公司。
XO-SM100超声波微波协同反应系统:南京先欧仪器制造有限公司;UV-2802S紫外可见分光光度计:上海尤尼柯公司;RV10旋转蒸发仪:广州IKA仪器设备有限公司;Quintix125D分析天平:北京赛多利斯科学仪器有限公司;Integral 10超纯水系统:德国Merck公司;DFT-500中药粉碎机:浙江荣浩工贸有限公司。
1.2 试验方法
1.2.1 金盏菊皂苷提取工艺
准确称取金盏菊粉末2.00 g,在一定的液料比下加入不同浓度的乙醇溶液,在一定的微波功率下处理2 min,固定提取温度为50℃,提取一定的时间,抽滤,得到金盏菊皂苷提取液。
1.2.2 单因素试验
1.2.2.1 液料比对提取率的影响
固定乙醇浓度为60%,微波功率400 W,微波时间2 min,提取温度50℃,超声时间10 min,考察液料比为 5∶1、10∶1、15∶1、20∶1、25∶1(mL/g)对金盏菊皂苷提取率的影响。
1.2.2.2 乙醇浓度对提取率的影响
固定液料比为 20∶1(mL/g),微波功率 400 W,微波时间2 min,提取温度50℃,超声时间10 min,考察乙醇浓度为30%、40%、50%、60%和70%对金盏菊皂苷提取率的影响。
1.2.2.3 微波功率对提取率的影响
固定乙醇浓度为 60%,液料比为 20∶1(mL/g),微波时间2 min,提取温度50℃,超声时间10 min,考察微波功率为200、300、400、500 W和600 W对金盏菊皂苷提取率的影响。
1.2.2.4 超声时间对提取率的影响
固定乙醇浓度为 60%,液料比为 20∶1(mL/g),微波功率400 W,微波时间2 min,提取温度50℃,考察超声时间为5、10、15、20 min和25 min对金盏菊皂苷提取率的影响。
1.2.3 响应面试验
在单因素试验结果的基础上,根据Box-Behnken的中心组合试验设计原理,利用Design-Expert.V8.0.6.1软件以皂苷提取率为响应值,选取液料比、乙醇浓度、微波功率、超声时间为自变量,设计四因素三水平的响应面试验,对金盏菊皂苷的提取工艺进行优化。响应面的因素水平见表1。

表1 响应面试验因素水平Table 1 Factors and levels of response surface analysis
1.2.4 皂苷提取率的测定
准确称取齐墩果酸标准品10.00 mg,置于100 mL容量瓶中,甲醇溶解并定容,即得浓度为0.1 mg/mL的齐墩果酸储备液。
准确吸取齐墩果酸储备液 0、0.2、0.4、0.6、0.8、1.0、1.2 mL,于60℃水浴挥干溶剂,分别加入5%的香草醛-冰醋酸0.2 mL和高氯酸0.8 mL,60℃水浴中加热15 min,取出流水冷却使其充分反应,分别加入5 mL冰醋酸,摇匀,静置30 min,在546 nm处测定吸光度,并设空白对照。
以吸光度为纵坐标,齐墩果酸的质量浓度为横坐标,绘制标准曲线[17]。回归方程为y=6.337 9x+0.022 6,R2=0.999 4,线性范围0.02 mg/mL~0.12 mg/mL。金盏菊皂苷的计算公式(1)如下。

式中:W为皂苷提取率,mg/g;c为根据吸光度计算出的皂苷质量浓度,mg/mL;D为溶液稀释倍数;V为供试品溶液体积,mL;m为金盏菊取样量,g。
1.2.5 金盏菊皂苷体外抗氧化作用评价
1.2.5.1 DPPH自由基清除率的测定
参照黄煦杰等[18]的方法,分别取2.0mL浓度为0.05、0.10、0.15、0.20、0.25、0.30、0.40、0.50 mg/mL 的金盏菊皂苷提取液和VC溶液,加入2.0 mL浓度为0.2 mmol/L的DPPH-乙醇溶液,置于暗处静置30 min,测定517 nm处的吸光度A,根据公式(2)计算DPPH自由基清除率。

式中:A为样品溶液的吸光度;A1为样品溶液本底吸光度;A0为空白对照溶液吸光度。
1.2.5.2 ABTS+自由基清除率的测定
参照杨洁等[19]的方法,取2 mmol/L ABTS溶液50 mL和70 mmol/L过硫酸钾溶液200 mL混匀后,低温放置12 h,使用时用无水乙醇稀释,使其在734 nm波长处吸光度A0为0.70±0.02。分别取0.1 mL浓度为0.05、0.10、0.15、0.20、0.25、0.30、0.40、0.50 mg/mL 的金盏菊皂苷提取液和VC溶液,加入1.9 mL稀释后的ABTS+溶液,静置15 min,测定734 nm处的吸光度A,根据公式(3)计算ABTS+自由基清除率。
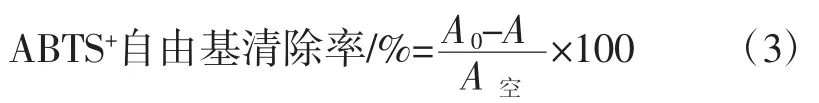
式中:A0为稀释后的ABTS+溶液的吸光度;A为样品溶液在734 nm处测定的吸光度;A空为用无水乙醇代替样品在734 nm处测定的吸光度。
1.2.5.3 铁离子还原能力(ferric reducing antioxidant power,FRAP)的测定
FRAP工作液:配制0.3 mol/L pH3.6的醋酸钠缓冲液、10 mmol/L的TPTZ溶液和20 mmol/L的三氯化铁溶液,按10∶1∶1的体积比混合即得FRAP工作液。
参照Xiong等[20]的方法,分别取0.1mL浓度为0.05、0.10、0.15、0.20、0.25、0.30、0.40、0.50 mg/mL 的金盏菊皂苷提取液和VC溶液,加入3 mL FRAP工作液,充分混合均匀后,在37℃水浴避光反应10min,在593nm测定吸光度。按照上述方法,测定FeSO4系列标准溶液(浓度范围0.1 mmol/L~1.0 mmol/L)的吸光度,得到标准曲线,根据回归方程计算出对应的FeSO4浓度,即为FRAP值,此值越大,表明其还原能力越强。
1.3 数据处理
本试验操作均平行测定3次,取平均值。采用Design-Expert.V8.0.6.1软件进行响应面试验设计,SPSS 20.0软件对数据进行方差分析。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 液料比对金盏菊皂苷提取率的影响
液料比对金盏菊皂苷提取率的影响见图1。
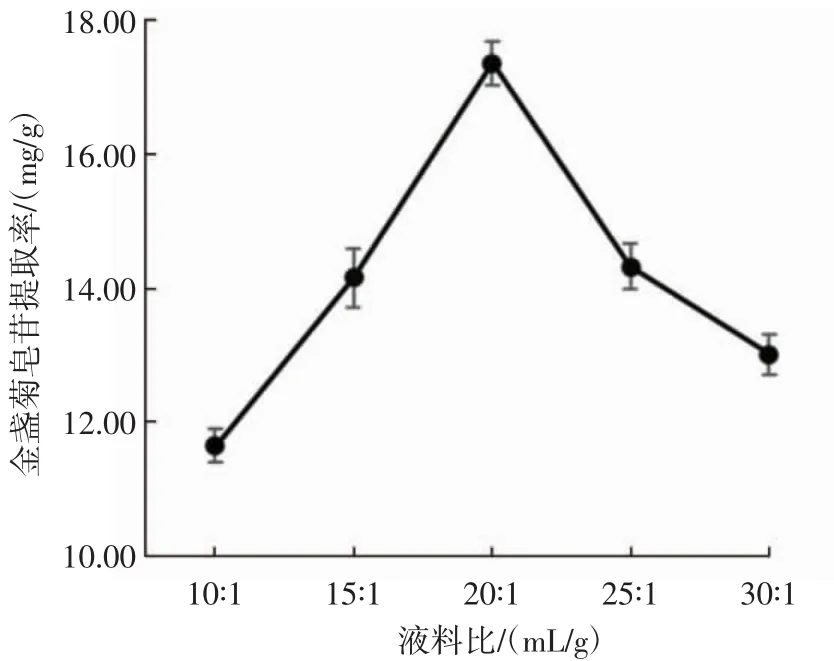
图1 液料比对金盏菊皂苷提取率的影响Fig.1 The effect of material liquid ratio on extraction rate of Calendula officinalis saponins
如图 1 所示,在液料比为 10∶1(mL/g)~20∶1(mL/g)时,随着溶剂的增加,金盏菊皂苷提取率呈上升状态,液料比为 20∶1(mL/g)时,皂苷提取率最高,达到 17.36mg/g,当液料比超过20∶1(mL/g)时,金盏菊皂苷提取率呈下降趋势。可能是溶剂太少不利于皂苷的溶出,溶剂太多导致非皂苷成分溶出增加,皂苷提取率下降。故选取液料比 15∶1、20∶1、25∶1(mL/g)进行响应面优化试验。
2.1.2 乙醇浓度对金盏菊皂苷提取率的影响
乙醇浓度对金盏菊皂苷提取率的影响见图2。

图2 乙醇浓度对金盏菊皂苷提取率的影响Fig.2 The effect of ethanol concentration on extraction rate of Calendula officinalis saponins
如图2所示,当乙醇浓度在30%~60%之间时,金盏菊皂苷提取率随乙醇浓度的升高而增大,当乙醇浓度为60%时,金盏菊皂苷提取率达到最大,为18.22 mg/g,之后随着乙醇浓度的升高,金盏菊皂苷的提取率反而降低,可能是由于随着乙醇浓度的增加,溶液的极性发生了变化,一些非皂苷成分的溶出增加,导致了提取率下降。因此选取乙醇浓度50%、60%、70%进行响应面试验。
2.1.3 微波功率对金盏菊皂苷提取率的影响
微波功率对金盏菊皂苷提取率的影响见图3。

图3 微波功率对金盏菊皂苷提取率的影响Fig.3 The effect of microwave power on extraction rate of Calendula officinalis saponins
如图3所示,随着微波功率的升高金盏菊皂苷提取率增大,是因为金盏菊中各个成分吸收的能量使分子的无规则热运动加强导致扩散速率增加,当微波功率为400 W时,金盏菊皂苷提取率为18.46 mg/g,达到最大,之后随着微波功率升高,金盏菊皂苷的提取率不升反而呈现小幅度下降,可能是因为高强度的微波作用产生过高的温度,导致了皂苷的降解。因此选取微波功率300、400、500 W进行响应面试验。
2.1.4 超声时间对金盏菊皂苷提取率的影响
超声时间对金盏菊皂苷提取率的影响见图4。

图4 超声时间对金盏菊皂苷提取率的影响Fig.4 The effect of ultrasonic time on extraction rate of Calendula officinalis saponins
由图4可知,超声时间在5 min~10 min内,随着超声时间的延长,皂苷提取率增加,超声时间为10 min时其提取率最高,达到18.23 mg/g。之后随着超声时间的延长,金盏菊皂苷的提取率变化不大,说明微波超声协同作用下能够提高提取率,超声10 min时皂苷成分基本全部溶出,随着超声时间的延长,溶出不再增加。因此选取5、10、15 min进行响应面试验。
2.2 响应面法优化结果与分析
2.2.1 模型建立及方差分析
利用Design-Expert.V8.0.6.1软件对所得数据进行响应面分析,响应面设计结果见表2。
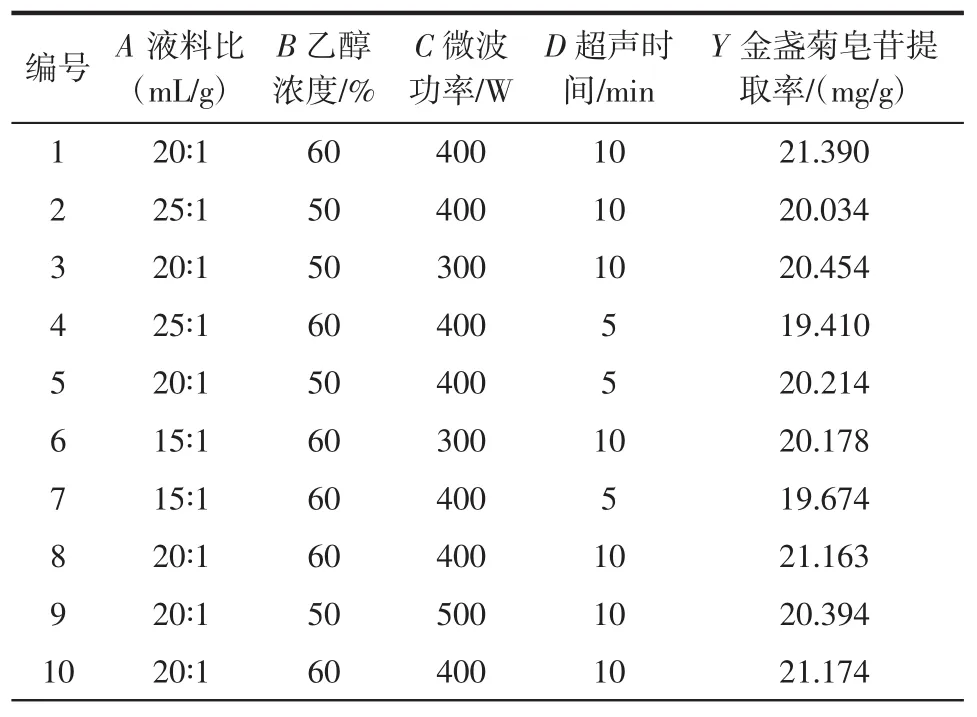
表2 响应面试验设计结果Table 2 Program and results of response surface method

续表2 响应面试验设计结果Continue table 2 Program and results of response surface method
经回归拟合后,得出模型的二次多项回归方程为Y=21.110 4-0.372 5A-0.517 7B+0.221 0C-0.223 2D-0.082 50AB+0.312 0AC-0.431 5AD+0.372 0BC+0.403 5 BD-0.7320CD-0.6753A2-0.6783B2-0.7128C2-1.2273D2。
对上述回归模型的方差及显著性分析结果见表3。
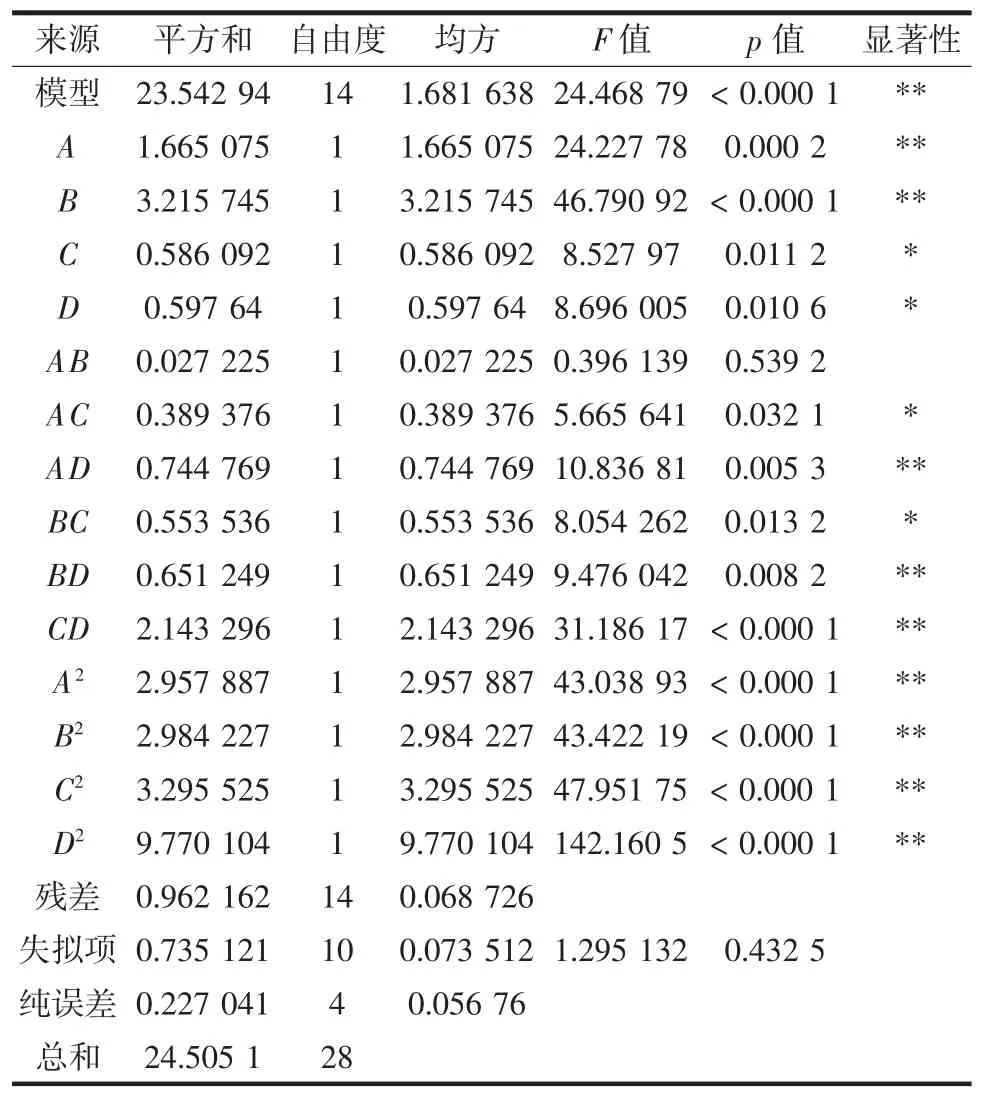
表3 模型回归方差分析结果Table 3 Variance analysis results of regression equation
由表3可知,模型的p<0.000 1,达到极显著性,失拟项的p值为0.432 5,不显著,表明该模型的拟合度良好,R2=0.960 7,表明有96.07%的试验数据可以运用该模型进行分析,试验误差小,模型的可靠性较高。因此,可用该模型分析和预测金盏菊皂苷的提取率。
由表3还可看出,模型中一次项A和B,二次项A2、B2、C2和 D2,交互项 AD、BD 和 CD 对金盏菊皂苷提取率影响极显著(p<0.01);一次项C和D,交互项AC和BC对金盏菊皂苷提取率影响显著(p<0.05),根据F值大小可以判断出各因素对金盏菊皂苷提取率的影响大小依次为B(乙醇浓度)>A(液料比)>D(超声时间)>C(微波功率)。
2.2.2 因素间交互作用分析
通过Design-Expert.v8.0.6.1软件绘制的响应面立体曲面图进一步分析和评价两个因素之间的交互作用,其曲面越陡峭,说明两个因素的交互作用越显著,各因素交互作用响应面图见图5。由图5可以看出,AD、BD和CD的交互作用对金盏菊皂苷提取率的影响极显著,这与表3的方差分析结果相一致。


图5 各因素交互作用对金盏菊皂苷提取率的影响Fig.5 Response surface plot and contour plot of the effects of each factor on the extraction rate of Calendula officinalis saponins
2.2.3 验证试验
由回归方程得到的金盏菊皂苷最佳提取工艺条件为液料比 19.08∶1(mL/g),乙醇浓度 56.10%,微波功率408.99 W,超声时间9.25 min。在此工艺条件下金盏菊皂苷提取率的预测值为21.272 mg/g。考虑到实际操作的可行性,将上述最佳工艺条件修正为液料比19∶1(mL/g),乙醇浓度 56%,微波功率 410 W,超声时间9.2 min,进行3次平行试验,得到金盏菊皂苷提取率平均值为21.298 mg/g,与理论预测值相差2.6%,说明由该模型优化的最佳提取工艺条件稳定可靠,具有实际应用价值。
2.3 金盏菊皂苷体外抗氧化活性测定结果
2.3.1 DPPH自由基清除能力
不同浓度的金盏菊皂苷对DPPH自由基的清除作用见图6。

图6 不同浓度的金盏菊皂苷对DPPH自由基的清除作用Fig.6 Scavenging ability of different concentration of Calendula officinalis saponins on DPPH
由图6可知,金盏菊皂苷和VC溶液对DPPH自由基的清除率随浓度的增加而逐渐增强,呈现明显的正相关性。金盏菊皂苷浓度为0.50 mg/mL时,其对DPPH自由基清除率达到61.36%,IC50为0.282 mg/mL,但弱于VC(IC50为0.028 mg/mL),表明金盏菊皂苷对DPPH自由基具有一定的清除能力及抗氧化活性。
2.3.2 ABTS+自由基清除能力
不同浓度的金盏菊皂苷对ABTS+自由基的清除作用见图7。
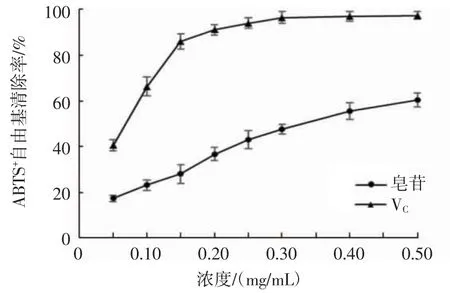
图7 不同浓度的金盏菊皂苷对ABTS+自由基的清除作用Fig 7 Scavenging ability of different concentration of Calendula officinalis saponins on ABTS+
由图7可知,金盏菊皂苷和VC溶液对ABTS+自由基的清除率随浓度的增加而逐渐增强。金盏菊皂苷浓度为0.50 mg/mL时,其对ABTS+自由基的清除率达到60.38%,IC50为0.337 mg/mL,但弱于VC(IC50为0.063 mg/mL),表明金盏菊皂苷对ABTS+自由基具有一定清除能力及抗氧化活性。
2.3.3 铁离子还原能力测定结果
FRAP法测定金盏菊皂苷还原能力如图8所示。
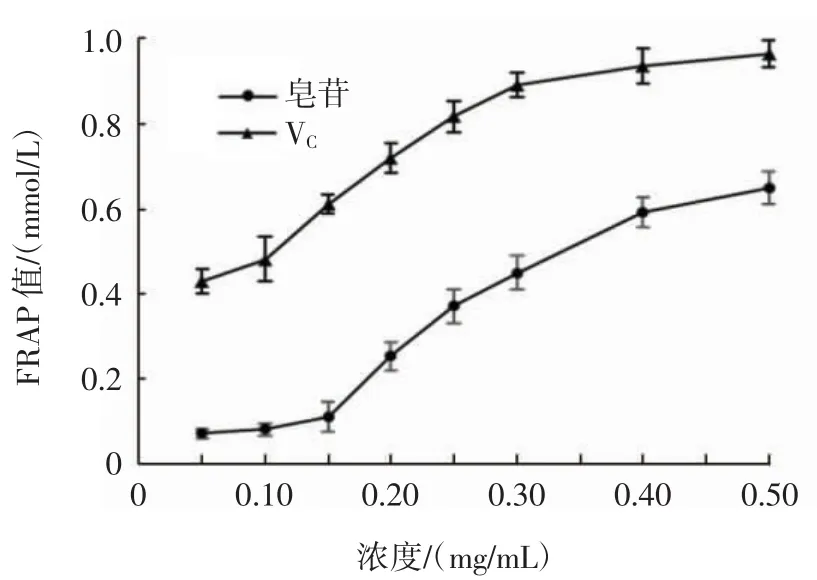
图8 不同浓度金盏菊皂苷的铁离子还原能力Fig 8 Reducing power of different concentration of Calendula officinalis saponins
由图8可知,FRAP法测定抗氧化活性有剂量依赖关系,在测定的浓度范围内,随着浓度的增加,金盏菊皂苷和VC的FRAP值增大,且呈一定的正相关,表明金盏菊皂苷具有一定的还原能力。
3 结论
本试验采用微波超声协同提取金盏菊皂苷,通过单因素试验和响应面优化得到的最佳提取工艺条件为液料比 19∶1(mL/g),乙醇浓度 56%,微波功率 410 W,超声时间9.2 min。在该条件下,金盏菊皂苷提取率为21.298 mg/g。抗氧化试验结果表明金盏菊皂苷对ABTS+自由基和DPPH自由基均具有良好的清除能力,且具有良好的还原能力和抗氧化活性。结果表明,微波超声联合提取金盏菊皂苷具有显著的协同作用,能够明显地缩短提取时间,提高提取效率。金盏菊资源丰富,具有多种有效成分,基于以上研究,金盏菊皂苷具有良好的清除自由基能力和抗氧化活性,为金盏菊的进一步开发和利用提供一定的理论依据。
