西达本胺治疗外周T细胞淋巴瘤中国专家共识(2016版)
2016-07-12中国临床肿瘤学会CSCO中国抗淋巴瘤联盟UCLI中华医学会血液学分会CSH白血病淋巴瘤学组中国抗癌协会血液肿瘤专业委员会中国抗癌协会淋巴瘤专业委员会
中国临床肿瘤学会(CSCO) 中国抗淋巴瘤联盟(UCLI) 中华医学会血液学分会(CSH)白血病·淋巴瘤学组中国抗癌协会血液肿瘤专业委员会 中国抗癌协会淋巴瘤专业委员会
西达本胺治疗外周T细胞淋巴瘤中国专家共识(2016版)
中国临床肿瘤学会(CSCO)中国抗淋巴瘤联盟(UCLI)中华医学会血液学分会(CSH)白血病·淋巴瘤学组中国抗癌协会血液肿瘤专业委员会中国抗癌协会淋巴瘤专业委员会
关键词西达本胺外周T细胞淋巴瘤临床研究不良反应
作者单位:哈尔滨血液病肿瘤研究所(哈尔滨市150010)
1 外周T细胞淋巴瘤概述
1.1 流行病学
外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)是一组高度异质性的淋巴细胞异常恶性增殖性疾病,包括来自胸腺起源的成熟T细胞及NK细胞肿瘤。PTCL的发病率具有明显的地域差异,在中国,PTCL发病例数约占非霍奇金淋巴瘤(NHL)的25%~30%[1-3],显著高于欧美国家的10%~15%[4-5]。
根据2008年WHO造血与淋巴组织肿瘤的分类标准,PTCL共包含22个亚型。我国最常见的亚型为结外NK/T细胞淋巴瘤(鼻型)28%、PTCL-非特指型20%,其他亚型包括T淋巴母细胞性淋巴瘤/白血病14%、血管免疫母细胞性T细胞淋巴瘤(AITL)12%、ALK阳性间变性大细胞淋巴瘤(ALCL,ALK+)7%和ALK阴性的ALCL(ALCL,ALK-)4%[3]。
1.2 治疗现状
目前PTCL尚无标准治疗方案。含蒽环类药物的化疗如CHOP和CHOP样方案是最常用的一线治疗方案。然而,除ALCLALK+外,CHOP或CHOP样方案对其他常见病理亚型的疗效较差,5年生存率仅30%[5-6]。一线及二线治疗方案的疗效均不满意,尤其是对蒽环类耐药的患者。因此,亟需可以改善生存的PTCL治疗方案。
根据2016年美国国立综合癌症网(NCCN)治疗指南[7],复发或难治性PTCL的二线治疗方案根据患者是否适合干细胞移植主要分为以下两类。
适合大剂量化疗联合造血干细胞移植的患者:首选临床试验。其他推荐治疗方案包括:1)联合化疗方案:DHAP、ESHAP、DA-EPOCH、GDP、Gemox以及ICE。2)单药:苯达莫司汀以及FDA近年批准的4种新药:普拉曲沙(pralatrexate)、罗米地辛(romidep⁃sin)、贝利司他(belinostat)和brentuximabvedotin(仅针对系统性ALCL及CD30+PTCL)。
不适用干细胞移植的患者:首选临床试验。其他推荐治疗方案:1)以易耐受的单药为主,包括上述FDA批准的4种新药以及阿伦单抗、硼替佐米、吉西他滨、环孢素(针对AITL)。2)放疗及DA-EPOCH也被推荐用于该类患者。
对于预后较差的结外NK/T细胞淋巴瘤(鼻型),近年来研究已证实含培门冬酶的化疗方案可取得较好的临床疗效[8-10]。其中,培门冬酶联合Gemox方案(P-Gemox)对初治或复发难治的NK/T细胞淋巴瘤均显示出突出的疗效[11]。
总之,传统化疗方案对于PTCL的疗效并不理想,随着临床研究进展,组蛋白去乙酰化酶(HDAC)抑制剂作为一种新型抗肿瘤药物,已在复发或难治性PTCL治疗中取得了显著成果,近年来已有3个HDAC抑制剂上市用于此适应证,包括美国FDA批准的罗米地辛(romidepsin)和贝利司他(belinostat),以及中国CFDA批准的西达本胺(chidamide,爱谱沙)。目前还有十余种HDAC抑制剂已在不同阶段的临床研发中。
2 国际已上市PTCL新药
2.1 单药临床研究
普拉曲沙(pralatrexate)为抗叶酸化疗药物,静脉推注给药。2009年9月美国FDA通过快速审批程序,批准该药为治疗PTCL的罕见病孤儿新药上市。入组111例复发或难治性PTCL患者的Ⅱ期临床试验结果显示[12],在可进行疗效评价109例患者中,普拉曲沙的客观缓解率(ORR)为26.6%。
罗米地辛是环四肽类的HDAC抑制剂,静脉滴注给药。于2011年6月美国FDA批准用于PTCL的二线治疗,主要是基于一项有131例复发或难治性PTCL患者参加的关键性Ⅱ期临床试验。结果显示[13],罗米地辛单药治疗的ORR为25.4%(33/130),完全缓解率为14.6%(19/130),中位缓解持续时间(DOR)为12个月。
贝利司他是一个羟肟酸类的HDAC抑制剂,亦为静脉滴注给药,于2014年7月美国FDA批准用于PTCL的二线治疗。贝利司他针对复发或难治性PTCL的Ⅱ期临床试验结果显示[14],在120例可评价患者中,贝利司他单药的ORR为25.8%,完全缓解率为10.8%,中位DOR 为8.4个月。
2.2 联合用药
2.2.1 罗米地辛作为HDAC非选择性抑制剂的罗米地辛,在与其他药物联合治疗PTCL方面已进行了较多探索,包括联合CHOP、ICE等化疗方案以及来那度胺单药等。
2.2.2 贝利司他同样作为HDAC非选择性抑制剂,其联合CHOP方案针对初治PTCL患者的Ⅰb期研究(n=23)已完成,初步研究结果显示[15],18例患者接受了全部6个周期的治疗,ORR为89%(16/18),其中完全缓解率为72%(13/18),部分缓解率为17%(3/18)。入组患者全部进行G-CSF预防性治疗。最常见的3/4级不良事件为血液学毒性,包括粒细胞减少(26%)和贫血(22%)。此联合方案作为PTCL一线治疗的地位即将在未来的Ⅲ期临床试验随机对照研究中进行验证。
2.2.3 普拉曲沙普拉曲沙与CEOP(环磷酰胺+依托泊苷+长春新碱+强的松)联合一线治疗PTCL的Ⅰ期临床试验正在进行中。
3 西达本胺
3.1 化学结构及作用机制
西达本胺是苯酰胺类HDAC亚型选择性抑制剂。其化学名称和结构如下:
化学名称:N-(2-氨基-4-氟苯基)-4-[N-[(E)-3-(3-吡啶)丙烯酰基]氨甲基]苯甲酰胺
化学结构式:

分子式:C22H19FN4O2
分子量:390.42
西达本胺主要针对第Ⅰ类HDAC中的1、2、3亚型和第Ⅱb类的10亚型,具有对肿瘤异常表观遗传功能的调控作用。通过抑制相关HDAC亚型以增加染色质组蛋白的乙酰化水平来引发染色质重塑,并由此改变多条信号传递通路基因表达(即表观遗传改变),进而抑制肿瘤细胞周期、诱导肿瘤细胞凋亡,同时对机体细胞免疫具有整体调节活性,诱导和增强自然杀伤细胞(NK)和抗原特异性细胞毒T细胞(CTL)介导的肿瘤杀伤作用[16-18]。西达本胺还通过调控表观遗传机制,诱导肿瘤干细胞分化、逆转肿瘤细胞的上皮间充质表型转化(EMT)等,进而在恢复耐药肿瘤细胞对药物的敏感性和抑制肿瘤转移、复发等方面发挥潜在作用[19-21]。
3.2 针对PTCL的主要研究结果
3.2.1 Ⅱ期临床试验研究西达本胺针对PTCL的新药上市申请基于两项临床试验,分别为探索性和关键性Ⅱ期临床试验。
在探索性Ⅱ期临床试验中,共入组19例复发或难治性PTCL患者,分为两组,其中一组(n=9)服药30mg/次,另一组(n=10)服药50 mg/次。两组患者均接受服药2次/周、服药2周后停药1周的给药方案,直至病情进展或者出现不能耐受的不良反应。并根据本阶段综合试验结果,推荐后续临床试验的给药方式和剂量为服药2次/周,30 mg/次,无停药休息周。
在关键性Ⅱ期临床试验(注册性临床试验)中,共入组83例复发或难治性PTCL患者,全部接受每次30 mg/次、2次/周的西达本胺片单药治疗,直至病情进展或者出现不能耐受的不良反应。在入组的患者中,79例病理诊断符合入选标准,进行疗效评价。试验的主要疗效指标为ORR。PTCL探索性Ⅱ期试验和关键性Ⅱ期试验的主要疗效结果见表1。
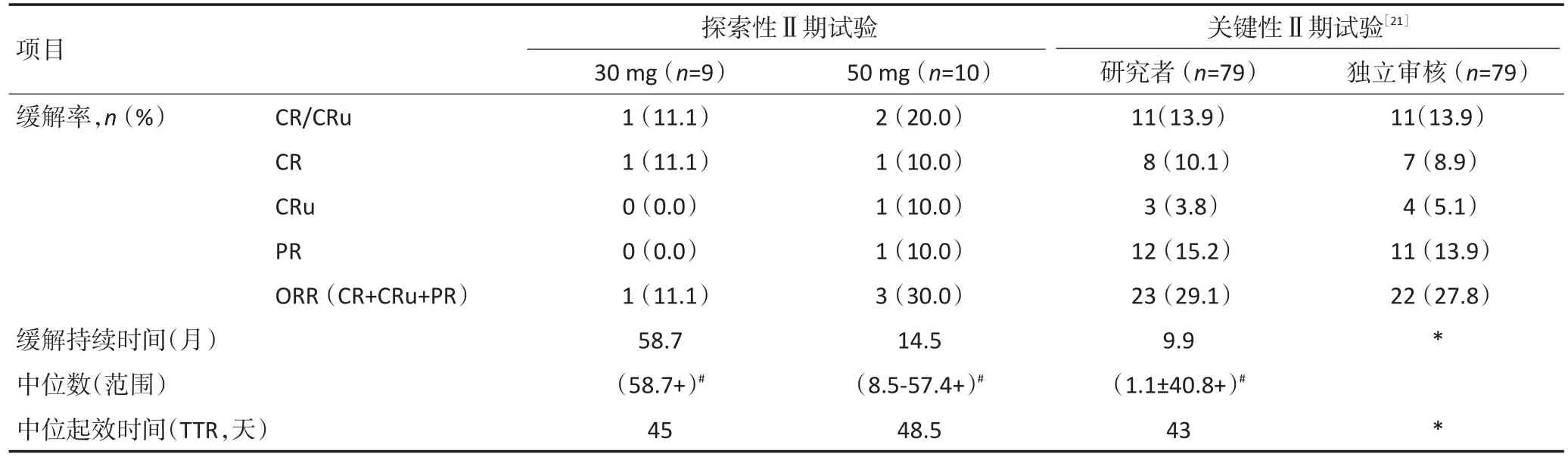
表1 PTCLⅡ期临床试验疗效结果Table 1 Efficacy from the phaseⅡstudy of Chidamide in relapsed or refractory PTCL

表1 PTCLⅡ期临床试验疗效结果(续表1)Table 1 Efficacy from the phaseⅡstudy of Chidamide in relapsed or refractory PTCL
安全性方面,关键性Ⅱ期临床试验显示,与西达本胺明确相关的不良反应以血液学不良反应为主。其他潜在的不良反应包括乏力、发热、食欲下降、胃肠道反应等。关键性Ⅱ期临床试验中≥5%患者发生的不良事件见表2。
3.2.2 针对PTCL常见亚型的临床试验在完成PTCL探索性和关键性Ⅱ期临床试验后,又开展了一项评价西达本胺片治疗复发或难治性PTCL常见亚型的临床试验研究,对西达本胺单药治疗PTCL四个主要亚型(PTCL-非特指型、结外NK/T细胞淋巴瘤-鼻型、间变性大细胞淋巴瘤,血管免疫母细胞T细胞淋巴瘤)的有效性和安全性进行评价,为上市后用药治疗进一步提供依据。试验中患者服用西达本胺2 次/周,30 mg/次,持续治疗,直到疾病进展或安全性原因退出。试验的主要疗效指标为缓解率。本试验在国内4家研究中心进行,共入组21例患者。已收集的20例患者的疗效评价结果:CR/CRu 10%,PR 20%,SD 45%,PD 25%,ORR 30%。不良反应均在可控范围内。
3.3 药代动力学
T细胞淋巴瘤患者口服30 mg西达本胺片后,体内达峰时间(Tmax)出现在2~6 h,血浆药物峰浓度(Cmax)50~150 ng/mL,服药时曲线下面积(AUC0-t)平均为(300~1 000 ng)×h/mL,终末消除半衰期(t1/2_z)平均约为17 h。与单次服药相比,第8次服药后的AUC0-t值平均升高1.8倍,未观察到连续服药后体内暴露量增加与安全性的关联性。相同剂量下,男性患者在单位体表面积/体重下的药物平均暴露量约为女性患者的60%。
不同患者单次口服30 mg西达本胺片后,药物的排出量及排出途径相似,服药后168 h(7天)尿液和粪便中西达本胺的总排泄量占服药量的80.2%± 9.5%,绝大部分的排出时间集中于前72 h。药物吸收后大部分经过肾脏由尿液排出体外,占总服药量的67.6%±12.7%。
西达本胺在临床推荐剂量浓度下,对人肝微粒体CYPs酶各主要亚型均无明显的直接抑制作用。西达本胺联合紫杉醇和卡铂以非小细胞肺癌为适应证的Ⅰ期临床研究结果显示,西达本胺对紫杉醇(CYP3A4的底物)的体内药代动力学参数无明显影响,紫杉醇或卡铂对西达本胺的体内动力学参数也无明显影响。西达本胺联合依西美坦以乳腺癌为适应证的临床研究结果显示,西达本胺对依西美坦(CYP3A4的底物)的体内药代动力学参数无明显影响,依西美坦对西达本胺的体内动力学参数也无明显影响。
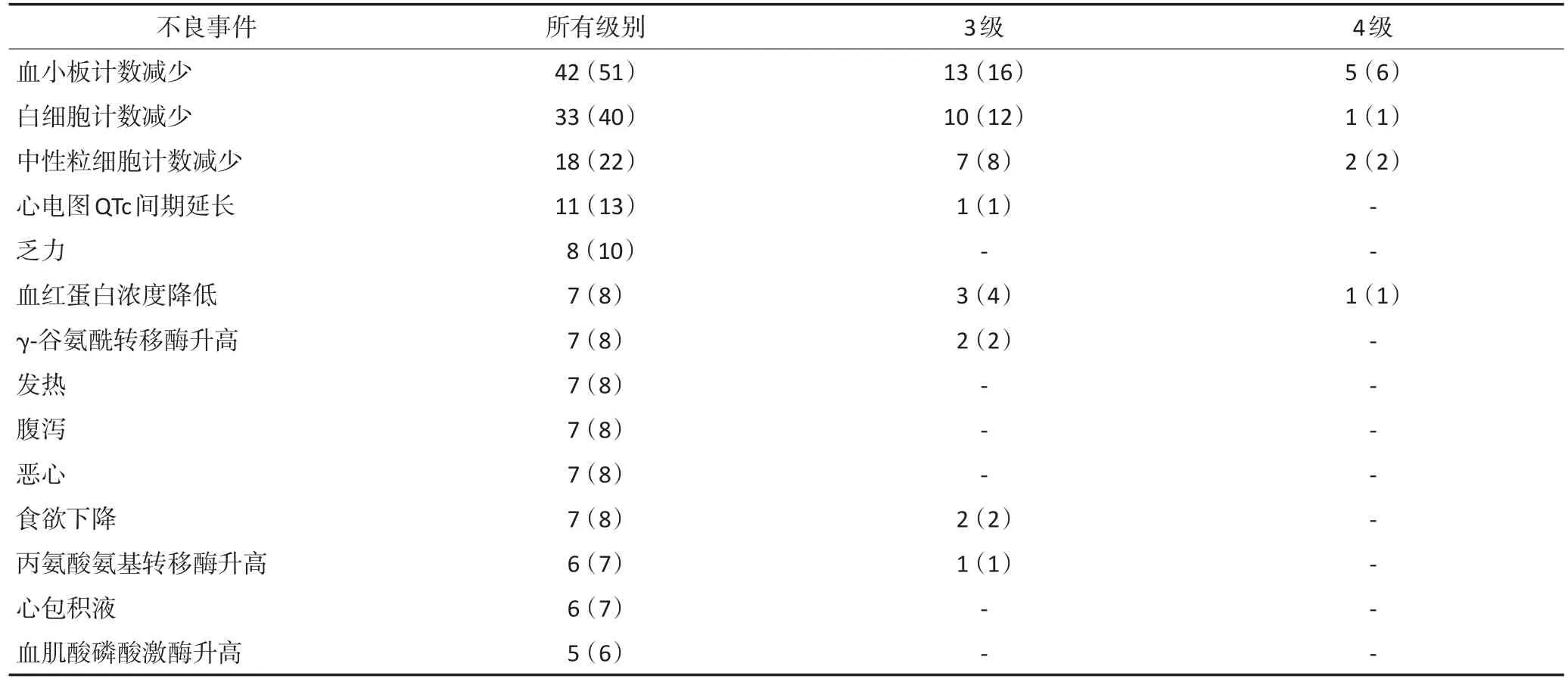
表2 西达本胺治疗PTCL关键性Ⅱ期临床试验≥5%患者发生的不良事件 n(%)(n=83)Table 2 Adverse events reported in at least 5% of patients from the pivotal phase II study of Chidamide in relapsed or refractory PTCL(n=83)

表2 西达本胺治疗PTCL关键性Ⅱ期临床试验≥5%患者发生的不良事件情况 n(%)(n=83)(续表2)Table 2 Adverse events reported in at least 5% of patients from the pivotal phase II study of Chidamide in relapsed or refractory PTCL(n=83)
4 西达本胺治疗PTCL的建议
4.1 单药治疗
4.1.1 复发或难治性患者采用西达本胺标准用药方法,即成人推荐服药30 mg/次,服药2次/周,2次服药间隔不应少于3天(如周一和周四、周二和周五、周三和周六等),早餐后30 min服用。若病情未进展或未出现不能耐受的不良反应,建议持续服药。
4.1.2 不能耐受常规化疗患者采用西达本胺标准用药方法,具体用药方法同4.1.1。
4.1.3 已获得疾病缓解或移植后患者维持治疗成人推荐服药20 mg/次,服药2次/周,2次服药间隔不应少于3天(如周一和周四、周二和周五、周三和周六等),早餐后30 min服用。连续服药,持续时间可为6~12个月。
4.2 与其他药物联合治疗
4.2.1 复发或难治性PTCL(NK/T淋巴瘤除外)
4.2.1.1 联合化疗方案标准剂量西达本胺+2/3剂量的ICE或DICE方案。联合ICE方案:西达本胺服药30 mg/次,服药2次/周,持续服药;异环磷酰胺0.8g/m2,d1~3;卡铂AUC3.3,d1~3;依托泊苷100mg/m2,d1~3。联合DICE方案:西达本胺每次服药30 mg,2次/周,持续服药;地塞米松10 mg,d1~3;异环磷酰胺1 g/m2,d1~3(美司钠解救);顺铂25 mg/m2,d1~3;依托泊苷60 mg/m2,d1~3。每21 d为1个周期,最长接受6~8个周期。
标准剂量西达本胺+PCT(泼尼松、环磷酰胺及沙利度胺)方案。西达本胺服药30 mg/次,服药2次/周,持续服药;泼尼松片20 mg/d,早餐后口服;环磷酰胺片50 mg/天,午餐后口服;沙利度胺片100 mg/天,晚餐后口服。28 d为1个治疗周期。
标准剂量西达本胺+PCE(泼尼松、环磷酰胺及依托泊苷)方案。西达本胺服药30 mg/次,服药2次/周,持续服药;泼尼松片20 mg/天,早餐后口服;环磷酰胺片为50 mg/天,午餐后口服;依托泊苷软胶囊50 mg/天,晚餐后口服。28天为1个治疗周期。
标准剂量西达本胺+DA-EPOCH方案。西达本胺服药30 mg/次,服药2次/周,持续服药;环磷酰胺750 mg/m2,d6;吡柔比星10 mg/m2,d1~4;长春新碱0.4 mg/m2,d1~4;依托泊苷50 mg/m2,d1~4;强的松100 mg,d1~5。21天为1个治疗周期,最长接受6~8个治疗周期。
4.2.1.2 联合非化疗单药方案采用标准剂量西达本胺联合沙利度胺。西达本胺服药30 mg/次,服药2 次/周,持续应用;沙利度胺服药200 mg/次,1次/天。28天为1个治疗周期。
采用标准剂量西达本胺联合来那度胺。西达本胺服药30 mg/次,服药2次/周,持续服药;来那度胺5~20 mg/天,口服,21天为1个治疗周期。
为了防止深部静脉血栓出现,可应用阿司匹林口服预防治疗。
4.2.2 复发或难治性NK/T细胞淋巴瘤患者采用标准剂量西达本胺联合改良Gemox或P-Gemox方案。
与改良Gemox方案联合:西达本胺服药30 mg/次,服药2次/周,持续服药;吉西他滨900 mg/m2,d1、d8;奥沙利铂80mg/m2,d1、d8,每21天为1个周期,最长接受6~8个周期。
与P-Gemox方案联合:西达本胺服药30 mg/次,服药2次/周,持续服药;吉西他滨800~1 000 mg/m2,d1,8;奥沙利铂130 mg/m2,d1;培门冬酶2 500 IU/m2,d2。21 d为1个治疗周期,最长接受6~8个治疗周期。
5 不良反应处理及注意事项
5.1 不良反应处理
5.1.1 单药治疗的不良反应处理血常规监测:用药期间需定期监测血常规(通常1~2次/周)。相关指标满足以下条件方可开始用药:中性粒细胞绝对值≥1.5×109/L,血小板≥75×109/L,血红蛋白≥9.0 g/dL。
血液学不良反应的处理和剂量调整:3级或4级中性粒细胞减少或缺乏症(中性粒细胞计数<1.0×109/L)时,暂停本品用药。若出现3级中性粒细胞减少伴体温高于38.5℃或4级中性粒细胞减少,则应予以G-CSF等细胞因子及抗感染治疗。应定期检测血常规(隔天1次或至少2次/周),待中性粒细胞绝对值恢复至≥1.5×109/L,并经连续2次检查确认,可继续本品治疗。如之前的不良反应为3级,恢复用药时可采用原剂量或剂量降低至20 mg/次;如之前的不良反应为4级,恢复用药时剂量应降低至20 mg/次。
3级或4级血小板减少(血小板计数<50.0×109/L)时,暂停本品用药,给予白介素11或促血小板生成素(TPO)治疗;如血小板计数<10.0×109/L或有出血倾向时,应考虑给予血小板输注治疗。应定期检测血常规(隔天1次或至少2次/周),待血小板恢复至≥75.0× 109/L,并经连续2次检查确认,可继续本品治疗:如之前的不良反应为3级,恢复用药时可采用原剂量或剂量降低至20 mg/次;如之前的不良反应为4级,恢复用药时剂量应降低至20 mg/次。
对于出血风险高的患者,为了预防治疗后血小板减少或保证治疗能够按照预定计划进行,可参考《肿瘤化疗所致血小板减少症诊疗中国专家共识2014版》,给予预防性应用TPO和(或)白介素11治疗。一般情况下,可在血小板最低值出现前10~14天注射300 U/kg,每日或隔日1次,连续7~10天。TPO最佳用药时间需要进一步探讨和尝试。
3级或4级贫血(血红蛋白降低至<7.0 g/dL):暂停本品用药,使用红细胞生成素(EPO)治疗;当血红蛋白<5.0 g/dL时,应给予成分输血。应定期检测血常规(隔天1次或至少2次/周),待血红蛋白恢复至≥8.0 g/dL,并经连续2次检查确认,可继续本品治疗。如之前的不良反应为3级,恢复用药时可采用原剂量或剂量降低至20 mg/次;如之前的不良反应为4级,恢复用药时剂量应降低至20 mg/次。
针对以上血液学不良反应进行处理和降低剂量后,若再次出现4级血液学不良反应或3级中性粒细胞减少或缺乏症伴体温高于38.5℃,应停止本品治疗,进行抗感染及G-CSF支持治疗。
非血液学不良反应的处理和剂量调整:若出现3级非血液学不良反应,应暂停用药并给予对症治疗。医生应根据具体不良反应,定期进行检查和监测,待不良反应缓解至≤1级时可恢复西达本胺用药,但剂量应降低至20 mg/次。如降低剂量后再次发生≥3级不良反应,应停止西达本胺治疗。用药过程中若出现4级非血液学不良反应,应停止本品治疗。
5.1.2 联合治疗的不良反应处理基于目前已有的临床试验数据,西达本胺引起的不良反应主要为血液学不良反应,表现为血小板减少、白细胞/中性粒细胞减少以及血红蛋白减少。非血液学不良反应主要表现为乏力和消化道反应,也有肝肾功能的实验室检查异常的报告。与其他HDAC抑制剂相关的非血液学不良反应如QTc间期延长、心包积液、感染、血栓形成等与西达本胺的相关性尚不确定。
在西达本胺联合化疗方案治疗时,如出现血液学不良反应,医生应根据患者的具体情况以及西达本胺和所联合的化疗药物的特点,对西达本胺及化疗药物与该不良反应的相关性进行分析,以确定是否调整西达本胺或化疗药物的剂量。如需调整则依据西达本胺单药治疗的剂量调整原则进行;如需调整化疗药物剂量则依据医疗实践常规进行。如出现非血液学不良反应,医生应综合具体情况对各药物与不良反应的相关性进行判断后,对相应药物剂量进行调整。
以下为西达本胺联合常用化疗方案时的不良反应处理方法:
标准剂量西达本胺+DA-EPOCH方案:1)出现4级中性粒细胞减少及缺乏症、3级中性粒细胞减少伴体温>38.5℃或3级血小板减少伴明显出血倾向暂停治疗,对症处理,待血液学毒性缓解至≤1级或治疗前水平时恢复用药。恢复用药时,需降低西达本胺和DA-EPOCH方案药物剂量,西达本胺剂量减少5mg/次,DA-EPOCH方案药物(环磷酰胺、阿霉素、依托泊苷)每次减少25%。2)出现≥3级非血液学毒性:根据非血液学不良事件与试验药物的相关性,暂停相应药物,无相关则继续治疗。待非血液学毒性缓解至≤1级或治疗前水平时恢复相应用药。恢复用药时,降低相应药物的剂量,西达本胺剂量减少5 mg/次,DAEPOCH方案相关药物每次减少25%。治疗过程中,若西达本胺剂量降低至10mg或者化疗方案中任一种药物剂量降低至初始剂量的50%后,仍出现耐受性问题,则停止治疗。
标准剂量西达本胺+P-Gemox方案:1)出现4级中性粒细胞减少、3级中性粒细胞减少伴体温>38.5℃或3度血小板减少伴明显出血倾向暂停治疗,对症处理,待血液学毒性缓解至≤1级或治疗前水平时恢复用药。恢复用药时,需降低后续治疗的西达本胺和P-Gemox方案药物剂量,西达本胺剂量减少5 mg/次,P-Gemox方案药物(吉西他滨、奥沙利铂)每次减少25%。2)出现≥3级非血液学毒性:根据非血液学不良事件与试验药物的相关性,暂停相应药物,不相关药物则继续治疗。待非血液学毒性缓解至≤1级或治疗前水平时恢复相应用药。恢复用药时,降低相应药物的剂量,西达本胺剂量减少5 mg/次,P-Gemox方案药物每次减少25%。治疗过程中,若西达本胺剂量降低至10 mg或者化疗方案中任一种药物剂量降低至初始剂量50%后,仍出现耐受性问题,则停止治疗。
5.2 注意事项
5.2.1 血液学不良反应服用西达本胺片治疗时,可能会出现血小板计数减少、白细胞计数减少、血红蛋白浓度降低等血液学不良反应。约75%的首次血液学不良反应出现在服药后的6周内。在服药过程中,建议每周进行1次血常规检查。当出现≥3级血液学不良反应时,应进行对症处理和暂停用药,至少隔天进行1次血常规检查,待相关血液学不良反应缓解至用药条件后可以恢复用药。
5.2.2 肝功能异常在西达本胺片单药治疗PTCL的探索性和关键性Ⅱ期临床试验中(n=102),观察到有部分患者出现肝功能检测指标异常。在服用本品前,如γ-GGT、ALT或AST>正常上限2.5倍,建议暂缓用药,待相关指标降至正常值时再进行首次药物服用。在用药过程中应至少每3周检测1次肝功能相关指标,若出现≥3级肝功能指标异常,需暂停用药,进行对症治疗,增加肝功能指标检查频率,直至不良反应缓解至≤1级或用药前水平,恢复用药时应减量使用。中/重度肝功能损伤患者应谨慎服用。对于活动性乙肝患者,参考《淋巴瘤免疫化疗乙型肝炎病毒再激活预防和治疗中国专家共识2014年》进行治疗。
5.2.3 肾功能异常在西达本胺片单药治疗PTCL的探索性和关键性Ⅱ期临床试验中(n=102),观察到有部分患者出现1级或2级肾功能检测指标异常。建议在用药过程中应至少每3周检测1次肾功能指标,若某一项肾功能检测指标出现≥3级异常情况,应暂停用药,进行对症处理,增加相关肾功指标检查频率,直至不良反应缓解至≤1级或用药前水平,恢复用药时应减量使用。中/重度肾功能损伤患者应谨慎服用。
5.2.4 高危血栓患者国际部分HDAC抑制剂临床研究中有导致静脉血栓的个案报道。在西达本胺单药治疗PTCL的探索性和关键性Ⅱ期临床试验中(n= 102),1例患者发生1级静脉血栓不良事件。目前尚不明确静脉血栓与服用西达本胺的关系。因T细胞淋巴瘤患者多为高龄且病情危重,对高危血栓患者可参考《肿瘤相关静脉血栓栓塞症的预防与治疗中国专家指南(2015版)》进行血栓预防及干预性治疗[22]。
5.2.5 EB病毒激活HDAC抑制剂对EB病毒(Ep⁃stein-Barr virus,EBV)具有一定的活化诱导作用。在一项罗米地辛单药治疗NK/T淋巴瘤的临床试验中发现部分患者出现EBV的再激活[23]。因此,对于EBV相关的血液肿瘤的治疗,应当注意对EBV的密切监测(如EBV-DNA拷贝数),必要时对服用西达本胺的EBV相关血液肿瘤患者进行抗病毒治疗。
本共识制定专家委员会成员
(按姓氏笔画排列)
执笔:
马军 哈尔滨血液病肿瘤研究所
石远凯中国医学科学院肿瘤医院
朱军 北京大学附属肿瘤医院淋巴瘤内科
李建勇江苏省人民医院血液内科
沈志祥上海交通大学医学院附属瑞金医院血液科
姜文奇中山大学附属肿瘤医院肿瘤内科
专家组成员:
王华庆天津市人民医院肿瘤科
王全顺中国人民解放军总医院(301医院)血液科
王季石贵州医科大学附属医院血液科
王鲁群山东大学齐鲁医院血液科
牛挺 四川大学华西医院血液科
白鸥 吉林大学第一医院肿瘤中心
冯继锋江苏省肿瘤医院肿瘤内科
刘林 重庆医科大学附属第一医院血液内科
刘霆 四川大学华西医院血液科
苏丽萍山西省肿瘤医院血液内科
苏航 中国人民解放军第307医院肿瘤科
李文瑜广东省人民医院肿瘤内科
李志铭中山大学附属肿瘤医院肿瘤内科
杨顺娥新疆肿瘤医院内科
吴德沛苏州大学附属第一医院血液内科
邱录贵中国医学科学院血液病医院淋巴肿瘤中心
沈建箴福建医科大学附属协和医院血液科
宋玉琴北京大学附属肿瘤医院淋巴瘤内科
宋永平河南省肿瘤医院血液科
张会来天津医科大学肿瘤医院肿瘤内科
张明智郑州大学第一附属医院肿瘤科
陈协群第四军医大学西京医院血液内科
林桐榆中山大学附属肿瘤医院肿瘤内科
金洁 浙江大学医学院附属第一医院血液科
周剑峰华中科技大学同济医学院附属同济医院血液科
周道斌北京协和医院血液内科
赵维莅上海交通大学医学院附属瑞金医院血液科
胡建达福建医科大学附属协和医院血液科
胡豫 华中科技大学同济医学院附属协和医院血液科
侯明 山东大学齐鲁医院血液科
侯健 上海长征医院血液内科
洪小南复旦大学附属肿瘤医院肿瘤内科
徐卫 江苏省人民医院血液内科
高玉环河北医科大学第四医院血液内科
郭晔 复旦大学附属肿瘤医院肿瘤内科
黄慧强中山大学附属肿瘤医院肿瘤内科
曹军宁复旦大学附属肿瘤医院肿瘤内科
蔡真 浙江大学医学院附属第一医院血液科
薛宏伟青岛大学附属医院肿瘤科
参考文献
[1] Yang QP, Zhang WY, Yu JB, et al.Subtype distribution of lymphomas in Southwest China:analysis of 6,382 cases using WHO classification in a single institution[J].Diagn Pathol, 2011, 6:77.
[2] Sun J, Yang Q, Lu Z, et al.Distribution of lymphoid neoplasms in China:analysis of 4,638 cases according to the World Health Organization classification[J].Am J Clin Pathol, 2012, 138(3):429-434.
[3] Li XQ, Li GD, Gao ZF, et al.Distribution pattern of lymphoma subtypes in China: A nationwide multicenter study of 10002 cases[J].Journal of Diagnostics Concepts & Practice, 2012, 11(2):111-115.[李小秋,李甘地,高子芬,等.中国淋巴瘤亚型分布:国内多中心性病例10002例分析[J].诊断学理论与实践,2012,11(2):111-115.]
[4] Hennessy BT, Hanrahan EO, Daly PA.Non-Hodgkin lymphoma:an update[J].Lancet Oncol, 2004, 5(6):341-353.
[5] Vose J, Armitage J, Weisenburger D.International peripheral T-cell and natural killer/T- cell lymphoma study:Pathology findings and clinical outcomes[J].J Clin Oncol, 2008, 26(25):4124-4130.
[6] Abouyabis AN, Shenoy PJ, Lechowicz MJ, et al.Incidence and outcomes of the peripheral T-Cell lymphoma subtypes in the United States[J].Leuk Lymphoma, 2008, 49(11):2099-2107.
[7] NCCN.The NCCN guidelines for Non-Hodgkin's lymphomas (version 2.2016)[EB/OL].Fort Washington: NCCN, 2016.http://www.nccn.org/professionals/physician_gls/f_guidelines.asp
[8] Wen JY, Li M, Li X, et al.Efficacy and tolerance of pegaspargasebased chemotherapy in patients with nasal-type extranodal NK/T-cell lymphoma:a pilot study[J].Asian Pac J Cancer Prev, 2014, 15 (15):6275-6281.
[9] Liu J, Tang Y, Chen YM, et al.Clinical study on pegaspargase combined with dexamethasone in the treatment of elderly patients with extranodal NK/T-cell lymphoma[J].China Oncology, 2013, 23 (4):298-301.[刘隽,唐勇,程毅敏,等.培门冬酶联合地塞米松治疗老年进展期结外NK/T细胞淋巴瘤的临床研究[J].中国癌症杂志,2013,23(4):298-301.]
[10] Reyes VE, Al-Saleem T, Robu VG, et al.Extranodal NK/T-cell lymphoma nasal type:efficacy of pegaspargase.Report of two patients from the United Sates and review of literature[J].Leuk Res, 2010, 34(1):e50-e54.
[11] Gao Y, Cai QC, Wang XX, et al.Efficacy and safety of pegaspargase with gemcitabine and oxaliplatin in patients with treatment-naïve, refractory extranodal natural killer/T-Cell lymphoma:a Single-Centre experience[J].Blood, 2013, 122(21):642.
[12] O'connor OA, Pro B, Pinter-Brown L, et al.Pralatrexate in patients with relapsed or refractory peripheral T-cell lymphoma:results from the pivotal PROPEL study[J].J Clin Oncol, 2011, 29(9):1182-1189.
[13] Coiffier B, Pro B, Prince HM, et al.Results from a pivotal,open-label, phase II study of romidepsin in relapsed or refractory peripheral T-cell lymphoma after prior systemic therapy[J].J Clin Oncol, 2012, 30(6):631-636.
[14] O'connor OA, Horwitz S, Masszi T, et al.Belinostat in patients with relapsed or refractory peripheral T-Cell lymphoma:results of the pivotal phase II BELIEF(CLN-19)study[J].J Clin Oncol, 2015, 33(23): 2492-2499.
[15] Johnston PB, Cashen AF, Nikolinakos PG, et al.Safe and effective treatment of patients with peripheral T-Cell lymphoma (PTCL) with the novel HDAC inhibitor, belinostat, in combination with CHOP: results of the Bel-CHOP phase 1 trial[J].Blood, 2015, 126(23):253-253.
[16] Ning ZQ, Li ZB, Newman MJ, et al.Chidamide (CS055/HBI-8000): a new histone deacetylase inhibitor of the benzamide class with antitumor activity and the ability to enhance immune cell-mediated tumor cell cytotoxicity[J].Cancer Chemother Pharmacol, 2012, 69(4): 901-909.
[17] Yao Y, Zhou J, Wang L, et al.Increased PRAME-Specific CTL killing of acute myeloid leukemia cells by either a novel histone deacetylase inhibitor chidamide alone or combined treatment with decitabine [J].PLoS One, 2013, 8(8):e70522.
[18] Gong K, Xie J, Yi H, et al.CS055(chidamide/HBI-8000),a novel histone deacetylase inhibitor,induces G1 arrest,ROS-dependent apoptosis and differentiation in human leukaemia cells[J].Biochem J, 2012, 443(3):735-746.
[19] Pan DS, Yang QJ, Fu X, et al.Discovery of an orally active subtype-selective HDAC inhibitor, chidamide, as an epigenetic modulator for cancer treatment[J].Med Chem Commun, 2014, 5(12):1789-1796.
[20] Zhou Y, Pan DS, Shan S, et al.Non-toxic dose chidamide synergistically enhances platinum- induced DNA damage responses and apoptosis in Non-Small-Cell lung cancer cells[J].Biomed Pharmacother, 2014, 68(4):483-491.
[21] Shi Y, Dong M, Hong X, et al.Results from a multicenter,open-label, pivotal phase II study of chidamide in relapsed or refractory peripheral T-cell lymphoma[J].Ann Oncol, 2015, 26(8):1766-1771.
[22] Ma J, Wu YL, Qin SK, et al.Chinese guidline on prevention and treatment of tumour-associated venous thromboembolism (2015 version)[J].Chin J Clin Oncol, 2015, 42(20):979-991.[马军,吴一龙,秦叔逵,等.肿瘤相关静脉血栓栓塞症的预防与治疗中国专家指南(2015版)[J].中国肿瘤临床,2015,42(20):979-991.]
[23] Kim SJ, Kim JH, Ki CS, et al.Epstein–Barr virus reactivation in extranodal natural killer/T-cell lymphoma patients:a previously unrecognized serious adverse event in a pilot study with romidepsin[J].Ann Oncol, 2016, 27(3):508-513.
(2016-03-02收稿)
(2016-03-20修回)
·基础研究·
doi:10.3969/j.issn.1000-8179.2016.08.239
通信作者:马军majun0322@126.com
