小鼠三阴性乳腺癌干样细胞对EMT发生及其生物学行为的影响*
2016-07-12刘加蒙孙保存孙慧誌张丹芳林贤李岩磊古强董学易刘芳
刘加蒙孙保存 孙慧誌张丹芳林贤李岩磊古强② 董学易② 刘芳②
小鼠三阴性乳腺癌干样细胞对EMT发生及其生物学行为的影响*
刘加蒙①孙保存①②③孙慧誌①张丹芳①林贤①李岩磊①古强①②董学易①②刘芳①②
摘要目的:探讨TA2小鼠三阴性乳腺癌中乙醛脱氢酶1+(ALDH1+)和CD133+表型的乳腺癌干样细胞在上皮间充质转化(EMT)发生中的作用,及对其生物学行为的影响。方法:使用流式细胞术分析TA2小鼠三阴性乳腺癌组织中ALDH1及CD133的表达量并分选出具有ALDH1+、ALDH1-、CD133+、CD133-表型的乳腺癌细胞,将其分别接种于TA2小鼠,根据细胞表型不同设置为AL⁃DH1+、ALDH1-,CD133+、CD133-组,观察肿瘤生长情况,并制成组织切片,行三阴性乳腺癌中乳腺癌干细胞表面标记物ALDH1、CD133与EMT相关蛋白Twist1、E-cadherin和VE-cadherin的免疫组织化学检测,分析其表达差异。结果:乳腺癌干细胞标记物ALDH1及CD133在TA2小鼠三阴性乳腺癌中表达率分别为31.2%和6.5%。ALDH1+、CD133+组肿瘤生成能力明显强于ALDH1-、CD133-组。免疫组织化学结果显示ALDH1、Twist1、VE-cadherin在ALDH1+组的表达明显高于ALDH1-组(均P<0.05),E-cadherin 在ALDH1+组的表达低于ALDH1-组(P<0.05)。CD133、Twist1、VE-cadherin在CD133+组的表达明显高于CD133-组(均P<0.05),E-cadherin在CD133+组的表达低于CD133-组(P<0.05)。结论:TA2小鼠三阴性乳腺癌中ALDH1+和CD133+表型的乳腺癌干样细胞可影响EMT相关蛋白的表达,并促进三阴性乳腺癌的形成。
关键词三阴性乳腺癌上皮间充质转化肿瘤干样细胞ALDH1 CD133流式细胞术
作者单位:①天津医科大学病理教研室(天津市300070);②天津医科大学总医院病理科;③天津医科大学肿瘤医院病理科
*本文课题受国家自然科学基金项目(编号:81230050)和天津医科大学科学基金(编号:2011ky34)资助
乳腺癌是一种常见恶性肿瘤,发病率高居女性肿瘤患者首位,严重威胁女性健康,研究乳腺癌的发生及发展具有重要的意义[1]。三阴性乳腺癌是乳腺癌的特殊类型,其特点为ER、PR、HER-2均为阴性。三阴性乳腺癌与其他类型相比,恶性程度更高,侵袭能力更强,更易发生内脏以及神经系统的转移,易复发,因缺乏特殊的治疗靶点,三阴性乳腺癌患者预后更差,生存期更短[2]。最新的研究表明,乳腺癌干细胞通过其自身的塑形能力在上皮间充质转化(EMT)过程中发挥重要作用,并影响肿瘤的转移和发展[3]。
目前对于乳腺癌干样细胞在三阴性乳腺癌生长机制的研究较少。本研究采用TA2小鼠三阴性乳腺癌作为研究对象,探讨乳腺癌干样细胞在三阴性乳腺癌EMT发生中的作用,及对TA2小鼠三阴性乳腺癌生物学行为的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组动物模型选取正常4~5周龄TA2雌鼠80只,体质量23~25 g,购自天津医科大学实验动物中心,实验动物饲养于清洁级环境内。TA2小鼠肿瘤组织来自本实验室培育的TA2三阴性乳腺癌小鼠。本实验遵从动物伦理学条例。将80只TA2小鼠随机分为ALDH1组和CD133组,每组40只;ALDH1组和CD133组分别根据接种细胞表型的不同,随机分为ALDH1+组和ALDH1-组、CD133+组和CD133-组,每组20只;再根据细胞浓度5×105、1×106、2×106、4×106/mL随机分为4组,每组5只。取流式细胞术分选细胞表型为ALDH1+、ALDH1-、CD133+、CD133-的单细胞悬液0.1 mL接种每只小鼠鼠蹊部。
TA2小鼠由天津医科大学自主培育和筛选,具有高自发乳腺癌特性,TA2小鼠乳腺癌组织中不表达ER、PR、HER-2,表现出人三阴性乳腺癌的特征,是研究三阴性乳腺癌的良好的动物模型。本实验室将自发性乳腺癌TA2小鼠外周血的肿瘤栓子注射至正常小鼠腹腔中,筛选并扩增乳腺癌转移细胞,建立三阴性乳腺癌动物模型,在原代培养中呈现悬浮不贴壁的状态,具有肿瘤干样细胞特征[4]。
1.1.2 试剂ALDEFLUOR干细胞分选试剂盒购自加拿大Stemcells Technologies公司。CD133-PE抗体购自德国Miltenyi公司。CD133抗体购自英国Biorbyt公司,ALDH1抗体购自美国LSBio公司,Twist1抗体购自美国Santa Cruz公司,E-cadherin抗体购自英国Abcam公司。
1.2 方法
1.2.1 流式细胞术制备TA2小鼠三阴性乳腺癌单细胞悬液,浓度调整至1×106/mL,采用ALDEFLUOR干细胞分选试剂盒分选ALDH1+表型的细胞。设置对照管和实验管各15个,对照管加入1 mL细胞悬液,实验管中加入5 μL ALDEFLUORTMDEAB试剂、再加入5 μL已活化的ALDEFLUORTM,迅速取实验管中混合液体0.5 mL加入对照管中,37℃孵育30 min、1 600 r/min离心5 min后重悬,行流式细胞术分选,并收集ALDH1+和ALDH1-表型的细胞。CD133+表型的细胞分选采用CD133-PE抗体标记,将重悬的单细胞悬液浓度调整至1×108/mL,加入稀释的CD133-PE抗体(1∶11),4℃冰箱孵育20 min后,1 mL PBS重悬后3 500 r/min离心5 min,行流式细胞检测及分选,并收集CD133+和CD133-表型的细胞。
1.2.2 TA2小鼠成瘤实验将分选后的肿瘤组织制成单细胞悬液,浓度调整至5×105、1×106、2×106、4× 106/mL,取单细胞悬液0.1 mL接种每只TA2小鼠鼠蹊部皮下。每天观察肿瘤生长情况并测量肿瘤大小,待小鼠肿瘤组织长至1 cm×1 cm×1 cm大小时处死,将切下的肿瘤组织固定包埋,并制成切片。肿瘤体积计算公式为TV=1/2×a×b2(TV为肿瘤体积、a为肿瘤的长径、b为肿瘤的宽径)。
1.2.3 免疫组织化学染色组织切片采用SP法,行二甲苯脱蜡、梯度酒精水化、3%过氧化氢灭活内源性过氧化物酶,抗原微波修复10 min,血清封闭后加入稀释的一抗ALDH1(1:1 000)、CD133(1:500)、Twist (1:500)、E-cadherin(1:500)、VE-cadherin(1:100),4℃冰箱过夜,次日加入山羊抗兔二抗、DAB显色。苏木素复染细胞核,脱水、透明、封片,显微镜下观察实验结果,并拍照。肿瘤组织中阳性细胞表达为棕黄色或黄褐色,每例标本选择含有阳性细胞的10个高倍视野(×400),分别计数100个肿瘤细胞,并计算阳性细胞在计数肿瘤细胞中所占百分率的均值,按照阳性细胞在计数肿瘤细胞中所占百分率的均值±标准差评价染色结果。
1.3 统计学分析
2 结果
2.1 ALDH1和CD133在TA2小鼠三阴性乳腺癌组织中表达
对TA2小鼠三阴性乳腺癌的单细胞悬液行流式细胞术分析显示,ALDH1表达量为31.2%,CD133表达量为6.5%(图1)。
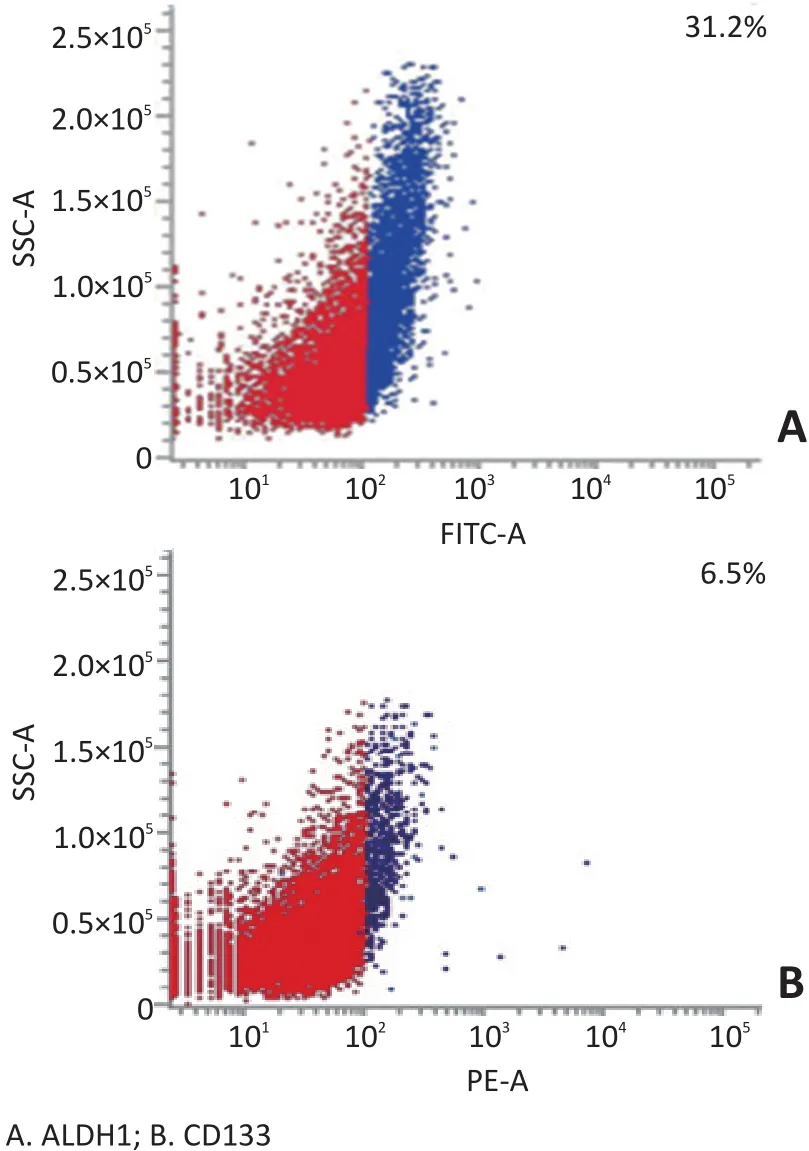
图1 TA2小鼠三阴性乳腺癌流式细胞术结果Figure 1 Result of flow cytometry in TA2 mice triple negative tumor
2.2 不同表型和细胞量的接种小鼠成瘤情况
将流式细胞术分选后的肿瘤细胞,分别按照5× 105、1×106、2×106、4×106/mL细胞浓度,取0.1 mL分选后的单细胞悬液接种每只TA2小鼠体内后,结果发现TA2小鼠接种细胞浓度5×105、1×106、2×106/mL组中,ALDH1-和CD133-组均不能形成肿瘤。接种细胞浓度4×106/mL组中,ALDH1+组成瘤率为100%(5/5)、ALDH-组成瘤率为60%(3/5),CD133+组成瘤率为100%(5/5)、CD133-组成瘤率为60%(3/5),见表1。ALDH1+组和CD133+组的肿瘤生成速度明显高于对照组(P<0.05,图2)。

表1 ALDH1+、ALDH1-、CD133+、CD133-组中接种不同细胞浓度的TA2小鼠成瘤情况比较 (cells/mL)Table 1 Situation of outgrowths in TA2 mice generated by cells with different concentrations in ALDH1+, ALDH1−, CD133+, and CD133−groups (cells/mL)
2.3 ALDH、CD133对EMT相关蛋白Twist1、E-cad⁃herin以及VE-cadherin表达的影响
免疫组织化学染色显示ALDH1分布于肿瘤细胞的胞质,CD133分布于细胞膜与胞质,Twist1在细胞核和细胞质中表达,E-cadherin在细胞膜中表达,VE-cadherin在胞质中表达。ALDH1+组中ALDH1、Twist1、VE-cadherin表达明显高于ALDH1-组,ALDH1+组中E-cadherin表达低于ALDH1-组,差异具有统计学意义(均P<0.05,图3);CD133+组中CD133、Twist1、VE-cadherin表达明显高于CD133-组,CD133+组中E-cadherin表达低于CD133-组,差异具有统计学意义(均P<0.05,图4)。

图2 TA2小鼠乳腺癌移植瘤生长曲线图Figure 2 Tumor growth curve of TA2 mice transplantation tamor of breast cancer
3 讨论
肿瘤干细胞作为肿瘤细胞中一种数量稀少的亚型,拥有无限的自我更新、多向分化、以及对放疗、化疗抵抗的能力。肿瘤干细胞首先发现于急性髓性白血病,随后在乳腺癌、肝癌、胰腺癌等肿瘤中陆续发现,肿瘤干细胞在肿瘤的发生以及发展中发挥着重要的作用。
乳腺癌干细胞是实体瘤中最早发现的肿瘤干细胞,NOD/SCID小鼠移植瘤研究中发现,仅200个CD44+CD24-/ESAlow标记的肿瘤细胞即可形成肿瘤,从而证实了乳腺癌干细胞的存在[5]。乳腺癌干细胞的检测和分离通过如CD44+CD24-、CD133+和ALDH1+表型的细胞也可作为乳腺癌干细胞分选的指标。
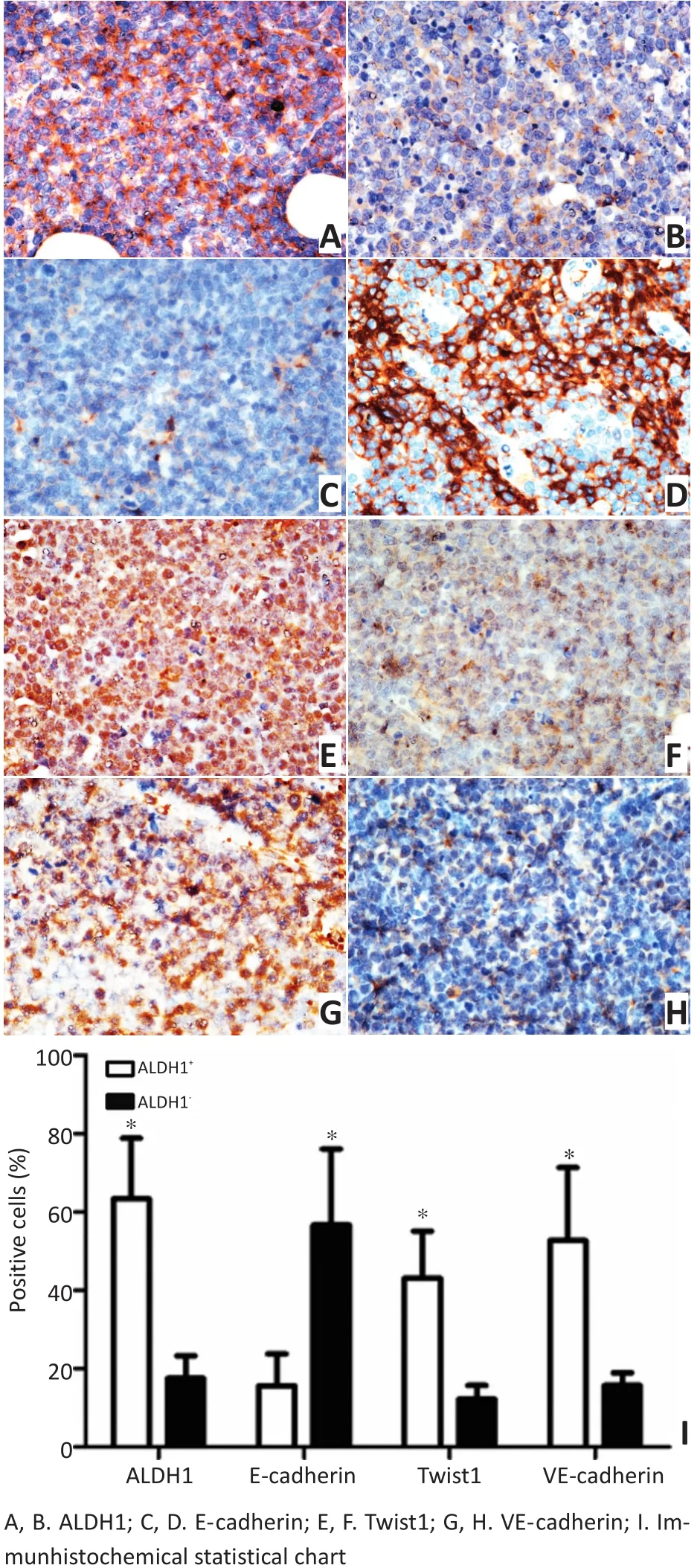
图3 免疫组织化学染色检测ALDH1+组和ALDH1-组中ALDH1、E-cadherin、Twist1和VE-cadherin的表达(SP法×400)Figure 3 Immunohistochemical staining of ALDH1, E-cadherin, Twist1, and VE-cadherin in ALDH1+and ALDH1−groups (SP staining×400)

图4 免疫组织化学染色检测CD133+组和CD133-组中CD133、E-cadherin、Twist1和VE-caherin的表达(SP法×400)Figure 4 Immunohistochemical staining of CD133, E-cadherin, Twist1, and VE-cadherin in the CD133+and CD133−groups (SP staining×400)
本研究课题组曾报道在三阴性乳腺癌细胞系MAD-MB-231中CD133+表型的细胞具有肿瘤干细胞特性,并且与肿瘤血管生成和血管生成拟态密切相关[6]。ALDH1也被证实为肿瘤干细胞标志物[7],ALDH1表达的乳腺癌患者的预后更差,转移率和耐药性更高,在化疗耐药方面也起着重要的作用[8]。本研究流式细胞术分析结果证实,在TA2小鼠三阴性乳腺癌中存在乳腺癌干样细胞。将流式细胞术分选细胞表型为ALDH1+、ALDH1-、CD133+、CD133-的肿瘤细胞接种TA2小鼠后,ALDH1+、CD133+组肿瘤形成能力和生长速度明显高于ALDH1-、CD133-组,说明乳腺癌干样细胞在三阴性乳腺癌的形成及发展中发挥着重要的作用。
在肿瘤干细胞的研究中,已发现多种可调控肿瘤干细胞的通路,如Wnt、Notch、TGF-β,这些通路不但在正常组织的发育和形成中发挥着重要的作用,而且也参与了肿瘤生长中EMT的过程[9]。E-cadherin的减少是EMT过程中最重要的部分,E-cadherin的丢失导致了紧密连接的上皮细胞失去了细胞间黏附的作用,提高了细胞的迁移和侵袭能力。在上皮性卵巢癌研究中发现,CD133+表型的肿瘤干细胞中E-cadherin蛋白呈低表达[10],在CD44+CD24-表型的乳腺癌干细胞中EMT相关转录因子Twist1、Snail、ZEB2表达升高,侵袭转移和血管生成能力更强[11],这说明肿瘤干细胞可通过诱导EMT相关转录因子而促进EMT过程。
肿瘤干细胞可通过EMT促进肿瘤的形成和转移,同时EMT也可影响肿瘤干细胞的表达。有研究证实,在EMT相关转录因子Twist1的作用下,细胞在发生EMT的同时有干样特征的增强,EMT可促进肿瘤细胞向干样特征转化[12]。在肝癌细胞系研究中发现,敲除CD44可抑制肝癌细胞的迁移和侵袭能力,并逆转EMT过程[13],在高表达CD133的胰腺癌细胞研究中,NF-κB蛋白表达增强,NF-κB蛋白可通过影响其下游因子Twist1蛋白[14]。这些均表明肿瘤干细胞在EMT过程中发挥着重要作用。
本研究免疫组织化学结果显示,ALDH1+组肿瘤组织中ALDH1以及EMT调节蛋白Twist1表达高于ALDH1-组,而ALDH1+组中EMT重要表型蛋白E-cadherin表达低于ALDH1-组;CD133+组中CD133、Twist1表达高于CD133-组,CD133+组中E-cadherin表达低于CD133-组。证实了在三阴性乳腺癌中ALDH1+和CD133+表型的肿瘤干样细胞可影响EMT相关蛋白的表达,可能是通过NF-κB通路影响其靶基因Twist1的表达继而影响EMT。另外在ALDH1+和CD133+组中VE-cadherin蛋白表达升高,本研究课题组曾报道Twist1可与VE-cadherin的启动子区域结合并促使其转录,并且VE-cadherin可促进肿瘤的转移和血管拟态的生成[15]。以上结果进一步说明了肿瘤干样细胞可能通过影响肿瘤细胞中EMT调控蛋白Twist1的表达,继而影响VE-cadherin的表达,并参与血管拟态生成的过程。
综上所述,本研究发现ALDH1+和CD133+表型的肿瘤干样细胞可促进三阴性乳腺癌的生长,并影响三阴性乳腺癌中EMT相关蛋白的表达。乳腺癌干样细胞和EMT之间具体分子通路的相互作用关系还需更进一步的研究。
参考文献
[1] Siegel RL, Miller KD, Jemal A.Cancer statistics, 2015[J].CA Cancer J Clin, 2015, 65(1):5-29.
[2] Abramson VG, Lehmann BD, Ballinger TJ, et al.Subtyping of triplenegative breast cancer: implications for therapy[J].Cancer, 2015, 121(1):8-16.
[3] Wang SS, Jiang J, Liang XH, et al.Links between cancer stem cells and epithelial-mesenchymal transition[J].Onco Targets Ther, 2015, 8:2973-2980.
[4] Zhang DF.Clinical and pathological characteristics of triple-negative breast cancer and a relative mouse model research[D].Tianjin: Tianjin Medical University, 2009:53-69.[张丹芳.三阴乳腺癌临床病理及其相关动物模型研究[D].天津:天津医科大学,2009:53-69.]
[5] Al-Hajj M, Wicha MS, Benito-Hernandez A, et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci U S A, 2003, 100(7):3983-3988.
[6] Liu TJ, Sun BC, Zhao XL, et al.CD133+cells with cancer stem cell characteristics associates with vasculogenic mimicry in triple-negative breast cancer[J].Oncogene, 2013, 32(5):544-553.
[7] Ginestier C, Hur MH, Charafe-Jauffret E, et al.ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome[J].Cell Stem Cell, 2007, 1(5):555-567.
[8] Mansour SF, Atwa MM.Clinicopathological significance of CD133 and ALDH1 cancer stem cell marker expression in invasive ductal breast carcinoma[J].Asian Pac J Cancer Prev, 2015, 16(17):7491-7496.
[9] Liu S, Cong Y, Wang D, et al.Breast cancer stem cells transition between epithelial and mesenchymal states reflective of their normal counterparts[J].Stem Cell Reports, 2013, 2(1): 78-91.
[10] Yu L, Zhou L, Wu SW, et al.Expressions of CD133, E-cadherin, and Snail in epithelial ovarian cancer and their clinicopathologic and prognostic implications[J].J South Med Univ, 2015, 35(9):1297-1302.[俞岚,周蕾,武世伍,等.上皮性卵巢癌中CD133与EMT相关因子表达的关系[J].南方医科大学学报,2015,35(9):1297-1302.]
[11] Luo M, Brooks M, Wicha MS.Epithelial-mesenchymal plasticity of breast cancer stem cells: implications for metastasis and therapeutic resistance[J].Curr Pharm Des, 2015, 21(10):1301-1310.
[12] Mani SA, Guo W, Liao MJ, et al.The epithelial-mesenchymal transition generates cells with properties of stem cells[J].Cell, 2008, 133 (4):704-715.
[13] Gao Y, Ruan B, Liu W, et al.Knockdown of CD44 inhibits the invasion and metastasis of hepatocellular carcinoma both in vitro and in vivo by reversing epithelial-mesenchymal transition[J].Oncotarget, 2015, 6(10):7828-7837.
[14] Nomura A, Banerjee S, Chugh R, et al.CD133 initiates tumors, induces epithelial-mesenchymal transition and increases metastasis in pancreatic cancer[J].Oncotarget, 2015, 6(10):8313-8322.
[15] Sun T, Zhao N, Zhao XL, et al.Expression and functional significance of Twist1 in hepatocellular carcinoma: its role in vasculogenic mimicry[J].Hepatology, 2010, 51(2):545-556.
(2016-01-04收稿)
(2016-03-30修回)

Influence of stem-like cells on EMT occurrence in mice with triple-negative breast cancer and on their biological behavior
Jiameng LIU1, Baocun SUN1,2,3, Huizhi SUN1, Danfang ZHANG1, Xian LIN1, Yanlei LI1, Qiang GU1,2, Xueyi DONG1,2, Fang LIU1,2
Correspondence to: Baocun SUN; E-mail: sunbaocun@aliyun.com
1Department of Pathology, Tianjin Medical University, Tianjin 300070, China;2Department of Pathology, Tianjin Medical University General Hospital, Tianjin 300052, China;3Department of Pathology, Tianjin Medical University Cancer Institute and Hospital, Tianjin 300060, China
This work was supported by the Key Project of the National Science Foundation of China (No.81230050) and the Foundation of Tianjin Medical University (No.2011ky34)
AbstractObjective: To discuss the influence of ALDH1+and CD133+phenotypic breast cancer stem-like cells in TA2 triple negative breast cancer on promoting epithelial-mesenchymal transition (EMT) occurrence in TA2 mice with triple-negative breast cancer and on their biological behavior.Methods: Flow cytometry was performed to analyze the markers ALDH1 and CD133 in TA2 mice triple negative breast cancer and breast cancer stem-like cells with ALDH1+, ALDH1−, CD133+, and CD133−phenotypes, which were sorted out.Then, the TA2 mice were inoculated with sorted tumor cells according to cell type.The mice were divided into ALDH1+, ALDH1−, CD133+, and CD133-groups.The tumor-growing conditions were observed.A tumor tissue was sliced for the immunohistochemical testing of ALDH1−, CD133−, and EMT-related Twist1, E-cadherin, and VE-cadherin proteins.The expression difference of breast cancer stem cell surface markers ALDH1 and CD133 in triple-negative breast cancer and EMT-related proteins Twist1, E-cadherin, and VE-cadherin was analyzed.Results: The expression rates of breast cancer stem cell markers ALDH1 and CD133 in TA2 mice triple negative breast cancer were 31.2% and 6.5%, respectively.The tumor growth ability of TA2 mice from ALDH1+group was obviously stronger than that from ALDH1−group.The CD133+group was evidently stronger than CD133−group.The immunohistochemical results showed that ALDH1, Twist1, and VE-cadherin expression levels in the ALDH1+group were evidently higher than that in the ALDH1−group (all P<0.05).E-cadherin expression decreased (P<0.05).CD133−, Twist1, and VE-cadherin expression levels in CD133+group were higher than that in CD133−group (all P<0.05).Conclusion: In TA2 mice triple negative breast cancer, ALDH1+and CD133+phenotypic breast cancer stem-like cells may influence the expression of EMT-related proteins, and promote the formation of triple-negative breast cancer.
Keywords:triple-negative breast cancer, epithelial-mesenchymal transition, cancer stem-like cells, aldehyde dehydrogenase 1, CD133, flow cytometry
doi:10.3969/j.issn.1000-8179.2016.08.003
通信作者:孙保存sunbaocun@aliyun.com
作者简介
刘加蒙专业方向为肿瘤病理学。E-mail:paladinbbc@163.com
·临床研究与应用·
