腹腔镜下往复式右半结肠D3/CME根治术
2016-07-12邓祥兵孟文建魏明天杨廷翰王存杨烈王自强
邓祥兵 孟文建 魏明天 杨廷翰 王存 杨烈 王自强
•经验交流•
腹腔镜下往复式右半结肠D3/CME根治术
邓祥兵 孟文建 魏明天 杨廷翰 王存 杨烈 王自强
【摘要】目的 随着腹腔镜右半结肠D3/CME根治手术逐渐成为发展趋势,为更好克服D3根治术SMV前方淋巴结清扫的困境,本文介绍一种易于操作的往复式推进术式。方法 该新手术方式具有下列2个特点:自尾侧向头侧多次往复式分离并以胰腺颈部下缘为终点,先于左侧缘显露SMV全长再处理静脉属支。回顾2012~2015年采用本方法的58例患者术中术后指标,评估其安全性及可行性。结果 2例患者因腹腔粘连中转,余58例患者均顺利完成手术,手术时间164±28.3 min,出血量64±63.5 ml,清扫淋巴结数目28±13.9个,术后无严重并发症及围手术期死亡。结论 腹腔镜下往复式右半结肠D3/CME根治术时简单、安全且可行的,为解决SMV静脉属支变异带来的手术困难提供了更安全的新的手术入路方式。
【关键词】结肠肿瘤; 腹腔镜; D3淋巴结清扫术; 全结肠系膜切除
腹腔镜结肠癌根治术的安全性、有效性及长期疗效已反复得到多个随机对照研究证实,并进而在各国范围内广泛开展。但现有的多数随机对照研究的结果均基于第二站淋巴结清扫的D2淋巴结清扫术。随着W. Hohenberger等[1]提出结肠癌CME手术的新技术标准,并被多个研究证实更为良好的疗效,结肠癌的CME手术及D3根治术日益受到重视。
腹腔镜右半结肠D3及CME根治术的可行性已为多个学者报道[2-4],但该术式要求行肠系膜上静脉前方的广泛淋巴结清扫及动静脉血管的根部结扎,由于外科干附近胃结肠干、中结肠静脉属支以及动脉分支的显著变异,加之肥胖、淋巴结转移等因素的影响,腹腔镜右半结肠D3/CME手术的实施具有相当的难度,易导致出血、胰腺损伤、重要血管损伤、淋巴瘘等严重外科并发症[5],这里我们介绍一种更加易于操作的往复式推进的腹腔镜右半结肠D3根治术。
资料与方法
一、一般资料
自2012~2015年华西医院胃肠外科本医疗组收治的173例右半结肠癌,其中67例行开腹手术,46例行手辅助腹腔镜手术,60例行腹腔镜辅助往复式右半结肠癌CME/D3根治术,2例因既往腹部手术史导致腹腔粘连而中转。所有患者均经肠镜确证为腺癌,CT未见明显转移病灶,无明显肠梗阻表现。患者的基本信息见表1。
二、手术方法(参见本期视频)
患者取平卧位,分开双腿,右高脚低位。全身静脉复合麻醉下完成手术。手术采用5个戳孔完成,主刀站于两腿之间(见图1)。助手将回结肠系膜(A2孔)及横结肠系膜(A1孔)向前腹壁牵拉,主刀(见图2 a):①先于回结肠静脉与肠系膜上静脉(superior mesenteric vein,SMV)夹角,或于SMV投影右侧侧缘向左2 cm处切开腹膜显露SMV(图2 c)。于空肠Traitz韧带与中结肠血管投影间辨认清胰颈下缘(图2 b)。自SMV显露处至辨认之胰腺下缘前开腹膜,并进而自中结肠血管左侧无血管区域进入小网膜囊充分显露胰腺,并稍向右侧分离胰腺颈部;②沿SMV左侧缘纵向薄层反复多次分离脂肪组织以显露跨越SMV前后的可能结肠动脉血管支(依次:或回结肠动脉或右结肠动脉及中结肠动脉),自根部处理各动脉分支(图2 d),充分显露SMV的全长,并在进入下一步前充分显露胰腺颈部(图2 e);③结扎处理中结肠静脉汇入SMV的属支后(图2 g),沿SMV的右侧缘分离显露十二指肠水平段及胰头下半部分即可,不要急于分离Toldt间隙,处理回结肠静脉/动脉;④沿SMV右侧向胰颈分离,显露胃结肠干(gastrocolic trunk of henle,GTH),不在根部处理该血管,结合由胰颈向右及沿GTH根部向远心端分离,显露清胃网膜右静脉主干(图2 j、2 k),辨认处理汇入GTH的右结肠静脉后(图2 l),再分离胰头的上半部分;⑤自胰十二指肠前筋膜前后向尾侧分离Toldt间隙之完全游离回盲部及升结肠部分;⑥网膜弓内(肝曲或右半横结肠)或弓外(升结肠或盲肠)游离胃结肠韧带,视肿瘤部位处理胃网膜右动脉根部,并进而游离肝曲,完成右半结肠分离;⑦经正中小切口将游离肠管拖出并切除吻合,并安置引流管。
结 果
本组60例拟行腹腔镜往复式右半结肠CME/D3根治术患者中,仅2例因腹腔粘连中转为开腹手术,其余58例成功完成手术患者基础资料及手术相关指标见表1。58例患者平均手术时间约164±28.3 min,出血量64±63.5 ml,所有患者术后均安全出院,无死亡病例,无吻合口瘘等严重并发症发生,2例发生乳糜漏,5例术后肺部感染,2切口感染,1例肺栓塞均保守治疗好转,术后平均肛门排气时间3.8±1.2天,术后平均住院时间7±4.6天。所有58例患者均达到全结肠系膜完整切除。平均检获淋巴结数量为28枚,阳性淋巴结数约1.2枚,总共23例(39.7%)患者伴有淋巴结转移。

表1 腹腔镜右半结肠根治术患者临床病例资料及手术指标表
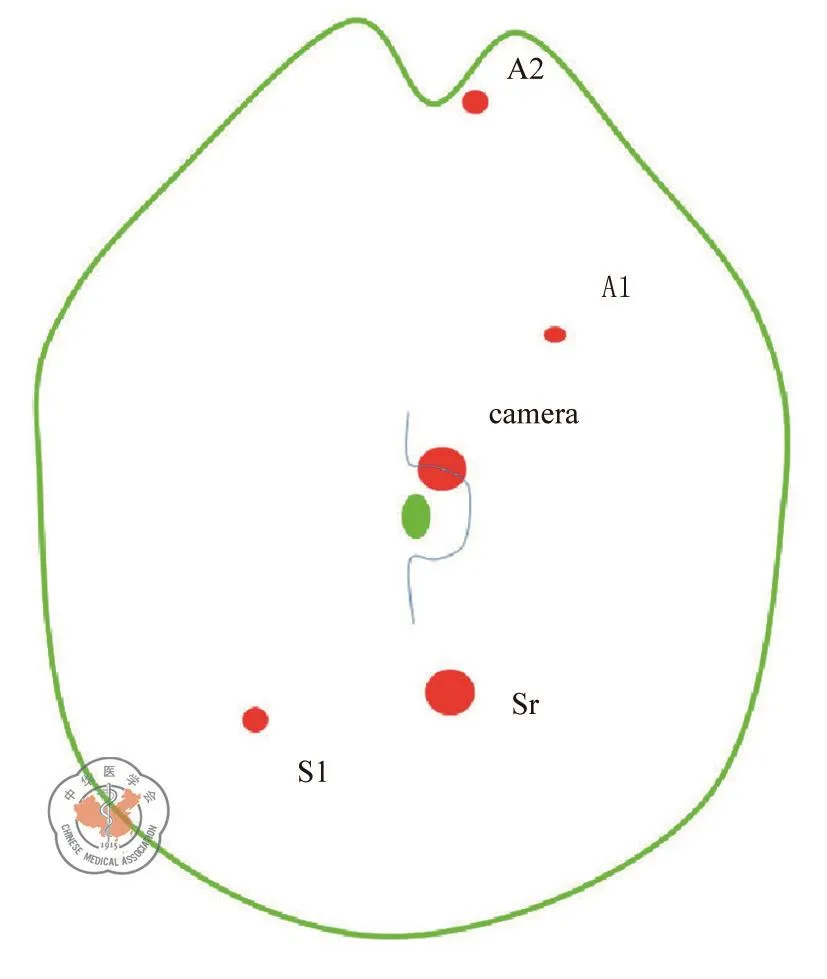
图1 腹腔镜下往复式右半结肠癌D3根治术的戳孔位置示意图
讨 论
随着COST[6]、CLASSIC[7]等多个随机对照研究显示腹腔镜手术治疗结肠恶性肿瘤能达到与开腹手术相同的长期疗效,腹腔镜技术在结直肠癌治疗中得到日益广泛的应用。这些临床RCT研究及早期腹腔镜手术在结直肠癌中的应用多基于第二站淋巴结清扫术(D2),而以中日韩为代表的东亚国家传统开腹手术常规施行D3手术方式,2009年W. Hohenberger等[1]报道全结肠系膜切除联合高位血管结扎能清扫更多阴性淋巴结及带来高达89.1%的5年生存率,后续的大量研究显示CME及D3手术有相似的阳性淋巴结清扫术及相同的长期疗效,尽管缺乏前瞻性随机对照研究,但回顾性研究显示CME/D3手术较传统的D2手术有更好的5年生存率,并逐步成为东西方广泛接受的共识及新的手术标准[8]。
CME及D3根治术要求高位或在结肠动脉分支的起始点结扎各结肠分支血管,完整清扫位于SMV前方(外科干部分)的淋巴结,对外科手术提出更高的挑战,术中准确把握SMV走行及位于近胰腺下缘的各个属支血管的解剖,是完成标准化根治术及避免出血及副损伤的关键。尤其是位于胃结肠干至胰腺下缘区域,SMV的属支变异多发,如中结肠静脉及副中结肠静脉数目及汇入部位的不确定性,胃结肠干的“合流”与“分流”(胃网膜右静脉、右结肠静脉及胰十二指肠前静脉分别汇入SMV)以及右结肠静脉、副右结肠静脉的缺失与数量变异,这些变异加之胰头及SMV前方肥厚的系膜脂肪组织及静脉壁的脆弱,易导致术中意外出血甚至主要血管或胰腺副损伤[9]。赵丽瑛等[5]报道腹腔镜扩大右半结肠癌根治术中,血管出血的总概率为43.6%(24/55),主要的出血部位是胰头前区域血管(16.4%,9/55)及中结肠血管(14.5%,8/55)。
腹腔镜右半结肠癌CME/D3手术术中意外出血的最常见原因是未能及时准确辨认静脉属支,现有的报道CME/D3手术多数采用内侧入路,分离步骤多自尾侧向头侧逐步推进的方式,及SMV的显露及各属支静脉及同名动脉的处理同步进行。这种分离方式存在的主要问题在于,由于中结肠动静脉及胃结肠干距胰腺下缘的距离不恒定,文献报道胃结肠干距胰腺下缘的距离为1.6~3.2 cm,中结肠静脉可汇入SMV或GTH或脾静脉等,而同时可能存在1~3支副中结肠静脉,这些解剖变异决定在肥胖患者沿SMV或胰头前向头侧分离时,常不能事先确定中结肠静脉及胃结肠干在左右及头尾纬度上的具体位置。我们采用的方法在处理各静脉属支前,先沿SMV左侧缘处理SMA的各结肠动脉分支,在SMV左缘分离几乎不会遇到汇入SMV前侧的静脉属支(即SMV左1/3无血管属支汇入,如图2 f、2 g),文献报道中结肠静脉仅约3.4%汇入SMV左侧的静脉(脾静脉及肠系膜下静脉),本组病人中仅1例中结肠静脉汇入空肠静脉。当各动脉分支切断后,SMV的全长得到显露,由于在SMV静脉鞘内,各属支(MCV及GCV)的根部之间并无脂肪组织间隔,仅少量疏松的纤维结缔组织,因而各SMV属支无需刻意分离,即可直接显露。
往复式清扫遵循的另一重要原则是以胰腺颈部下缘为标志(图2 e),在处理静脉属支前,优先游离头侧胰颈周围的空间,即使遇到意外出血时,由于血管头侧的空间已游离,宜于出血控制。给为重要的时,胰腺颈部后缘是SMV所在平面的标志,辨认清胰颈后缘时,医生可非常清楚SMV所在位置,即使在肥胖患者遭遇出血时,对出血控制更有信心,避免发生严重的意外损伤。
腹腔镜手术中导致出血的第二个常见原因在于对横结肠的过渡牵拉,多数的研究报道优先分离Toldt′s间隙已达到更好的牵拉效果,协助显露静脉属支及SMV。尽管更好的张力可以增大脂肪淋巴组织与SMV及胰头前方的疏松间隙,但过渡的张力也容易传递到GTH的属支,如右结肠静脉及胰十二指肠前静脉上,过渡的张力极易导致分离过程中意外出血(图2 i)。本法在完成SMV前方游离前并不分离Toldt′s间隙,因而并不会将横结肠的牵拉张力传递到胰十二指肠前静脉及右结肠静脉。在处理右结肠静脉前,也先联合从胰颈向左侧分离及沿GTH向头侧分离的方法,充分显露胃网膜右静脉。这样做的好处在于,若从十二指肠胰头侧向胰颈方向分离尽管可快速找到右结肠静脉,但此时并未显露胃网膜右静脉,由于可有多支胰十二指肠前静脉汇入GTH或胃网膜右静脉本身(图2 j),当盲目分离右结肠静脉或GTH后方时很容易导致GTH或胃网膜右静脉的小属支出血,我们主张一定要在辨认清楚胃网膜右静脉、GTH及RCV的关系后再单独处理RCV(图2 i)。在RCV离断后,再分离胰十二指肠前间隙及Toldt′s间隙,并不会将张力传递至胰十二指肠前静脉,从而最大限度减少胰头前区域出血的机会。为解决过渡牵拉横结肠带来的血管损伤,Matsuda T等[10]报道采用优先经胃结肠韧带切开处理中结肠血管,由头侧向尾侧分离的入路方式,尽管在入路选择上与我们的方法显著差异,但在优先显露胰腺下缘这一思路上是一致的,这一操作能显著增加SMV在胰腺下缘附近各属支处理的安全性。
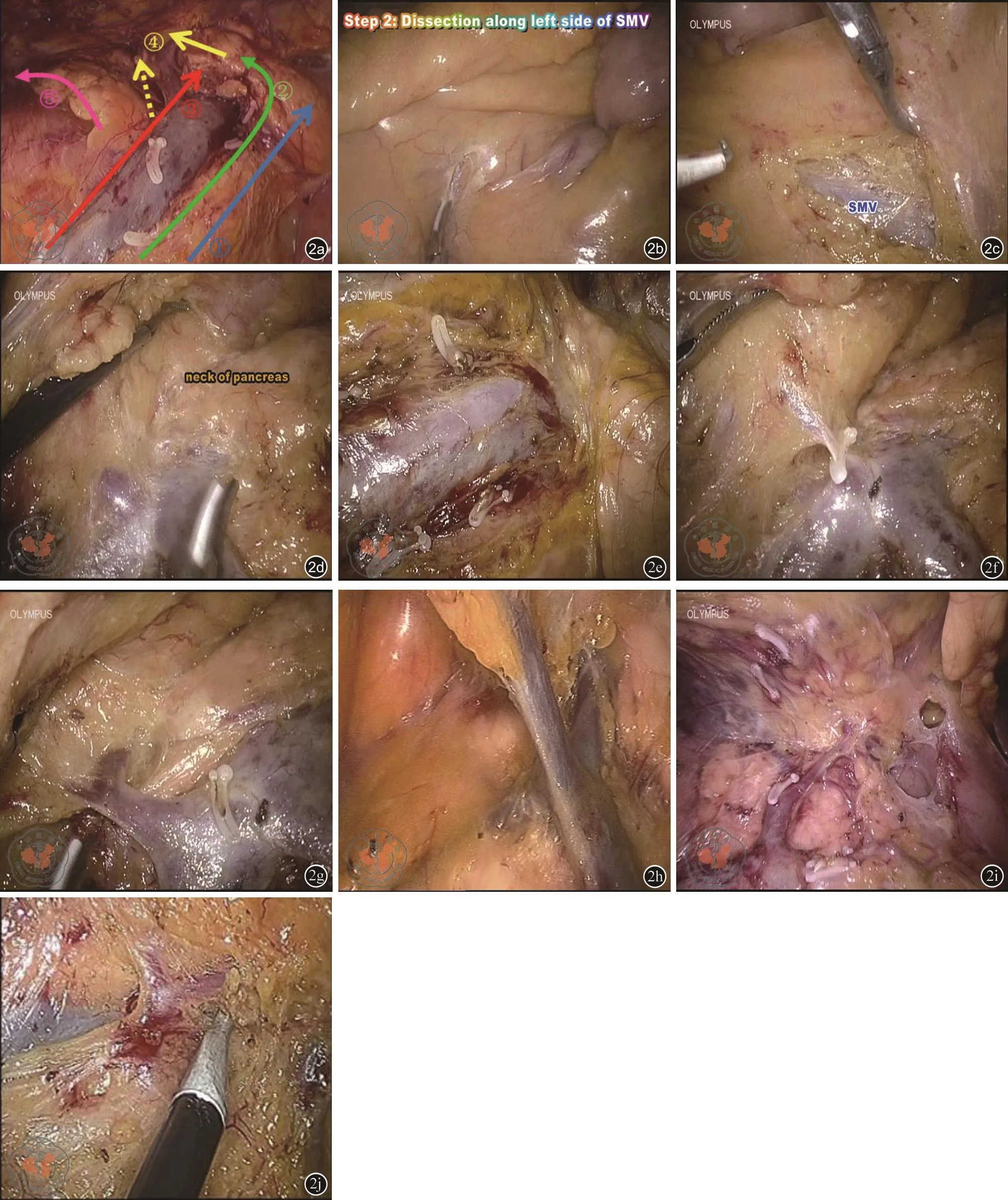
注:a:往复式清扫术的主要步骤;b:在空肠Traitz韧带与中结肠动脉间辨认胰腺下缘;c:小肠系膜远端暴露SMV;d:在SMV左侧缘暴露处理中结肠及右结肠动脉之公干;e:处理中结肠静脉前显露清楚胰腺下缘;f:SMV前份的左1/3无静脉属支汇入;g:处理中结肠静脉,并注意空肠静脉跨越SMA前方,注意MCV 与GTH无致密脂肪组织间隔;h:处理右结肠静脉前显露清楚胃网膜右静脉;i:GTH、胃网膜右静脉及右结肠静脉的关系;j:显示多个细小的胰十二指肠前静脉汇入GTH及胃网膜右静脉的侧后壁图2 手术示意图
Toldt′s筋膜[11]是发育过程中结肠系膜后腹膜与后腹壁腹膜融合而成的融合筋膜,而在胰十二指肠前方及后方均存在融合筋膜,本法自胰十二指肠前筋膜向尾侧分离,可顺利进入Toldt′s筋膜前方,可有效避免由尾侧向头侧分离时进入十二指肠后间隙。
尽管主淋巴结转移率较低,文献报道仅0%~5.8%[12],但这部分患者在行CME/D3根治术后仍能获得36.4%的5年DFS[13],提示并不能将主淋巴结转移视为远处转移(不能等同腹主动脉淋巴结转移),本组仅1/58例患者存在主淋巴结转移。而且主淋巴结转移清扫的意义不仅于此,常规病理检查阴性的淋巴结可能存在微小转移(<2 mm)或孤立癌细胞(<0.2 mm)或免疫组化能检测到的癌细胞,文献显示免疫组化检测能增加主淋巴结微转移率8.5%[14]。回顾性的大宗临床对比研究显示CME手术能获得更高的5年生存率,这种生存获益可能与更多的阴性淋巴结切除有关[15]。本组平均清扫淋巴结28±13.9枚(5~63),平均清扫阳性淋巴结数为2.5±3.5枚,本组淋巴结清扫数显著高于日本D3清扫数的平均21枚(16~27),而略低于德国Erlangen中心的淋巴结清扫数32枚(20~40)[16],显示本组的清扫达到D3的根治要求,而略低于德国的数据则可能与本组远端大肠肠管切除的长度相对较短有关,W. Hohenberger等[1]主张完全切除横结肠右半,在其左半进行小肠结肠吻合,而我们常规仅要求达到足够的远端切缘即可。本组远端肠管切除距离平均为15.1±5.39 cm(新鲜标本),超过日本指南规定的肠管切除10 cm以上或超过供血动脉5 cm以上的规定。
本手术方式也存在自身的不足及解剖风险点,①首先可有1~2支空肠静脉跨越SMV前方(图2 g),并略微较SMV偏向腹侧(被SMV抬高),Nesgaard JM等[17]报道约30.9%的患者存在空肠静脉跨越SMA前方。本组中1例患者出现空肠静脉管径被部分切开,并行腔镜下缝合修补,术前CT检查可轻易发现这一解剖变异,分离过程中应严格以SMV左侧缘为标志,避免过渡偏左及以SMA为标志,则可避免该副损伤发生;②尽管SMV的左1/3前方少见静脉属支汇入,但仍有少数解剖变异情况,如Yamaguchi等[15]报道中结肠静脉仅约3.4%汇入SMV左侧的静脉胰颈下缘走向胰尾的血管出血,Ogino T等[19]报道了更高比例的患者MCV可汇入SMV以左的静脉,如6%汇入空肠静脉,5%汇入IMV,1%汇入脾静脉。本组研究过程中2例患者1例MCV汇入脾静脉,1例汇入空肠静脉,我们注意到当中结肠静脉跨越SMV左缘时,中结肠静脉表面的脂肪组织通常菲薄较易辨认其走行方向,我们认为此时仅需在SMV左缘离断MCV,而无需追踪至根部(横结肠癌除外)。Nesgaard JM等[17]报道2.2%病例IMV也可从左侧进入D3根治区域并汇入SMV。
总之,腹腔镜往复式右半结肠D3根治术以SMV左缘及胰腺颈部下缘为分离标志,首先显露SMV全长,再由左向右处理静脉分支,可简化对SMV的各结肠静脉属支的暴露,减轻对横结肠系膜的牵拉张力,能有效降低术中静脉意外出血几率,是一种简单安全的新的手术分离入路,其安全性及有效性的进一步验证需更大宗的临床研究。
参 考 文 献
[ 1 ] Hohenberger W, Weber K, Matzel K, et al. CME Standardized surgery for colonic cancer: complete mesocolic excision and central ligation--technical notes and outcome [J]. Colorectal Dis, 2009,11(4): 354-364; discussion 364-365.
[ 2 ] Feng B, Sun J, Ling TL, et al. Laparoscopic complete mesocolic excision (CME) with medial access for right-hemi colon cancer: feasibility and technical strategies [J]. Surg Endosc, 2012, 26(12): 3669-3675.
[ 3 ] Fujita J, Uyama I, Sugioka A, et al. Laparoscopic right hemicolectomy with radical lymph node dissection using the notouch isolation technique for advanced colon cancer [J]. Surg Today,2001, 31(1): 93-96.
[ 4 ] Bae SU, Saklani AP, Lim DR, et al. Laparoscopic-assisted versus open complete mesocolic excision and central vascular ligation for right-sided colon cancer [J]. Ann Surg Oncol, 2014, 21(7):2288-2294.
[ 5 ] 赵丽瑛, 李国新, 张策,等. 腹腔镜下右半结肠血管解剖及血管并发症分析[J]. 中华胃肠外科杂志, 2012, 15(4): 336-341.
[ 6 ] Bonjer HJ, Deijen CL, Abis GA, et al. A randomized trial of laparoscopic versus open surgery for rectal cancer [J]. N Engl J Med,2015, 372(14): 1324-1332.
[ 7 ] Jayne DG, Thorpe HC, Copeland J, et al. Five-year follow-up of the Medical Research Council CLASICC trial of laparoscopically assisted versus open surgery for colorectal cancer [J]. Br J Surg,2010, 97(11): 1638-1645.
[ 8 ] Sehgal R, Coffey JC. The development of consensus for complete mesocolic excision (CME) should commence with standardisation of anatomy and related terminology [J]. Int J Colorectal Dis, 2014,29(6): 763-764.
[ 9 ] Matsuda T, Iwasaki T, Mitsutsuji M, et al. Cranial-to-caudal approach for radical lymph node dissection along the surgical trunk in laparoscopic right hemicolectomy [J]. Surg Endosc, 2015, 29(4): 1001.
[ 10 ] Coffey JC, Sehgal R, Culligan K, et al. Terminology and nomenclature in colonic surgery: universal application of a rule-based approach derived from updates on mesenteric anatomy [J]. Tech Coloproctol, 2014, 18(9): 789-794.
[ 11 ] Culligan K, Walsh S, Dunne C, et al. The mesocolon: a histological and electron microscopic characterization of the mesenteric attachment of the colon prior to and after surgical mobilization [J]. Ann Surg, 2014, 260(6): 1048-1056.
[ 12 ] Søndenaa K, Quirke P, Hohenberger W, et al. The rationale behind complete mesocolic excision (CME) and a central vascular ligation for colon cancer in open and laparoscopic surgery [J]. International Journal of Colorectal Disease, 2014, 29(4): 419-428.
[ 13 ] Yukihide K, Koji K, Kenya K, et al. D3 Lymph Node Dissection in Right Hemicolectomy with a No-touch Isolation Technique in Patients With Colon Cancer [J]. Diseases of the Colon & Rectum,2013, 56(7): 815-824.
[ 14 ] Merrie A E H, Phillips L V, Yun K, et al. Skip metastases in colon cancer: assessment by lymph node mapping using moleculardetection [J]. Surgery, 2001, 129(6): 684-691.
[ 15 ] Bertelsen C A, Neuenschwander A U, Jansen J E, et al. Disease-free survival after complete mesocolic excision compared with conventional colon cancer surgery: a retrospective, population-based study [J]. The Lancet Oncology, 2015, 16(2): 161-168.
[ 16 ] Kobayashi H, West N P, Takahashi K, et al. Quality of surgery for stage III colon cancer: comparison between England, Germany, and Japan [J]. Annals of Surgical Oncology, 2014, 21(3 Supplement):398-404.
[ 17 ] Nesgaard JM, Stimec BV, Bakka AO, et al. Navigating the mesentery: a comparative pre- and per-operative visualization of the vascular anatomy [J]. Colorectal Dis, 2015, 17(9): 810-818.
[ 18 ] Yamaguchi S, Kuroyanagi H, Milsom JW, et al. Venous Anatomy of the Right Colon [J]. Diseases of the Colon & Rectum, 2002, 45(10):1337-1340.
[ 19 ] Ogino T, Takemasa I, Horitsugi G, et al. Preoperative evaluation of venous anatomy in laparoscopic complete mesocolic excision for right colon cancer [J]. Ann Surg Oncol, 2014, 21 (Suppl 3): S429-435.
(本文编辑:杨明)
邓祥兵, 孟文建, 魏明天, 等. 腹腔镜下往复式右半结肠D3/CME根治术 [J/CD]. 中华结直肠疾病电子杂志, 2016, 5(3):263-268.
Unidirectionally proceding and pancreas-oriented procedure for laparoscopic radical righthemicolectomy with D3 lymphadenectomy
Deng Xiangbing, Meng Wenjian, Wei Mingtian, Yang Tinghan,Wang Cun, Yang Lie, Wang Ziqiang. Department of upper GI and Colorectal Surgery, West China Hospital,Sichuan University, Sichuan 610000, China
Corresponding author: Wang Ziqiang, Email: Wangziqiang@163.com
【Abstract】Objective To facilitate laparoscopic D3/CME right hemicolectomy, here we introduce an unidirectionally proceding and pancreas-oriented procedure for laparoscopic radical right hemicolectomy with D3 lymphadenectomy. Methods This novel approach of D3 hemicolectomy is characterized by the following two features: series of repeated unidirctionally preceding dissection along SMV starting caudally and ending at the lower edge of pancreatic neck, and identifying the left 1/3 aspect of the whole length of SMV firstly followed by ligation of individual colonic veins. From Jan 2012 to Dec 2015, 58 patients but 2 underwent this procedure successfully. Results The operation time was 164±28.3 min, blood loss was 64±63.5 ml, retrieved lymph nodes were 28±13.9, no mortality and major mobidity were observed. Conclusions This novel unidirectionally proceding and pancreas-oriented procedure for laparoscopic radical right hemicolectomy with D3 lymphadenectomy is safe and feasible, with the merit of providing an easier and safer way of managing the frequent variations of tributaries of SMV.
【Key words】Colonic neoplasms; Laparoscopes; D3 lymphadenectomy; Complete mesocolon excision
DOI:10.3877/cma.j.issn.2095-3224.2016.03.014
基金项目:国家自然科学基金资助项目(81172373)
作者单位:610041 四川大学华西医院胃肠外科
通讯作者:王自强,Email:wangzqzyh@163.com
收稿日期:(2016-03-11)
