BDNF-trkB信号通路在氯胺酮治疗糖尿病神经病理性疼痛中的作用
2016-07-07胡明珠
宗 剑,杨 春,胡明珠,周 波,季 永
[江南大学 1.附属医院(无锡市第四人民医院)麻醉科, 2. 无锡医学院,江苏 无锡 214062]
BDNF-trkB信号通路在氯胺酮治疗糖尿病神经病理性疼痛中的作用
宗剑1,杨春1,胡明珠2,周波1,季永1
[江南大学 1.附属医院(无锡市第四人民医院)麻醉科, 2. 无锡医学院,江苏 无锡214062]
摘要:目的研究脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)-酪氨酸受体激酶B(tyrosine receptor kinase B,trkB)信号通路在氯胺酮治疗糖尿病神经病理性疼痛中的作用。方法♂ Wistar大鼠48只,3月龄,体质量200~250 g,采用随机数字表法,将其分为4组(n=12):正常对照组(C组)、生理盐水组(S组)、氯胺酮组(K组)及氯胺酮+ANA-12组(KA组)。S、K及KA组大鼠腹腔单次注射链脲菌素(STZ)65 mg·kg-1构建糖尿病神经病理痛模型。28 d后,S、K及KA组大鼠分别连续7 d腹腔注射等容积生理盐水、氯胺酮10 mg·kg-1及氯胺酮10 mg·kg-1+ANA-12 0.5 mg·kg-1。d 8,测定大鼠机械缩足痛阈(MWT), 然后处死大鼠取腰段脊髓背根及大脑前额皮层。采用Western blot和高尔基染色检测BDNF、p-trkB/trkB、突触素(synaptophysin)及树突棘密度。结果与C组比较,S组大鼠MWT明显下降,且脊髓背根和前额皮层BDNF、p-trkB/trkB、突触素及树突棘密度均明显下降(P<0.05);与S组相比,K组大鼠MWT、各部位BDNF、p-trkB/trkB、突触素和树突棘密度均明显增加(P<0.05);与K组相比,KA组大鼠MWT明显下降,且各部位BDNF、p-trkB/trkB、突触素和树突棘密度均明显下调(P<0.05)。各部位BDNF与树突棘密度均呈现正相关(P<0.05)。结论氯胺酮治疗糖尿病神经病理性疼痛的机制与BDNF-trkB信号通路的激活有关。
关键词:氯胺酮;神经病理性疼痛;脑源性神经营养因子;酪氨酸受体激酶;树突棘密度; 突触素
糖尿病神经病理性疼痛(diabetic neuropathic pain,DNP)是指由糖尿病引起的一类外周及中枢神经病变所致的顽固性疼痛[1]。目前,该类疾病的发病机制尚未完全阐明,且治疗手段主要依赖于改善患者的血糖水平及促进外周神经损伤的修复。然而,Schreiber等[2]报道,目前的治疗策略及手段,约有37%患者未得到满意疗效。氯胺酮是临床常用的一类麻醉药,其主要通过阻断N-甲基-D-天冬氨酸(NMDA)受体而发挥药理学作用。新近基础研究表明,小剂量(亚麻醉剂量)氯胺酮可明显促进受损神经元的修复与再生[3]。本研究拟通过链脲菌素构建DNP大鼠模型,观察氯胺酮对其治疗作用并试图阐明其可能机制。
1材料与方法
1.1动物与试剂
♂ Wistar大鼠48只,3月龄,体质量200~250 g,采用随机数字表法,将其分为4组(n=12):正常对照组(C组)、生理盐水组(S组)、氯胺酮组(K组)及氯胺酮+ANA-12组(KA组)。S、K及KA组大鼠腹腔单次注射链脲菌素(streptozocin,STZ,美国Sigma公司)65 mg·kg-1制备糖尿病大鼠模型,于注射后48 h,测量尾静脉空腹血糖,血糖浓度>16.7 mmol·L-1,认为造模成功。4周后,S、K及KA组大鼠分别连续7 d腹腔注射等容积生理盐水、氯胺酮(10 mg·kg-1)及氯胺酮10 mg·kg-1+ANA-12(0.5 mg·kg-1)。
1.2机械缩足痛阈检测
药物干预后d 8,参考先前文献[4],对模型大鼠采用机械缩足痛阈(MWT)测定,将大鼠放置于底为5 mm×5 mm的透明有机玻璃箱中,适应20~30 min。采用折力分别为0.4、0.6、1.4、2.0、4.0、6.0、8.0、15.0 g的经典von-Frey纤毛,首先从2.0 g开始,将纤毛垂直刺向大鼠左后爪,依据大鼠有无缩足反射,再更换纤毛,每次持续时间不超过8 s,测试间隔时间为10 s。记录大鼠对不同折力纤毛的反应。若大鼠出现快速的缩足反射,则记为阳性反应,且以“X”表示,若无反应,则视为阴性反应,以“O”表示。以出现“X”的前一次“O”作为起点,选择包含该起点的6次连续刺激反应,作为推算50%机械缩足反应阈值(mechanical paw withdrawal threshold,MWT)的关键序列,推算公式50% MWT/g=(10[Xf+κδ])/10 000。其中,Xf为序列中最后一根von Frey纤毛的对数值;κ为根据测量所得“X”、“O”序列查表后得到的值,δ为各个纤毛力度取对数后的均差,在此约等于0.224。若在0.4~2.0 g力度范围的刺激均为阳性反应,50% MWT记为0.4 g;若在2.0~15.0 g范围力度的刺激均为阴性反应,50% MWT记为15.0 g。
1.3Western blot检测
大鼠测试行为学后,采用异氟醚麻醉处死,并称取脊髓背根和前额皮层组织各200 mg,组织标本中加入300 μL裂解液,于4 ℃离心后取上清液。进行蛋白定量,取等量上样缓冲液于试管中,并于(95~100) ℃ 5 min后,冰上冷却上样。取出凝胶,置于转移缓冲液中平衡15 min,按约0.1 mL·cm-2的量将膜置于封闭液和BDNF(1 ∶200, 批号:H117,Santa Cruz公司,美国)、p-trkB抗体(1 ∶1 000,批号:135645,Santa Cruz公司,美国)、trkB抗体(1 ∶200,批号:4606,Cell Signaling公司,美国)和突触素抗体(1 ∶1 000,批号:5461,Cell Signaling公司,美国),摇床震荡孵育(4 ℃,过夜)。洗涤液漂洗滤膜3次,每次10 min。将膜与辣根过氧化物酶结合的二抗(浓度1 ∶5 000,南京建成生物公司)室温下摇荡孵育2 h。随后将显影液加于膜上,室温放置1 min。将膜在X光胶片上曝光,调整曝光时间,直至呈现最佳条带。采用Image J软件对条带进行分析,测定灰度值。
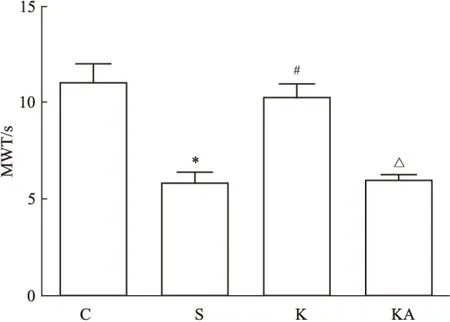
Fig 1 Effects of ketamine and ANA-12 on MWT in DNP rats
*P<0.05vsC group;#P<0.05vsS group;△P<0.05vsK group
1.4免疫组化
参照先前文献[5],切取相应组织,加入4%多聚甲醛缓冲液固定标本,30%蔗糖缓冲液浸泡(4 ℃),待组织下沉后,OCT包埋,恒冷箱切片机制备10 μm厚的冠状连续切片。各组切片分别用1%锇酸固定30 min;漂洗后用3.5%重铬酸钾浸泡1~3 h。将切片竖直放入1%硝酸银溶液中6~24 h,取出切片,依次进行梯度酒精脱水、水杨酸甲酯透明,然后封片。在显微镜下,从距离锥体细胞胞体50 μm处的2、3级树突的树突棘,连续选取10个树突棘测量其长度,进行分析,计算10 μm长度内的树突棘个数。
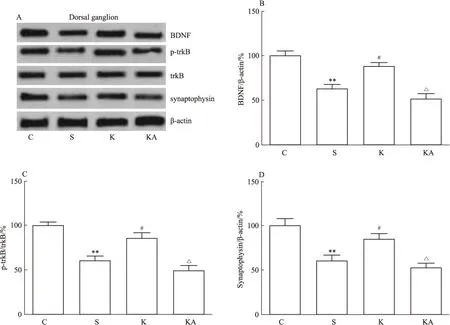
Fig 2 Effects of ketamine and ANA-12 on expression of BDNF,ratio of p-trkB/trkB and synaptophysin in dorsal ganglion of DNP rats
A: Images of Western blot; B~D: Bar graphs of BDNF, p-trkB and synaptophysin.**P<0.01vsC group;#P<0.05vsS group;△P<0.05vsK group
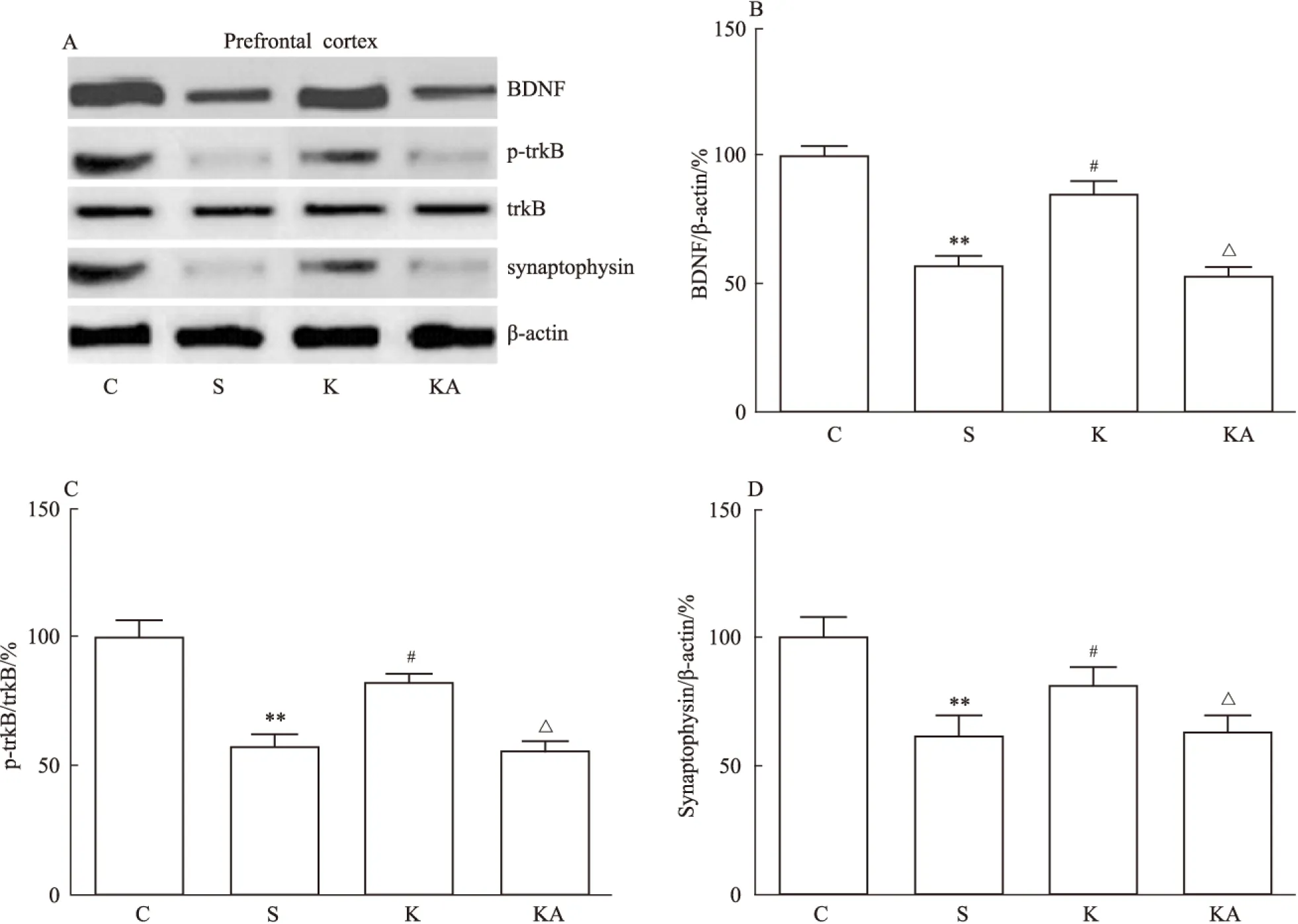
Fig 3 Effects of ketamine and ANA-12 on expression of BDNF, ratio of p-trkB/trkB and synaptophysin in prefrontal cortex of DNP rats
A: Images of Western bands. B~D: Figures of BDNF, p-trkB and synaptophysin.**P<0.01vsC group;#P<0.05vsS group;△P<0.05vsK group
1.5统计学方法

2结果
2.1疼痛对大鼠行为学及BDNF-trkB信号通路的影响
与C组比较,S组大鼠MWT明显下降,且脊髓背根和前额皮层BDNF、p-trkB/trkB、突触素及树突棘密度均明显下降(P<0.05);与S组相比,K组大鼠MWT、及各部位BDNF、p-trkB/trkB、突触素和树突棘密度均明显增加(P<0.05)。见Fig 1~4。
2.2氯胺酮对DNP大鼠行为学及BDNF-trkB信号通路的影响
与K组相比,KA组大鼠MWT明显下降,且各部位BDNF、p-trkB/trkB、突触素和树突棘密度均明显下调(P<0.05)(Fig 1~4)。各部位BDNF与树突棘密度均呈现明显正相关(P<0.05)(Fig 5)。
3讨论
DNP的发病机制至今尚不明确,约有87%糖尿病患者长期承受着神经病变所致的慢性疼痛[2]。本研究结果表明,氯胺酮作为一类常用麻醉药,在DNP的治疗方面,有独特的疗效。Zhou等[6]指出氯胺酮对DNP可获得满意治疗效果。再者,我们观察到trkB受体阻断剂ANA-12可明显抑制氯胺酮对DNP的治疗效果。众所周知,脊髓背根神经节是外周伤害性刺激传递信息的换元神经所在部位,以往研究多集中于观察此部位。然而,我们知道,疼痛是一种伴有躯体症状的主观不愉快感受。因此,本研究观察前额皮层这一脑区,试图说明外周神经病变亦可通过上行神经纤维将伤害性刺激投射至更高级的中枢神经。我们通过Western blot及Glogi染色分别观察到在脊髓背根和前额皮层BDNF-trkB信号通路激活引起的神经棘突再生参与到氯胺酮治疗DNP的机制中。
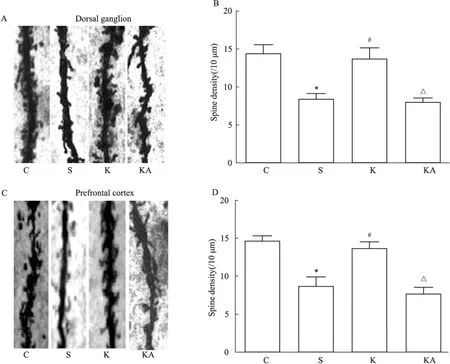
Fig 4 Effects of ketamine and ANA-12 on spine density in dorsal ganglion and prefrontal cortex in DNP rats
A and C: Images of Golgi stainning; B and D: Figures of spine density numbers.*P<0.05vsC group;#P<0.05vsS group;△P<0.05vsK group
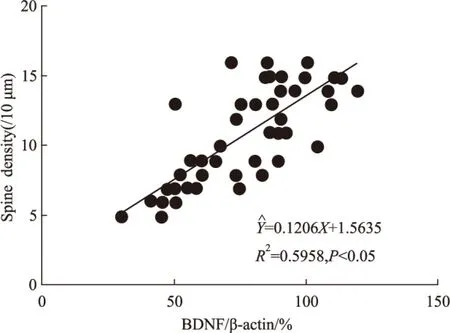
Fig 5 Scatter gram of correlationship between BDNF and spine density
Forty-eight samples were enrolled in this analysis. R2=0.5958,P<0.05
BDNF对神经元的存活、分化、生长发育及损伤修复起重要作用[7-8]。BDNF主要以未成熟前体形式proBDNF及成熟的mBDNF两种形式存在[9]。本研究观察的是14 ku位点的mBDNF,并未观察位于28 ku的proBDNF。BDNF(特指mBDNF)对trkB具有高度亲和性,通过使trkB磷酸化而发挥作用[9]。本研究结果表明,在亚麻醉剂量氯胺酮治疗7 d后,大鼠脊髓背根和前额皮层BDNF及p-trkB均呈现明显上调,且在ANA-12干预组该两类指标表达水平明显下降。该结果提示,氯胺酮在外周及中枢神经系统均可通过激活BDNF-trkB信号通路而发挥对DNP的治疗作用。然而,氯胺酮可导致神经类副作用[10]。Anderson等[11]认为啮齿类动物腹腔注射氯胺酮,其认知功能明显下降,且精神分裂发生率较生理盐水对照组明显增加。尽管本研究并未采用前脉冲抑制、敞箱实验来观察氯胺酮的精神分裂样副作用,但我们认为10 mg·kg-1亚麻醉剂量氯胺酮是安全的,主要有以下原因:① 氯胺酮在啮齿类动物模型上构建精神分裂动物模型的剂量约为50 mg·kg-1以上,这远远超过本研究中使用的剂量;② 微清蛋白(PV)及其所产生的γ震荡波的异常表达是精神分裂检测的金标准,10 mg·kg-1氯胺酮是否引起脑内PV神经元的缺失,目前尚无研究报道;③ 慢性疼痛患者往往伴有抑郁症状,Liebrenz等[12]提示重复间断静脉注射亚麻醉剂量氯胺酮在改善抑郁的同时,对患者简易精神量表(BDI)并未有影响。
神经元细胞的突起是传递信号的重要结构基础。本研究结果表明,氯胺酮可明显增加神经突起数目,间接提示氯胺酮可通过改善受损的突触,激活突触再生,从而发挥治疗DNP的作用。BDNF对突触再生有促进作用,我们采用Pearson相关分析认为BDNF可促进突起的再生,且在氯胺酮治疗DPN中呈现一致性变化。据此,我们推测氯胺酮通过激活脊髓背根BDNF的表达,促进trkB磷酸化,进而上调突触素的表达促进神经棘突起的再生,从而发挥对DNP的治疗作用,且该效应通过脊髓上行系统投射至疼痛敏感区前额皮层,可通过中枢调控机制发挥对慢性疼痛所伴随的主观感受的改善。
综上所述,本研究通过STZ构建的DNP大鼠模型,观察到氯胺酮对DNP的明显改善作用,且其机制与激活脊髓背根和前额皮层BDNF-trkB信号通路及促进神经突起再生有关。后续研究需进一步阐明其确切机制,从而为临床治疗DNP提供理论依据。
参考文献:
[1]King J B, Schauerhamer M B, Bellows B K. A review of the clinical utility of duloxetine in the treatment of diabetic peripheral neuropathic pain[J].TherClinRiskManag, 2015, 11:1163-75.
[2]Schreiber A K,Nones C F,Reis R C,et al. Diabetic neuropathic pain: physiopathology and treatment[J].WorldJDiabetes,2015,6(3):432-44.
[3]Li N, Lee B, Liu R J, et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists[J].Science, 2010, 329(5994): 959-64.
[4]Lim D W, Kim J G, Han T, et al. Analgesic effect of ilex paraguariensis extract on postoperative and neuropathic pain in rats[J].BiolPharmBull, 2015, 38(10): 1573-9.
[5]Rico A M, Mendoza A L, Durán D A, et al. The effects of chronic restraint on the morphology of ventral CA1 neurons in female Long Evans rats[J].Stress, 2015, 18(1): 67-75.
[6]Zhou H Y, Chen S R, Pan H L. Targeting N-methyl-D-aspartate receptors for treatment of neuropathic pain[J].ExpertRevClinPharmacol, 2011, 4(3): 379-88.
[7]Khan N, Smith M T. Neurotrophins and neuropathic pain: role in pathobiology[J].Molecules, 2015, 20(6): 10657-88.
[8]万东,祝慧凤,罗勇,谢鹏.梓醇上调局灶脑缺血大鼠缺血灶周围大脑皮质BDNF和TrkB蛋白表达[J].中国药理学通报,2013,29(6):787-92.
[8]Wan D,Zhu H F,Luo Y,Xie P.Catalpol increases around the focal ischemic focal cerebral ischemia rats cortex BDNF and TrkB protein expression[J].ChinPharmacolBull, 2013,29(6):787-92.
[9]Hashimoto K, Shimizu E, Iyo M. Critical role of brain-derived neurotrophic factor in mood disorders[J].BrainResBrainResRev, 2004, 45(2): 104-14.
[10]李建立,高冬艳,杜彦茹,侯艳宁.17β雌二醇对氯胺酮诱导皮层神经元凋亡的影响[J].中国药理学通报,2014,30(6):816-20.
[10]Li J L,Gao D Y,Du Y R,Hou Y N.17 beta estradiol impact on ketamine induced cortical neuron apoptosis[J].ChinPharmacolBull,2014,30(6):816-20.
[11]Anderson P M,Pinault D,O′Brien T J,et al. Chronic administration of antipsychotics attenuates ongoing and ketamine-induced increases in cortical γ oscillations[J].IntJNeuropsychopharmacol, 2014, 17(11):1895-904.
[12]Liebrenz M, Stohler R, Borgeat A. Repeated intravenous ketamine therapy in a patient with treatment-resistant major depression[J].WorldJBiolPsychiatry,2009,10(4 Pt 2):640-3.
Role of BDNF-trkB signaling pathway in ketamine treating diabetic neuropathic pain
ZONG Jian1, YANG Chun1, HU Ming-zhu2, ZHOU Bo1, JI Yong1
[1.DeptofAnesthesiology,AffiliatedHospitalofJiangnanUniversity(Wuxi4thPeople′sHospital);2.WuxiMedicalCollege,JiangnanUniversity,WuxiJiangsu214062,China]
Abstract:AimTo investigate the role of brain-derived neurotrophic factor(BDNF)- tyrosine receptor kinase B(trkB) signaling pathway in the therapeutic effects of ketamine on diabetic neuropathic pain.MethodsForty-eight Wistar rats, aged 3 months, weighing 200~250 g, were equally randomized into 4 groups(n=12):control group(C group), saline group(S group), ketamine group(K group) and ketamine+ANA-12 group(KA group).Rats in S, K and KA groups were intraperitoneally injected with a single of streptozotocin(STZ) 65 mg·kg-1to construct diabetic neuropathic pain model. After twenty-eight days, rats in S, K and KA groups were intraperitoneally injected with saline, ketamine 10 mg·kg-1and ketamine 10 mg·kg-1+ANA-12 0.5 mg·kg-1for consecutive 7 days, respectively. On the 8th day, mechanical withdrawal threshold(MWT) of rats was measured. After that, the rats were immediately sacrificed, and dorsal ganglion of lumbar spine and prefrontal cortex(PFC) were harvested for measuring BDNF, p-trkB/trkB, synaptophysin and spine density by Western blot and glogi staining.ResultsCompared with C group, rats in S group significantly decreased MWT, BDNF, p-trkB/trkB, synaptophysin and spine density in dorsal ganglion and PFC(P<0.05 ).Compared with S group, rats in K group showed a significant increase of MWT, BDNF, p-trkB/trkB, synaptophysin and spine density in the all observed regions(P<0.05).On the contrary, rats in KA group showed a significant decrease of MWT and BDNF, p-trkB/trkB, synaptophysin and spine density as compared with K group in all regions(P<0.05 ). Furthermore, BDNF was positively correlated with spine density in all regions(P<0.05).ConclusionBDNF- trkB signaling pathway mediates ketamine-induced therapeutic effects in diabetic neuropathic pain.
Key words:ketamine; neuropathic pain; brain-derived neurotrophic factor; tyrosine receptor kinase B; spine density; synaptophysin
收稿日期:2016-02-16,修回日期:2016-03-20
基金项目:无锡市医学管理中心医学科研面上项目(No YGZXM1407)
作者简介:宗剑(1978-),男,博士生, 主治医师,研究方向:疼痛机制,Tel:0510-88682025,E-mail : zw0086@126.com;
doi:10.3969/j.issn.1001-1978.2016.06.013
文献标志码:A
文章编号:1001-1978(2016)06-0801-06
中国图书分类号:R-332;R322.81;R345.57;R441.1;R587.1;R741.02;R971.2;R977.6
网络出版时间:2016-5-25 15:39网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160525.1539.026.html
季永(1969-),男,博士,教授,主任医师,硕士生导师,研究方向:疼痛机制,Tel:0510-88682025,通讯作者,E-mail:jiyong6914@163.com
