蛋白激酶D1促血管新生的体内外实验分析*
2016-07-05毛秉豫徐国昌叶松山张培华张瓅方
杨 雷, 刘 暖, 毛秉豫, 徐国昌, 叶松山, 张培华, 张瓅方
(南阳理工学院医学实验中心,河南 南阳 473004)
·短篇论著·
蛋白激酶D1促血管新生的体内外实验分析*
杨雷,刘暖,毛秉豫△,徐国昌,叶松山,张培华,张瓅方
(南阳理工学院医学实验中心,河南 南阳 473004)
[摘要]目的: 探讨蛋白激酶D1(PKD1)促血管新生的作用,为心肌梗死等缺血性疾病以PKD1为治疗靶点提供新的思路。方法: 体外培养、分离和鉴定内皮祖细胞(EPCs),观察PKD1及其特异性阻断剂CID755673对EPCs中血管内皮生长因子(VEGF)及其受体KDR表达的影响。复制大鼠心肌梗死模型,分析PKD1及CID755673干预对大鼠心肌梗死后受损心肌组织病理形态学、微血管和内皮细胞变化以及VEGF、KDR表达的影响。结果: EPCs体外细胞培养实验表明,PKD1可明显上调EPCs中VEGF和KDR的表达水平。大鼠心肌梗死动物实验结果表明,PKD1干预后的大鼠心肌组织排列较为有序,结构较为清晰,内皮细胞胞膜光滑、完整,周细胞可见,心肌组织中的VEGF和KDR表达水平显著上调。结论: PKD1有明显的促血管新生作用,该作用可能是通过VEGF介导而实现的。
[关键词]蛋白激酶D1; 心肌梗死; 血管新生; 内皮祖细胞; 血管内皮生长因子
蛋白激酶D(protein kinase D, PKD)属于钙/钙调蛋白依赖性的丝氨酸/苏氨酸激酶,家族成员主要包括PKD1、PKD2以及PKD3,参与多种组织细胞的迁移、增殖、跨膜转运、免疫反应等[1-2]。PKD1还是肿瘤血管形成进程中的关键调控蛋白之一,抗PKD1抑制肿瘤血管的成熟而促进肿瘤细胞凋亡的治疗策略已应用于临床并取得了较为积极的效果[3]。和肿瘤治疗策略相反,促血管新生疗法是心肌梗死治疗的理想策略之一,PKD1既然是肿瘤血管新生的关键调控蛋白之一,是否也在缺血受损的心肌组织中发挥着重要的作用?是否有望成为心肌梗死治疗的潜在靶点?
在本课题组前期的实验研究中,我们从体外细胞培养水平观察到PKD1有明显的促进骨髓源性内皮祖细胞(endothelial progenitor cells,EPCs)的黏附、迁移、增殖和血管形成能力的作用,并且上调EPCs中eNOS mRNA的表达和蛋白表达水平[4]。在此基础上,我们拟进一步探讨PKD1对EPCs中血管内皮生长因子(vascular endothelial growth factor, VEGF)及含激酶插入区受体(kinase insert domain receptor, KDR)表达的影响,并从动物整体实验水平探讨PKD1对心肌梗死后受损心肌组织病理形态学变化以及VEGF、KDR表达的影响,为以“PKD1”为靶点治疗心肌梗死提供更深入的理论支持。
材料和方法
1实验动物、仪器、药物与试剂
SD大鼠购自河南省实验动物中心,雄性,清洁级,8周龄,重约200~240 g,动物生产许可证号为SCXK(豫)2010-0002,动物质量合格证号为1000142。
A2-1389型生物安全柜(Thermo Scientific);164-5052型PowerPac HC 电泳仪及FACSCanto II型流式细胞仪(Bio-Rad);Bullet Blender Storm组织细胞破碎仪(Next Advance); T25组织匀浆机(IKA);HX-100E型小动物呼吸机(成都泰盟科技有限公司);ERM-3100型半自动病理切片机(苏州郝思琳科技有限公司);TKY-BMB型石蜡包埋机(深圳博大精科技实业有限公司);Nikon Tis型荧光显微镜及NIS-Elements Software BR分析系统(Nikon); SU3500型高清扫描电子显微镜(HITACHI)。
PKD1购自Pierce;PKD1特异阻断剂CID755673购自Med Chem Express;DNA酶 I、Dulbecco’s PBS、胎牛血清、胶原酶I购自上海宝曼生物科技有限公司;EBM-2培养基购自北京达科为生物技术有限公司;VEGF、KDR抗体购自天津恒业生物科技有限公司;羊抗兔IgG、DAB显色液购自武汉博士德生物工程有限公司;纤连蛋白(fibronectin,FN)、FITC和DAPI购自北京碧橙蓝生物科技有限责任公司;其它试剂为国产分析纯。
2方法
2.1EPCs的体外分离、培养和鉴定及实验分组EPCs的体外分离、培养和鉴定参见本课题组前期的研究文献[4]。提前用FN(50 mg/L)包被6孔细胞培养板,将EPCs用含2% 胎牛血清的EBM-2的基础培养基重悬,每孔105个加入6孔培养板中,待细胞贴壁后,更换无血清培养基培养。实验分3个组:空白对照组;PKD1(100 μg/L)处理组;PKD1+CID755673(100 μg/L)处理组,以下简称CID755673处理组。每组设置6个复孔,实验重复3次。
2.2PKD1对EPCs中VEGF、 KDR mRNA转录表达的影响TRIzol法提取EPCs中总RNA,根据GenBank序列,分别设计VEGF、KDR的上、下游引物,VEGF的上游引物为5’-ATGAACTTTCTGCTCTCTTGGG-3’,下游引物为5’-CTCTCCTATGTGCTGGCTTTG-3’,产物长度354 bp;KDR上游引物为5’-TCACGGTTGGGCTACTGC-3’,下游引物为5’-AGACCTTCTGCCATCACG-3’,产物长度418 bp。每组细胞取2 μg总RNA,根据试剂盒的说明书逆转录合成cDNA,再取2 μg逆转录产物进行普通PCR,扩增条件为:94 ℃ 5 min;95 ℃ 1 min,58 ℃ 1 min,72 ℃ 1 min,30个循环;延伸5 min。取反应产物10 μg进行1.5%琼脂糖凝胶电泳,EB染色后AlphaView SA软件摄图,并分析VEGF、KDR与β-actin的灰度比值。
2.3PKD1对EPCs中VEGF、KDR蛋白表达的影响应用Next Advance Bullet Blender Storm组织细胞破碎仪将EPCs打碎,匀浆,4 ℃下12 000×g离心2 min,提取组织总蛋白后Bradford法测定蛋白浓度,取其中20 μg蛋白进行12%的SDS-聚丙烯酰胺凝胶电泳,转移至硝酸纤维素膜上,5%的脱脂奶粉封闭2 h后洗膜,标记1∶1 000稀释的VEGF、KDR的 I 抗,4 ℃过夜,洗膜,与辣根过氧化物酶标记的羊抗小鼠IgG(1∶2 000稀释)孵育1 h后TBST洗膜,冲洗后暗室曝光显影。同时以β-actin蛋白表达水平作为内参照。胶片经成像分析系统扫描,并应用AlphaView SA软件分析各样本与β-actin蛋白灰度的比值,记录蛋白相对含量。
2.4心肌梗死模型建立及分组参照我们之前的研究[2],采用冠状动脉左前降支结扎造模方法复制大鼠心肌梗死模型。术后存活达2 d以上的心肌梗死大鼠随机被分为模型组、PKD1处理组、CID755673处理组,另设正常对照组,每组8只大鼠。PKD1处理组大鼠按照10 mg·kg-1·d-1的标准腹腔注射PKD1,模型组注射等量的生理盐水,CID755673处理组大鼠在PKD1处理组的基础上按照10 mg·kg-1·d-1的标准同时腹腔注射CID755673。连续饲养14 d后处死大鼠。
2.5HE染色下PKD1对心肌梗死大鼠心肌组织形态学变化的影响取大鼠术后的心尖部心肌组织,用液氮快速冷冻,之后用10%的甲醛浸泡固定,沿左室长轴的中点行组织切片,其厚度保持在4 μm左右。用去离子水清洗切片组织后,苏木精染色3~5 min,再次用去离子水清洗后,置入含1% HCl的无水乙醇中固定,之后再用伊红染色1~4 min,去离子水清洗干净,无水乙醇固定后石蜡包埋,光学显微镜下观察分析。
2.6电镜下PKD1对心肌梗死大鼠心肌超微结构变化的影响剪取大鼠术后的心尖部梗死区少许心肌组织,用生理盐水洗去血迹并移至盛满碎冰的玻璃培养皿上,组织周围保持有适量2.5%戊二醛,用双面刀片迅速将组织切成0.5 mm×0.5 mm×0.5 mm小块,立即移至2.5%戊二醛固定液中固定3 h后1%锇酸固定,梯度脱水,环氧树脂与丙酮包埋、聚合成块,超薄切片(50 nm),醋酸铀-柠檬酸铅染色,透射电镜下观察、摄片。
2.7PKD1对心肌梗死大鼠VEGF和KDR mRNA转录表达的影响取出-80 ℃冰箱的冻存管中100 mg梗死区心肌组织,IKA-T 25匀浆机制成匀浆,4 ℃下12 000×g离心5 min,TRIzol法提取总RNA后进行mRNA检测。
2.8PKD1对心肌梗死大鼠心肌VEGF、KDR蛋白表达变化的影响组织匀浆的制作方法同2.7部分,常规方法提取匀浆组织总蛋白,Bradford法测定蛋白浓度后进行蛋白检测。
3统计学处理
采用SPSS 16.0统计软件,计量资料以均数±标准差(mean±SD)表示,多组间均数比较用单因素方差分析,组间多重比较用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1EPCs的鉴定
EPCs呈卵圆形、纺锤形或者不规则状,EPCs结合FITC后呈现绿色,DAPI 复染后胞核呈蓝色;CD133、CD34或KDR表达呈阳性,相关结果已在本课题组前期论文[4]中发表。
2PKD1对EPCs中VEGF和KDR mRNA及蛋白表达的影响
和对照组相比,PKD1处理组VEGF、KDR mRNA和蛋白表达水平均显著升高(P<0.01),加入CID755673处理之后,EPCs中VEGF、KDR mRNA和蛋白表达水平均显著降低(P<0.01),见图1。

Figure 1.The effects of PKD1 on the mRNA and protein expression of VEGF and KDR in the EPCs.Mean±SD.n=6.**P<0.01vsPKD1 group.
图1PKD1对EPCs中VEGF和KDR mRNA及蛋白表达的影响
3HE染色下PKD1对心肌梗死大鼠心肌组织形态学的影响
正常对照组大鼠组织形态规整,细胞轮廓清晰。模型大鼠心肌组织排列错乱,细胞轮廓模糊,有核溶解现象,坏死心肌组织呈现明显的纤维化,形态学上清晰完整的血管少见;和模型组相比,PKD1处理组大鼠心肌组织排列相对有序,心肌细胞轮廓较为清晰,明显可见形态学上清晰完整的血管;加入CID755673处理之后,心肌组织形态学接近模型组大鼠,见图2。
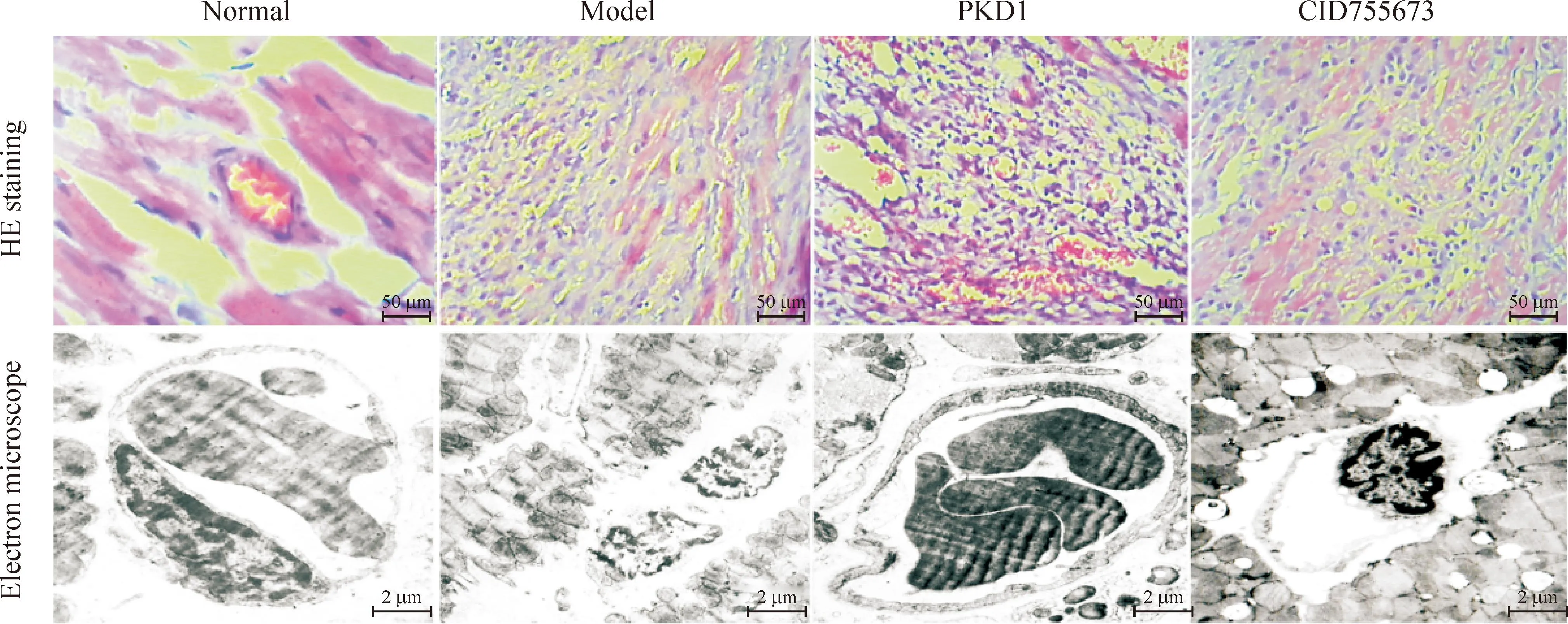
Figure 2.The effects of PKD1 on the myocardial pathomorphology and myocardial ultrastructure in the rats with myocardial infarction.
图2PKD1对心肌梗死大鼠心肌组织形态学变化的影响
4PKD1对心肌梗死大鼠心肌组织超微结构变化的影响
正常对照组大鼠心肌组织排列整齐,闰盘清晰,内皮细胞完整。模型组大鼠心肌组织排练紊乱,闰盘不太清晰,残存的血管管壁内皮细胞严重皱缩,体积明显缩小,完整的内皮细胞少见;和模型组比较,PKD1处理组大鼠心肌组织形态清晰、规则,血管内皮细胞胞膜光滑完整,处在增殖状态的胞核较多,周细胞可见;加入CID755673处理之后,内皮细胞皱缩,胞膜模糊,周细胞消失,清晰完整的内皮细胞明显减少,见图2。
5PKD1对心肌梗死大鼠心肌组织VEGF和KDR mRNA及蛋白表达的影响
和正常对照组相比,模型组大鼠心肌组织VEGF的mRNA和蛋白表达水平略有升高,KDR mRNA和蛋白表达水平略有降低,但均无统计学差异;和模型组比较,PKD1处理组大鼠心肌组织VEGF、KDR mRNA和蛋白表达水平均显著增加(P<0.01);加入CID755673处理之后,VEGF的mRNA和蛋白表达水平均显著降低(P<0.01),见图3。
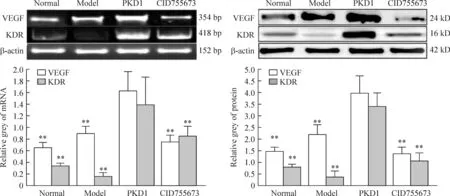
Figure 3.The effects of PKD1 on the mRNA and protein expression of VEGF and KDR in the rats with myocardial infarction. Mean±SD.n=8.**P<0.01vsPKD1 group.
图3PKD1对心肌梗死大鼠心肌组织VEGF和KDR mRNA及蛋白表达的影响
讨论
在前期的实验研究中,我们分别从PKD1诱导和阻断2个截然相反的角度证实了PKD1可以明显促进大鼠骨髓源性EPCs的黏附、迁移和血管形成能力,并且时间依赖性地促进EPCs增殖[4]。骨髓源性EPCs的黏附、迁移和增殖是应对心肌梗死等缺血性组织损伤的一种自然反应,明显促进受损组织区域内微血管的新生。本研究进一步证实,PKD1可显著上调骨髓源性EPCs中VEGF及其受体KDR的表达。VEGF是EPCs介导的血管新生的重要参与者,在血管新生和管腔形成中扮演着重要的角色[5-6],小鼠[7]和成人[8]VEGF基因移植治疗缺血受损心肌的疗法均证实VEGF通过动员骨髓源性EPCs而在血管新生中发挥着关键作用。在促血管新生的进程中,VEGF的受体KDR介导的信号通路可活化丝裂原活化蛋白激酶相关途径,诱导肌动蛋白的改组、内皮细胞的趋化和迁移,增加细胞有丝分裂的能力,促进内皮细胞的增殖[9]。同时,还可以调节内皮细胞间及内皮细胞与基质间的相互作用,表现出明显的血管腔化作用和增加血管的通透性[10]。这表明,PKD1促大鼠骨髓源性EPCs黏附、增殖、迁移和血管形成能力的作用与VEGF及其受体KDR密切相关。
心肌梗死后心肌组织的缺血损伤激发促血管新生信号,生长因子、NO和内皮细胞被激活,内皮细胞之间的连接松散,周细胞从血管壁分离,血管通透性增加,血浆蛋白外渗,为内皮细胞的迁移提供了必要的基质成分[11]。之后,在一种叫做“端细胞”的特异内皮细胞的调控下,微血管的“芽”出现,邻近的内皮细胞增殖以拓展“芽”的长度,最终管腔形成,周细胞聚集以加固新形成的管腔的稳定性[11],这一进程主要受VEGF及其受体KDR所诱导调控。本研究中PKD1可以明显改善心肌梗死大鼠紊乱的心肌组织形态,促进大鼠受损心肌组织微血管数量的增加,电镜下超微结构分析表明PKD1也可以诱导内皮细胞和周细胞的增生,这为受损心肌组织内血管的新生提供了必要的条件。此外,增生的内皮细胞和心肌梗死后心肌组织中残存的正常细胞之间的“串话”调控着心肌细胞的收缩能力[12],并且以一种依赖NO的作用方式对缺血损伤的心肌细胞起到药理学意义上的保护作用[13]。进一步实验证实,PKD1明显上调梗死心肌组织中VEGF及其受体KDR的表达。VEGF家族成员在心肌梗死后的血管新生中发挥着极其重要的作用,VEGF与其受体KDR结合后可以促进内皮细胞的分化、增殖和迁移,为新生血管的形成提供了必要条件[14]。在人或者啮齿类动物心肌梗死后缺血的心肌组织中,受缺氧或者牵张等因素的刺激诱导[15-16],通过缺氧诱导因子-1的作用,VEGF被快速激活,促进新生血管的管腔形成。这表明,PKD1促血管新生的作用可能是通过VEGF信号通路所介导的。
之前的研究表明,来自血管内皮细胞的VEGF可以诱导PKD1的激活,从而在内皮细胞的增殖和迁移以及微血管的新生中发挥着重要的作用[17],而本研究证实PKD1有显著上调EPCs中VEGF mRNA和蛋白表达的作用。这表明,PKD1和VEGF之间可能存在着相互调控、相互促进的作用。这也意味着,PKD1有明显的促血管新生作用,有望成为继VEGF之后缺血性心脏病新的治疗靶点。
[参考文献]
[1]Wille C, Seufferlein T, Eiseler T. Protein kinase D family kinases: roads start to segregate[J]. Bioarchitecture, 2014, 4(3):111-115.
[2]杨雷,毛秉豫,徐国昌,等. 黄芪提取物对大鼠心肌梗死后心肌组织PKD1蛋白表达的影响[J]. 中国药理学通报,2013, 29(4):512-519.
[3]Kentaro JJ, Masaaki L, Douglas WL. Endothelial progenitor cells in neovascularization of infracted myocardium[J]. J Mol Cell Cardiol, 2008, 45(4): 530-544.
[4]刘暖,杨雷,毛秉豫,等. 蛋白激酶D1在大鼠骨髓源性内皮祖细胞中的促血管新生作用[J]. 中国药理学通报,2015, 31(9):1259-1264.
[5]Grundmann S, Hans FP, Kinniry S, et al. MicroRNA-100 regulates neovascularization by suppression of mammalian target of rapamycin in endothelial and vascular smooth muscle cells[J]. Circulation, 2011, 123(9): 999-1009.
[6]刘暖,杨雷,毛秉豫,等. 丹参提取物促大鼠心肌梗死后心肌组织血管新生的作用[J]. 中国病理生理杂志,2015, 31(8):1490-1494,1499.
[7]Autiero M, Waltenberger J, Communi D, et al. Role of PIGF in the intra- and intermolecular cross talk between the VEGF receptors Flt1 and Flk1[J]. Nat Med, 2003, 9(7):936-943.
[8]Haider H, Akbar SA, Ashraf M. Angiomyogenesis for myocardial repair[J]. Antioxid Redox Signal, 2009, 11(8):1929-1944.
[9]Lee WS, Pyun BJ, Kim SW, et al. TTAC-0001, a human monoclonal antibody targeting VEGFR-2/KDR, blocks tumor angiogenesis[J]. MAbs, 2015, 7(5):957-968.
[10]Zhang Y, Song D, Zhang G. Study on vascular endothelial growth factor and its receptor in the vitreous of diabetic rats[J]. West Indian Med J, 2013 , 62(9):799-802.
[11]Carmeliet P, Jain RK. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature, 2011, 473(7347):298-307.
[12]Winegrad S, Henrion D, Rappaport L, et al. Vascular endothelial cell-cardiac myocyte crosstalk in achieving a balance between energy supply and energy use[J]. Adv Exp Med Biol, 1998,453:507-514.
[13]Leucker TM, Bienengraeber M, Muravyeva M, et al. Endothelial-cardiomyocyte crosstalk enhances pharmacological cardioprotection[J]. J Mol Cell Cardiol, 2011, 51(5):803-811.
[14]Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors[J]. Nat Med, 2003, 9(6):669-676.
[15]徐丹苹,吴焕林. 参术冠心颗粒对心肌梗死大鼠冠脉微循环的影响[J]. 中国病理生理杂志,2014, 30(3):438-443.
[16]Lee SH, Wolf PL, Escudero R, et al. Early expression of angiogenesis factors in acute myocardial ischemia and infarction[J]. N Engl J Med, 2000, 342(9): 626-633.
[17]Evans IM, Bagherzadeh A, Charles M, et al. Characterization of the biological effects of a novel protein kinase D inhibitor in endothelial[J]. Cells Biochem J, 2010, 429(3):565-572.
(责任编辑: 陈妙玲, 余小慧)
Promoting angiogenesis of protein kinase D1 in vitro and in vivo
YANG Lei, LIU Nuan, MAO Bing-yu, XU Guo-chang, YE Song-shan, ZHANG Pei-hua, ZHANG Li-fang
(MedicalExperimentalCenter,NanyangInstituteofTechnology,Nanyang473004,China.E-mail:maobingyu2005@126.com)
[ABSTRACT]AIM: To explore the effect of protein kinase D1 (PKD1) on promoting angiogenesis in vitro and in vivo, and to furnish a new idea on targeting PKD1 for the treatment of ischemic heart disease such as myocardial infarction. METHODS: The culture, isolation and identification of endothelial progenitor cells (EPCs) were performed in vitro. The effects of PKD1 and its specific blocking agent CID755673 on expression levels of vascular endothelial growth factor (VEGF) and kinase insert domain receptor (KDR) in EPCs were determined. The rat model of myocardial infarction was established, the intervention effects of PKD1 and CID755673 on morphology, changes of microvessels and endothelial cells, and the expression of VEGF and KDR in the impaired myocardial tissue were analyzed. RESULTS: PKD1 significantly upregulated the expression of VEGF and KDR in EPCs in vitro. Meanwhile, the structure of myocardial tissue was more regular and clear, the cytomembrane of endothelial cells were more smooth and integrity, the pericytes were visible, and the expression of VEGF and KDR was significantly increased in PKD1 treatment group in vivo.CONCLUSION: PKD1 has the ability of angiogenesis obviously, which might be mediated by VEGF.
[KEY WORDS]Protein kinase D1; Myocardial infarction; Angiogenesis; Endothelial progenitor cells; Vascular endothelial growth factor
[文章编号]1000- 4718(2016)01- 0146- 06
[收稿日期]2015- 04- 06[修回日期] 2015- 11- 24
*[基金项目]国家自然科学基金资助项目 (No. 81473438; No. 81202791);河南省中医内科学重点学科支撑课题(豫教高[2012]186号)
通讯作者△Tel: 0377-62071305; E-mail: maobingyu2005@126.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.025
